大学化学第二版部分习题参考答案 ppt课件
有机化学_第二版答案(全)

《有机化学》第二版习题参考答案第二章烷烃1、用系统命名法命名下列化合物(1)2,3,3,4-四甲基戊烷(2)3-甲基-4-异丙基庚烷(3)3,3,-二甲基戊烷(4)2,6-二甲基-3,6-二乙基辛烷(5)2,5-二甲基庚烷(6)2-甲基-3-乙基己烷(7)2,2,4-三甲基戊烷(8)2-甲基-3-乙基庚烷2、试写出下列化合物的结构式(1) (CH3)3CC(CH2)2CH2CH3(2) (CH3)2CHCH(CH3)CH2CH2CH2CH3(3) (CH3)3CCH2CH(CH3)2(4) (CH3)2CHCH2C(CH3)(C2H5)CH2CH2CH3(5)(CH3)2CHCH(C2H5)CH2CH2CH3(6)CH3CH2CH(C2H5)2(7) (CH3)2CHCH(CH3)CH2CH3(8)CH3CH(CH3)CH2CH(C2H5)C(CH3)33、略4、下列各化合物的系统命名对吗?如有错,指出错在哪里?试正确命名之。
均有错,正确命名如下:(1)3-甲基戊烷(2)2,4-二甲基己烷(3)3-甲基十一烷(4)4-异丙基辛烷(5)4,4-二甲基辛烷(6)2,2,4-三甲基己烷5、(3)>(2)>(5)>(1) >(4)6、略7、用纽曼投影式写出1,2-二溴乙烷最稳定及最不稳定的构象,并写出该构象的名称。
H交叉式最稳定重叠式最不稳定8、构象异构(1),(3)构造异构(4),(5)等同)2),(6)9、分子量为72的烷烃是戊烷及其异构体(1) C(CH3)4(2) CH3CH2CH2CH2CH3 (3) CH3CH(CH3)CH2CH3(4) 同(1)10、分子量为86的烷烃是己烷及其异构体(1)(CH3)2CHCH(CH3)CH3(2) CH3CH2CH2CH2CH2CH3 , (CH3)3CCH2CH3 (3)CH3CH2CH(CH3)CH2CH3(4)CH3CH2CH2CH(CH3)214、(4)>(2)>(3)>(1)第三章 烯烃1、略2、(1)CH 2=CH — (2)CH 3CH=CH — (3)CH 2=CHCH 2— CH 2CH CH 3M eH H i-P rE t M en-P rM e M e E t i-P rn-P r (4)(5)(6)(7)3、(1)2-乙基-1-戊烯 (2) 反-3,4-二甲基-3-庚烯 (或(E)-3,4-二甲基-3-庚烯 (3) (E)-2,4-二甲基-3-氯-3-己烯 (4) (Z)-1-氟-2-氯-2-溴-1-碘乙烯(5) 反-5-甲基-2-庚烯 或 (E)-5-甲基-2-庚烯 (6) 反-3,4-二甲基-5-乙基-3-庚烯 (7) (E) -3-甲基-4-异丙基-3-庚烯 (8) 反-3,4-二甲基-3-辛烯 4、略 5、略 6、CH 3CH 2CHC H 2CH 3CH 3CH 2CCHC H 3CH 3OH BrCH 3CH 2CCHC H3CH 3Cl ClCH 3CH 2C CHC H3CH 3OH OHCH 3CH 2CHCHC H 3CH 3OHCH 3CH 2COCH3CH 3CHOCH 3CH 2CHCHC H 3CH 3Br(1)(2)(3)(4)(5)(6)(7)7、活性中间体分别为:CH 3CH 2+ CH 3CH +CH 3 (CH 3)3C + 稳定性: CH 3CH 2+ > CH 3CH +CH 3 > (CH 3)3C + 反应速度: 异丁烯 > 丙烯 > 乙烯8、略9、(1)CH 3CH 2CH=CH 2 (2)CH 3CH 2C(CH 3)=CHCH 3 (有顺、反两种) (3)CH 3CH=CHCH 2CH=C(CH 3)2 (有、反两种)用KMnO 4氧化的产物: (1) CH 3CH 2COOH+CO 2+H 2O (2)CH 3CH 2COCH 3+CH 3COOH (3) CH 3COOH+HOOCCH 2COOH+CH 3COCH 310、(1)HBr ,无过氧化物 (2)HBr ,有过氧化物 (3)①H 2SO 4 ,②H 2O (4)B 2H 6/NaOH-H 2O 2 (5)① Cl 2,500℃ ② Cl 2,AlCl 3(6)① NH 3,O 2 ② 聚合,引发剂 (7)① Cl 2,500℃,② Cl 2,H 2O ③ NaOH 11、烯烃的结构式为:(CH 3)2C=CHCH 3 。
《大学有机化学》ppt课件

烯烃、炔烃衍生物及其应用
01
烯烃衍生物
包括醇、醛、酮、羧酸等,具有广泛的应用,如合成香料、药物、塑料
等。
02
炔烃衍生物
包括炔醇、炔醛、炔酮等,可用于合成橡胶、染料、农药等。
2024/1/24
03
烯烃、炔烃及其衍生物的应用
在有机合成中具有重要的地位,可用于合成各种复杂的有机化合物,同
时也是许多天然产物和生物活性物质的重要合成原料。
2024/1/24
偶氮化合物的结构特点
含有偶氮基(-N=N-)的有机化合物, 偶氮基两端连接两个烃基。
偶氮化合物的物理性质
多数偶氮化合物为有色物质,难溶于 水。
偶氮化合物的化学性质
相对稳定,不易被氧化;能在一定条 件下发生还原反应;能与金属离子形 成络合物等。
29
生物碱简介及应用
01
生物碱的定义
一类含氮的碱性有机化合物, 在植物界中分布广泛,具有显 著的生理活性。
24
醛、酮类化合物结构与性质
醛类化合物
羰基与一个烃基和一个氢原子相连形 成的化合物,具有刺激性气味和还原 性。常见的醛有甲醛、乙醛等。
酮类化合物
羰基与两个烃基相连形成的化合物, 具有酮味和一定的稳定性。根据烃基 的不同,可分为脂肪酮、芳香酮等。
2024/1/24
25
羧酸及其衍生物结构与性质
2024/1/24
3
农药领域
一些杂环和元素有机化合物具有杀虫、 除草等活性,被用作农药的活性成分。 例如,吡啶类化合物可用于合成新型杀 虫剂,含磷化合物可用于制备除草剂。
2024/1/24
/1/24
35
羧酸类化合物
羧基与烃基相连形成的化合物,具有酸性、还原性和酯化反应等性质。常见的羧酸有甲 酸、乙酸等。
大学无机化学第二版河北师范大学课后习题答案.doc讲课讲稿

第1章 物质的聚集态习题答案1-1 实验室内某氦气钢瓶,内压为18 MPa ,放出部分氦气后,钢瓶减重500 kg ,瓶内氦气的压强为9.5 MPa 。
假定放出气体前后钢瓶的温度不变,钢瓶原储有氦气为多少(物质的量)?解:V 与T 一定时,n 与p 成正比,即: mol .0026410500MPa )5.918(MPa 183⨯=-总n 解得 mol 10645.25⨯=总n 1-2 273K和101 kPa 的1.00 dm 3干燥空气缓慢通过液态的二甲醚(CH 3OCH 3)。
假定(1)通过二甲醚后的空气被二甲醚饱和且液态二甲醚损失0.0335g ;(2)被二甲醚饱和的空气的总压强仍为101kPa 。
计算二甲醚在273K时的饱和蒸汽压。
解:由理想气体状态方程得: 空气的物质的量:m ol 0445.0K273K m ol dm 8.314kPa 1.00dm kPa 1011133=⨯⋅⋅⋅⨯==--空RT pV n 二甲醚的物质的量:mol 10283.7molg 0.46g 02335.041--二甲醚⨯=⋅==M m n 二甲醚的摩尔分数:0161.00445.010283.710283.744=+⨯⨯=+=--二甲醚空二甲醚二甲醚n n n x 二甲醚的饱和蒸汽压: 1.626kPa kPa 1010161.0=⨯=⋅=p x p 二甲醚二甲醚1-3 在273.15 K 和1.01325×105 Pa 压力下,测得某气体的密度为1.340 g ·dm -3,在一实验中测得这种气体的组成是C 79.8%和H 20.2%。
求此化合物的分子式。
解=30.02(g·mol -1)每分子含碳原子:30.02×0.798/12.01=1.9953≈2每分子含氢原子:30.02×0.202/1.008=6.016≈6即分子式为:C 2H 61-4 在293 K 和9.33×104 Pa 条件下,在烧瓶中称量某物质的蒸气得到下列数据,烧瓶容积为2.93×10-4 m3,烧瓶和空气的总质量为48.3690 g,烧瓶与该物质蒸气质量为48.5378 g,且已知空气的平均相对分子质量为29。
有机化学_第二版答案(全)

《有机化学》第二版习题参考答案第二章 烷烃1、用系统命名法命名下列化合物(1)2,3,3,4-四甲基戊烷 (2)3-甲基-4-异丙基庚烷 (3)3,3,-二甲基戊烷 (4)2,6-二甲基-3,6-二乙基辛烷 (5)2,5-二甲基庚烷 (6)2-甲基-3-乙基己烷 (7)2,2,4-三甲基戊烷 (8)2-甲基-3-乙基庚烷 2、试写出下列化合物的结构式(1) (CH 3)3CC(CH 2)2CH 2CH 3 (2) (CH 3)2CHCH(CH 3)CH 2CH 2CH 2CH 3 (3) (CH 3)3CCH 2CH(CH 3)2 (4) (CH 3)2CHCH 2C(CH 3)(C 2H 5)CH 2CH 2CH 3 (5)(CH 3)2CHCH(C 2H 5)CH 2CH 2CH 3 (6)CH 3CH 2CH(C 2H 5)2(7) (CH 3)2CHCH(CH 3)CH 2CH 3 (8)CH 3CH(CH 3)CH 2CH(C 2H 5)C(CH 3)3 3、略4、下列各化合物的系统命名对吗?如有错,指出错在哪里?试正确命名之。
均有错,正确命名如下:(1)3-甲基戊烷 (2)2,4-二甲基己烷 (3)3-甲基十一烷(4)4-异丙基辛烷 (5)4,4-二甲基辛烷 (6)2,2,4-三甲基己烷5、(3)>(2)>(5)>(1) >(4)6、略7、用纽曼投影式写出1,2-二溴乙烷最稳定及最不稳定的构象,并写出该构象的名称。
H H HHHHH H Br BrBr Br交叉式 最稳定重叠式 最不稳定8、构象异构(1),(3) 构造异构(4),(5) 等同)2),(6)9、分子量为72的烷烃是戊烷及其异构体(1) C(CH 3)4 (2) CH 3CH 2CH 2CH 2CH 3 (3) CH 3CH(CH 3)CH 2CH 3 (4) 同(1)10、 分子量为86的烷烃是己烷及其异构体(1) (CH 3)2CHCH(CH 3)CH 3 (2) CH 3CH 2CH 2CH 2CH 2CH 3 , (CH 3)3CCH 2CH 3 (3)CH 3CH 2CH(CH 3)CH 2CH 3 (4)CH 3CH 2CH 2CH(CH 3)2 14、 (4)>(2)>(3)>(1)第三章 烯烃1、略2、(1)CH 2=CH — (2)CH 3CH=CH — (3)CH 2=CHCH 2— CH 2CH CH 3MeH H i-PrEt Men-PrMe Me Et i-Prn-Pr (4)(5)(6)(7)3、(1)2-乙基-1-戊烯 (2) 反-3,4-二甲基-3-庚烯 (或(E)-3,4-二甲基-3-庚烯 (3) (E)-2,4-二甲基-3-氯-3-己烯 (4) (Z)-1-氟-2-氯-2-溴-1-碘乙烯(5) 反-5-甲基-2-庚烯 或 (E)-5-甲基-2-庚烯 (6) 反-3,4-二甲基-5-乙基-3-庚烯 (7) (E) -3-甲基-4-异丙基-3-庚烯 (8) 反-3,4-二甲基-3-辛烯 4、略 5、略 6、CH 3CH 2CHCH 2CH 3CH 3CH 2CCHCH 3CH 3OH BrCH 3CH 2CCHCH 3CH 3Cl ClCH 3CH 2C CHCH 3CH 3OH OHCH 3CH 2CH CHCH 3CH 3OHCH 3CH 2COCH 3CH 3CHOCH 3CH 2CH CHCH 3CH 3Br(1)(2)(3)(4)(5)(6)(7)7、活性中间体分别为:CH 3CH 2+ CH 3CH +CH 3 (CH 3)3C + 稳定性: CH 3CH 2+ > CH 3CH +CH 3 > (CH 3)3C + 反应速度: 异丁烯 > 丙烯 > 乙烯8、略9、(1)CH 3CH 2CH=CH 2 (2)CH 3CH 2C(CH 3)=CHCH 3 (有顺、反两种) (3)CH 3CH=CHCH 2CH=C(CH 3)2 (有、反两种)用KMnO 4氧化的产物: (1) CH 3CH 2COOH+CO 2+H 2O (2)CH 3CH 2COCH 3+CH 3COOH (3) CH 3COOH+HOOCCH 2COOH+CH 3COCH 310、(1)HBr ,无过氧化物 (2)HBr ,有过氧化物 (3)①H 2SO 4 ,②H 2O (4)B 2H 6/NaOH-H 2O 2 (5)① Cl 2,500℃ ② Cl 2,AlCl 3(6)① NH 3,O 2 ② 聚合,引发剂 (7)① Cl 2,500℃,② Cl 2,H 2O ③ NaOH 11、烯烃的结构式为:(CH 3)2C=CHCH 3 。
基础化学第二版习题答案chap9

第九章胶体分散系习题解答1.答:相界面上的微粒与处于内部的微粒受力状况不同是产生表面现象主要原因。
小液滴和小气泡总是呈球形是为了缩小表面积,以减低表面能。
恒温下,纯液体的σ是一个常数,因此表面能的减小只能通过减小表面积的办法进行。
这是热力学自发过程。
2.答:不对。
表面张力的作用方向与表面相切。
3.答:溶胶是高度分散的热力学不稳定系统,而实际上又常能相对稳定存在。
主要原因:①胶体粒子带电,决定溶胶稳定性的主要因素是胶粒表面的双电层结构。
②溶胶表面水化膜的保护作用③Brown运动。
4.答:其胶体结构为:{m AgCl·n Ag+(n-x)Cl-}x+·x Cl-胶体粒子带正电,电泳时向负极移动。
5. 答:能显著降低水的表面张力的物质称为表面活性剂。
从结构上分析,表面活性剂分子中一般都含有亲脂性的非极性基团,和亲水性极性基团。
以脂肪酸钠盐(肥皂)为例,当它进入水中,亲水的羧基端有进入水中的倾向,而亲油的长碳链端则力图离开水相,如若进入水中的肥皂量不大,它主要集中在水的表面定向排列起来。
从而减小了水的表面张力,降低了表面能。
6.答:见表8-67.答:A溶胶带有负电荷,B溶胶带有正电荷8.答:ξ电位是固液两相作相对移动时的滑动面与均匀液相间的电势差。
9.答:Tyndall效应的本质是分散相粒子对光的散射作用。
一束光照射到某物体后,光可能被吸收、反射或散射。
光的吸收主要由物体的化学组成和结构所决定。
反射及散射与该物体的分散相粒子的大小有关,如果粒子大于波长,则光波以一定的角度从粒子表面反射出来;如果粒子远小于光波的波长,则光波绕过粒子前进不受阻碍。
只有当粒子的大小和光波波长接近或稍小时,光波才产生散射。
10.答:在一定条件下,使高分子溶质或胶体粒子相互连接,形成空间网状结构,而溶剂小分子充满在网架的空隙中,成为失去流动性的半固体状体系,称为凝胶。
形成凝胶的条件主要是温度下降或溶解度减小。
大学有机化学答案2
(3) 甲醛
苯甲醛
希夫试剂
紫红色 紫红色
硫酸
不褪色 褪色
苯乙酮
×
(4) 首先用希夫试剂加硫酸,紫红色不褪的是甲醛,褪色 的是乙醛和丙醛,后两者再用碘仿反应区别,有黄色沉淀 生成的是乙醛,没有现象的是丙醛。
4. (1) (2)
H3C
C H3C
N
NH 2
H3C
H3C
H3C CH 2 CH CH CHO , H3C CH2 CH C CHO
(4) 2,4-二硝基苯甲酸> 4-二硝基苯甲酸>苯甲酸> 4-甲基苯甲酸
O
+ 4. (1) CH3COONa CH3CH2OH (2)
COOH ,
COOH
C O
C
O
(3)
CH 2 CO ,
CH 2 C N OH
CH 2
CH 2
(4) H3C CH CH COOH , H3C CH CH CH2OH
(5)N-甲基-N-乙基对甲基苯胺 (6)三乙醇胺
(7) 氢氧化三甲基乙基铵
(8)溴化对羟基重氮苯
(9) N-甲基-N-亚硝基苯胺 (10) 4,4´-二甲基偶氮苯
(11) N-甲基-N-乙基-2-甲基丙酰胺 (12) 3-(间)硝基苯甲酰胺
(13) O,O-二甲基甲基磷酸酯 (14) 三苯基膦
4.
2.
3. (1)
(2)
(3)
(4)
(5)
4. (1)
(2)
5. (1)
+ CH3I
(2)
O
(3)
(4) 2 H3C C CH3
(5)
(6)
,
(7)
基础化学第二版习题答案
基础化学第二版习题答案第一章:原子结构与元素周期表1. 根据质子数确定元素:- 质子数为1的元素是氢(H)。
- 质子数为6的元素是碳(C)。
2. 元素周期表中元素的排列规律:- 元素按照原子序数递增排列。
- 元素周期表分为s区、p区、d区和f区。
3. 元素周期表中的族和周期:- 每个周期代表一个电子壳层。
- 每个族代表一个价电子层。
第二章:化学键与分子结构1. 离子键与共价键的区别:- 离子键是由正负离子之间的静电吸引力形成的。
- 共价键是由两个原子共享电子对形成的。
2. 极性分子与非极性分子:- 极性分子具有不对称的电荷分布。
- 非极性分子的电荷分布是对称的。
3. 分子间作用力:- 包括氢键、范德华力等。
第三章:化学计量学1. 摩尔的概念:- 摩尔是化学中用于表示物质量的单位。
2. 摩尔质量的计算:- 摩尔质量是元素的相对原子质量,以克/摩尔为单位。
3. 化学方程式的平衡:- 确保方程式两边的原子数相等。
第四章:溶液与溶解度1. 溶液的类型:- 包括水溶液、有机溶液等。
2. 溶解度的定义:- 溶解度是在特定条件下,物质在溶剂中的最大溶解量。
3. 溶液的浓度表示方法:- 包括摩尔浓度、质量浓度等。
第五章:化学反应速率与化学平衡1. 反应速率的影响因素:- 包括温度、浓度、催化剂等。
2. 化学平衡的定义:- 反应物和生成物的浓度不再随时间变化的状态。
3. 勒夏特列原理:- 描述了化学平衡对系统条件变化的响应。
第六章:氧化还原反应1. 氧化与还原的定义:- 氧化是电子的损失,还原是电子的获得。
2. 氧化还原反应的平衡:- 涉及电子的转移,需要考虑电子的平衡。
3. 氧化还原电位:- 描述了氧化还原反应的倾向性。
第七章:酸碱平衡1. 酸与碱的定义:- 酸是能够释放氢离子的物质,碱是能够释放氢氧根离子的物质。
2. pH的定义:- pH是溶液酸度的度量,表示为氢离子浓度的负对数。
3. 缓冲溶液:- 能够抵抗小量酸或碱添加引起的pH变化。
基础化学第二版习题答案chap3
第三章 酸碱解离平衡 习题解答1.(1)错误。
原因:氨水为一元弱碱,其[OH -]=c k b θ(2)错误。
原因:n HCl =n HAc 故所需NaOH 的摩尔数应相同,体积相同。
2.I=1/2∑CiZi 2=1/2[0.050×(+3)2+3×0.050×(-1)2+2×0.020×(+1)2+0.020×(-3)2]=0.36 (mol ·L -1) 51.3pH 101.3%31100.1]H [ %31 1 , 500 / , 20 3.432θa θa a w a θa =⨯=⨯⨯===-=〈〉⋅--+ααααc c k k c K c K 按近似式计算4. 应加入碱。
原因:H 2SHS -+H + HS -S 2- + H + 要使[S 2-]增加,应减小[H +],使平衡右移,故应加碱。
5.稀氨水中加入少量晶体NH 4Ac ,会产生同离子效应,氨水解离度减小,颜色变浅(或消退)。
101.10.3)10(2.97)10(1.12][H ][HS ][S ][HS ][S ][H S H HS 102.970.30.1108.91][H S][H ][HS S][H ][HS ][H HS H S H 6. 9812θa222θa22882θa12θa12---+----+-+---+--+-+⨯=⨯⨯⨯=⨯=∴⋅=+⇔⨯=⨯⨯=⨯=∴⋅=+⇔K K K K7.NH 4+-NH 3, Ac --HAc, H 2O-H 3O +, H 2O-OH -, HSO 4—-SO 42-, HNO 3-NO 3-, H 2SO 4-HSO 4-,CO 32—-HCO 3-, HCO 3—-H 2CO 38. 质子酸:HCl质子碱:NH 3, SO 42-, NO 3-, Ac -, OH -两性物质:[Al(H 2O)4]3+, HSO 4-, HS -, HCO 3-, H 2PO 4-, H 2O9. 否。
基础化学第二版习题答案chap5
基础化学第二版习题答案chap5第五章难容电解质溶液的沉淀溶解平衡习题答案1.何谓沉淀溶解平衡?同物质的量的BaCl2和H2SO4混合溶液中,含有哪些离子?这些离子浓度之间存在着哪些关系?答:难溶电解质溶解和沉淀速度相等,固体的量和溶液中分子或离子的量不再改变的状态,称为沉淀溶解平衡。
Ba2+、Cl-、SO4、H+、OH-?θ?-θ[Ba2?][SO24]?Ksp,[H][OH]?Kw等2?2.活度积、溶度积、离子积之间有何区别与联系?答:活度积、溶度积指平衡状态下的活度积或浓度积,对给定的难溶电解质其活度积只与温度有关,溶度积不但与温度有关,还和溶液离子强度有关,对于MA型难溶电解质:θKap(MA)θ?Ksp(MA)。
离子积指任意状态下的浓度积,其值是任意的。
?(M?)??(A?)3.无副反应时,沉淀的溶度积与溶解度有何关系?溶度积小的物质,它的溶解度是否一定小?举例说明。
答:s?m?nθKsp(MmAn)mmnncθ不同类型难溶电解质的溶解度不能根据溶度积数值大小直接判断。
溶度积小的物质,它的溶解度是不一定小,如Ag2CrO4与AgCl。
4.除了沉淀物质本性以外,影响沉淀溶解度的主要因素有哪些?答:除了沉淀物质本性以外,影响沉淀溶解度的主要因素还有:同离子效应、盐效应、酸碱效应、配位效应等。
5.判断下列操作中可能发生的反应和现象并予以解释。
(1)将少量CaCO3固体放入稀HCl中。
(2)将少量Mg(OH)2放入NH4Cl溶液中。
(3)向少量MnSO4溶液中加入数滴饱和H2S水溶液,再逐滴加入2mol・L-1的氨水。
(4)向盛少量PbS固体的试管中,滴入H2O2溶液。
(5)向盛少量AgCl沉淀的试管中,滴入KI溶液。
(6)向盛少量Cu(OH)2沉淀的试管中,滴入2mol・L-1NH3・H2O溶液。
答:(1)CaCO3固体溶解,有无色无味气体产生。
CaCO3(s)Ca2+ + CO32-+2H+H 2CO 3→ CO 2 +H 2O(2)Mg(OH)2固体溶解,有无色刺激性气体产生。
有机化学第二版习题答案
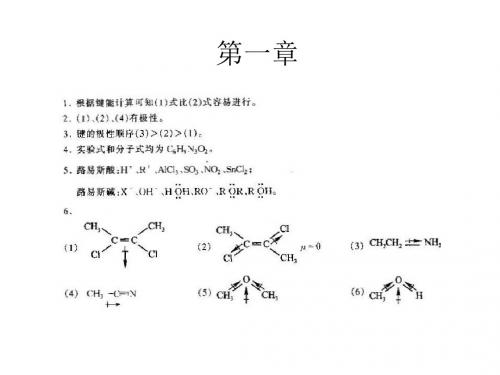
第一章绪论1-1 扼要解释下列术语.(1)有机化合物 (2) 键能、键的离解能(3) 键长 (4) 极性键 (5) σ键(6)π键 (7) 活性中间体 (8) 亲电试剂 (9) 亲核试剂 (10)Lewis碱(11)溶剂化作用 (12) 诱导效应 (13)动力学控制反应 (14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
lgKө = - △rGmө/ 2.303RT = -(141.36)/(2.303×8.314×10-3×1573.15)
=198.65 (J·mol-1·K-1)
ΔrGmө(T) ≈ΔrHmө( 298.15 K ) -T·ΔrSmө( 298.15K )
= 92.22-398.15× 198.65 ×10-3
= 13.13(kJ·mol-1)
3
2020/12/27
2NH3 (g) = N2 (g) + 3H2 (g)
4
2020/12/27
[P33:3题] 解题思路
解: 查表可知:
Sn(s) + O2(g) = SnO2(s)
ΔfGmө (298.15K)/( kJ·mol-1) 0
0 -519.7
(1) 根据 ΔrGm(T)=ΔrGmө(T) + 2.303RTlgQ 计算.
当T=298.15K时,ΔrGmө(T) = △rGmө(298.15K) △rGmө(298.15K) =∑vi△fGmө(生成物) -∑vi△fGmө(反应物) = (-519.7) - 0 = - 519.7 (kJ·mol-1)
Smө(298.15K)/(J·mol-1·K-1) 39.75 248.22 205.pa×21% = 21.28Kpa
1
Pө
100Kpa
Q=
=
=
= 4.699
P(O2)/Pө
P(O2) 21.28Kpa
5
ΔrGm(T) = ΔrGmө(T)+2.303RT lgQ
Sn(s)+O2(g)= SnO2(s)
= △rGmө(298.15K) + 2.303×8.314×10-3×298.15×lg(4.699) = -515.86 (kJ·mol-1) < 0 , 向正方向自发进行. ∴ 金属锡制件在常温的空气中能被氧化。
Q P= (O2)/Pө
Pө
=
P(O2)
> 1091.04
∴ P(O2) < 10-89.04 Kpa
6
∴ 常温空气中使Sn不被氧化所需O2最高压力应低于10-89.04 Kpa.
[P34:8题] 设汽车内燃机内温度因燃料燃烧反应达到1300℃,
试计算该反应: N2 (g) + O2 (g) = 2NO(g) 在1300℃时的标准摩尔吉布斯函数变和标准平衡常数Kө。
=2×90.25 =180.50 kJ•mol-1
△rSmө(298.15K)=∑vi Smө(生成物) -∑viSmө(反应物)
=2×210.76 –(191.5 + 205.14)
=24.88 J•k-1•mol-1
7
2020/12/27
T =1300℃ = 1300 + 273.15 = 1573.15K
Q=
(PN2/Pө)1 ·(PH2/Pө)3
=
(1000/100)1 ·(1000/100)3
= 100
(PNH3/Pө)2
(1000/100)2
ΔrGm(T) = ΔrGmө(T) + 2.303RTlgQ = -21.63 + 2.303×8.314×10-3×573.15×lg(100)
= 0.318(kJ·mol-1)
根据: ΔrGmө(T)≈ΔrHmө(298.15K) –T•ΔrSmө(298.15K) 计算.
2020/12/27
△rHmө(298.15K)=∑vi△fHmө(生成物)-∑vi△fHmө(反应物) = 0 – 2×(-46.11)
= 92.22(kJ·mol-1)
△rSmө(298.15K) =∑viSmө(生成物) -∑viSmө(反应物) =[ 191.50 + (3×130.684) ] - (2×192.45)
= - 4.69
Kө = 10-4.69 = 2.0×10-5
答: 略。
8
[P33: 4题] 解题思路
解: 查附录4可知:
CaO(s)+ SO2(g) +1/2O2(g)=CaSO4(s)
2020/12/27
ΔfHmө(298.15K)/(kJ·mol-1) -635.09 -296.83 0
-1433
2020/12/27
(2) 使Sn在常温空气中不被氧化, 应使反应非自发.
即: ΔrGm(T) = ΔrGmө(T) + 2.303RTlgQ>0, 非自发。
ΔrGmө(T) + 2.303RT lgQ >0 ,
lgQ > -ΔrGmө(T)
= 91.04, 则: Q >1091.04
2.303RT 1
2020/12/27
解: 查ΔfH表m知ө(2:98.Δ15rKG)/(mkJө•(mTol)-1)=ΔNr0H2(gm)ө+(TO0)2(-gT) =·Δ29rN0S.O2m5(gө()T)
△rHmSөm(2ө(92898.1.155KK))=/( Jl∑•gmvKoi△lө-1=•fKH--1m)Δ2ө(.r生3G10成9m31өR物.(5TT0))-∑2v0i5△.1f4Hmө2(反10应.76物)
(3) T=300℃=300+273.15K=573.15K
根据 ΔrGm(T) =ΔrGmө(T) + 2.303RTlgQ 计算.
ΔrGmө(T) = ΔrHmө(298.15K) -T·ΔrSmө(298.15K) = 92.22- 573.15×198.65×10-3 = -21.63 (kJ·mol-1)
-46.11 0
0
192.45 191.50 130.684
-16.45 0
0
解: (1) T=298.15K △rGmө(298.15K)=∑vi△fGmө(生成物) -∑vi△fGmө(反应物) = 0 - 2×(-16.45 ) = 32.90 (kJ·mol-1)
2
(2) T=398.15K
2020/12/27
第一章部分习题参考答案
1
2020/12/27
[P33: 6题] 解题思路
解: 查附录4中有关数据如下:
ΔfHmө (298.15K)/( kJ·mol-1) Smө (298.15K)/( J·mol-1·K-1) ΔfGmө (298.15K)/( kJ·mol-1)
2NH3(g) = N2(g) + 3H2(g)
