专题:难溶电解质的沉淀溶解平衡
高二下学期化学《难溶电解质的溶解平衡》知识点归纳

2019学年高二下学期化学《难溶电解质的溶解平衡》知识点归纳学生们在享受学习的同时, 还要面对一件重要的事情就是考试, 查字典化学网为大家整理了难溶电解质的溶解平衡知识点归纳, 希望大家仔细阅读。
(一)沉淀溶解平衡1.沉淀溶解平衡和溶度积定义:在一定温度下, 当把PbI2固体放入水中时, PbI2在水中的溶解度很小, PbI2表面上的Pb2+离子和I-离子, 在H2O分子作用下, 会脱离晶体表面进入水中。
反过来在水中的水合Pb2+离子与水合I-离子不断地作无规则运动, 其中一些Pb2+(aq)和I-(aq)在运动中相互碰撞, 又可能沉积在固体表面。
当溶解速率与沉淀速率相等时, 在体系中便存在固体与溶液中离子之间的动态平衡。
这种平衡关系称为沉淀溶解平衡, 其平衡常数叫溶度积常数或溶度积。
沉淀溶解平衡和化学平衡、电离平衡一样, 一种动态平衡, 其基本特征为:(1)可逆过程;(2)沉积和溶解速率相等;(3)各离子浓度不变;(4)改变温度、浓度等条件平衡移动。
2、溶度积的一般表达式:AmBn(s)mAn++nBm-Ksp=[An+]m·[Bm-]n在一定温度下, 难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数, 这个常数称为该难溶电解质的溶度积。
用符号Ksp表示。
3.溶度积的影响因素:溶度积Ksp的大小和溶质的溶解度不同, 它只与难溶电解质的性质和温度有关, 与浓度无关。
但是, 当温度变化不大时, Ksp数值的改变不大, 因此, 在实际工作中, 常用室温18~25℃的常数。
4.溶度积的应用:(1)溶度积Ksp可以用来判断难溶电解质在水中的溶解能力, 当化学式所表示的组成中阴、阳离子个数比相同时, Ksp数值越大的难溶电解质在水中的溶解能力越强。
(2)溶度积Ksp可以判断沉淀的生成、溶解情况以及沉淀溶解平衡移动方向。
5.溶度积(Ksp)的影响因素和性质:溶度积(Ksp)的大小只与难溶电解质性质和温度有关, 与沉淀的量无关, 离子浓度的改变可使平衡发生移动, 但不能改变溶度积, 不同的难溶电解质在相同温度下Ksp不同。
高考化学二轮复习知识点专题解析17---难溶电解质的沉淀溶解平衡

mmol,两溶液混合,AgNO3+HCl===AgCl↓+HNO3,HCl 过量:1 mmol-0.9 mmol =0.1 mmol,故反应后的 c(Cl-)=(500.+1 m50m)omlL=1×10-3mol·L-1,H+未被消耗,c(H+)
1 mmol =(50+50)mL=
1×10
-2mol·L-1。c(Ag+)·c(Cl-)=1.8×10-10,即
(2)外因:温度、浓度等条件的影响符合勒夏特列原理。
(3)实例分析
已知沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),请分析当改变下列条件时, 对该沉淀溶解平衡的影响,填写下表(浓度变化均指平衡后和原平衡比较):
条件改变
移动方向
c(Mg2+)
c(OH-)
加少量水
正向移动
不变
不变
9 / 11
·L-1,c(PO34-)=1.58×10-6 mol·L-1,则 Ca3(PO4)2 的 Ksp 为( )
A.2.0×10-29
B.3.2×10-12
C.6.3×10-18
D.5.1×10-27
答案 A
3.将足量的 BaCO3 粉末分别加入下列溶液中,充分溶解至溶液饱和。下列溶液中 Ba2 +的浓度最小的是( ) A.10 mL 0.2 mol·L-1 Na2CO3 溶液
【高中化学】高中化学知识点:沉淀溶解平衡

【高中化学】高中化学知识点:沉淀溶解平衡沉淀溶解平衡:1.定义:在一定条件下,当难熔电解质的溶解速率等于溶液中相关离子再生沉淀的速率时,溶液中溶解与沉淀之间的动态平衡称为沉淀-溶解平衡。
例如:2.沉淀-溶解平衡特征:(1)逆:沉淀溶解平衡是可逆过程。
(2)等等:(3)动:动态平衡,溶解的速率和沉淀的速率相等且不为零。
(4)测定:当达到平衡时,溶液中各离子的浓度保持不变,(5)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3.影响沉淀溶解平衡的因素(1)内因:难溶电解质本身的性质。
(2)外因a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但不变。
b.温度:多数难溶电解质溶于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时变大点。
c.同离子效应:向沉淀溶解平衡体系中,加入含原体系中某离子的物质,平衡向沉淀生成的方向移动,但不变。
d.其他:向沉淀溶解平衡体系中,加入可与体系巾某些离子反应生成更难溶的物质或气体的物质,平衡向溶解的方向移动,不变。
沉淀溶解平衡的应用:1.降水的形成(1)意义:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法a.调节ph法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节ph至7~8,可使变成沉淀而除去。
b、添加沉淀剂的方法:如果等作沉淀剂,使某些金属离子如从而形成极难溶解的硫化物等沉淀,也是分离、除杂常用的方法。
注:化学上,通常认为溶液中剩余的离子浓度小于时即沉淀完全。
2.沉淀的溶解(1)意义:在实际工作中,常常会遇到需要使难溶物质溶解的问题、根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去沉淀溶解平衡体系中的相应离子,使平衡会朝着沉淀溶解的方向移动,使沉淀溶解。
(2)方法a、生成弱电解质:在沉淀-溶解平衡体系中加入适当的物质与某些离子反应生成弱电解质。
如香沉淀中加入解决方案结合生成邮寄的溶解平衡向右移动。
无机化学第6章 难溶强电解质的沉淀-溶解平衡

常见难溶强电解质的溶度积
二、标准溶度积常数与溶解度 的关系
一定温度下,溶度积和溶解度都可表示难 溶电解质在水中的溶解能力。
若溶解度s 的单位用mol.L-1,称为摩尔溶 解度。
注意:推导若溶度积和溶解度关系时, 溶解度采用摩尔溶解度。
2. 溶度积与溶解度
二、标准溶度积常数与溶解度的关系
难溶强电解质Mv Av饱和溶液中存在沉淀-溶解平衡:
MvAv (s) vMz (aq) vAz (aq)
1-2型
如:Ag2CrO4 (s) 2Ag+ (aq) + CrO42- (aq)
2s
s
Ksp ={ceq (Ag+ )}2 {ceq (CrO42- )}= (2 s)2 (s)
Question
我们常说的沉淀,是不是一点都不溶?
例:
实验:取上层清液适量
滴加少量KI溶液
黄色沉淀(AgI)
AgCl
是否含有 s(AgCl)=1.34×10-5 mol·L-1
Ag+、Cl-
=1.92×10-4克/100mL
Question
我们常说的沉淀,是不是一点都不溶?
例:
AgCl(s) 溶解 AgCl(aq) 沉淀
AgCl(aq)
解离 Ag+ (aq)+ Cl-(aq) 分子化
AgCl
是否含有
AgCl(s)
溶解 Ag+ (aq)+ Cl-(aq) 沉淀
Ag+、Cl-
沉淀-溶解平衡
图 6-1 难溶强电解质的溶解和沉淀过程
沉淀溶解平衡
难溶强电解质Mv+Av-饱和溶液中存在如下动态平衡:
难溶电解质的沉淀溶解平衡

难溶电解质的沉淀溶解平衡1. 引言你有没有想过,在我们的生活中,许多看似普通的事情背后,其实隐藏着一套复杂的化学原理?今天,我们就来聊聊一个听起来有点高大上的话题——难溶电解质的沉淀溶解平衡。
别担心,不用怕,这个词听起来像是在讲课,其实它背后可是有趣得很!就像一场关于水和盐的小戏剧,咱们来细细品味一下。
2. 难溶电解质的世界2.1 什么是难溶电解质?首先,咱们得知道,什么叫难溶电解质。
简单来说,难溶电解质就是在水中不容易溶解的盐,比如碳酸钙、硫酸钡这些。
它们就像个性十足的小家伙,宁愿呆在自己的小世界里,也不想和水混在一起。
你能想象吗?这些盐在水里就像石头一样,静静待着,不肯动弹。
2.2 沉淀与溶解的斗争然而,事情并没有那么简单。
虽然这些电解质在水中难以溶解,但它们仍然和水发生着一场“潜伏已久”的较量。
就像老江湖一样,沉淀(也就是不溶解的部分)和溶解(水中能形成的部分)之间总是有那么一丝丝微妙的平衡。
换句话说,水中的这些难溶电解质,虽不愿意溶解,却又总是会跟水“你来我往”。
这就像是在谈恋爱,一边拉扯,一边又互相吸引,真是纠缠不清!3. 沉淀溶解平衡的秘密3.1 平衡的奥秘那么,这种沉淀和溶解的平衡到底是怎么回事呢?这就涉及到一个叫做“化学平衡”的概念。
听起来有点复杂,其实就是在某种条件下,沉淀和溶解的速率相等时,整个系统就达到了平衡。
就像两个人打架,打着打着,突然决定休战,互不相扰。
每一秒都有一些盐溶解到水中,同时又有一些从水中沉淀出来。
这种微妙的平衡,才让难溶电解质在水中生存得如此“自在”。
3.2 影响因素但是,平衡可不是一成不变的哦!就像天气一样,今天阳光明媚,明天可能就下雨。
我们可以通过改变温度、压力,甚至是盐的浓度,来影响这个平衡。
比如说,温度一升高,盐的溶解度可能就会增加,沉淀的部分就会减少。
想象一下,天气热了,人们都想去海滩玩,盐也一样,想要“溶”进水里,享受那份清凉。
4. 生活中的应用4.1 实际例子那么,难溶电解质的沉淀溶解平衡在我们的生活中有什么用呢?其实,它们可谓无处不在哦!比如在水处理过程中,为了去除水中的杂质,往往需要利用这些难溶电解质进行沉淀反应。
难溶电解质的沉淀溶解平衡
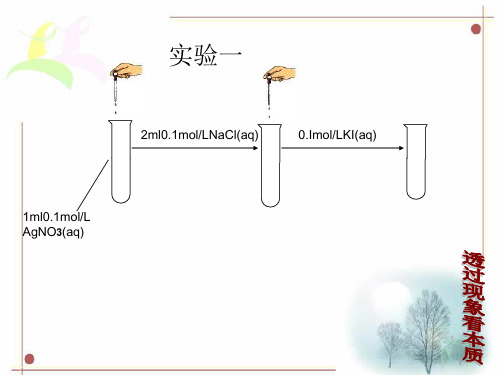
2ml0.1mol/LNaCl(aq)
0.Imol/LKI(aq)
1ml0.1mol/L AgNO3(aq)
一、 难溶电解质的溶解平衡
1、概念: 在一定条件下,当难溶电解质 v(溶解)= v (沉淀)时, 此时溶液中存在的溶解和沉淀间的动态平衡,称为沉 淀溶解平衡. 溶解平衡时的溶液是饱和溶液。
滴加0.5mol/L
Na2SO4(aq)
2C5a℃CO溶3解:1.度5 :×10-3g CaSO4:2.1 ×10-1g
注意:观察对比生成沉淀时Na2CO3(aq) 和Na2SO4(aq)的用量及实验现象。
水垢的主要成分:CaCO3、CaSO4、Mg(OH)2 如何除去水垢?
沉淀的溶解
实验三
CaCO3(S)
• 1、为什么医学上做胃部造影所服用的“钡餐”是 BaSO4而不是BaCO3?
• 2、为什么钙片的成分是CaCO3而不是CaSO4?
• 3、菠菜和豆腐为什么不宜同食?
• 4、如何预防肾结石[CaC2O4和Ca3(PO4)2]呢?
硬水的成分:是指含有较多Ca 、Mg 的水
——硬水的危害
1、全棉衣服或毛巾板结僵硬,多次洗涤后 颜色黯淡 。
2、洗澡后皮肤干燥、粗糙、发痒 。 3、热水器、增湿器、洗衣机等设备管路阻
塞、流量减小、寿命缩短 。
二、沉淀平衡的应用
沉淀的生成
实验二
滴加0.5mol/L
Na2CO3(aq)
CaCl2(aq) 0.5mol/L各1ml
①绝对不溶的电解质是没有的。
②同是难溶电解质,溶解度差别也很大。
b、外因:遵循平衡移动原理
①浓度: 加水,平衡向溶解的方向移动。 加入相同离子,平衡向沉淀方向移动。
第四节 难溶电解质

(3)影响因素:KSP只与难溶电解质的 性质和温度有关
(4)应用:判断有无沉淀——溶度积规则 Q(离子积)= [c(Mn+)]m·[c(Am-)]n
Q>KSP时,溶液中有沉淀析出 Q=KSP时,沉淀与溶解处于平衡状态
Q<KSP时,溶液中无沉淀析出
二、沉淀溶解平衡的应用
(一)沉淀的生成
方法:1、调节pH法:
例:Ag2S(s) 2Ag+(aq)+S2-(aq) Ksp=c2(Ag+)·c(S2-)
(2)意义:
对于同类型(阴、阳离子个数相同)的难溶电解质, 在相同温度下,Ksp越大→S(溶解度)越大
例:Ksp(AgCl)=1.8×10-10 Ksp(AgBr)=6.3×10-15 说明S(AgCl)> S(AgBr)
除去NH4Cl中的FeCl3 溶于水,加NH3 H2O调节pH值在7-8
Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ 2、加沉淀法:
以Na2S、H2S做沉淀剂除去Cu2+和Hg2+
Cu2 S 2 CuS
Hg
2
S 2
HgS
Cu2 H2S CuS 2H Hg 2 H2S HgS 2H
(3)如果生成各种沉淀所需试剂离子的浓度相差较大, 就能实现分步沉淀,从而达到提纯、分离的目的。
3、常见转化:常用银盐溶解度的大小顺序
Ag2CrO4 ↓(砖红色)Cl AgCl↓(白) Br AgBr↓(浅黄色)
I AgI↓(黄色) S2 Ag2S↓(黑色)
4、应用:
(1)锅炉除水垢:CaSO4
注:(1)生成沉淀的离子反应不能进行到底(即离子浓度≠0), 一般情况下,当溶液中剩余离子的浓度小于1×10-5mol/L时,化学 上通常认为生成沉淀的反应就进行完全了
第22讲难溶电解质的沉淀溶解平衡

知识精讲
一、沉淀溶解平衡的基本概念
3. 沉淀溶解平衡方程式 MmAn(s) ⇌ mMn+(aq) + nAm-(aq)
沉淀溶解平衡方程式中各物质 要标明聚集状态 → “s” “aq”
如AgCl沉淀溶解平衡:AgCl(s) ⇌ Ag+(aq) + Cl-(aq)
请写出Ag2S、Ca(OH)2的溶解平衡方程式
如Fe(OH)3(s) ⇌ Fe3+ (aq) + 3OH- (aq) Ksp= c(Fe3+)·c3(OH-) 2.影响因素 ① 溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关。 ② 溶解平衡一般是吸热的,温度升高,平衡正移,Ksp增大,但Ca(OH)2相反。
知识精讲
三、溶度积(Ksp) 3. 意义
第22讲 难溶电解质的沉淀溶解平衡
课前引入
初中所学,关于物质的溶解性是如何分类的?
往饱和 NaCl 溶液中加入浓盐酸,会有什么现象?
课前引入
NaCl 饱和溶液中,存在溶解平衡:NaCl(s) ⇌ Na+(aq)+Cl-(aq) 加浓盐酸,Cl- 的浓度增大,平衡逆向移动,NaCl析出
NaCl 饱和溶液存在溶解平衡,那难溶的电 解质在水中是否也存在溶解平衡呢?
D
对点训练
题型四:沉淀溶解平衡图像
【例5】(2021·江苏昆山·高二月考)不同温度(T1和T2)时,硫酸钡在水中的 沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法 正确的是
A.T1>T2 B.加入BaCl2固体,可使溶液由a点变到c点 C.c点时,在T1、T2两个温度下均没有固体析出 D.图中c点对应的是T1时硫酸钡的过饱和溶液
知识精讲
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题:难溶电解质的沉淀溶解平衡
1.下列说法正确的是()
A.难溶电解质的溶度积K sp越小,则它的溶解度越小
B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用K sp表示
C.溶度积常数K sp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,K sp也变小2.(2010年天津理综)下列液体均处于25 ℃,有关叙述正确的是()
A.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)不变
B.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明K sp[Cu(OH)2]<K sp[Mg(OH)2]
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)增大
3.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是()
提示:BaSO4(s)2+(aq)+SO2-4(aq)的平衡常数K sp=c(Ba2+)·c(SO2-4),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的K sp大于c点对应的K sp
4.已知:K sp(AgCl)=1.8×10—10,K sp(AgI)=1.5×10—16 ,K sp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI> Ag2CrO4B.AgCl> Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl 5.已知25℃时,电离常数K a(HF)=3.6×10-4,溶度积常数K sp(CaF2)=1.46×10-10。
现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1 mol/L HF溶液中pH=1
B.K sp(CaF2)随温度和浓度的变化而变化
C.该体系中,K sp(CaF2)=
1
K a
D.该体系中有CaF2沉淀产生
6.已知298K时下列物质的溶度积(单位略
)
下列说法正确的是()
A.等体积浓度均为0.02mol·L-1的CH3COONa和AgN03溶液混合能产生沉淀
B.离浓度均为0.01mol·L-1的CrO42-和Cl-混合溶液中慢慢滴入AgN03溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加人盐酸发生反应的离子方程式:
CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时.上述四种饱和溶液的物质的量浓度:
7.已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。
AgX(s) +(aq)+X-(aq)
Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-
10
+(aq)+Y-(aq)
Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s) +(aq)+Z-(aq)
Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/溶液的体积表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为__________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)__________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为__________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:______________________。
②在上述(3)体系中,能否实现AgY向AgX的转化?根据自己的观点选答一项。
若不能,请简述理由:________________________________________________。
若能,则实现转化的必要条件是:__________________。
8.已知常温下AgCl 与AgI 的溶度积分别是。
若向200 mL 饱和AgCl 溶液中加入等体积的KI 溶液,为使饱和溶液中产生AgI 沉淀,则所需加入的KI 溶液的物质的量浓度最小是______________。
9.已知溶液中c (Ag +)、c (Cl -)的乘积是一个常数,
即K sp (AgCl)=c (Ag +)·c (Cl -)=1.0×10-10(mol·L -1)2向50 mL 0.018 mol/L 的AgNO 3溶液中
(1)加入50 mL 0.018 mol/L 的盐酸,生成沉淀后,溶液中c (Ag +)=________。
(2)加入50 mL 0.020 mol·L -1的盐酸,生成沉淀。
①沉淀生成后溶液中c (Ag +)为 。
②沉淀生成后溶液的pH 是________。
10. 向氯化钡溶液中加入AgNO 3 和KBr ,当两种沉淀共存时,c(Br -)/c(Cl -)==
K sp (AgCl )=2.0×10—10,K sp (Ag (Br )=5.4×10—13
11. 查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积K sp =8.0×10-38, Cu(OH)2的溶度积K sp =3.0×10-20,通常残留在溶液中的离子浓度小于 1×10-5 mol·L -1时就认为沉淀完全,设溶液中CuSO 4的浓度为3.0 mol·L -1,
则Cu(OH)2开始沉淀时溶液的pH 为_______,Fe 3+
完全沉淀时溶液的pH 为________。
(提示:lg 5=0.7)
12. 25°C 时,BaCO 3和BaSO 4的溶度积常数分别是8x10-9和1X10
-10,某含有BaCO 3 沉淀的悬浊液中,
,如果加入等体积的Na 2SO 4溶
液,若要产生 BaSO 4沉淀,加入Na 2SO 4溶液的物质的量浓度最小是________mol • L _1。
13. CO 2在自然界循环时可与CaCO 3反应,CaCO 3是一种难溶物质,其K SP =2.8×10-9(25℃)。
现将体积比为1:1的CaCl 2溶液与Na 2CO 3溶液混合,若混合前Na 2CO 3溶液的浓度为2×10 -4mol·L -1,则生成沉淀所需原CaCl 2溶液
的最小浓度为 。
14. 刻蚀印刷电路的废液中含有大量的CuCl 2、FeCl 2、FeCl 3,任意排放将导致环境污染和资源的浪费,为了使FeCl 3循环利用和回收CuCl 2,现设计如下生产过程:
①试剂Y 的名称 ;物质X 最好是 (填化学式)。
②若常温下1L 废液中含CuCl 2、FeCl 2、FeCl 3的物质的量浓度均为0.5 mol·1L ,
则加入Cl 2气和物质X 使溶液的pH 在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl 2 不产生沉淀。
( K SP [Fe(OH)3]=1.0×10—38 、 K SP [Cu(OH)2]=2.0×10—20 、 lg5=0.7)。
