等效电阻的计算题(培优)
欧姆定律等效电路培优习题
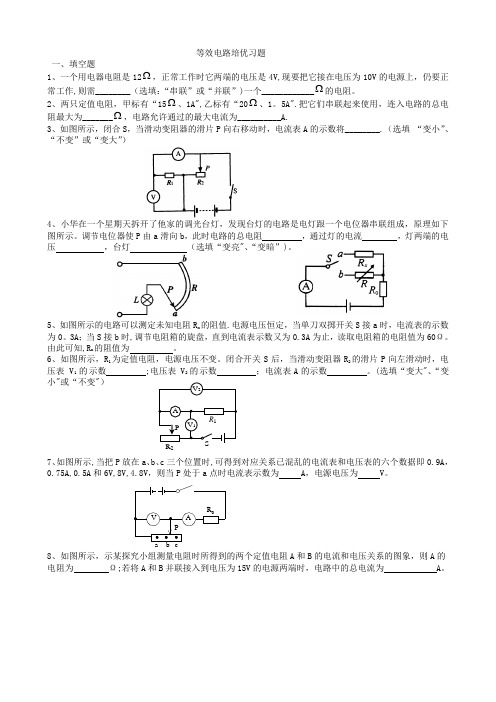
等效电路培优习题 一、填空题1、一个用电器电阻是12Ω,正常工作时它两端的电压是4V,现要把它接在电压为10V 的电源上,仍要正常工作,则需________(选填:“串联”或“并联”)一个____________Ω的电阻。
2、两只定值电阻,甲标有“15Ω、1A",乙标有“20Ω、1。
5A".把它们串联起来使用,连入电路的总电阻最大为_______Ω,电路允许通过的最大电流为__________A.3、如图所示,闭合S ,当滑动变阻器的滑片P 向右移动时,电流表A 的示数将________.(选填 “变小”、“不变”或“变大”)4、小华在一个星期天拆开了他家的调光台灯,发现台灯的电路是电灯跟一个电位器串联组成,原理如下图所示。
调节电位器使P 由a 滑向b ,此时电路的总电阻 ,通过灯的电流 ,灯两端的电压 ,台灯 (选填“变亮"、“变暗”)。
5、如图所示的电路可以测定未知电阻R x 的阻值.电源电压恒定,当单刀双掷开关S 接a 时,电流表的示数为0。
3A ;当S 接b 时,调节电阻箱的旋盘,直到电流表示数又为0.3A 为止,读取电阻箱的电阻值为60Ω。
由此可知,R x 的阻值为 。
6、如图所示,R 1为定值电阻,电源电压不变。
闭合开关S 后,当滑动变阻器R 2的滑片P 向左滑动时,电压表V 1的示数 ;电压表V 2的示数 ;电流表A 的示数 。
(选填“变大"、“变小"或“不变")7、如图所示,当把P 放在a 、b 、c 三个位置时,可得到对应关系已混乱的电流表和电压表的六个数据即0.9A ,0.75A,0.5A 和6V,8V,4.8V ,则当P 处于a 点时电流表示数为 A ,电源电压为 V 。
VPa b cAR 08、如图所示,示某探究小组测量电阻时所得到的两个定值电阻A 和B 的电流和电压关系的图象,则A 的电阻为 Ω;若将A 和B 并联接入到电压为15V 的电源两端时,电路中的总电流为 A 。
等效电阻练习题
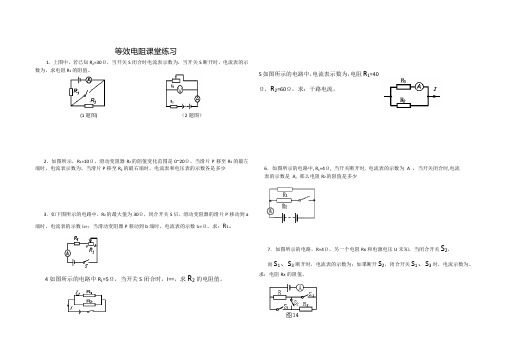
等效电阻课堂练习
1. 上图中,若已知R2=30Ω,当开关S闭合时电流表示数为,当开关S断开时,电流表的示
数为,求电阻R1的阻值。
(1题图) (2题图)
2.如图所示,R1=10Ω,滑动变阻器R2的阻值变化范围是0~20Ω。
当滑片P移至R2的最左端时,电流表示数为。
当滑片P移至R2的最右端时,电流表和电压表的示数各是多少
3.如下图所示的电路中,R2的最大值为30Ω,闭合开关S后,滑动变阻器的滑片P移动到a 端时,电流表的示数I1=;当滑动变阻器P移动到b端时,电流表的示数I2=Ω。
求:R1。
4如图所示的电路中R1=5Ω,当开关S闭合时,I==,求R2的电阻值。
5如图所示的电路中,电流表示数为,电阻R1=40
Ω,R2=60Ω,求:干路电流。
6.如图所示的电路中, R1=4Ω, 当开关断开时, 电流表的示数为A ,当开关闭合时,电流
表的示数是A, 那么电阻R2的阻值是多少
7.如图所示的电路,R=4Ω,另一个电阻Rx和电源电压U未知,当闭合开关S2,
而S1、S3断开时,电流表的示数为;如果断开S2,闭合开关S1、S3时,电流示数为。
求:电阻Rx的阻值。
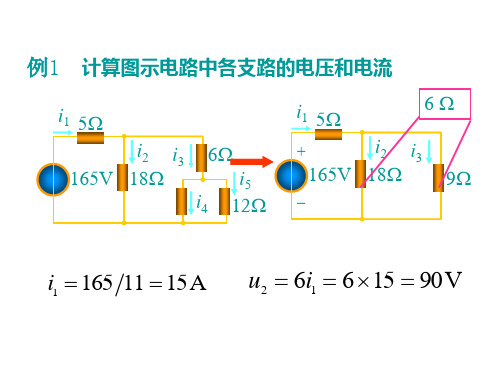
电阻电路的等效变换例题
15
-
等效
5
+ 10 u_1 15
u1 15i1
i2
u1 10
1.5i1
i i1 i2 2.5i1
u 5i u1 5 2.5i1 15i1 27.5i1
Rin
u i
27.5i1 2.5i1
11Ω
Rin
5 1015 10 15
11Ω
E
R
- 3k 3k
例9 求负载电阻RL消耗的功率
30
30
20 10 10 20
20 30 20
2A
2A 30
30 40 RL
30
10 40 RL
30
I L 1A
PL
RL
I
2 L
40W
10 2A
10 10
40
IL RL
40
例10 利用电源转换简化电路计算
ab 20 100
60 40
例5 求: Rab
5
15 6
a b
20 缩短无 电阻支路
7
6
Rab=10
4 a b
15
10
20
5
a
15 b
7 6 6 4 a
b
15 7
3
• 例6 计算90电阻吸收的功率
1 +
20V
-
1 +
20V
-
1
10
4 9 90
6A
10 + 6_6V
• 1.
+ 10V
_ 10
+ 6A _10V
7A 10
(完整版)电阻电路的等效变换习题及答案
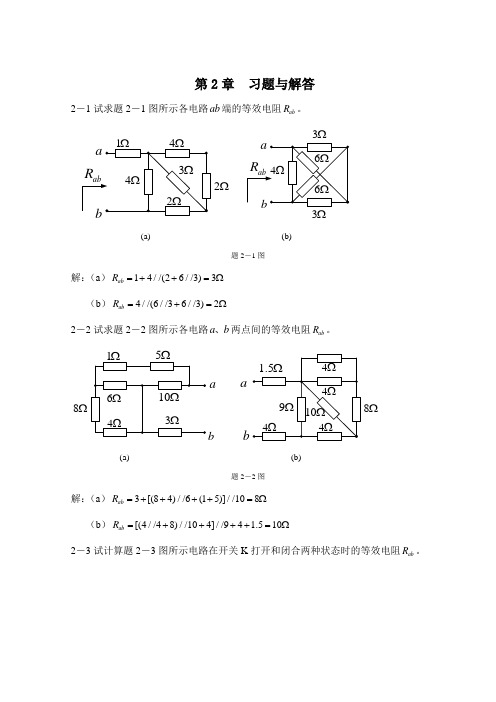
第2章 习题与解答2-1试求题2-1图所示各电路ab 端的等效电阻ab R 。
2Ω3Ω(a)(b)题2-1图解:(a )14//(26//3)3ab R =++=Ω (b )4//(6//36//3)2ab R =+=Ω2-2试求题2-2图所示各电路a b 、两点间的等效电阻ab R 。
ab8Ωab8Ω(a)(b)题2-2图解:(a )3[(84)//6(15)]//108ab R =++++=Ω (b )[(4//48)//104]//94 1.510ab R =++++=Ω2-3试计算题2-3图所示电路在开关K 打开和闭合两种状态时的等效电阻ab R 。
8Ωab(a) (b)题2-3图解:(a )开关打开时(84)//43ab R =+=Ω开关闭合时4//42ab R ==Ω(b )开关打开时(612)//(612)9ab R =++=Ω开关闭合时6//126//128ab R =+=Ω2-4试求题2-4图(a )所示电路的电流I 及题2-4图(b)所示电路的电压U 。
6Ω6Ω(a) (b)题2-4图解:(a )从左往右流过1Ω电阻的电流为1I 21/(16//123//621/(142)3A =++++=)=从上往下流过3Ω电阻的电流为36I 32A 36=⨯=+ 从上往下流过12Ω电阻的电流为126I 31A 126=⨯=+ 所以 312I I -I =1A =(b )从下往上流过6V 电压源的电流为 66I 4A 1.5===(1+2)//(1+2)从上往下流过两条并联支路的电流分别为2A 所以 U 22-12=2V =⨯⨯2-5试求题2-5图所示各电路ab 端的等效电阻ab R ,其中121R R ==Ω。
2Ω(a)(b)题2-5图解:(a )如图,对原电路做△-Y 变换后,得一平衡电桥1a所以 111//11332ab R =++=Ω()()(b )将图中的两个Y 形变成△形,如图所示2Ωab即得4021Ωab所以 1.269ab R =Ω2-6计算题2-6图所示电路中a b 、两点间的等效电阻。
【初中物理】人教版九年级全一册第1课时 等效电阻(练习题)

人教版九年级全一册第1课时等效电阻(154)1.并联电路中总电阻的倒数等于。
若并联=,也可的两个电阻阻值分别为R1、R2,并联后的总电阻为R,则1R以表示为。
2.电阻的并联相当于增加了电阻的横截面积,所以并联电阻的总电阻比任何一个分电阻都,且并联的电阻越多,总电阻越。
(均选填“大”或“小”)3.电阻R1=15Ω,R2=30Ω,把它们并联在电压为4.5V的电源两端,则并联后的等效电阻为,通过R2的电流为。
4.一个阻值为0.1Ω的电阻与另一个阻值为10Ω的电阻并联,并联后的等效电阻()A.小于0.1ΩB.等于1ΩC.等于10.1ΩD.小于10Ω但大于0.1Ω5.下列几组电阻并联后,等效阻值最小的一组是()A.30Ω和15ΩB.20Ω和25ΩC.10Ω和35ΩD.5Ω和40Ω6.下图中有四组不同的电阻,已知R1<R2。
那么电阻最小的是()A. B.C. D.7.有两个阻值不同的电阻R1、R2,它们的电流随电压变化的U−I图象如图所示。
如果R1、R2串联后的总电阻为R串,并联后的总电阻为R并,则关于R串、R并的U−I 图线所在的区域,下列说法中正确的是()A.R串在Ⅰ区域,R并在Ⅲ区域B.R串在Ⅱ区域,R并在Ⅰ区域C.R串在Ⅰ区域,R并并在Ⅱ区域D.R串和R并都在Ⅰ区域8.将n个相同的电阻R1分别串联和并联在相同的电源上,总电阻分别为R串和R并,则串联总电阻与并联总电阻的比值为()A.n2B.nR1C.R12D.R19.如图甲所示的电路中,电源电压恒为12V,滑动变阻器铭牌上标有“100Ω0.5A”字样,图乙为R1的U—I图象,则R1的阻值为Ω。
当电路中的电流为0.2A 时,滑动变阻器R2接入电路的阻值为Ω。
为了不损坏变阻器R2,其接入电路的阻值应不小于Ω。
10.某用电器R1上标有“10Ω3A”的字样,另一用电器R2上标有“50Ω15A”字样。
问:(不能烧坏用电器)(1)若把R1、R2串联后接到电源上,为了使其中一个用电器正常工作,电源电压应不超过多少伏?(2)若把R1、R2并联起来接到电源上,为使其中一个用电器正常工作,干路中的电流应不超过多少安?11.如图所示,电源电压为6V,R2=30Ω,滑动变阻器R1的取值范围为0~120Ω,求:(1)当S闭合后,滑片P移到滑动变阻器R1的中点时,通过电阻R2的电流I2和电路的总电流I。
等效电阻练习题

等效电阻练习题等效电阻练习题电阻是电路中常见的元件之一,它能够限制电流的流动。
在电路中,多个电阻可以串联或并联,从而形成不同的电路结构。
而等效电阻就是将这些串联或并联的电阻简化为一个单一的电阻,以便于分析和计算电路的性质和特点。
在学习电路的过程中,我们经常会遇到等效电阻的计算题目。
这些题目旨在考察我们对电阻串联和并联的理解和应用能力。
下面,我们就来看几个典型的等效电阻练习题。
题目一:串联电阻的计算已知电路中有三个电阻,分别为R1=10Ω,R2=20Ω,R3=30Ω。
求这三个电阻串联后的等效电阻。
解析:串联电阻的计算很简单,只需要将各个电阻的阻值相加即可。
所以,等效电阻R=10Ω+20Ω+30Ω=60Ω。
题目二:并联电阻的计算已知电路中有两个电阻,分别为R1=10Ω,R2=20Ω。
求这两个电阻并联后的等效电阻。
解析:并联电阻的计算稍微复杂一些,需要应用并联电阻的公式。
公式为1/R=1/R1+1/R2,其中R1和R2分别为并联电阻的阻值。
代入数值计算得到1/R=1/10Ω+1/20Ω=3/20Ω,然后将分数倒数得到R=20Ω/3。
题目三:复杂电路的等效电阻计算已知电路中有四个电阻,分别为R1=10Ω,R2=20Ω,R3=30Ω,R4=40Ω。
其中R1和R2并联,R3和R4串联,然后两个并联电阻和串联电阻再并联。
求整个电路的等效电阻。
解析:这是一个稍微复杂一些的电路,需要将电路进行分解和组合。
首先,将R1和R2并联后的等效电阻记为R12。
根据并联电阻的公式,可以得到1/R12=1/R1+1/R2=1/10Ω+1/20Ω=3/20Ω,然后将分数倒数得到R12=20Ω/3。
接下来,将R3和R4串联后的等效电阻记为R34。
根据串联电阻的计算方法,可以得到R34=R3+R4=30Ω+40Ω=70Ω。
最后,将R12和R34并联后的等效电阻记为R。
根据并联电阻的计算方法,可以得到1/R=1/R12+1/R34=1/(20Ω/3)+1/70Ω=3/20Ω+1/70Ω=11/140Ω,然后将分数倒数得到R=140Ω/11。
(完整版)电阻电路的等效变换习题及答案.docx
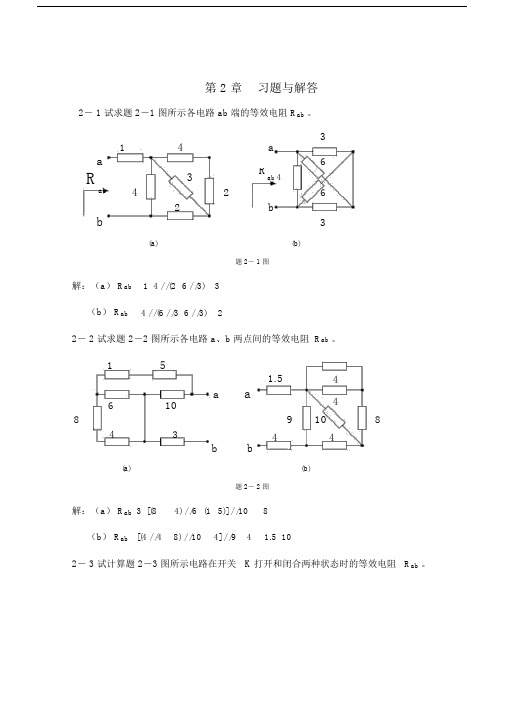
第 2 章 习题与解答2- 1 试求题 2-1 图所示各电路 ab 端的等效电阻 R ab 。
143aa6Rab43Rab 426b2b3(a)(b)题 2- 1 图解:(a ) R ab1 4 / /(2 6 / /3) 3(b ) R ab4 / /(6 / /3 6 / /3)22- 2 试求题 2-2 图所示各电路 a 、b 两点间的等效电阻 R ab 。
151.54a 610a49883104bb 44(a)(b)题 2- 2 图解:(a ) R ab 3 [(84) / /6 (1 5)] / /10 8(b ) R ab [(4 / /48) / /104] / /941.5 102- 3 试计算题 2-3 图所示电路在开关 K 打开和闭合两种状态时的等效电阻 R ab 。
4612a a48b6K12b K(a)(b)题 2- 3 图解:(a)开关打开时R ab(8 4) / /43开关闭合时 R ab 4 / /42(b)开关打开时R ab(6 12) / /(612) 9开关闭合时 R ab 6 / /12 6 / /12 82- 4 试求题 2-4 图(a)所示电路的电流 I 及题 2- 4 图( b)所示电路的电压 U 。
1361221VI6V U 12621 (a)(b)题2- 4 图解:(a)从左往右流过 1电阻的电流为I1 21/ (1 6 / /12 3 / /6) =21/ (1 4 2)3A从上往下流过 3电阻的电流为I 3632A 36从上往下流过 12电阻的电流为 I1263 1A 126所以 I I 3 -I12 =1A(b)从下往上流过 6V 电压源的电流为I664A ( 1+2) //( 1+2) 1.5从上往下流过两条并联支路的电流分别为2A所以U 2 2-1 2=2V2- 5 试求题 2-5 图所示各电路 ab 端的等效电阻R ab,其中R1R21。
(完整版)电阻电路的等效变换习题及答案

第 2 章习题与解答2-1试求题2-1图所示各电路ab端的等效电阻R ab题2-1 图解:(a) R ab 1 4//(2 6//3) 3b)R ab 4/ /(6/ /3 6/ /3) 22-2试求题2-2图所示各电路a、b两点间的等效电阻R ab解:(a) R ab 3 [(8 4)//6 (1 5)]/ /10 8(b) R ab [(4 / /4 8)/ /10 4]//9 4 1.5 102-3试计算题2-3图所示电路在开关K 打开和闭合两种状态时的等效电阻R ab(a)(b)1(a)题2-2 图解:(a)开关打开时R ab (8 4)/ /4 3开关闭合时R ab 4//4 2b)开关打开时R ab(6 12) / /(6 12) 9开关闭合时R ab6//12 6/ /12 8题2-4 图解:(a)从左往右流过1电阻的电流为I1 21/ (1 6/ /12 3 / /6)=21/ (1 42) 3A从上往下流过3电阻的电流为I3从上往下流过12 电阻的电流为I1263 2A366 3 1A12 6所以I I3-I12 =1Ab)从下往上流过6V 电压源的电流为I1+2) // (1+2) 1.56 4A2从上往下流过两条并联支路的电流分别为2A 所以 U 2 2-12=2V2-5试求题 2-5图所示各电路 ab 端的等效电阻 R ab ,其中 R 1 R 2 1b )将图中的两个 Y 形变成△形,如图所示2.58445即得2(b)题 2-5 图1 11所以 R ab ( 1 1)/(/ 1 1) 1ab3 3 2所以R ab 1.269解:(a)将图中的Y 形变成△形,如图所示所以R ab 12//6 4b)将图中的Y 形变成△形,如图所示209402140382-6计算题2-6图所示电路中a8888 8 8b(a)12所以R ab 3/ /4 122-7 对题2-7 图所示电路,应用Y—△等效变换求电路ab 端的等效电阻角线电压U 及总电压U ab 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有关等效电阻的欧姆定律计算题
一、知识梳理:
1、串联、并联电路的电流、电压、电阻特点 注意:n 个相同的电阻R 1串联,总电阻R=
n 个相同的电阻R 1并联,总电阻R= 2、欧姆定律(注意同体性、同时性、统一单位)
U = I =
R =
二、中考真题:
如图所示.电源电压U 保持不变,滑动变阻器R 2的最大
阻值为20Ω,灯泡L 的电阻是10Ω。
当S 闭合,S 1断开,且滑片P 在b 端时,电流表示数为0.2A :当S 、S 1都闭合,且滑片P 在b 端时,电流表的示数为0.8A ,则电源电压为_____V ,电阻R 1的阻值为_____Ω. 三、过关检测
1、 现在电阻R 1=30Ω,R 2=20Ω,(1)若将R 1,R 2串联,则总电阻是多少?(2)若将R 1、R 2并联,则总电
阻是又是多少?
2、如图2所示电路,电源电压为50V ,电阻R 1=10Ω,R 2=15Ω,闭合开关后,求:(1)电路的总电阻R (2)电路中的电流I (3)R 1两端的电压U 1
3.如图3所示电路中,电源电压为6V ,R 1=8Ω,R 2=4Ω,闭合开关。
求:(1)电路的总电阻(2)通过R 1的电流 (3)电流表的示数(4)电压表的示数
4、如图4所示电路,R 1=3Ω,R 2=6Ω,电源电压为18V ,求:(1)R 1 、R 2并联后的
总电阻是多少?(2)电流表的示数是多少?
5、如图5所示,R 1=30Ω,闭合开关后,电流表的示数为0.3A ,电压表的示数为6V 。
求:(1)求R 1和R 2并联后的总电阻。
(2)R 2的电阻
6、如图6所示,已知电流表的示数为0.3A ,电压表的示数是9V ,L 1的电阻R 1=20
Ω,
求:(1)L 1与L 2的总电阻R (2)L 2的电阻R 2 (3)L 2两端电压U 2 7. 在图7电路中,电阻R 1的阻值为10Ω.闭合开关S ,电流表A 的示数为0.6A ,电流表A1示数为0.3A ,求:(1)通过电阻R 1的电流.(2)电源电压.
(3)电阻R 2的阻值. (4)R 1与R 2的总电阻。
8.如图8所示,已知电源电压U 为6V ,电阻R 1=5Ω, 电流表的示数为I=1.5A ,求:
串联电路
并联电路
电路图
电流特点 串联电路中各处的电流相等。
公式: 在并联电路中干路里的电流等于各支路中的电流之和。
公式: 电压特点
串联电路两端的电压等于串联电路中各部分电路两端的电压之和。
公式:
在并联电路中,各支路两端的电压相等。
公式: 电阻特点
串联电路的总电阻等于各串联电阻之和。
公式: 并联电路的总电阻的倒数等于各支路电阻的倒数之和。
公式: 或
图2 R 1 R 2 图6 L 1 L 2 A V 图3 R 1 R 2 V
A 图7 R 1R 2
A
A 1 R 1
R 2
A
图8
R 1R 2
A 图4 V A
R 1
R 2 图5 R 1
R 2
R 2
R 1
(1)R 1两端的电压U 1;(2)R 1与R 2的总电阻。
(3)通过R 2的电流I 2;(4)R 2的阻值。
9. 根据电路如图9所示,已知电源电压为24V ,电阻R 2的阻值为40 Ω,闭合开关后,电流表的示数为0.8 A ,求:(1)R 1的阻值;(2)电路的总电阻。
下面是小鹏对该题的计算过程,你认为正确吗?如果不正确,请说明理由,
并写出你的正确解答过程。
10、在右图10所示的电路中,电源电压不变,当开关闭合后,
电流表的示数为0.6A, R 1和R 2
并联后的总电阻为20Ω,求(1)电源电压U (2)若R 1的电阻为24Ω,则电阻R 2的阻值为多少?
11、如图11所示,电阻R 1=R 2=4Ω,电源电压保持不变。
(1)当S 1、S 2都闭合时,电流表的示数为1.5A ,此时电路的总电阻为多少?当S 2闭合、S 1断开时,电路的总电阻是多少?电流表的示数又是多少?
12、如图12所示,R 1与R 2串联在电路中,已知R 1两端电压为2V ,R 2两端电压为4V ,其中R 2为滑动变阻器,滑片在最左端,R 1+R 2=60Ω。
求:⑴R 1的阻值和R 2的最大阻值各为多少?
⑵R 2的滑片由左向右滑动时,电流表的示数大小如何变化?
13、如图13所示,已知电源电压为9V ,另外手头有四个电阻R 1=15Ω,R 2=25Ω,R 3=100Ω,R 4=5Ω请你用其中的两个电阻在图中虚线框内连成电路,使图中的电流表的示数为0.45A 。
请求出电路中的总电阻,并在虚线框内画出电路图,并注明连入电路的阻值。
图11
A
R 1
R 2
S 1
S 2
图10
R 1R 2
A 图12
图13
A
图9 R 2 S Ω=Ω+Ω=+=Ω===704030)2(308.024)1(21111R R R A V
I U R。
