第九章思考题与习题.doc
工程热力学-思考题答案-沈维道-第九章

第九章 实际气体答:理想气体模型中忽略了气体分子间的作用力和气体分子所占据的体积。
实际气体只有在高温低压状态下,其性质和理想气体相近。
或者在常温常压下,那些不易液化的气体,如氧气、氦气、空气等的性质与理想气体相似,可以将它们看作理想气体,使研究的问题简化。
2. 答:压缩因子为温度、压力相同时的实际气体比体积与理想气体比体积之比。
压缩因子不仅随气体的种类而且随其状态而异,故每种气体应有不同的曲线。
因此不能取常数。
3. 答:范德瓦尔方程其计算精度虽然不高,但范德瓦尔方程式的价值在于能近似地反映实际气体性质方面的特征,并为实际气体状态方程式的研究开拓了道路,因此具有较高的地位。
4. 答:当需要较高的精度时应采用实验数据拟和得到a 、b 。
利用临界压力和临界温度计算得到的a 、b 值是近似的。
5. 答:在相同的压力与温度下,不同气体的比体积是不同的,但是只要他们的和分别相同,他们的必定相同这就是对应态原理,。
对应态原理并不是十分精确,但大致是正确的。
它可以使我们在缺乏详细资料的情况下,能借助某一资料充分的参考流体的热力性质来估算其他流体的性质。
相对于临界参数的对比值叫做对比参数。
对比温度,对比压力,对比比体积。
6. 答:对简单可压缩的系统,任意一个状态参数都可以表示成另外两个独立参数的函数。
其中,某些状态参数若表示成特定的两个独立参数的函数时,只需一个状态函数就可以确定系统的其它参数,这样的函数就称为“特性函数”由函数知且将两公式进行对比则有,但是对于比容无法用该函数表示出来,所以此函数不是特性函数。
7.答:将状态方程进行求导,然后带入热力学能、焓或熵的一般关系式,在进行积分。
),(T p f Z =r p r T r v 0),,(=r r r v T p f c T T r T =c p p r p =c v v r v =),(p s u u =dp p u ds s u du v p ⎪⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂=pdv Tds du -=p s u T ⎪⎭⎫ ⎝⎛∂∂=8. 答:以为独立变量时,将第二方程代入同时,得到同理:以为独立变量时,将第三方程代入,得到以为独立变量时,将第一方程代入得以为独立变量时,将第三方程代入得9. 答:热力学能、焓、熵都是状态参数,计算两个平衡状态之间的变量可任意选择其过程。
物理化学第九章课后答案完整版

第九章 统计热力学初步1.按照能量均分定律,每摩尔气体分子在各平动自由度上的平均动能为2RT 。
现有1 mol CO气体于0 ºC 、101.325 kPa 条件下置于立方容器中,试求: (1)每个CO 分子的平动能ε; (2)能量与此ε相当的CO 分子的平动量子数平方和()222xy y nn n ++解:(1)CO 分子有三个自由度,因此,2123338.314273.15 5.65710 J 22 6.02210RT L ε-⨯⨯===⨯⨯⨯(2)由三维势箱中粒子的能级公式()(){}2222223223222222221233426208888828.0104 5.6571018.314273.15101.325106.626110 6.022103.81110x y zx y z h n n n ma ma mV m nRT n n n h h h p εεεε-=++⎛⎫∴++=== ⎪⎝⎭⨯⨯⨯⨯⨯⎛⎫= ⎪⨯⎝⎭⨯⨯⨯=⨯2.2.某平动能级的()45222=++zy xn n n,使球该能级的统计权重。
解:根据计算可知,x n 、yn 和z n 只有分别取2,4,5时上式成立。
因此,该能级的统计权重为g = 3! = 6,对应于状态452245425254245,,,,ψψψψψ542ψ。
3.气体CO 分子的转动惯量246m kg 1045.1⋅⨯=-I ,试求转动量子数J 为4与3两能级的能量差ε∆,并求K 300=T 时的kT ε∆。
解:假设该分子可用刚性转子描述,其能级公式为()()J 10077.31045.1810626.61220 ,81224623422---⨯=⨯⨯⨯⨯-=∆+=πεπεI h J J J22210429.710233807.130010077.3--⨯=⨯⨯⨯=∆kT ε4.三维谐振子的能级公式为()νεh s s ⎪⎭⎫ ⎝⎛+=23,式中s 为量子数,即,3 ,2 ,1 ,0=++=z y x s v v v 。
电工技术(第四版高教版)思考题及习题解答:第九章 继电-接触器控制 席时达 编.doc

第九章继电-接触器控制思考题解答9-1-1一个复合按钮的动合触点和动断触点有可能同时闭合或同时断开吗?[答]由教材图9-1-5复合按钮的结构可知,当按钮被按下,动触片移动时,是先断开动断触点,后接通动合触点的,在动触片移动的过程中有一段很短的时间内动断触点和动合触点是同时断开的;当松开按钮时,是动合触点先复位断开,然后动断触点再复位闭合,中间也有一段很短的时间内动断触点和动合触点是同时断开的。
所以复合按钮的动断触点和动合触点只可能同时断开,而不可能同时闭合。
9-2-1 能否直接用按钮来控制三相笼型异步电动机主电路的通/断?为什么?[答]不能,理由有二:1. 三相笼型异步电动机主电路有三根电线,需用三只按钮同步控制,显然不合适;2. 按钮触点的允许通过电流一般不超过5A,而三相异步电动机的额定电流一般都超过此值,起动电流则更大。
9-2-2 在图9-1的电动机起、停控制控制电路中已装有接触器KM,为什么还要装一个隔离开关QS?它们的作用有何不同?图9-1[答] 接触器KM是控制电动机起、停的电器,而刀开关QS是隔离开关,它的作用是在检修时隔离电源以保安全,两者不能互相替代。
9-2-3 在图9-1中,如果将隔离开关QS下面的三个熔断器改接到隔离器上面的电源线上是否合适?为什么?[答]通常熔断器安装在刀开关的下方,是为了在更换熔丝时便于与电源隔离以确保安全,如果将刀开关下面的三个熔断器改接到刀开关上面的电源线上,则在更换熔丝时将带电操作,因此从安全方面考虑是不合适的。
9-2-4 按图9-1所示的三相异步电动机起、停控制电路接好线,通电操作时如果出现以下两种情况,试分析问题可能出在哪部分:(1) 按下起动按钮SBst ,接触器KM已经动作,但电动机不转或转得很慢并发出嗡嗡声;(2)当电动机已经起动后,松开起动按钮SBst ,电动机不能继续运转。
[答] (1) 按下起动按钮SBst,接触器KM已经动作,说明控制电路正常,但电动机不转或转得很慢并发出嗡嗡声.,说明三相电动机未通电或处于单相运行状态,可见问题出在主电路,可能是主电路中未接控制电路一相(图9-1中的L1相)的熔断器熔断,或是主电路中某处线路未接好或接触不良。
第9章思考题参考答案_71570171

d 0.622
pv ps ps 0.622 0.622 p p p pv p ps s
根据上式,比湿度除了与相对湿度有关,而且与湿空气总压力和湿空气中 水蒸气的饱和分压力有关 (即与湿空气的温度有关) 。 在湿空气的温度和压力都 不变的情况下,相对湿度越大,比湿度越大。 9.冬季室内供暖时,为什么会感到空气干燥?用火炉取暖时,经常在火炉上
i
xi
ห้องสมุดไป่ตู้
Mi
Mi i
i
Mi
M
对于一个组分固定的气体混合物,其质量分数 M 不变,某一个组元的摩尔 成分的大小取决于其质量成分和质量分数; 若质量成分大, 摩尔成分不一定大。 5.为什么在计算理想混合气体中组元气体的熵时必须采用分压力而不能用总 压力? 答:根据总参数的加和性:除总容积外,理想混合气体其他各种总参数都等于 各组员气体在混合气体温度下单独占有混合气体容积时相应参数的总和。熵是 状态参数,当其表示为温度和压力的函数时,对于理想气体的任一组元,都是 处在混合气体温度和分压力(根据分压力定律)状态下,而不是在混合气体温 度和总压力状态下(违背分压力定律) 。 6.解释降雾,结霜和结露现象,并说明它们发生的条件。 答:降雾、结霜和结露的基本原理是相同的。
d u p v du
i i i
dT
d i ui dT
dp v i i i i dT dT
Rm 1
cv
M
i i
Rm cv R M
其中 M 为理想气体混合物的质量分数;R 为理想气体混合物的气体常数, 因此理想混合气体仍旧遵循迈耶公式。 4.凡质量成分较大的组元气体,其摩尔成分是否也一定较大? 答:根据换算公式:
9第九章思考题

1、如图9-6所示,一块无限长直导体薄板宽为d ,板面与y 轴垂直,板的长度方向沿x轴,板的两侧与一个伏特计相接。
整个系统放在磁感应强度为B 的均匀磁场中,B的方向沿y 轴正方向。
如果伏特计与导体平板均以速度υ向x 轴正方向移动,则伏特计指示的电压值为多少? 【答案:υBd 】详解:导体平板以速度υ向x 轴正方向移动时,其中的电子所受的洛伦兹力为B e F L υ=电子向导体薄板一侧积累形成电场,设稳定电场强度的大小为E ,这时电子所受的电场力为eE F e =由于洛伦兹力与电场力平衡,因此eE B e =υ电场强度的大小E 与导体薄板两侧电势差的关系为d U E =因此dU B =υ 由此解得导体薄板两侧电势差,即伏特计指示的电压值为Bd U υ=2、如图9-7所示,矩形区域为均匀稳恒磁场,半圆形闭合导线回路在纸面内绕轴O 以角速度ω作顺时针方向匀速转动,O 点是圆心且恰好落在磁场的边缘上,半圆形闭合导线完全在磁场外时开始计时。
试画出感应电动势随时间变化的函数关系图象。
【答案:函数关系图象见下图】详解:长度为L 的导体棒在磁感应强度为B的均匀磁场中以角速度ω绕棒的一端做匀速转动时,如果转动平面垂直磁场方向,金属棒中产生的电动势为图9-6图9-72i 21BL ωε=该电动势与时间无关。
半圆形闭合导线完全在磁场外时开始计时,则半圆形闭合导线在转动的前半周时间内,电动势的方向为逆时针,在后半周时间内电动势的方向为顺时针。
如果电动势以顺时针方向为正方向,则可以画出感应电动势随时间变化的关系曲线如图所示。
3、如图9-8所示,两根无限长平行直导线载有大小相等方向相反的电流I ,并各以d I /d t 的变化率增长,一个矩形线圈位于导线平面内。
线圈中有没有感应电流?如果有感应电流存在,感应电流的方向如何?【答案:线圈中有感应电流;顺时针方向】详解:由7.1思考与讨论第3题的计算结果可知,通过如图所示矩形线圈的磁通量为)1ln(2π0m cbIaΦ+=μ 在该线圈中产生的感应电动势为tI c b a t Φd d )1ln(2πd d 0m i +-=-=με 由于两根无限长平行直载流导线对应同一个线圈,它们中的电流随时间的变化率相等,且d I /d t >0,因此距线圈近的无限长载流导线比远的导线在线圈中产生的感应电动势大,前者产生的感应电动势方向为顺时针,后者产生的感应电动势方向为逆时针,总感应电动势方向为顺时针。
运筹学习题答案(第九章)

A
15
-
F
5
D,E
B
10
-
G
20
C,F
C
10
A,B
H
10
D,E
D
10
A,B
I
15
G,H
E
5
B
H
4
第九章习题解答
H
5
第九章习题解答
表9-9
工作 工时(d) 紧前工作 工作 工时(d) 紧前工作
A
3
-
G
6
D,B
B
2
-
H
2
E
C
5
-
I
4
G,H
D
4
A
J
5
E,F
E
7
B
K
2
E,F
F
8
C
L
6
I,J
H
6
第九章习题解答
工作
完成概率
表9-16 工时(常数或期望值) 紧后工作
a
1
25
B或f
b
0.7
6
C或d
c
0.7
4
g
d
0.3
3
e
e
1
4
c
f
0.3
6
g
g
1
2
-
H
29
第九章习题解答
解:下图就是随机网络图。成品率为100%,平 均加工时间为37.9天
H
30
3
200
2
220
26
第九章习题解答
9.9 一项小修期各是多少天?
(2)日常经营费为50元/天,最佳工期应是多少天 ?列出每项工作的相应工时。
高教第五版分析化学课后习题及思考题答案第9章

第八章 电位分析法思 考 题1. 参比电极和指示电极有哪些类型?它们的主要作用是什么?答:参比电极包括标准氢电极(SHE ),标准氢电极是最精确的参比电极,是参比电极的一级标准。
实际工作中常用的参比电极是甘汞电极和银-氯化银电极。
参比电极电位恒定,其主要作用是测量电池电动势,计算电极电位的基准。
指示电极包括金属-金属离子电极,金属-金属难溶盐电极,汞电极,惰性金属电极,离子选择性电极。
指示电极能快速而灵敏的对溶液中参与半反应的离子活度或不同氧化态的离子的活度比,产生能斯特响应,主要作用是测定溶液中参与半反应的离子活度。
2. 直接电位法的依据是什么?为什么用此法测定溶液pH 时,必须使用标准pH 缓冲溶液?答:直接电位法是通过测量电池电动势来确定待测离子活度的方法,其主要依据是E=Φ参比— ΦMn+/M = Φ参比—ΦθMn+/M—nFRTln αMn+式中Φ参比和ΦθMn+/M在温度一定时,都是常数。
由此式可知,待测离子的活度的对数与电池电动势成直线关系,只要测出电池电动势E ,就可求得αMn+。
测定溶液的pH 时是依据:E = ΦHg 2Cl 2/Hg — ΦAgCl/Ag — K + 0.059 pH 试 + ΦL , 式 中ΦHg 2Cl 2/Hg , ΦAgCl/Ag ,K ,ΦL 在一定的条件下都是常数,将其合并为K ˊ,而K ˊ中包括难以测量和计算的不对称电位和液接电位。
所以在实际测量中使用标准缓冲溶液作为基准,并比较包含待测溶液和包含标准缓冲溶液的两个工作电池的电动势来确定待测溶液的pH 值,即:25℃时Es = Ks ˊ+ 0.059pHs, Ex = Kx ˊ+ 0.059pHx,若测量Es 和Ex 时的条件保持不变,则Ks ˊ= Kx ˊ,pHx =pHs+(Ex -Es)/0.059 ,由此可知,其中标准缓冲溶液的作用是确定K ˊ。
3. 简述pH 玻璃电极的作用原理。
答:玻璃电极的主要部分是 一 个玻璃泡,泡的下半部是对H +有选择性响应的玻璃薄膜,泡内装有pH 一定的0.1mol ·L -1的HCl 内参比溶液,其中插入一支Ag-AgCl 电极作为内参比电极,这样就构成了玻璃电极。
运筹学教程答案第九章
A B C D E
page 13 22 May 2012
5 8 3 6 10
A,C A C B,C
F G H I J
4 8 2 4 5
B,C C F,G E,H F,G
School of Management
运筹学教程
第九章习题解答
page 14 22 May 2012
School of Management
运筹学教程
第九章习题解答
表9-12 工时( ) 工作 工时(d) 紧前工作 工时( ) 工作 工时(d) 紧前工作
A B C D E F G H
page 15 22 May 2012
18 6 5 21 27 15 24 13
A A B B D,E
I J K L M N P Q
6 15 6 3 12 5 3 6
运筹学教程
第九章习题解答
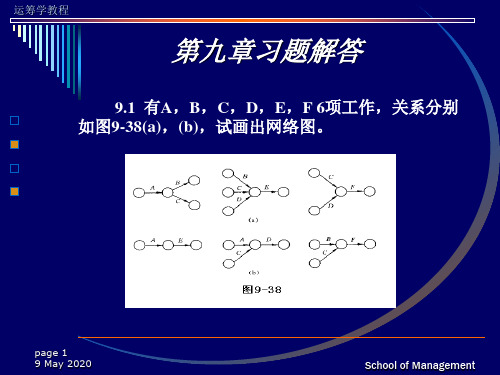
9.1 有A,B,C,D,E,F 6项工作,关系分别 项工作, , , , , , 项工作 如图9-38(a),(b),试画出网络图。 如图 , ,试画出网络图。
page 1 22 May 2012
School of Management
运筹学教程
第九章习题解答
page 2 22 May 2012
School of Management
运筹学教程
第九章习题解答
9.4 绘制表 绘制表9-11,表9-12所示的网络图,并用表 所示的网络图, , 所示的网络图 上计算法计算工作的各项时间参数、确定关键路线。 上计算法计算工作的各项时间参数、确定关键路线。
表9-11 工时( ) 工作 工时(d) 紧前工作 工时( ) 工作 工时(d) 紧前工作
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章思考题与习题1 •重量分析对沉淀的要求是什么?答:要求沉淀要完全、纯净。
对沉淀形式的要求:溶解度要小,纯净、易于过滤和洗涤,易于转变为称量形式。
对称量形式的要求:沉淀的组分必须符合一定的化学式、足够的化学稳定性、尽可能人的摩尔质量。
2.解释下列名词:沉淀形式,称量形式,固有溶解度,同离子效应,盐效应,酸效应,络合效应,聚集速度,定向速度,共沉淀现象,后沉淀现象,再沉淀,陈化,均匀沉淀法,换算因数。
答:沉淀形式:往试液中加入沉淀剂,使被测组分沉淀出来,所得沉淀称为沉淀形式。
称量形式:沉淀经过过滤、洗涤、烘干或灼烧Z后所得沉淀。
固有溶解度:难溶化合物在水溶液中以分子状态或离子対状态存在的活度。
同离子效应:当沉淀反应达到平衡后,加入与沉淀组分相同的离子,以增大构晶离子浓度,使沉淀溶解度减小的效应。
盐效应:由于强电解质盐类的存在,引起沉淀溶解度增加的现彖。
酸效应:溶液的酸度对沉淀溶解度的影响。
配位效应:溶液中存在能与沉淀构品离子形成配位化合物的配位剂时,使沉淀的溶解度增大的现象。
聚集速度:沉淀形成过程屮,离了之间互相碰撞聚集成晶核,晶核再逐渐长人成为沉淀的微粒,这些微粒可以聚集为更大的聚集体。
这种聚集过程的快慢,称为聚集速度。
定向速度:构品离子按一定的品格排列成品体的快慢,称为定向速度。
共沉淀现象:在进行沉淀时某些可溶性杂质同时沉淀下來的现象。
后沉淀现象:当沉淀析出后,在放置过程屮,溶液中的杂质离子漫漫在沉淀表面上析出的现象。
再沉淀:将沉淀过滤洗涤Z后,重新溶解,再加入沉淀剂进行二次沉淀的过程。
陈化:亦称熟化,即当沉淀作用完毕以后,让沉淀和母液在一起放置一段吋间,称为陈化。
均匀沉淀法:在一定条件F,使加入沉淀剂不能立刻与被测离子牛成沉淀,然后通过一种化学反应使沉淀剂从溶液中慢慢地均匀的产生出來,从而使沉淀在整个溶液中缓慢地、均匀地析出。
这种方法称为均匀沉淀法。
换算因数:被测组分的摩尔质量与沉淀形式摩尔质量之比,它是一个常数。
若分子、分母中主体元素的原子数不和等,应乘以适当的系数,这一比值称为“换算因数”,亦称“化学因数”。
3.活度积、溶度积、条件溶度积有何区别?答:活度积:在一定温度下,难溶化合物的饱和溶液中,各构晶离了活度的乘积为一个常数。
此常数称为活度积常数,简称活度积,用K a p表示Z。
溶度积:在一定温度下,难溶化合物的饱和溶液中各构晶离了浓度的乘积为一个常数。
此常数称为溶度积常数,简称溶度积,用Ksp表示之。
条件溶度积:在沉淀平衡的过程中,构晶离子在溶液中各型体的总浓度之积,用K\p 表示当溶液屮离子强度很小时,Kap=K sp若溶液中离子强度大时,则两者不相等,而是K ap 小于Ksp。
4•影响沉淀溶解度的因素有哪些?答:主要冇同离了效应、盐效应、酸效应和配位效应。
此外还冇温度、溶剂、沉淀颗粒的大小和沉淀的结构等。
5.简述沉淀的形成过程,形成沉淀的类型与哪些因素有关?答:在难溶化合物的过饱和溶液中,构晶离子互相碰撞而形成晶核,其它构晶离子向晶核扩散并吸附于晶核(异相成核则为外来杂质微粒)之上,便逐渐成长为晶体。
形成沉淀的类型人体可分为三类:晶体沉淀、凝乳状沉淀和无定形沉淀。
若溶液的相对过饱和度小吋,沉淀速度很慢,沉淀主要是界和成核过程,从而可得到较大的沉淀颗粒,即品体沉淀。
若溶液的相対过饱和度大时,沉淀速度快,沉淀是片相成核与均相成核同时进行, 从而可得到较小的沉淀颗粒,即凝乳状沉淀或无定形沉淀。
6.BaSO4和AgCl的K$p相差不人,但在相同条件下进行沉淀,为什么所得沉淀的类型不同?答:因为BaSO4形成品核的临界均相过饱和比为1000, AgCl的临界均相过饱和比则为5.5,所以虽然两者的ksp基本相等,但当加入沉淀剂时BaSO4不易超过其Q/S,不致产生太多的晶核,故生成较大的沉淀颗粒;FljAgCl则容易超过其Q/S,易形成大量的晶核,所以沉淀颗粒非常微小,而形成凝乳状沉淀。
7.影响沉淀纯度的因索有哪些?如何提高沉淀的纯度?答:影响沉淀纯度的因素有:共沉淀现彖(表面吸附、吸留为包夹、生成混品)和后沉淀现彖。
提高沉淀纯度的措施有:选择适当的分析程序、降低易被沉淀吸附的杂质离子浓度、选择适当的洗涤剂进行洗涤、及时进行过滤分离,以减少示沉淀、进行再沉淀和选择适宜的沉淀条件。
8.说明沉淀表面吸附的选择规律,如何减少表面吸附的杂质?答:笫一吸附层的吸附规律是:首先吸附构品离子,英次是与构品离子的半径大小和近、所带电荷相同的离子。
第二吸附层的吸附规律是:电荷数越高的离子越容易被吸附;与构品离子能形成难溶或溶解度较小的化合物的离了容易被吸附。
此外沉淀的总表面积越人、杂质离子浓度越人吸附杂质越多,温度越高吸附杂质越少。
减少表面吸附杂质的办法:(1)选择适当的分析程序;(2)降低易被吸附的杂质离子浓度;(3)用适当的洗涤剂进行洗涤;(4)必耍时进行再沉淀;(5)选择适当的沉淀条件。
9.简要说明晶形沉淀和无定形沉淀的沉淀条件。
答:晶形沉淀的沉淀条件:在适当稀的溶液小进行,并加入沉淀剂的稀溶液;在不断搅拌下逐滴加入沉淀剂以进行沉淀;沉淀作用应在热溶液中进行;沉淀Z后进行陈化。
无定形沉淀的沉淀条件:沉淀作用应在比较浓的溶液中进行,加沉淀剂的速度也可以适当快一些;沉淀作川应在热溶液小进行;在溶液屮加入适当的电解质;不必陈化;必要时进行再沉淀。
10.为什么要进行陈化?哪些情况不需要进行陈化?答:初生成的沉淀颗粒有大有小,而大颗粒的溶解度比小颗粒小,经陈化Z后,小的沉淀颗粒的溶解,大的沉淀颗粒长的更大;另外还可以使亚稳态晶型沉淀变成稳态晶型沉淀, 使不完整的晶体沉淀变成完整的晶体沉淀,因而减少杂质含量,便于过滤和洗涤,所以要进行陈化过程。
当冇后沉淀现象发生时,陈化反应增加杂质的含量;对于高价氢氧化物陈化时会火去水份而聚集的十分紧密,不易洗涤除去所吸附的杂质。
所以在上述情况下,沉淀完毕应立即过滤,不需要进行陈化。
11.均匀沉淀法有何优点?答:均匀沉淀法使沉淀剂从溶液中缓慢地、均匀地产生出来,避免了沉淀剂局部过浓的现象,因而过饱和不致超过临界过饱和比太多,产生的晶核较少,易于过滤和洗涤。
12.有机沉淀剂较无机沉淀剂有何优点?有机沉淀剂必须具备什么条件?答:有机沉淀剂有以下优点:(1)选择性高(2)沉淀的溶解度小,有利于被测组分的沉淀完全;(3)沉淀吸附杂质少;(4)沉淀称竝形式的摩尔质量人,则同样量的被测物质可以得到质量更多的沉淀,减少称量误差。
有机沉淀剂必须具备的条件:能生成螯合物的沉淀剂必须具有酸性基团如:-COOH> -SO3H 等,还必须貝备含有配位原子的碱性基团如・NH2、>c=o等.牛成缔合物的沉淀剂必须在溶液中能够电离出大体积的离子,这种离子与被测离子带有杲性电荷,而结合成缔合物沉淀。
13.有机沉淀剂一般有哪些类型?反应机理如何?答:有机沉淀剂分为螯合物和缔合物两种类型。
生成螯合物的沉淀剂的酸性基团上的H*被被测金属离子置换而形成盐,沉淀剂的碱性基团中的配合原子与金属离子形成配合键,因而形成螯合物沉淀。
生成缔合物的沉淀剂在水溶液屮电离岀人体积的离了,这种离了与被测离了结合形成溶解度很小的缔合物沉淀。
14.称取纯BaCl2-2H20试样0.3675g,溶于水后,加入稀H2SO4将Ba?+沉淀为BaSO4,如果加入过量50%的沉淀剂,问需要O^Omol L-1的H2SO4溶液若干毫升?解:设等量沉淀BaCl2需要0.50 mol-L1的H2SO4溶液V o mLBaCl2• 2H2O+H2SO4=BaSO4|+2HCl+2H2O1 10.3675/244.3 0.50V。
解之,V()=3.0 mL过量50%沉淀剂时,需H2SO4Z体积为VmLV=V O(1 +50%)=3.0x(1 +50%)=4.5mL15.计算BaSO4的溶解度。
(1)在纯水中;(2)考虑同离子效应,在0.10 mol-L^BaCh溶液中;(3)考虑盐效应,在0.10 mol-L^NaCl溶液屮;(4)考虑酸效应,在2.0 mol-L^HCl溶液中(5)考虑络合效应,在pH=0.010mol・L“LEDTA溶液屮.解:(1)设BaSO4在纯水中Z溶解度为Si则[Ba2+]=[ SO?]= S] K sp=[Ba2+][ SO42 ]= S J2所以S L庙=Jl.lxlO"。
= 1.05xl0*5molL'1(2)设BaSO4ftO.lOmobf'BaCh溶液中之溶解度为S2.则[SO42']= S2 [Ba2+]=0.10+S2因为S2«0.10所以[Ba2+]=0.10瓦卩=田玄为[S042']=0.10S2S2=K SP/0」0=(Ll X W10)/0」O=1.1x10® mol-L'1(3)设BaSO4在0.10mol L」NaCl溶液中的溶解度为S3首先计算溶液中的离了 I 。
I 冷工 GZ,2 冷(C M +X^+C 一 xr+CgXZZ+Cso/x??) 因为CBa2+、Cs ()42-远远小于Cg 和Cci-,故后两项可以忽略彳、计。
冷工GZ :* (0.10xl 2+0.10xl 2)=0」0 由教材附录中查得当1=0.1吋活度系数分别为%+ =0.38 Y so ^_ =0.355则 S 3=—乞一(实际附录中的为)=1.1X1Q-10「Yo.38xO.355=2.86xlO'5molL'1(4) 设BaSO 4在2.0 molf'HCl 溶液中之溶解度为S 4o 由教材附录中查的H 2SO 4的 Ka 2=1.0xl0'2.则[Ba 2+]=S 4[SO 42']+[HSO 4']= S 4 HSO/ H ++SO 42'“冷1rs 册1代入上式K sp =[Ba 2+][SO 42-]= S 4X 5.0X 10'3 S 4所以Sf ©V5.OX1O -3pH=&0 时 OC Y(H} = 102 2溶液中的平衡关系为BaSO 4=Ba 2++SO 42' IIHY=Y+HII1.0x10-2 1.0X 10_2+2.0X 54= 5.0X 10_3X 54 1.1x10"° 5.0x107=L5xlO"4 mobf 1(5)已知 K B aY=107-86sp( BaSO 4)= 10-9 96["]+©xS 4BaY考虑酸效应和络介效应后,BaSO4的溶解度为S=[Ba2+]=[SO42']0.01 10-4.27Ksp(BaSOJ * ^BaYa Y{H)a B a(Y)= 1 +心3丫[丫]= 1 +107 86X1 CT4% 10如9s=7w9-96xio3 59 =io~318 ^e.exio-4 moi-L-116.计算在pH=2.00时的CaF?溶解度。
