第二章2 固体结构试题与答案
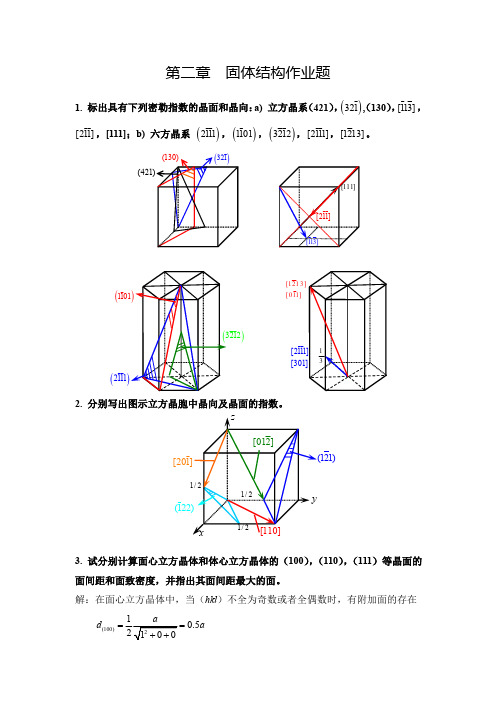
固体物理答案-第二章

N0=6.0221023,与N0对应的质量应为
M=23+35.5=58.5(g)
Na原子量
Cl原子量
阿伏加德罗常数
面心立方,最近邻原子有12个, 由N个惰性气体原子构成的分子晶体,其总互作用势能可表示为
(2)计及最近邻和次近邻,次近邻有6个。
2.14 KCl晶体的体积弹性模量为 相邻离子间距缩小0.5%,需要施加多大的压力。 ,若要使晶体中 解:根据体积弹性模量K的定义, 得 ,因而 设R为相邻离子间的距离。KCL具有NaCL结构,平均每体 才有一个离子,若晶体中共含N个离子,则晶体体积 积
式中,V为晶体体积,N为晶体包含的原子数,v为每个原子平 均占据的体积。若以
表示晶体包含的晶胞数,
中每个晶胞的体积,n表示晶胞中所含的粒子数,则(1)式完全 等效于
解:题给
表示晶体
(1)
于是得
(2)
R为离子间的最短距离。题给的各种晶格均为立方格子,如令
证明:
选取负离子O为参考离子,相邻两离子间的距离用R表示。
第j个离子与参考离子的距离可表示为
对于参考
离子O,它与其它离子的互作用势能为
马德隆常数
2.3 设两原子间的互作用能可由 表述。 式中第一项为吸引能,第二项为排斥能; 均为正的常数。证明,要使这两原子系统处于平衡状态,必须n>m。 且 即当 时, 证明:相互作用着的两原子系统要处于稳定平衡状态,相应 于平衡距离 处的能量应为能量的极小值,
为常数,试求
(1)平衡时原子间的最短距离;
(2)平衡时晶体体积;
(3)平衡时体积弹性模量;
(4)抗张强度。
解:
(1)
由
得
01
高中物理 第2章 固体 第2节 固体的微观结构自我小测 鲁科版选修3-3(2021年最新整理)

高中物理第2章固体第2节固体的微观结构自我小测鲁科版选修3-3 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中物理第2章固体第2节固体的微观结构自我小测鲁科版选修3-3)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中物理第2章固体第2节固体的微观结构自我小测鲁科版选修3-3的全部内容。
固体的微观结构1。
下列关于晶体的微观表述正确的是()A。
晶体的微观结构具有周期性特点B.晶体的微观结构不具有周期性特点C。
晶体内部各微粒之间存在着很强的相互作用力,将微粒约束在一定的平衡位置上D。
晶体内部各微粒之间存在着很弱的相互作用力,微粒可以自由移动2.发现晶体内部的物质微粒是按一定的规律整齐排列的科学家是()A.劳厄B.伦琴C。
玻尔 D.富勒3。
晶体的结合类型有( )A.离子晶体B。
原子晶体C.金属晶体D。
分子晶体4。
单晶体在不同方向上微粒排列及物质结构情况是________的,所以单晶体在物理性质上表现为________。
非晶体在不同方向上的微粒排列及物质结构情况________,所以非晶体在物理性质上表现为________。
5.下列说法中正确的是()A.黄金可以切割加工成任意形状,所以是非晶体B.同一种物质只能形成一种晶体C。
单晶体的所有物理性质都是各向异性的D.玻璃没有确定的熔点,也没有规则的几何形状6。
下列叙述中错误的是()A。
晶体的各向异性是由于它的微粒按空间点阵排列B。
单晶体具有规则的几何外形是由于它的微粒按一定规律排列C.非晶体有规则的几何形状和确定的熔点D。
石墨的硬度与金刚石差很多,是由于它的微粒没有按空间点阵分布7.晶体不同于非晶体,它具有规则的几何外形,在不同方向上物理性质不同,而且具有一定的熔点,下列哪些说法可以用来解释晶体的上述特性( )A。
初中固体物理试题及答案

初中固体物理试题及答案一、选择题(每题2分,共20分)1. 固体的三种基本类型是()。
A. 晶体、非晶体、准晶体B. 晶体、非晶体、多晶体C. 晶体、非晶体、单晶体D. 晶体、多晶体、准晶体答案:A2. 晶体的特点是()。
A. 无规则排列B. 规则排列C. 部分规则排列D. 完全无序排列答案:B3. 非晶体与晶体的主要区别在于()。
A. 原子排列方式B. 原子大小C. 原子种类D. 原子数量答案:A4. 晶体的熔点通常比非晶体的熔点()。
A. 低B. 高C. 相同D. 不可比较答案:B5. 准晶体是一种介于晶体和非晶体之间的固体,其特点是()。
A. 完全无序排列B. 长程有序但不具备周期性C. 规则排列D. 完全有序排列答案:B6. 晶体的X射线衍射图样是()。
A. 无规则的斑点B. 规则的点状图案C. 连续的曲线D. 无规则的条纹答案:B7. 固体的热膨胀系数是指()。
A. 固体在加热时体积不变B. 固体在加热时体积变化的比率C. 固体在冷却时体积变化的比率D. 固体在加热时质量变化的比率答案:B8. 固体的导电性主要取决于()。
A. 原子的质量B. 原子的排列方式C. 原子的体积D. 原子的数量答案:B9. 金属导电的原因是()。
A. 金属内部有自由移动的电子B. 金属内部有自由移动的原子C. 金属内部有自由移动的离子D. 金属内部有自由移动的分子答案:A10. 半导体的导电性介于()之间。
A. 金属和绝缘体B. 金属和非金属C. 非金属和绝缘体D. 金属和晶体答案:A二、填空题(每题2分,共20分)1. 晶体的三种基本类型是单晶体、多晶体和________。
答案:准晶体2. 晶体的原子排列具有________性。
答案:长程有序3. 非晶体的原子排列具有________性。
答案:短程有序4. 晶体的熔点较高是因为其内部________。
答案:原子排列紧密5. 准晶体的原子排列具有________性。
《固体物理学》基础知识训练题及其参考答案

《固体物理》基础知识训练题及其参考答案说明:本内容是以黄昆原著、韩汝琦改编的《固体物理学》为蓝本,重点训练读者在固体物理方面的基础知识,具体以19次作业的形式展开训练。
第一章作业1:1.固体物理的研究对象有那些?答:(1)固体的结构;(2)组成固体的粒子之间的相互作用与运动规律;(3)固体的性能与用途。
2.晶体和非晶体原子排列各有什么特点?答:晶体中原子排列是周期性的,即晶体中的原子排列具有长程有序性。
非晶体中原子排列没有严格的周期性,即非晶体中的原子排列具有短程有序而长程无序的特性。
3.试说明体心立方晶格,面心立方晶格,六角密排晶格的原子排列各有何特点?试画图说明。
有那些单质晶体分别属于以上三类。
答:体心立方晶格:除了在立方体的每个棱角位置上有1个原子以外,在该立方体的体心位置还有一个原子。
常见的体心立方晶体有:Li,Na,K,Rb,Cs,Fe等。
面心立方晶格:除了在立方体的每个棱角位置上有1个原子以外,在该立方体每个表面的中心还都有1个原子。
常见的面心立方晶体有:Cu, Ag, Au, Al等。
六角密排晶格:以ABAB形式排列,第一层原子单元是在正六边形的每个角上分布1个原子,且在该正六边形的中心还有1个原子;第二层原子单元是由3个原子组成正三边形的角原子,且其中心在第一层原子平面上的投影位置在对应原子集合的最低凹陷处。
常见的六角密排晶体有:Be,Mg,Zn,Cd等。
4.试说明, NaCl,金刚石,CsCl, ZnS晶格的粒子排列规律。
答:NaCl:先将错误!未找到引用源。
两套相同的面心立方晶格,并让它们重合,然后,将一套晶格沿另一套晶格的棱边滑行1/2个棱长,就组成Nacl晶格;金刚石:先将碳原子组成两套相同的面心立方体,并让它们重合,然后将一套晶格沿另一套晶格的空角对角线滑行1/4个对角线的长度,就组成金刚石晶格;Cscl::先将错误!未找到引用源。
组成两套相同的简单立方,并让它们重合,然后将一套晶格沿另一套晶格的体对角线滑行1/2个体对角线的长度,就组成Cscl晶格。
工程材料第二章固体结构作业答案
所以 Cr 的晶体结构为体心立方结构(bcc) 8. 铁在 912℃时由 α–Fe(体心立方)变为 γ–Fe(面心立方) ,已知碳存在于铁 的间隙中,试解释为什么碳在γ–Fe 中的溶解度(最高可达 wc2.11%)比在α–Fe 中的溶解度(最高只有 wc 0.0218% )大?(已知γ–Fe、α–Fe 和碳的原子半径分 别为 0.129nm、0.125nm 和 0.077nm) 解: 实验证明, 碳原子无论是溶入α-Fe 还是γ-Fe 所处的间隙位置都是八面体间隙 现计算两种间隙的大小。 对γ-Fe,如课本面心立方晶体的八面体间隙图所示,以(100)晶面上碳原
因此 c/a=√8/3=1.633 6. Ni 的晶体结构为面心立方结构,其原子半径为 r =0.1243nm,试求 Ni 的晶格 常数和密度。
解:晶格常数 a Ni 的密度
4r 4 0.1243 0.3516(nm) 2 2
4A r 4 58.69 8.967(g/cm3 ) 3 8 3 23 a N A (3.516 10 ) 6.02 10
3
=4.308(g / cm3 )
4 3 4 3 4 rCs+ rCl (0.1673 0.1813 ) 3 K3 =3 0.683 3 3 2rCs+ +2rCl- 2(0.167 0.181) 3 3
4. 立方晶系的各{111}晶面构成一个八面体,试作图画出该八面体,并注出这些 具体晶面的指数。
(111) (111) (111) (111) (111) (111) (111)
(111)
5. 试证明理想密排六方结构的轴比 c/a=1.633。 证明:理想密排六方晶格配位数为 12,即晶胞上底面中心原子与其下面的 3 个 位于晶胞内的原子相切,成正四面体,如图所示
固体物理学考试题及答案

固体物理学考试题及答案一、选择题(每题2分,共20分)1. 固体物理学中,描述晶体中原子排列的周期性规律的数学表达式是()。
A. 布洛赫定理B. 薛定谔方程C. 泡利不相容原理D. 费米-狄拉克统计答案:A2. 固体中电子的能带结构是由()决定的。
A. 原子的核外电子B. 晶体的周期性势场C. 原子的核电荷D. 原子的电子云答案:B3. 在固体物理学中,金属导电的原因是()。
A. 金属中存在自由电子B. 金属原子的电子云重叠C. 金属原子的价电子可以自由移动D. 金属原子的电子云完全重叠答案:C4. 半导体材料的导电性介于导体和绝缘体之间,这是因为()。
A. 半导体材料中没有自由电子B. 半导体材料的能带结构中存在带隙C. 半导体材料的原子排列无序D. 半导体材料的电子云完全重叠答案:B5. 固体物理学中,描述固体中电子的波动性的数学表达式是()。
A. 薛定谔方程B. 麦克斯韦方程C. 牛顿第二定律D. 热力学第一定律答案:A6. 固体中声子的概念是由()提出的。
A. 爱因斯坦B. 德拜C. 玻尔D. 费米答案:B7. 固体中电子的费米能级是指()。
A. 电子在固体中的最大能量B. 电子在固体中的最小能量C. 电子在固体中的平均水平能量D. 电子在固体中的动能答案:A8. 固体物理学中,描述固体中电子的分布的统计规律是()。
A. 麦克斯韦-玻尔兹曼统计B. 费米-狄拉克统计C. 玻色-爱因斯坦统计D. 高斯统计答案:B9. 固体中电子的能带理论是由()提出的。
A. 薛定谔B. 泡利C. 费米D. 索末菲答案:D10. 固体中电子的跃迁导致()的发射或吸收。
A. 光子B. 声子C. 电子D. 质子答案:A二、填空题(每题2分,共20分)1. 固体物理学中,晶体的周期性势场是由原子的______产生的。
答案:周期性排列2. 固体中电子的能带结构中,导带和价带之间的能量区域称为______。
答案:带隙3. 金属导电的原因是金属原子的价电子可以______。
固体物理学考试试题及答案

固体物理学考试试题及答案题目一:1. 介绍固体物理学的定义和基本研究对象。
答案:固体物理学是研究固态物质行为和性质的学科领域。
它主要研究固态物质的结构、形态、力学性质、磁学性质、电学性质、热学性质等方面的现象和规律。
2. 简述晶体和非晶体的区别。
答案:晶体是具有有序结构的固体,其原子、离子或分子排列规则且呈现周期性重复的结构。
非晶体则是没有明显周期性重复结构的固体,其原子、离子或分子呈现无序排列。
3. 解释晶体中“倒易格”和“布里渊区”的概念。
答案:倒易格是晶体中倒格矢所围成的区域,在倒易格中同样存在周期性的结构。
布里渊区是倒易格中包含所有倒格矢的最小单元。
4. 介绍固体中的声子。
答案:声子是固体中传递声波和热传导的一种元激发。
它可以看作是晶体振动的一种量子,具有能量和动量。
5. 解释“价带”和“能带”之间的关系。
答案:价带是材料中的电子可能占据的最高能量带。
能带是电子能量允许的范围,它由连续的价带和导带组成。
6. 说明禁带的概念及其在材料中的作用。
答案:禁带是能带中不允许电子存在的能量范围。
禁带的存在影响着材料的导电性和光学性质,决定了材料是绝缘体、导体还是半导体。
题目二:1. 论述X射线衍射测定晶体结构的原理。
答案:X射线衍射利用了X射线与晶体的相互作用来测定晶体结构。
当X 射线遇到晶体时,晶体中的晶格会将X射线发生衍射,衍射图样可以提供关于晶体的结构信息。
2. 解释滑移运动及其对晶体的影响。
答案:滑移运动是晶体中原子沿晶格面滑动而发生的变形过程。
滑移运动会导致晶体的塑性变形和晶体内部产生位错,影响了晶体的力学性质和导电性能。
3. 简述离子的间隙、亚格子和空位的概念。
答案:间隙是晶体结构中两个相邻原子之间的空间,可以包含其他原子或分子。
亚格子是晶体结构中一个位置上可能有不同种类原子或离子存在的情况。
空位是晶体结构中存在的缺陷,即某个原子或离子缺失。
4. 解释拓扑绝缘体的特点和其应用前景。
答案:拓扑绝缘体是一种特殊的绝缘体,其表面或边界上存在不同于体内的非平庸的拓扑态。
固体物理习题参考答案

固体物理第一次习题参考答案1.如果将等体积球分别排成下列结构,设x 表示刚球所占体积与总体积之比,证明结构 x简单立方 0.526x π=≈体心立方 30.688x π=≈ 面心立方 20.746x π=≈ 六角密排 20.746x π=≈ 金刚石 30.3416x π=≈解:设钢球半径为r ,立方晶系晶格常数为a ,六角密排晶格常数为a,c 钢球体积为V 1,总体积为V 2(1)简单立方单胞含一个原子,a r =2 52.06343321≈==ππa r V V(2)体心立方取惯用单胞,含两个原子,r a 43= 68.0833423321≈=⋅=ππar V V (3)面心立方取惯用单胞,含4个原子,r a =2 74.0623443321≈=⋅=ππar V V (4)六角密排与面心立方同为密堆积结构,可预期二者具有相同的空间占有率 取图示单胞,含两个原子,a r =2 单胞高度a c 38=(见第2题) 74.062233422321≈=⋅⋅=ππc a r V V (5)金刚石取惯用单胞,含8个原子,r a 2341= 34.01633483321≈=⋅=ππar V V2.试证六方密排密堆积结构中128() 1.6333c a =≈解: 六角密排,如图示,4个原子构成正四面体222)2332(2a a c =⋅+⎪⎭⎫⎝⎛ ⇒ a c 38=3.证明:体心立方晶格的倒格子是面心立方,面心立方的倒格子是体心立方。
证:体心立方基矢取为⎪⎪⎪⎩⎪⎪⎪⎨⎧+-=++-=-+=)(2)(2)(2321k j i a a k j i a a k j i a a其中a 为晶格常数其倒格子基矢,按定义)(2)(21111114212)(223321j i b j i a kj ia a a a b+=+=--⋅=⨯Ω=πππ)(2)(2132k j b a a b +=⨯Ω=π)(2)(2213k i b a a b +=⨯Ω=π可见,体心立方的倒格子是晶格常数为a b π4=的面心立方。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、名词解释:相、固溶体、中间相、超结构、电子浓度、正常价化合物、电子化合物、间隙相、间隙化合物;二、计算题:1、青铜为铜和锡组成的固溶体合金,其中大约有3%的铜原子为锡原于所取代,且仍维持着fcc结构。
试求合金中所含Cu和Sn的质量分数(已知cu的相对原子量为63.54,Sn为118.69)解由题意知,合金中所含Sn的摩尔分数为X Sn=3%,所台Cu的摩尔分数为X Cu=97%,故其质量分数为2、在1000℃时,有Wc=1.7%的碳溶入面心立方结构的铁中形成固溶体,求100个单位晶胞中有多少个碳原子?解因为100个单位晶胞中,有400个铁原子,其质量分数W Fe=98.3%总质量为(400×55.85)/0.983=22726碳原子数为22726×0.017/12.0l=32大约l/3个单位晶胞中才有1个碳原子。
这是因为碳原子半径较八面体间隙半径稍大些,因而碳原子不太可能都填满所有的等效位置。
3、β’黄铜的结构为简单立方。
如图2-3所示。
如果Cu和Zn原子半径分别为0.13nm和0.14 nm,试估计其密度(已知Cu和Zn的相对原子质量分别为63.54及65.38)。
4、计算单质原子配位数为6的晶体结构的致密度,并计算此时的原子半径与配位数为12时的原子半径比值。
配位数为6的晶体结构为简单立方结构,设其半径为r,晶格常数为a,二者关系为a=2r,致密度3343=0.52336raππη==,6121r/ra=5、Mg具有hcp结构,c/a=1.624体密度为1.74g/cm3,求a,c,原子半径和致密度。
1.74AnMVNρ===,得a=0.32nm,c=0.52nm,r=0.1598,致密度为3460.74rπη⨯==6、测得X Au=40%的Cu-Au固溶体点阵常数a=0.3795nm,密度为14.213g/cm3,计算说明该合金是什么类型固溶体?利用Cu Au(X X)Cu AuAn M MVNρ+=,得出n=3.95≈4,故为置换固溶体AuM=2007、Fe-Mn-C固溶体具有面心立方结构,Mn和C的质量分数为12.3%和1.34%,点阵常数为0.3624nm,密度为7.83g/cm3,请说明Mn和C在Fe中各是什么固溶体?再计算固溶体中每个原子的平均重量23230.821755.850.11954.940.0593128.8219106.0210A g-⨯+⨯+⨯==⨯⨯每个晶胞中的原子数为3723(0.362410)7.834.28768.821910anAρ--⨯⨯===⨯因为Fe-Mn-C合金固溶体具有面心立方结构,每个晶胞中含有4各原子,现在计算得每个晶胞中含有4.2876个原子,说明其中一个或全部溶质组元都是间隙溶质原子。
上面计算结果说明每个晶胞中含有0.2876各间隙原子,间隙原子的摩尔分数应该为0.2876/4.2876=0.067,而Mn 的实际摩尔分数为0.2239,所以Mn 不是间隙组元,Mn 与Fe 形成置换固溶体,而C 实际的摩尔分数是0.0593,所以C 是间隙组元,与Fe 形成间隙固溶体。
8、渗碳体(Fe 3C )是一种间隙化合物。
具有正交结构,a=0.4514nm ,b=0.508,c=0.6734nm ,密度为7.66g/cm 3,求每单位晶胞中所含Fe 原子和C 原子的数目。
设Fe 3C 晶胞中C 原子个数为x 个,Fe 原子为3x 个,由3C FeAxM xM abcN ρ+=,知,x=49、(1)原子半径为r ,计算fcc 和bcc 晶体中四面体间隙及八面体间隙的大小,并注明间隙中心坐标及数目。
(2)指出溶解在γ-Fe 中C 原子所处的位置,若此位置全部为C 原子所占据,则γ-Fe 能溶解C 的质量分数为多少?而实际上C 在铁中的最大溶解度为2.11%,二者在数值上的差异的原因是什么?(1)fcc 八面体间隙半径:八面体中心到最近邻原子中心的方向是<100>方向,在1/2<100>长度内包含一个原子半径r 和一个八面体间隙半径r oc ,所以oc 11r (2)2)0.41422a r r r =-=-=位置:(1/2,1/2,1/2)及其等效位置,即晶胞各棱的中点。
数目:4fcc 四面体间隙半径:四面体间隙中心到最近邻原子中心的方向是<111>,在1/4<111>长度内包含一个原子半径r 和一个四面体半径r Te ,所以Te r 0.224744a r r r =-=⨯-= 位置:(1/4,1/4,1/4)及其等效位置,即体对角线离顶点的1/4处。
数目:8bcc 八面体间隙半径:<001>方向,八面体中心位置到最临近原子的距离为12a ,故10.15472oc r a r r r =-==<110>,故0.6332oc r a r r r =-== 位置:(1/2,1/2,0),晶胞的每个棱边中心及6个面的中心都是其等效位置。
数目:6 bcc 四面体间隙半径:四面体间隙位置是(1/2,1/4,1),最近邻原子中心位置是(0,0,1),他们之间的距离为0.559a ,0.5590.5594/0.291Te r a r r r r =-=⨯=。
位置:(1/2,1/4,0)及其等效位置。
数目:12(2)γ-Fe 为fcc 结构,八面体间隙半径较大,故C 原子一般溶于八面体间隙中,由于fcc 中原子数目与八面体间隙数目相等,所以八面体间隙都被C 原子占据时,原子分数为50%,质量分数17.6%,实际中只能是2.11%,因为C 原子半径为0.077nm ,大于八面体间隙半径0.054nm ,所以C 的溶入会引起晶格畸变,妨碍了C 原子的进一步溶入。
10、计算间隙化合物Cr 23C 6晶胞中所包含的原子数,其结构如P51,图2.43所示(注意:必须写出计算过程,直接写答案不得分)晶体结构分析:将该立方晶胞模型分为8个立方体,各立方体的角顶交替分布着由金属原子群组成的立方八面体(以●表示,共14个)和小立方体(以○表示,共13个,而各立方体8个),碳原子以◇表示,位于立方八面体和小立方体的中心连线上,并与8个金属原子相邻。
原子数的计算:1 碳原子位置:晶胞内6个+每条棱上两个(共12条棱)+每个面上4个(共六个面) C 原子数为6+(1/4)×2×12+(1/2)×4×6=24个2 立方八面体位置:立方晶胞8个顶角+6个面的面心 每个立方八面体有13个原子立方八面体原子数为(1/8)×8×13+(1/2)×6×13=52 3 小立方体位置:晶胞棱的中点12个+晶胞体心位置1个 每个小立方体中有8个原子小立方体原子数为8+(1/4)×12×8=32个==碳原子 其它均为Cr 原子或者其它金属原子4 大晶胞分为8个立方体,每个立方体的体心位置还有一个金属原子晶胞中的总原子数为:24+52+32+8=116个三、简答题:1、绘出CuAuI型有序固溶体晶体中的(111)和(110)晶面的原子剖面图,并标出(111)面上[101],[011],[110]晶向以及(110)面上[001],[110]晶向。
2、说明间隙固溶体,间隙相,间隙化合物之间的区别溶质原子分布于溶剂晶格间隙而想成的固溶体为间隙固溶体,形成间隙固溶体的溶质原子通常是原子半径小于0.1nm 的非金属元素,如H ,B ,C ,N ,O 等。
间隙固溶体保持母相溶剂的晶体结构,成分可在一定固溶度极限内波动,不能用分子式表示。
间隙相和间隙化合物属于原子尺寸因素占主导地位的中间相,它们也是原子半径较小的非金属元素占据晶格间隙,然而间隙相,间隙化合物的晶格与组成它们的任一组员晶格都不相同;它们的成分可在一定范围内波动,但是组元具有一定的原子比组成,可用化学分子式表示。
当r B /r A <0.59时,形成间隙相,结构为简单晶体结构,具有极高的熔点和硬度;当r B /r A 》0.59时,形成间隙化合物,结构为复杂的晶体结构。
3、铁在912℃由bcc 结构转变为fcc 结构,体积减少1.06%,根据fcc 结构的原子半径计算bcc 结构的原子半径,它们的相对变化为多少?如果假定转变前后原子半径不变,计算转变后的体积变化,这些结构说明了什么?(1)33333324 1.0622fccbccbcc fccbcc bcca a V a →-∆===%,得出 1.07fcc bcc r r = (2)若转变前后原子半径不变,均设为r ,则333333248.1222fccbccbcc fccbcca a V a →-∆===%,说明晶体结构不同,原子半径大小也不相同,由于原子配位数的降低,原子半径收缩。
4、体心立方结构中八面体及四面体间隙半径分别为0.154r 和0.291r (r 为原子半径),说明为什么间隙原子处在八面体间隙而不是四面体间隙中。
八面体间隙在各个方向的尺寸是不等同的,在<100>方向和两个溶剂原子接触,尺寸为0.154r ,而在<110>方向和4个溶剂原子接触,在这个方向间隙中心距原子中心的距离为2,即在这个方向间隙的尺寸为0.6332a r r r -=-=,显然在此方向的尺寸比四面体间隙尺寸大得多。
综合两个方向的尺寸知,溶质间隙原子处在八面体间隙时只有一个方向的畸变比处在四面体间隙时大,其它两个方向的畸变要比处在四面体时小得多,所以溶质原子都处在八面体间隙中。
5、C 在Fe fcc 和Fe bcc 中的最大溶解度(原子百分数)分别为8.9%和0.1%有多少个面心立方八面体间隙被占据?面心立方比体心立方结构致密度高,为什么C 在面心立方中的溶解度比在体心立方结构中大?(1)在面心立方结构中,一个晶胞含有4各原子,也含有4个八面体间隙位置。
当固溶体含8.9%C ,则100个原子中只有(100-8.9)个铁原子,即100-8.9个间隙位置,C 处在八面体间隙位置中,所以有8.99.771008.9=-%的八面体间隙位置被占据。
(2)在体心立方中,一个晶胞中含有2个原子,但是含有6个八面体间隙位置,当固溶体含有0.1%C 时,100个原子中只有100-0.1个铁原子,即(100-0.1)*3个八面体间隙位置,所以有0.10.033(1000.1)3=-⨯%的八面体间隙位置被占据。
(3)虽然面心立方结构的堆垛密度比体心立方结构大,,即面心立方的总空隙体积比体心立方小,但是由于面心立方结构中1个晶胞含有4个原子以及4个八面体间隙和8个四面体间隙,原子数与间隙数之比为1:3;而体心立方结构中1个晶胞含1个原子以及6个八面体间隙和12个四面体间隙,原子数与间隙数之比为1:9,可见,体心立方结构中的间隙数量比面心立方多得多,使得每个间隙的体积比面心立方结构小得多。
