酶切位点保护碱基
酶切位点保护碱基
CCCCGGGG CCCCCGGGGG TCCCCCGGGGGA
CGGATCCG CGGGATCCCG CGCGGATCCGCG
CAGATCTG GAAGATCTTC GGAAGATCTTCC
GGCGCGCC AGGCGCGCCT TTGGCGCGCCAA
10 〉90
0 0 0
0 0 0 75
〉90 〉90 >90
0 0 75
0 〉90 〉90
0 50
0 75
0 0 0 0 〉90 〉90
0 25 50
0 10 10 90 >90
〉90 〉90
0 25 >90
0 25 50 〉90
Pst I
Pvu I Sac I Sac II Sal I
Sca I Sma I
TTAATTAA GTTAATTAAC CCTTAATTAAGG
GTTTAAAC GGTTTAAACC GGGTTTAAACCC AGCTTTGTTTAAACGGCGCGCCGG
>90 〉90 >90
0 0 10
0 〉90 >90
0 25
0 50
0 0 0 0 75 75
0 10 10
0 10 10 25 25
>90 >90 〉90
〉90 >90 >90
Hae III Hind III Kpn I
Mlu I Nco I Nde I
Nhe I Not I
Nsi I Pac I Pme I
GGGGCCCC AGCGGCCGCT TTGCGGCCGCAA
CAAGCTTG CCAAGCTTGG CCCAAGCTTGGG
NEB保护碱基-各种酶切位点保护碱基
切割率%
2 hr
20 hr
0
0
0
0
0
0
0
0
>90
>90
>90
>90
>90
>90
>90
>90
>90
>90
50
>90
>90
>90
>90
>90
10
25
>90
>90
>90
>90
0
0
75
>90
25
>90
0
0
0
0
50
>90
0
10
0
0
25
50
25
>90
0
0
0
0
>90
>90
50
50
>90
>90
>90
>90
>90
>90
0
0
>90
>90
75
>90
75
>90
Xho I
CCTCGAGG CCCTCGAGGG CCGCTCGAGCGG
0
0
10
25
10
75
欢迎阅读
Xma I
CCCCGGGG CCCCCGGGGG CCCCCCGGGGGG TCCCCCCGGGGGGA
0
0
25
75
50
>90
>90
>90
注释:
各种酶切位点的保护碱基 引物设计必看
各种酶切位点的保护碱基酶不同,所需要的酶切位点的保护碱基的数量也不同。
一般情况下,在酶切位点以外多出3个碱基即可满足几乎所有限制酶的酶切要求。
在资料上查不到的,我们一般都随便加3个碱基做保护。
寡核苷酸近末端位点的酶切(Cleavage Close to the End of DNA Fragments(oligonucleotides)为了解不同内切酶对识别位点以外最少保护碱基数目的要求,NEB采用了一系列含识别序列的短双链寡核苷酸作为酶切底物进行实验。
实验结果对于确定双酶切顺序将会有帮助(比如在多接头上切割位点很接近时),或者当切割位点靠近DNA末端时也很有用。
在本表中没有列出的酶,则通常需在识别位点两端至少加上6个保护碱基,以确保酶切反应的进行。
实验方法:用γ-[32P]ATP在T4多聚核苷酸激酶的作用下标记0.1A260单位的寡核苷酸。
取1 μg 已标记了的寡核苷酸与20单位的内切酶,在20°C条件下分别反应2小时和20小时。
反应缓冲液含70 mM Tris-HCl (pH 7.6), 10 mM MgCl2 , 5 mM DTT及适量的NaCl或KCl(视酶的具体要求而定)。
20%的PAGE(7 M尿素)凝胶电泳分析,经放射自显影确定酶切百分率。
本实验采用自连接的寡核苷酸作为对照。
若底物有较长的回文结构,切割效率则可能因为出现发夹结构而降低。
2.双酶切的问题参看目录,选择共同的buffer。
其实,双酶切选哪种buffer是实验的结果,takara公司从1979年开始生产限制酶以来,做了大量的基础实验,也积累了很多经验,目录中所推荐的双酶切buffer完全是依据具体实验结果得到的。
有共同buffer的,通常按照常规的酶切体系,在37℃进行同步酶切。
但BamH I在37℃下有时表现出star活性,常用30℃单切。
两个酶切位点相邻或没有共同buffer的,通常单切,即先做一种酶切,乙醇沉淀,再做另一种酶切。
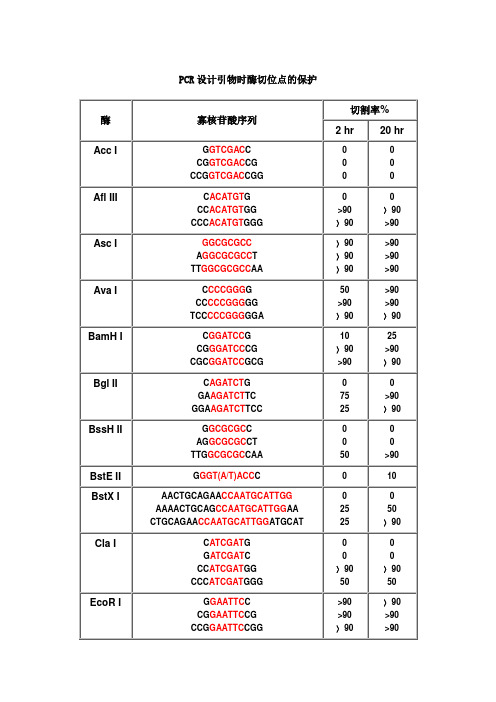
PCR设计引物时酶切位点的保护碱基

PCR设计引物时酶切位点的保护碱基引物设计是PCR实验的关键步骤之一,引物的好坏会直接影响到PCR反应的成功与否。
而在引物设计过程中,酶切位点的保护碱基是需要考虑的重要因素之一在PCR实验中,引物的作用是指定PCR反应的放大区域,并提供启动位点供聚合酶结合。
一般情况下,引物至少需要包含一段特定的DNA序列,以便与目标序列互补配对。
在引物设计过程中,选择合适的酶切位点是十分必要的。
酶切位点是指位于特定DNA序列上的限制酶可以识别并切割的区域。
酶切位点的选择通常需要考虑如下几个方面:1.切割效果:选择切割效果好的酶切位点可以提高PCR反应的特异性和灵敏度。
经典的选择是选择一种具有4-6个碱基的酶切位点,并且该位点在引物中间的位置。
这可以有效防止酶切位点的保护碱基对PCR反应的影响。
2.特异性:引物需要选择适合的酶切位点,以确保只有目标序列被放大,而不包括其他与之相关的非特异性序列。
因此,在选择酶切位点时应尽量避免与其他非特异性序列存在相似性。
3.引物长度:引物长度的选择也与酶切位点相关。
如果引物长度过短,可能会导致酶切位点过于靠近PCR反应产物的端点,从而使切割效果不佳。
因此,在引物设计时,应选择适当的引物长度,以保证酶切位点的保护碱基不会对PCR反应产物的生成产生不利影响。
酶切位点的保护碱基是指在特定的DNA序列上,通过选择相应的碱基来避免受到酶切的影响。
常见的保护碱基有甲基化碱基、磷酸化碱基以及接上阻断扩增的非互补碱基等。
1.甲基化碱基:将酶切位点中的一些碱基进行甲基化处理,可以有效地阻止特定酶的切割作用。
甲基化碱基可以通过DNA甲基转移酶进行甲基化修饰。
2.磷酸化碱基:磷酸化碱基是在引物设计过程中添加磷酸基团的方法,通过给酶切位点添加一个磷酸基团来阻断酶的切割作用。
3.非互补碱基:为了阻断酶切位点的切割作用,可以在酶切位点的周围引入一个与其不互补的碱基序列。
这样可以阻断酶的结合和切割。
总的来说,选择合适的酶切位点和保护碱基对PCR实验的成功至关重要。
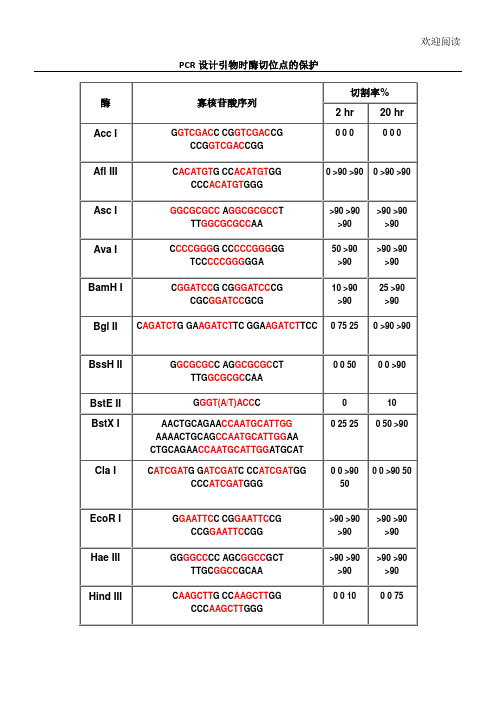
各种酶切位点的保护碱基引物设计必看

各种酶切位点的保护碱基引物设计必看Document serial number【KK89K-LLS98YT-SS8CB-SSUT-SST108】各种酶切位点的保护碱基酶不同,所需要的酶切位点的保护碱基的数量也不同。
一般情况下,在酶切位点以外多出3个碱基即可满足几乎所有限制酶的酶切要求。
在资料上查不到的,我们一般都随便加3个碱基做保护。
寡核苷酸近末端位点的酶切(Cleavage Close to the End of DNA Fragments(oligonucleotides)为了解不同内切酶对识别位点以外最少保护碱基数目的要求,NEB采用了一系列含识别序列的短双链寡核苷酸作为酶切底物进行实验。
实验结果对于确定双酶切顺序将会有帮助(比如在多接头上切割位点很接近时),或者当切割位点靠近DNA末端时也很有用。
在本表中没有列出的酶,则通常需在识别位点两端至少加上6个保护碱基,以确保酶切反应的进行。
实验方法:用γ-[32P]ATP在T4多聚核苷酸激酶的作用下标记0.1A260单位的寡核苷酸。
取1 μg 已标记了的寡核苷酸与20单位的内切酶,在20°C条件下分别反应2小时和20小时。
反应缓冲液含70 mM Tris-HCl (pH , 10 mM MgCl2 , 5 mM DTT及适量的NaCl或KCl(视酶的具体要求而定)。
20%的PAGE(7 M尿素)凝胶电泳分析,经放射自显影确定酶切百分率。
本实验采用自连接的寡核苷酸作为对照。
若底物有较长的回文结构,切割效率则可能因为出现发夹结构而降低。
2.双酶切的问题参看目录,选择共同的buffer。
其实,双酶切选哪种buffer是实验的结果,takara公司从1979年开始生产限制酶以来,做了大量的基础实验,也积累了很多经验,目录中所推荐的双酶切buffer完全是依据具体实验结果得到的。
有共同buffer的,通常按照常规的酶切体系,在37℃进行同步酶切。
限制性内切酶酶切位点及保护碱基

寡核苷酸近末端位点的酶切(Cleavage Close to the End of DNA Fragments (oligonucleotides))为什么要添加保护碱基?在分子克隆实验中,有时我们会在待扩增的目的基因片段两端加上特定的酶切位点,用于后续的酶切和连接反应。
由于直接暴露在末端的酶切位点不容易直接被限制性核酸内切酶切开,因此在设计PCR引物时,人为的在酶切位点序列的5‘端外侧添加额外的碱基序列,即保护碱基,用来提高将来酶切时的活性。
其次,在分子克隆实验中选择载体的酶切位点时,相临的两个酶切位点往往不能同时使用,因为一个位点切割后留下的碱基过少以至于影响旁边的酶切位点切割。
该如何添加保护碱基?添加保护碱基时,最关心的应该是保护碱基的数目,而不是种类。
什么样的酶切位点,添加几个保护碱基,是有数据可以参考的。
添加什么保护碱基,如果严格点,是根据两条引物的Tm值和各引物的碱基分布及GC含量。
如果某条引物Tm值偏小,GC%较低,添加时多加G或C,反之亦反。
为了解不同内切酶对识别位点以外最少保护碱基数目的要求,NEB采用了一系列含识别序列的短双链寡核苷酸作为酶切底物进行实验。
实验结果对于确定双酶切顺序将会有帮助(比如在多接头上切割位点很接近时),或者当切割位点靠近DNA末端时也很有用。
在本表中没有列出的酶,则通常需在识别位点两端至少加上6个保护碱基,以确保酶切反应的进行。
单位的寡实验方法:用γ-[32P]ATP在T4多聚核苷酸激酶的作用下标记0.1A260核苷酸。
取1 µg已标记了的寡核苷酸与20单位的内切酶,在20°C条件下分别反应2小时和20小时。
反应缓冲液含70 mM Tris-HCl (pH 7.6), 10 mM MgCl,25 mM DTT及适量的NaCl或KCl(视酶的具体要求而定)。
20%的PAGE(7 M尿素)凝胶电泳分析,经放射自显影确定酶切百分率。
本实验采用自连接的寡核苷酸作为对照。
酶切位点保护碱基表

酶切位点保护碱基表:PRC引物保护碱基的设计首先要明确什么是保护碱基限制性内切酶识别特定的DNA序列,除此之外,酶蛋白还要占据识别位点两边的若干个碱基,这些碱基对内切酶稳定的结合到DNA双链并发挥切割DNA作用是有很大影响的,被称为保护碱基。
添加保护碱基的目的在分子克隆实验中,有时我们会在待扩增的目的基因片段两端加上特定的酶切位点,用于后续的酶切和连接反应。
但实验证明,大多数限制酶对裸露的酶切位点不能切断。
必须在酶切位点旁边加上一个至几个保护碱基,才能使所定的限制酶对其识别位点进行有效切断。
因此在设计PCR引物时,为保护5` 端外加的内切酶识别位点,人为地在酶切位点序列的5‘端外侧添加额外的碱基序列,即保护碱基,用来提高酶切时的活性,使酶切完全。
其次,在分子克隆实验中选择载体的酶切位点时,相临的两个酶切位点往往不能同时使用,因为一个位点切割后留下的碱基过少以至于影响旁边的酶切位点切割。
添加保护碱基的原则添加保护碱基,需要考虑两个因素:一是碱基数目,一是碱基种类。
添加保护碱基时,最关心的应该是保护碱基的数目,而不是种类。
什么样的酶切位点,添加几个保护碱基,是有数据可以参考的。
一般情况下,普通的内切酶只加入两个保护碱基,其内切反应就可以正常进行;而有一类,仅仅只加入两个保护碱基,其内切反应就不能正常进行,这是因为内切酶不能正常结合DNA段上。
如NdeI就属这类,需要加入至少6个保护碱基,常用的HindIII也要三个。
添加什么保护碱基,如果严格点,是根据两条引物的Tm值和各引物的碱基分布及GC含量。
如果某条引物Tm值偏小,GC%较低,添加时多加G或C,反之亦反。
为了解不同内切酶对识别位点以外最少保护碱基数目的要求,NEB采用了一系列含识别序列的短双链寡核苷酸作为酶切底物进行实验。
实验结果对于确定双酶切顺序将会有帮助(比如在多接头上切割位点很接近时),或者当切割位点靠近DNA末端时也很有用。
在本表中没有列出的酶,则通常需在识别位点两端至少加上6个保护碱基,以确保酶切反应的进行。
各种酶切位点的保护碱基引物设计必看

各种酶切位点的保护碱基引物设计必看酶切位点的保护碱基引物设计在分子生物学领域中起着至关重要的作用。
它们是研究者在酶切实验中必不可少的工具,用于保护酶切位点周围的碱基,以避免酶的切割作用。
本文将介绍保护碱基引物设计的一般原则和具体步骤,并探讨一些常见的问题和注意事项。
保护碱基引物设计的一般原则如下:1.引物长度:保护碱基引物的长度通常为15-25个碱基对。
2.引物序列:引物应根据酶切位点的序列设计。
为了确保引物的特异性,通常将酶切位点和其周围的碱基考虑在内。
3.引物组成:引物的核苷酸组成应考虑碱基的GC含量,以保持引物的稳定性。
通常,GC含量高于50%的引物更稳定。
4.引物末端修饰:引物的末端修饰可以提高引物与目标DNA的亲和性,并增加引物的稳定性。
常用的末端修饰包括磷酸化和胺基修饰等。
保护碱基引物设计的步骤如下:1.获取酶切位点序列:首先,需要获取目标DNA序列中待保护的酶切位点的序列。
2.引物设计:根据酶切位点的序列设计引物。
引物的长度通常为15-25个碱基对。
为了提高特异性,可以考虑在引物序列中加入一些限制性内切酶无法识别的碱基。
3.引物末端修饰:根据需要选择引物的末端修饰方式,例如磷酸化和胺基修饰等。
4.引物的合成:完成引物设计后,可以委托专业的生物科技公司进行引物的合成。
确保引物的纯度和质量。
在进行保护碱基引物设计时,还需注意一些常见的问题和注意事项:1.引物特异性:在设计引物时,要确保引物与目标DNA的序列具有高度特异性,以避免引物与非目标区域的杂交。
2.引物的稳定性:引物的稳定性对于酶切实验的成功至关重要。
在设计引物时,要尽量选择稳定的引物序列,例如具有较高GC含量的引物。
3.引物纯度和质量:为了保证引物的质量和稳定性,引物的合成必须由专业的生物科技公司进行。
确保引物的纯度高,无杂质。
4.引物的浓度和稀释:在使用引物进行酶切实验时,要合理确定引物的浓度和稀释倍数,以保证实验的成功。
总之,保护碱基引物设计是分子生物学研究中不可或缺的一部分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
25
90
AAGGAAAAAAGCGGCCGCAAAAGGAAAA
25
>90
Nsi I
TGCATGCATGCA CCAATGCATTGGTTCTGCAGTT
10
>90
>90
>90
Pac I
TTAATTAA GTTAATTAAC CCTTAATTAAGG
0
0
0
25
0
>90
Pme I
GTTTAAAC GGTTTAAACC GGGTTTAAACCC AGCTTTGTTTAAACGGCGCGCCGG
CATCGATG GATCGATC CCATCGATGG CCCATCGATGGG
GGAATTCC CGGAATTCCG CCGGAATTCCGG
GGGGCCCC AGCGGCCGCT TTGCGGCCGCAA
CAAGCTTG CCAAGCTTGG CCCAAGCTTGGG
切割率%
2 hr
20 hr
0
0
10
25
0
10
Sac I Sac II
CGAGCTCG
GCCGCGGC TCCCCGCGGGGA
10
10
0
0
50
>90
Sal I
GTCGACGTCAAAAGGCCATAGCGGCCGC
0
0
GCGTCGACGTCTTGGCCATAGCGGCCGCGG
10
50
ACGCGTCGACGTCGGCCATAGCGGCCGCG
10
75
GAA
Sca I Sma I Spe I Sph I Stu I Xba I Xho I Xma I
GAGTACTC AAAAGTACTTTT
CCCGGG CCCCGGGG CCCCCGGGGG TCCCCCGGGGGA
GACTAGTC GGACTAGTCC CGGACTAGTCCG CTAGACTAGTCTAG
CAGATCTG GAAGATCTTC GGAAGATCTTCC
GGCGCGCC AGGCGCGCCT TTGGCGCGCCAA
GGGT(A/T)ACCC
AACTGCAGAACCAATGCATTGG AAAACTGCAGCCAATGCATTGGAA CTGCAGAACCAATGCATTGGATGCAT
0
0
0
25
0
50
75
>90
Pst I
GCTGCAGC TGCACTGCAGTGCA
0
0
10
10
AACTGCAGAACCAATGCATTGG
>90
>90
AAAACTGCAGCCAATGCATTGGAA
>90
>90
CTGCAGAACCAATGCATTGGATGCAT
0
0
Pvu I
CCGATCGG ATCGATCGቤተ መጻሕፍቲ ባይዱT TCGCGATCGCGA
基(黑色),相同如果要在 3‘端加保护碱基,就在酶切位点识别碱基序列(红色)
的 3’端加上相应的碱基(黑色)。
2.切割率:正确识别并酶切的效率
3。加保护碱基时最好选用切割率高时加的相应碱基。
GGCATGCC CATGCATGCATG ACATGCATGCATGT
AAGGCCTT GAAGGCCTTC AAAAGGCCTTTT
CTCTAGAG GCTCTAGAGC TGCTCTAGAGCA CTAGTCTAGACTAG
CCTCGAGG CCCTCGAGGG CCGCTCGAGCGG
CCCCGGGG CCCCCGGGGG CCCCCCGGGGGG TCCCCCCGGGGGGA
>90
>90
0
0
0
0
10
75
Kpn I
GGGTACCC GGGGTACCCC CGGGGTACCCCG
0
0
>90
>90
>90
>90
Mlu I
GACGCGTC CGACGCGTCG
0
0
25
50
Nco I
CCCATGGG CATGCCATGGCATG
0
0
50
75
Nde I
CCATATGG CCCATATGGG CGCCATATGGCG GGGTTTCATATGAAACCC GGAATTCCATATGGAATTCC GGGAATTCCATATGGAATTCCC
酶切位点保护碱基
Revised at 2 pm on December 25, 2020.
酶 Acc I Afl III Asc I Ava I BamH I Bgl II BssH II BstE II BstX I Cla I
EcoR I Hae III Hind III
PCR 设计引物时酶切位点的保护
0
0
0
0
0
0
0
0
>90
>90
>90
>90
>90
>90
>90
>90
>90
>90
50
>90
>90
>90
>90
>90
10
25
>90
>90
>90
>90
0
0
75
>90
25
>90
0
0
0
0
50
>90
0
10
0
0
25
50
25
>90
0
0
0
0
>90
>90
50
50
>90
>90
>90
>90
>90
>90
>90
>90
>90
>90
10
25
75
75
0
10
0
10
10
50
>90
>90
10
>90
10
>90
0
50
0
50
0
0
0
25
10
50
>90
>90
>90
>90
>90
>90
0
0
>90
>90
75
>90
75
>90
0
0
10
25
10
75
0
0
25
75
50
>90
>90
>90
注释:
1.如果要加在序列的 5‘端,就在酶切位点识别碱基序列(红色)的 5’端加上相应的碱
寡核苷酸序列
GGTCGACC CGGTCGACCG CCGGTCGACCGG
CACATGTG CCACATGTGG CCCACATGTGGG
GGCGCGCC AGGCGCGCCT TTGGCGCGCCAA
CCCCGGGG CCCCCGGGGG TCCCCCGGGGGA
CGGATCCG CGGGATCCCG CGCGGATCCGCG
0
0
0
0
0
0
0
0
75
>90
75
>90
Nhe I
GGCTAGCC CGGCTAGCCG CTAGCTAGCTAG
0
0
10
25
10
50
Not I
TTGCGGCCGCAA ATTTGCGGCCGCTTTA
0
0
10
10
AAATATGCGGCCGCTATAAA
10
10
ATAAGAATGCGGCCGCTAAACTAT
