第四章蛋白酶与溶解酶解析
最新蛋白质与酶学讲义完全版_图文ppt课件

三、蛋白质的氨基酸序列与生物功能
(一)同源蛋白质的物种差异与生物进化
1.同源蛋白质
同源蛋白质是指在不同生物体中行使相同或相似功能的蛋白质。
同源蛋白质的氨基酸序列具有明显的相似性,这种相似性序列称 序列同源性(sequence homology)。
肌球蛋白(兔)
470000
核酮糖二磷酸羧化酶(菠菜) 560000
谷氨酰合成酶(E.coli)
600000
残基数目/链 21(A), 30(B) 104 124 129 153 13(α),132(β),97(γ) 141(α),146(β) 550 200 214(α), 446(β) 500
1800 (重链h), 190 (α) ,149 (α/) ,160 (β)
用两种或几种不同的断裂方法(指断裂点不同)将每条多肽链样品降解 成两套或几套重叠的肽段或称肽碎段。
(7)测定各肽段的氨基酸序列
常用的肽段测序方法是Edman降解法,此外还有酶解法和质谱法等。
(8)重建完整多肽链的一级结构
利用两套或多套肽段的氨基酸序列彼此间有交错重叠可以拼凑出原来的 完整多肽链的氨基酸序列。
(9 )确定半胱氨酸残基间形成的S—S交联桥的位置
(二)N—末端和C—末端氨基酸残基的鉴定
1.N—末端分析
(1)二硝基氟苯(DNFB或FDNB)法
多肽或蛋白质的游离末端NH2与DNFB(称Sanger试剂) 反应后, 生成DNP—多肽或DNP—蛋白质。DNP—多肽经酸水解后,只 有N—末端氨基酸为黄色DNP—氨基酸衍生物,其余的都是游 离氨基酸。
不变碱基(invariant residue):同源蛋白质的氨基酸序列中有许 多位置的氨基酸残基对所有已研究过的物种来说都是相同的。 可变碱基 (variant residue):其他位置的氨基酸残基对不同物种 有相当大的变化。
食品酶学:内 容

内容第一章概述2第二章酶的结构与功能4第三章酶的提取、分离与纯化6第四章糖酶4第五章蛋白酶4第六章脂酶4第七章氧化酶类4第八章溶菌酶2第九章果胶酶类4第十章酶和酶制剂在食品加工中的应用4第一章概述酶是一种具有生物活性的蛋白质。
第二节酶的一般特征一、酶是蛋白质1、支持实验:酶在用热、强酸、强碱、重金属和洗涤剂处理时易失活,而蛋白质在用同样条件处理易变性。
与蛋白质一样,用强酸、强碱长时间处理生产氨基酸;蛋白质的所有典型实验,如双缩脲反应。
2、全酶蛋白质部分:脱辅基酶蛋白非蛋白质部分:辅助因子辅助因子:低分子量的有机化合物或者金属离子。
二、酶是催化剂影响反应的速度,但本身不没有成为反应的产物。
降低反应的活化能。
三、酶具有特异性蛋白酶水解肽键。
麦芽糖酶水解麦芽糖为葡萄糖。
第三节酶的分类和命名一、分类和命名习惯名称:底物的名称而确定。
如脲酶(Urease),乳酸脱氢酶(Lactate dehyogenase)。
老黄酶(Old yellow enzyme),过氧化氢酶(Catalase),木瓜蛋白酶(Payain)和胰蛋白酶(Trypsin)等。
1955年,成立了国际生物化学协会酶委员会。
该委员会对酶分为六大类:第一大类:氧化还原酶第二大类:转移酶第三大类:水解酶第四大类:裂合酶第五大类:异构酶第六大类:连接酶(合成酶)国际生物化学酶委员会的系统命名每一种酶有一个四位数的号码第一位数表示大类;第二位数表示亚类;第三位数表示次亚类;第四位数表示酶在次亚类中的编号。
如乳酸脱氢酶:1.1.1.27三糖磷酸异构酶:5.3.1.1尚有少数的酶没有系统命名,因为它所催化的反应还没有精确地确定。
缺点:1、没有考虑到酶的来源。
从不同组织和器官中提取的酶可以催化相同的反应,但他们可能含有不同的氨基酸组合;2、使用不便。
二、同功酶(同工酶)在同一个生物品种或组织中可能存在着能催化系统反应的不同的酶的形式。
它们的差异:氨基酸顺序、共价性质或三维结构等。
酶学课件之蛋白酶

高岭土吸附
洗脱、压滤
汁液
吸附物
洗脱液
盐析
盐析物
离心 湿粗酶饼 溶解、过滤 澄清液
沉淀 湿酶
干燥
精品
学习文档
菠萝蛋白酶
(2)单宁沉淀法工艺流程
压榨
菠萝下脚料
汁液
去杂质
澄清液 加稳定剂
稳稳定定液液
加单宁 单宁沉淀物 洗脱
滤液
干燥
酶制品
学习文档
菠萝蛋白酶
(3)超滤浓缩法工艺流程
菠萝下脚料 压榨
汁液 去杂质
学习文档
金属蛋白酶的特性
❖ 从鲤鱼肌肉中纯化得到的金属蛋白酶活性温 度范围为30~50℃;
❖ 来源于草鱼肌肉的金属蛋白酶最适温度为 40℃;
❖ 来源于微生物的金属蛋白酶其对温度的耐受 性更强。
❖ 最适pH值在7.5~8.0之间。
学习文档
学习文档
学习文档
1)广泛存在于动物胰脏、细菌、霉菌中,活性中心含 丝氨酸残基,酶活性可受到二异丙基磷酰氟(DFP),苯 甲基磺酰氟(PMSF)和马铃薯抑制剂(PI)等的专一 性抑制。
2)酶学性质 ➢ 酶的最适pH在9.5~10.5,个别为中性 ➢ 分子量在15~30kDa ➢ 等电点PI约9,在低温下于pH9~10稳定,但在65℃时
3、4、2、3 天门冬氨酸蛋白酶类
[carboxyl(asid) pritelnase]
活性中心含 Asp,最适pH 在5以下
胃蛋白酶 凝乳酶
3、4、2、4 金属蛋白酶类
活性中心含有
(metallopritelnase)学习文档Z等n金2+属、 Mg2+
枯草杆菌蛋白酶 嗜热菌蛋白酶
2.1 丝氨酸蛋白酶
蛋白酶k

作用
值得注意的是,蛋白酶K在原位杂交技术中通常用于杂交前的处理,它具有消化包围靶DNA蛋白质的作用,以增 加探针与靶核酸结合的机会,提高杂交信号.但蛋白酶K的浓度过高、消化时间过长或孵育温度过高时,都会对细胞 的结构有一定的破坏,导致组织切片的脱落,细胞核的消失,从而影响杂交结果.EDTA缓冲液可以替代蛋白酶K的作 用,解决上述出现的问题,并能达到理想的染色效果.
简介
从林伯氏白色念球菌(tritirachium album limber)中纯化得到。据资料显示:该酶有两个Ca2+结合位点, 它们离酶的活性中心有一定距离,与催化机理并无直接关系。然而,如果从该酶中除去Ca2+,由于出现远程的结 构变化,催化活性将丧失80%左右,但其剩余活性通常已足以降解在一般情况下污染酸制品的蛋白质。所以,蛋 白酶k消化过程中通常加入EDTA(以抑制依赖于Mg2+的核酸酶的作用)。但是,如果要消化对蛋白酶k具有较强耐 性的蛋白,如角蛋白一类,则可能需要使用含有1mmol/l Ca2+而不含EDTA的缓冲液。在消化完毕后、纯化核酸前 要加入EGTA(ph8.0)至终浓度为2mmol/l,以鳌合Ca2+。
蛋白酶K,是一种切割活性较广的丝氨酸蛋白酶。它切割脂族氨基酸和芳香族氨基酸的羧基端肽键。此酶经纯 化去除了RNA酶和DNA酶活性。由于蛋白酶K在尿素和SDS中稳定,还具有降解天然蛋白质的能力,因而它应用很广 泛,包括制备脉冲电泳的染色体DNA,蛋白质印迹以及去除DNA和RNA制备中的核酸酶。蛋白酶K的一般工作浓度是 50—100μg/ml。在较广的pH范围内(pH 4-12.5)均有活性。
蛋白酶k
强力蛋白溶解酶
蛋白酶催化蛋白质水解

蛋白酶催化蛋白质水解1、酶的重要性生命的最重要、最基本的特性在于生物体的新陈代谢,具体体现为活体经常由外部摄取所需要的物质,以生物能为动力,通过体内同化、更新、异构化,并排出某些物质,发散热能至外界。
机体或单个细胞的全部这些化学反映,基本上是在催化剂作用下完毕的。
酶是人体内新陈代谢的催化剂,只有酶存在,人体内才干进行各项生化反映。
人体内酶越多,越完整,其生命就越健康。
当人体内没有了活性酶,生命也就结束。
人类的疾病,大多数均与酶缺少或合成障碍有关。
2、酶的生物学功效在生物体内,酶发挥着非常广泛的功效,具体功效以下:(1)信号转导和细胞活动的调控都离不开酶。
特别是激酶和磷酸酶的参加。
(2)酶也能产生运动。
通过催化肌球蛋白上ATP 的水解产生肌肉收缩,并且能够作为细胞骨架的一部分参加运输胞内物质。
(3)参加在动物消化系统的工作。
以淀粉酶和蛋白酶为代表的某些酶能够将进入消化道的大分子(淀粉和蛋白质)降解为小分子,方便于肠道吸取。
淀粉不能被肠道直接吸取,而酶能够将淀粉水解为麦芽糖或更进一步水解为葡萄糖等肠道能够吸取的小分子。
不同的酶分解不同的食物底物。
(4)在代谢途径中,多个酶以特定的次序发挥功效:前一种酶的产物是后一种酶的底物;每个酶催化反映后,产物被传递到另一种酶。
有些状况下,不同的酶能够平行地催化同一种反映,从而允许进行更为复杂的调控:例如一种酶能够以较低的活性持续地催化该反映,而另一种酶在被诱导后能够较高的活性进行催化。
酶的存在拟定了整个代谢按对的的途径进行;而一旦没有酶的存在,代谢既不能按所需环节进行,也无法以足够的速度完毕合成以满足细胞的需要。
事实上如果没有酶,代谢途径,如糖酵解,无法独立进行。
例如,葡萄糖能够直接与 ATP 反映使得其一种或多个碳原子被磷酸化;在没有酶的催化时,这个反映进行得非常缓慢以致能够无视;而一旦加入己糖激酶,在 6 位上的碳原子的磷酸化反映获得极大加速,即使其它碳原子的磷酸化反映也在缓慢进行,但在一段时间后检测能够发现,绝大多数产物为葡萄糖-6-磷酸。
第四章 补体

三条途径:
经典途径(classical pathway) 旁路途径(alternative pathway) MBL途径(MBL pathway)
(一) 经典(传统)激活途径:
抗原抗体复合物依次活化C1(C1q、C1r、
C1s)、C4、C2、C3,形成 C3 与 C5 转化酶, 这一激活途径称经典途径,是抗体介导的体液 免疫反应的主要效应方式.
一般性质:
A. 主要产生细胞为肝细胞和巨噬细胞; B. 多数组分为糖蛋白; C. 血清中各成分含量不等,C3含量最多, D因子最少; D. 正常生理情况下,以非活化形式存在; E. 性质不稳定:加热56℃, 30min 失活。
二. 补体系统的激活
生理情况下血清中的补体成分大部分以 无活性的前体形式存在,在某些活化物作用下, 或在特定的颗粒表面,补体各成分依次被激活, 最终导致溶胞效应;同时,产生多种水解片段, 参与免疫调节及炎症反应等多种活动。
CR2,CD21,C3d受体
单链膜整合的糖蛋白,是 C3d 、 iC3b 、 C3dg 和
C3b 的受体,主要结合 C3d ,多数分布在 B 细胞上。
1、调节B细胞增殖、分化、记忆和抗体的产生; 2、作为EB病毒受体,与某些疾病相关。
3、补体受体 3 型
CR3,Mac-1,CD11b/CD18)
是C3b的受体,为异源二聚体,有结合 C3降解产物(iC3b,C3d)的位点; 1、介导粘附; 2、增强吞噬细胞功能; 3、具有凝集素活性。
(三) MBL(甘露糖结合凝集素)激活途径
细菌表面的多糖(甘露糖或N氨基半乳糖)经血 浆中的甘露糖结合凝集素(Mannose binding le ctin,MBL )和MBL相关的丝氨酸蛋白酶(MBL associated serum protease,MASP)活化C4和C2。 无C1的参与
酶的概念

胰 蛋 白 酶 原
S S
S-S
胰 蛋 白 酶
各种蛋白酶的激活
酶原 激活条件 活性酶 除去的小 分子 6个多肽碎 片 六肽
胃蛋白酶原
胰蛋白酶原
H+或胃蛋白酶
胃蛋白酶
胰蛋白酶
肠激酶或胰蛋 白酶 胰凝乳蛋白酶 胰蛋白酶或胰 原 凝乳蛋白酶 羧基肽酶原A 胰蛋白酶
O 酯酶:R—C—O—R′ + H2O
CH2OH
RCOO- +R OH + H+ ′
CH2OH
5
α-葡萄糖 苷酶
5
O
1
O
1
OH OH OH
O R
+H2O
OH
OH
+ ROH
OH OH
绝对专一性:只能作用于某一底物。
O 脲酶:H2N—C—NH2 + H2O 2NH3 + CO2
(二)关于酶作用专一性的假说
3.水 解 酶 类
主要包括淀粉酶、蛋白酶、核酸酶及脂酶等。 例如,脂肪酶(Lipase)催化的脂的水解反应:
R COOCH2CH3
H2O
RCOOH
CH3CH2OH
4.裂解酶类
主要包括醛缩酶、水化酶(脱水酶)及脱氨酶等。
裂合酶催化从底物分子中移去一个基团或原子而 形成双键的反应及其逆反应。 例如, 苹果酸裂合酶即延胡索酸水合酶催化的 反应。
4.1.2 酶的化学本质及其组成
(一)酶的化学本质
证明酶的化学本质是蛋白质的主要依据是:
1.酶经酸碱水解后的最终产物是氨基酸,酶能被蛋白酶水 解而失活; 2.酶是具有空间结构的生物大分子,凡使蛋白质变性的因 素都可使酶变性失活;
蛋白酶与溶解酶
白酶,以无活性的酶原形式被分泌出来。
随着小牛的长大,由摄取母乳改变成青草
和谷物时,凝乳酶的数量下降,而胃蛋白
酶的数量增加。
• 凝乳酶从无活性酶原转变成活性酶时
经受了部分水解,分子量从36000下
降到31000,pH5时酶原主要通过自 身催化作用激活,而在pH2时,激活
过程进行得非常快。
• 凝乳酶在pH5.3~6.3最稳定,在
浑浊物质主要是由蛋白质(15~65%)
和多酚类化合物(10~35%),通称茶乳酪 (creamy),是绿茶饮料生产中的关键, 添加木瓜蛋白酶除去绿茶浸提液中的蛋白 质,对稳定绿茶饮料十分有利。
2 溶菌酶
• 溶菌酶(N-乙酰胞壁质聚糖水解酶,
EC3.2.1.17)又称为胞壁质酶,是一
种专门作用于微生物细胞壁的水解酶。
适合于配制肉类嫩化剂的蛋白酶必须具
有较高的耐热性。这是因为嫩化剂的作用
主要发生在当肉类被烧煮,温度逐渐升高,
而酶尚未失活之前的这个阶段。
烧煮导致肉类结缔组织中胶原蛋白质和强性
蛋白质变性,而蛋白酶较易作用于变性的
胶原蛋白质和弹性蛋白质。木瓜蛋白酶在
60~65度时使胶原蛋白质增溶的速度最快。
• 2、绿茶饮料浑浊:
• 4、根据酶活性部位:
(1)丝氨酸蛋白酶
(2)巯基蛋白酶(木瓜蛋白酶)
(3)金属蛋白酶
(4)酸性蛋白酶(凝乳蛋白酶)
1.3木瓜蛋白酶:
• 其酶活性部位中含有巯基,属巯基蛋
白酶。
– 木瓜蛋白酶存在于木瓜汁液中,分子量 23900,至少有3个氨基酸残基存在于酶 的活性部位,它们是Cys25(半胱)、 His159(组)和Asp158(天冬)。
– 当Cys25被氧化剂氧化或与重金属离子
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
– 木瓜蛋白酶存在于木瓜汁液中,分子量 23900,至少有3个氨基酸残基存在于酶 的活性部位,它们是Cys25(半胱)、 His159(组)和Asp158(天冬)。
– 当Cys25被氧化剂氧化或与重金属离子结 合时,酶活力被抑制,而还原剂半胱氨 酸(或亚硫酸盐)或EDTA能恢复酶的活 力。还原剂作用:从-S-S——-SH, EDTA螯合重金属离子。
– (3)对于肽链端解酶的氨肽酶,要求底物中X 是一个-H,优先选择Y不是-OH,特异性表现 在R1上。
• 5、对肽键的要求:
大多数蛋白酶不仅限于水解肽键, 尚能作用于酰胺(-NH2)、酯(COOR)、硫羟酸酯(-COSR)和异 羟污酸(力。如肽键→脂键, 即使R2满足要求也不能作为底物。
• 1、R1和R2基团的性质:
– 胰凝乳蛋白酶仅能水解R1是酪氨酸、苯 丙氨酸或色氨酸残基的侧链的肽键;胰 蛋白酶仅能水解R1是精氨酸或赖氨酸残 基的侧链的肽键。
– 胃蛋白酶和羧肽酶对R2基团具有特异性 要求,如R2是苯丙氨酸残基的侧链,那
• 2、氨基酸构型: 必须是L型的,天然蛋白质均属L
型。 • 3、底物分子大小:
5.1.2蛋白酶分类:
• 1、来源: (1)植物:菠萝、木瓜、无花果 (2)动物:胃、胰蛋白酶、凝乳酶 (胃)
(3)微生物:1398枯草杆菌、3942栖 土曲霉蛋白酶、放线菌蛋白酶
• 2、最适作用条件: (1)中性蛋白酶:pH6~8 1398枯草 杆菌、3942栖土曲霉蛋白酶 (2)碱性蛋白酶:pH9~11 2709枯草 杆菌蛋白酶
1.5 蛋白酶水解蛋白质的苦味来源:
• 水解蛋白酶的苦味和蛋白质原有的氨基
酸组成有关。特别是蛋白质中的疏水性 氨基酸是导致蛋白质经水解后产生苦肽
的重要原因。当蛋白质处于天然状态时, 这些氨基酸埋藏在蛋白质结构的内部, 因而对蛋白质的味道不会产生明显的影 响。
• 在酶水解过程中,小肽的数量将增加, 从而暴露了这些疏水性氨基酸,当它 们同味蕾相作用时就产生了苦味。
• 凝乳酶在pH5.3~6.3最稳定,在 pH3.5~4.5由于自我消化而失活。在中 性和碱性范围,无凝乳活力。
• 凝乳酶催化酪蛋白沉淀是干酪制造中 非常重要的一步。
• 原料乳杀菌——添加发酵剂、凝乳酶、 色素——凝块形成——排除乳清—— 切块、搅拌、加热
• (CaCl20.01%)——成型压榨——腌 渍——发酵成熟——上色挂蜡——成 品
• 木瓜蛋白酶在pH5时,有良好稳定性, 如pH<3或>11时酶很快失活,最适pH 随底物改变。
• 木瓜蛋白酶具有较高的耐热性,酶液在pH7 和70度下加热30分钟,而使牛乳凝结的活 力仅下降20%。
• 木瓜蛋白酶对酯和酰胺类底物表现出很高 的活力。
1.4酸性蛋白酶:(重点介绍凝乳蛋白酶) • 酸性蛋白酶是指蛋白酶具有较低的最 适pH,而不是指酸性基团存在于酶的 活性部位。酶的活性部位含有一个或 更多的羧基。
• 有胃蛋白酶、凝乳酶 • 凝乳酶是存在于哺乳期小牛第四胃中的蛋
白酶,以无活性的酶原形式被分泌出来。 随着小牛的长大,由摄取母乳改变成青草 和谷物时,凝乳酶的数量下降,而胃蛋白 酶的数量增加。
• 凝乳酶从无活性酶原转变成活性酶时 经受了部分水解,分子量从36000下降 到31000,pH5时酶原主要通过自身催 化作用激活,而在pH2时,激活过程进 行得非常快。
对于胰凝乳蛋白酶和胰蛋白酶, 底物分子大小不重要,如前述。
• 4、X和Y性质:X、Y可以是-H、-OH, 也可以继续衍生出去。
– (1)如果是肽链内切酶,在R1、R2能满足特 异性要求的前提下,肽链就能裂开,显然X和Y 必须继续衍生出去,内切酶活力才表现出最高。 X、Y可以是氨基酸残基。
– (2)对于肽链端解酶的羧肽酶,要求底物中Y 是一个-OH,其特异性对R2有严格要求。在X 不是-H时,可表现高活力。
• 如果采取有控制的酶水解,使蛋白质的水 解反应停止在某一个阶段,使肽键具有足 够的长度将疏水性氨基酸埋藏在它的结构 内部,就能减少水解蛋白质的苦味。
1.6蛋白酶作为食品添加剂的应用:
• 1、作为肉类嫩化剂 多使用木瓜蛋白酶。从宰杀老龄的动
物得到的肉类,经烧煮后口感粗糟和坚硬。 肉类中存在一定数量的胶原蛋白质,胶原 蛋白质中的交联数目和强度随动物年龄的 增加而提高。木瓜蛋白酶作用效果从肉类 感官评定和剪切力测定中可以看出。
(3)酸性蛋白酶:pH1~3 胃蛋白酶
• 3、对底物作用方式: (1)内肽酶:产物为脲、胨、多肽、低
肽 (2)外肽酶:羧肽酶:从以羧基末端
氨肽酶:从氨基末端
• 4、根据酶活性部位: (1)丝氨酸蛋白酶 (2)巯基蛋白酶(木瓜蛋白酶) (3)金属蛋白酶 (4)酸性蛋白酶(凝乳蛋白酶)
1.3木瓜蛋白酶:
适合于配制肉类嫩化剂的蛋白酶必须具 有较高的耐热性。这是因为嫩化剂的作用 主要发生在当肉类被烧煮,温度逐渐升高, 而酶尚未失活之前的这个阶段。
烧煮导致肉类结缔组织中胶原蛋白质和强性 蛋白质变性,而蛋白酶较易作用于变性的 胶原蛋白质和弹性蛋白质。木瓜蛋白酶在 60~65度时使胶原蛋白质增溶的速度最快。
第四章 蛋白酶、溶菌酶
主要内容: 1. 蛋白酶 2. 溶菌酶
1.蛋白酶
• 蛋白酶是食品工业中最重要的一类酶。 在干酪生产、肉类嫩化和植物蛋白质 改性中都大量使用蛋白酶。人体消化 道中存在的胃蛋白酶、胰凝乳蛋白酶、 羧肽酶和氨肽酶使人体摄入的蛋白质 水解成小分子肽和氨基酸。
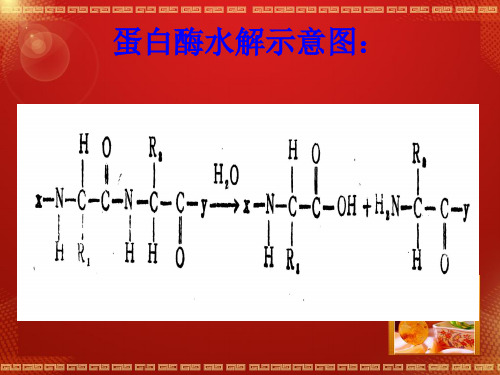
蛋白酶水解示意图:
1.1蛋白质的特异性要求
• 2、绿茶饮料浑浊: 浑浊物质主要是由蛋白质(15~65%)
和多酚类化合物(10~35%),通称茶乳酪 (creamy),是绿茶饮料生产中的关键,添 加木瓜蛋白酶除去绿茶浸提液中的蛋白质, 对稳定绿茶饮料十分有利。
2 溶菌酶
• 溶菌酶(N-乙酰胞壁质聚糖水解酶, EC3.2.1.17)又称为胞壁质酶,是一 种专门作用于微生物细胞壁的水解酶。 溶菌酶是由129个氨基酸构成的单纯碱 性球蛋白,化学性质非常稳定。
