教材第六章习题解答
教材课后题答案-第6章_指针习题答案

习题解答一、单项选择题1.若定义了int n=2, *p=&n, *q=p;则下面【】的赋值是非法的。
A.p=qB. *p=*qC. n=*qD. p=n【答案】D2.若定义了double *p, a;则能通过scanf函数给输入项读入数据的程序段是【】。
A.p=&a; scanf(“%1e”,p);B. *p=&a; scanf(“%1f”,p);C. p=&a; scanf(“%f”,p);D. p=&a; scanf(“%1f”,a);【答案】C3.若定义了int a[10], i=3, *p; p=&a[5];下面不能表示为a数组元素的是【】。
A.p[-5]B. a[i+5]C. *p++D. a[i-5]【答案】D4.若有如下定义:int n[5]={1,2,3,4,5},*p=n;则值为5的表达式是【】。
A.*+5B. *(p+5)C. *p+=4D. p+4【答案】C5.设变量b的地址已赋给指针变量ps,下面为“真”的表达式是【】。
A.b==&psB. b==psC. b==*psD. &b==&ps【答案】C6.设有以下定义和语句:int a[3][2]={1,2,3,4,5,6},*p[3];p[0]=a[1];则*(p[0]+1)所代表的数组元素是【】。
A.a[0][1]B. a[1][0]C. a[1][1]D. a[1][2]【答案】C7.若定义了char *str=”Hello!”;下面程序段中正确的是【】。
A.char c[ ], *p=c; strcpy(p,str);B.char c[5], *p; strcpy(p=&c[1],&str[3]);C.char c[5]; strcpy(c,str);D.char c[5]; strcpy(p=c+2,str+3);【答案】B8.若有下面的程序段,则不正确的fxy函数的首部是【】。
第六章-化学反应动力学习题解答

第六章 化学反应动力学思考题解答一、是非题(判断下列说法是否正确,并说明理由)1. 错2. 对3. 错4. 错5. 错6. 错7. 对8. 对9.错 10. 对 二、选择题1. B2. A.3. B.4. D. 5 .C 6.D. 7. A. 8. B 9. B. 10. C.习题解答1.请根据质量作用定律,写出下列各基元反应或复合反应中Ad d c t与各物质浓度的关系。
(1)2A + B 2P k−−→ (2)A + 2B P + 2S k−−→ (3)22A + M A M k−−→+ (4)2A B (5)2A 2B+D B+A 2D(6)解:(1)2A A B d 2d c kc c t -= (2)2A A Bd d c kc c t -=(3)2A A M d 2d c kc c t -= (4)2A 2B 1A d 2+2d c k c k c t -=- (5)222A 1B D 1A 2A B 2D d 2+2+d c k c c k c k c c k c t ---=--(6)A 1A 2A 3C d d ck c k c k c t-=+-2.某人工放射性元素放出α粒子,半衰期为15min 。
试问多长时间后该试样能分解掉80%。
解:由题意得该反应为一级反应,符合一级反应的条件,则112ln 2t k =得 1k = ln 215=0.0462mol -1 由积分定义式 1ln ak t a x=- 令0.8xy a==得 11ln 1k t y =- 则 t=34.84mink 1 k-1 k 1 k-1 k k3.反应25222N O (g)4NO (g)O (g)−−→+,在318K 下测得N 2O 5的浓度如下: t /min 0 20 40 60 80 100 120 140 160 c /mol·m -317.69.735.462.951.670.940.500.280.16求该反应的级数和速率常数及半衰期。
第6章 相关与回归分析习题解答

第六章 相关与回归分析思考与练习一、判断题1.产品的单位成本随着产量增加而下降,这种现象属于函数关系。
答:错。
应是相关关系。
单位成本与产量间不存在确定的数值对应关系。
2.相关系数为0表明两个变量之间不存在任何关系。
答:.错。
相关系数为零,只表明两个变量之间不存在线性关系,并不意味着两者间不存在其他类型的关系。
3.单纯依靠相关与回归分析,无法判断事物之间存在的因果关系。
答:对,因果关系的判断还有赖于实质性科学的理论分析。
4.圆的直径越大,其周长也越大,两者之间的关系属于正相关关系。
答:错。
两者是精确的函数关系。
5.总体回归函数中的回归系数是常数,样本回归函数中的回归系数的估计量是随机变量。
答:对。
6.当抽取的样本不同时,对同一总体回归模型估计的结果也有所不同。
答:对。
因为,估计量属于随机变量,抽取的样本不同,具体的观察值也不同,尽管使用的公式相同,估计的结果仍然不一样。
二、选择题1.变量之间的关系按相关程度分可分为:b 、c 、da.正相关;b. 不相关;c. 完全相关;d.不完全相关; 2.复相关系数的取值区间为:aa. 10≤≤R ;b.11≤≤-R ;c.1≤≤∞-R ;d.∞≤≤-R 1 3.修正自由度的决定系数a 、b 、da.22R R ≤; b.有时小于0 ; c. 102≤≤R ;d.比2R 更适合作为衡量回归方程拟合程度的指标 4.回归预测误差的大小与下列因素有关:a 、b 、c 、da 样本容量;b 自变量预测值与自变量样本平均数的离差c 自变量预测误差;d 随机误差项的方差三、问答题1.请举一实例说明什么是单相关和偏相关?以及它们之间的差别。
答:例如夏季冷饮店冰激凌与汽水的消费量,简单地就两者之间的相关关系进行考察,就是一种单相关,考察的结果很可能存在正相关关系,即冰激凌消费越多,汽水消费也越多。
然而,如果我们仔细观察,可以发现一般来说,消费者会在两者中选择一种消费,也就是两者之间事实上应该是负相关。
第六章 醇、酚、醚习题解答

第六章醇、酚、醚一、学习要求1.掌握醇、酚、醚的结构和命名。
2.掌握醇、酚、醚的主要化学性质和醇的重要的物理性质。
3.了解硫醇、硫醚和冠醚的结构、命名、性质及其重要用途。
二、本章要点醇、酚、醚是三类重要的有机化合物,有的在医药上用作消毒剂、麻醉剂、溶剂,有的是有机合成的常用原料。
(一)醇1.结构醇分子中的羟基氧为不等性sp3杂化,其中2个杂化轨道被2对未成键电子占据,另2个杂化轨道分别与α- C的sp3杂化轨道和氢原子的S轨道形成σ键。
由于氧的电负性大,故羟基氧电子云密度大,氢电子云密度小,因此氢氧键极性较大。
2. 命名醇的普通命名是在“醇”前加上烃基名称,并省去“基”字。
醇的系统命名原则是:(1)选择含有羟基的最长碳链作为主链,称为“某醇”,并使羟基相连的碳原子编号最小,将羟基位次写在“某醇”之前,其余的原则与烷烃相同。
(2)多元醇,应选择含羟基数目最多的最长碳链作主链,按羟基数目的多少称为“某二醇”、“某三醇”等。
(3)不饱和一元醇:选择既含羟基又含不饱和键数目最多的最长碳链作主链,编号时应使羟基位次最小,根据主链碳原子数称为“某烯(炔)醇”,并在“烯(炔)”、“醇”前面标明不饱和键和羟基的位次。
(4)命名芳香醇时,将芳环作为取代基,以侧链脂肪醇为母体。
(5)脂环醇,根据脂环烃基的名称,称为“环某醇”,从羟基所连接的碳原子开始,按“取代基位次之和最小”的原则给环碳原子编号,将取代基的位次、数目、名称依次写在“环某醇”的名称之前。
3. 性质(1)重要物理性质:由于醇可形成分子间氢键,故低级醇的沸点通常比相对分子质量相近的烷烃高得多。
随着醇中烷基的增大,醇羟基与水形成氢键的能力逐渐减弱,因此低级醇易溶于水,中级醇部分溶于水,高级醇则不溶于水。
(2)主要化学性质:①醇与活泼金属(如Na、K、Mg、Al等)反应,生成相应的醇盐,并放出氢气。
醇与活泼金属的反应速率顺序为:1)低级醇>中级醇>高级醇;2)甲醇>伯醇>仲醇>叔醇②醇可以与氢卤酸、卤化磷及氯化亚砜等发生亲核取代反应。
数字信号处理第三版 教材第六章习题解答

6.2 教材第六章习题解答1. 设计一个巴特沃斯低通滤波器,要求通带截止频率6p f kHz =,通带最大衰减3p a dB =,阻带截止频率12s f kHz =,阻带最小衰减3s a dB =。
求出滤波器归一化传输函数()a H p 以及实际的()a H s 。
解:(1)求阶数N 。
lg lg sp spk N λ=-0.10.30.1 2.51011010.0562101101p s asp a k --==≈--332121022610s sp p πλπΩ⨯⨯===Ω⨯⨯将sp k 和sp λ值代入N 的计算公式得lg 0.05624.15lg 2N =-=所以取N=5(实际应用中,根据具体要求,也可能取N=4,指标稍微差一点,但阶数低一阶,使系统实现电路得到简化。
) (2)求归一化系统函数()a H p ,由阶数N=5直接查表得到5阶巴特沃斯归一化低通滤波器系统函数()a H p 为54321() 3.2361 5.2361 5.2361 3.23611a H p p p p p p =+++++或 221()(0.6181)( 1.6181)(1)a H p p p p p p =+++++ 当然,也可以按(6.12)式计算出极点:121()22,0,1,2,3,4k j Nk p ek π++==按(6.11)式写出()a H p 表达式41()()a k k H p p p ==-代入k p 值并进行分母展开得到与查表相同的结果。
(3)去归一化(即LP-LP 频率变换),由归一化系统函数()a H p 得到实际滤波器系统函数()a H s 。
由于本题中3p a dB =,即32610/c p rad s πΩ=Ω=⨯⨯,因此()()a a cH s H p s p ==Ω5542332453.2361 5.2361 5.2361 3.2361c c c cc cs s ss s Ω=+Ω+Ω+Ω+Ω+Ω对分母因式形式,则有()()a a cH s H p s p ==Ω52222(0.6180)( 1.6180)()c c c c cc s s s s s Ω=+Ω-Ω+Ω-Ω+Ω如上结果中,c Ω的值未代入相乘,这样使读者能清楚地看到去归一化后,3dB 截止频率对归一化系统函数的改变作用。
第六章 化学平衡练习题解答

第六章 化学平衡练习题解答练习6.1 反应的r m G ∆是(),/T p G ξ∂∂,它可表示为G -ξ图中的 切 线。
化学亲和势是defrmΔG-=A 。
练习6.2 T 、p 及组成恒定时反应n 的摩尔反应吉布斯函数变r m G ∆与化学势的关系是r m B B B ,T pG G νμξ⎛⎫∂=∆= ⎪∂⎝⎭∑,写出两个中的任意一个即可。
练习6.3 已知气相反应A(g)+B(g)D(g)−−→←−−在温度T 时的标准摩尔反应吉布斯函数变r m G ∆(T ),用r mG ∆(T )判断反应自动进行的方向和限度的条件是在温度T 的标准状态下,且无其它功的条件下,才可以用r m G ∆(T )判断反应自动进行的方向和限度。
练习6.4 如用化学亲和势判断反应的方向和程度的判式是0>A ,反应自发地向右进行; 0A <,反应自发地向左;0=A ,反应达到平衡。
练习6.5 混合吉布斯自由能的定义是 混合后与混合前的吉布斯自由能之差,即mix BB Bln G RTnx ∆=∑,化学反应通常不能进行到底的本质原因是反应物和产物之间存在混合吉布斯自由能。
练习6.6 假设让反应能够进行到底,则使其反应在 Van ’t Hoff 平衡箱中进行,使反应物和产物 完全分离的状态 。
讨论6-1 化学平衡的热力学条件是什么?它遵循什么原则?化学反应为何不能进行到底?怎样才能进行到底? 练习6.7p K 与p Q 与分压力的关系不同的地方在于 p K 是平衡时的分压商,p Q 是任意状态下的分压商。
练习6.8 在298 K 时反应N 2O 4(g)=2NO 2(g)的p K = 0.1132,当242(N O )(NO )1kPa p p ==时反应将向 右 移动。
当24(N O )10kPa,p =p (NO 2)=1 kPa 时,反应将向 左 移动。
练习6.9 若用下列两个化学计量方程来表示合成氨的反应, (1)2233H (g)+N (g)2NH (g) r m ,1G ∆ ,,1p K(2)22331H (g)+N (g)NH (g)22r m,2G ∆ ,,2p K 。
第六章金属电子论习题
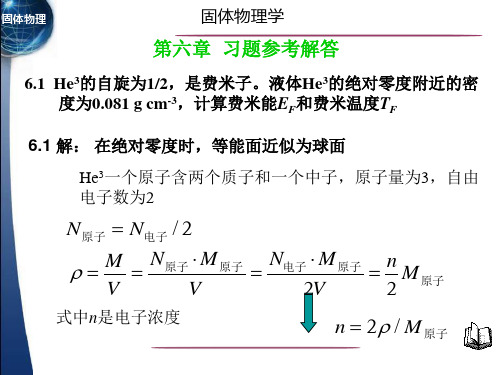
电导率
q2 m*
n (EF0 )
弛豫时间
( E F0
)
m*
nq 2
平均自由程
v (EF0 )
m*v
nq 2
kF
nq2
0 K到室温之间的费密半径变化很小
9
固体物理
固体物理学
或近自由电子近似情况下
EF
EF0
1
2
12
kBT EF0
2
kF m
1.055
10 34 1.20 9.1110 31
0
10
1.39 106 m / s
固体物理
固体物理学
(4) 费密球面的横截面积
S (kF sin )2 4.52 sin 2m2
是 与 轴之间的夹角
kF
(3n
2
)
1 3
8
固体物理
固体物理学
(5) 在室温以及低温时电子的平均自由程
3
固体物理
固体物理学
N
N(
( E F0
E
)
)
4V
(
2m h2
3N / 2EF0
)3/2 E1/2
N(E)
(
EF EF0
)1/
2
N
(
EF0
)
TF
EF0 kB
3N 2kB N (EF0 )
3 6.0221023 21.3811023 3.321042
19624K
N
固体物理
第六章 习题解答

2
Λm =
κ
c
=(
0.944 )Ω −1 ⋅ m 2 ⋅ mol−1 = 9.44 × 10−3 Ω −1 ⋅ m 2 ⋅ mol−1 3 0.1 × 10
6-6 用银电极电解 AgNO3 溶液。通电一段时间后,测得在阴极上析出 1.15g 银,并知 + + 阴极区溶液中 Ag 的总量减少了 0.605g。试计算 AgNO3 溶液中离子的迁移数 t(Ag )和 t(NO3-) 。 解:在电解池的阴极上:Ag +e →Ag(s),每还原 1molAg 则需 96500C 的电量,所以通 过电解池的总电量: Q 总 =
-
x-
(2) t (K + ) = 0.6 /1 = 0.6; t ([Ag(CN) 2 ]− ) = 1 − 0.6 = 0.4
6-9 用铜电极电解 CuSO4 溶液。电解前每 100g 溶液中含 10.06g CuSO4,通电一段时 间后,测得在银电量计中沉积了 0.5008g 银,并测知阳极区溶液重 54.565g,其中含 CuSO4 2- 2+ 5.726g。试计算 CuSO4 溶液中离子的迁移数 t(Cu )和 t(SO4 ) 。
第六章 电化学
6-1 用铂电极电解 CuCl2 溶液,通过的电流为 20A,经过 15min 后,问在阴极上能析 出多少铜?在阳极上能析出多少 27℃、100kPa 下的 Cl2? 解: (1)在电解池的阴极上 Cu +2e →Cu(s) 析出 Cu 的质量:
2+ -
m=
M Cu It 63.546 × 10−3 × 20 × 15 × 60 =( )kg = 5.927 × 10−3 kg ZF 2 × 96500
-3 -1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章化学动力学习题解答1.回答问题:(1)什么是基元反应(简单反应)和非基元反应(复杂反应)?基元反应和平时我们书写的化学方程式(计量方程式)有何关系?(2)从活化分子和活化能角度分析浓度、温度和催化剂对化学反应速率有何影响。
【解答】(1)化学反应进行时,反应物分子(或离子、原子、自由基)在碰撞过程中,只经过一步直接转化为生成物分子的反应,称为基元反应。
由一种基元反应组成的总反应,称为简单反应。
由两种或两种以上基元反应所组成的总反应,是非基元反应,称为复合反应。
基元反应是反应机理最简单的反应,化学方程式是一个宏观的总反应。
(2)一定温度下,气体分子具有一定的平均能量,具体到每个分子,则有的能量高些有的低些。
只有极少数的分子具有比平均值高得多的能量,它们碰撞时能导致原有化学键破裂而发生反应,这些分子称为活化分子。
活化分子所具有的最低能量与分子的平均能量之差称为简单碰撞的活化能,简称活化能。
对一定温度下的某一特定反应,反应物分子所占的分数是一定的。
因此单位体积内的活化分子的数目与单位体积内反应分子的总数成正比,当反应物浓度增大时,单位体积内分子总数增多,活化分子的数目也相应增多。
于是单位时间内有效碰撞次数增多,反应速度加快。
温度升高不仅使分子间碰撞频率增加,更主要的是使较多的分子获得能量而成为活化分子。
结果导致单位时间内有效碰撞次数显著增加,从而大大加快了反应速率。
升高温度可使活化分子的分数增加。
催化剂能加快化学反应速率的实质,主要是因为它改变了反应的途径,降低了反应的活化能,相应地增加了活化分子的分数,反应速率也就加快。
2.设反应A+3B →3C在某瞬间时3()3-=⋅c C mol dm ,经过二秒时3()6-=⋅c C mol dm ,问在二秒内,分别以A 、B 和C 表示的反应速率A B C υυυ、、各为多少?【解答】 A + 3B → 3C由公式:υ= tc v B B∆∆⋅1有υ(A) =υ(B) =υ(C) = sdm mol dm mol t c v C C 23631133--⋅-⋅⨯=∆∆⋅ = 0.5 mol ·dm -3·s -13.下列反应为基元反应 (1)I+H →HI (2)I 2→2I(3)Cl+CH 4→CH 3+HCl写出上述各反应质量作用定律表达式。
它们的反应级数各为多少? 【解答】对于基元反应, 有 υ= K ·a A c ·bB c所以 (1)υ= k c (I)·c (H) , 反应级数为2 (2)υ= k c (I 2), 反应级数为1 (3)υ= k c (Cl)·c (CH 4), 反应级数为24.反应2HI→H 2+I 2在600K 和700K 时的速率常数分别为 2.75×10-6和5.50×10-4dm 3·mo l -1·s -1。
计算:(1)反应的活化能;(2)该反应在650K 时的速率常数。
【解答】(1)由EaRTk Ae-=,(T 1∽k 1)(T 2∽k 2)得:2211122303lg().a E k T Tk R TT -= 212211461230370060055102303831470060027510185044.lg ...lg.T T kEa RT T k J mol ---=-⨯⨯=⨯⨯-⨯=⋅ (2)由2323322303185044700650230383147006501062lg().()...a E T T k k R T T -=-=⨯⨯=,2311535.k k =, k 2=5.50×10-4dm 3·mol -1·s -1, k 3=4.77×10-5dm 3·mol -1·s -1 该反应在650K 时的速率常数4.77×10-5dm 3·mol -1·s -15.根据实验,在一定的温度范围内,反应:2NO(g)+Cl 2(g)→2NOCl(g) 符合质量作用定律,试求:(1)该反应的反应速率方程式; (2)该反应的总级数;(3)其它条件不变,如果将容器的体积增大到原来的2倍,其反应速率如何变化?(4)如果容器体积不变,而将NO 的浓度增加到原来的3倍,反应速率又将如何变化?【解答】(1)该反应的速率方程式:22NO Cl r kc c =。
(2)该该反应的总级数n=2+1=3。
(3)如果将容器的体积增大到原来的2倍,反应物的浓度下降为原来的一半, 反应速率则为原来的1/8。
(4)如果容器体积不变,而将NO 的浓度增加到原来的3倍,反应速率则为原来的9倍。
6.蔗糖的转化反应为12221126126C H O H O C H O +→(果糖)+6126C H O (葡萄糖)当催化剂HCl 的浓度为30.1-⋅mol dm ,温度为321.15K 时,由实验测得其速率方程式为r=0.0193c (蔗糖)31(min )--⋅⋅mol dm 。
今有浓度为30.2-⋅mol dm 的蔗糖溶液,于上述条件下,在一有效容积为32dm 的容器中进行反应,试求:(1)初速率是多少?(2)20min 后可得多少摩尔的葡萄糖和果糖?(3)20min 时蔗糖的转化率是多少?【解答】(1)r = 0.0193c 蔗糖 (mol ·dm -3·min -1)= 0.0193⨯0.2 = 3.86⨯10-3mol ·dm -3·min -1 ≈ 6.43⨯10-5(mol ·dm -3·min -1) (2)20min 后,蔗糖的浓度为: 0lnc kt c= c ≈ 0.136 mol ·dm -3 20min 内蔗糖的变化为 ∆n = (0.200–0.136) mol ·dm -3 ⨯ 2 dm 3= 0.128 mol即20min 后可各得0.128 mol 的葡萄糖和果糖。
(3)转化率 = %322200.0128.0n n 0=⨯=∆7.根据实验结果,在高温时焦碳与二氧化碳的反应为:2()()2()C s CO g CO g +=其活化能为1167360-⋅J mol ,计算自900K 升高到1000K 时,反应速率之比。
【解答】2211122303lg().a E k T T k R TT -=, 211673601000900230383149001000lg()..k k -=⨯⨯⨯ ≈ 0.97 ∴ K 2/K 1 = 9.368.在301K 时鲜牛奶大约4.0小时变酸,但在278K 的冰箱中可保持48小时。
假定反应速率与变酸时间成反比,求牛奶变酸反应的活化能。
【解答】 1222112303.()lg a TT k E R T T k =-, 21124048.k t k t ==则 48.4lg )301278278301(314.8303.2⨯-⨯⨯⨯=a E ≈ 75176 J ·mol -1≈ 75 kJ ·mol -19.已知242()2()N O g NO g →的指前因子221110A s -=⨯,活化能415.4410-=⨯⋅a E J mol ,求此反应在298K 时的k 值是多少?【解答】由/Ea RT k Ae -= 得:2303lg()lg()[].[]a E k AK RT A =-+ 4225441011023038314298.lg()lg []..k K ⨯=-+⨯⨯⨯ k = 2.92 ⨯ 1012 s -110.反应252421()()()2N O g N O g O g →+在298K 时511 3.410k s --=⨯,在328K 时,312 1.510k s --=⨯,求此反应的活化能a E 和指前因子A 。
【解答】由/Ea RT k Ae -= 得:512221123031010.()lg .a TT k E R T T k =≈⨯- J ·mol -1 112303lg()lg()[].[]a E k A K RT A =-+ 222303lg()lg()[].[]a E k AK RT A =-+ 将相应数据代入,得 A = 1.1 ⨯ 1013 s -111.对下列反应2524()()()→+C H Cl g C H g HCl g已知其活化能1246.9-=⋅a E kJ mol ,700K 时的速率常数511 5.910k s --=⨯,求800K 时的速率常数 k 2是多少?【解答】由/Ea RT k Ae -=得:2211122303lg().a E k T T k R TT -= 将K 1=5.9⨯10-5s -1,E a =246.9⨯103J ·mol -1,T 1=700K ,T 2=800K 代入上式,可解得 K 2=1.2⨯10-2 s -112.已知在967K 时,2()N O g 的分解反应2221()()()2N O g N g O g →+,在无催化剂时活化能为1244.8-⋅kJ mol ,而在Au 作催化剂时的活化能为1121.3-⋅kJ mol 。
问:在金作催化剂时反应速率增加为原来的多少倍?【解答】由/Ea RTk Ae-=,得1224481213283149671...a a E E RTk e e k --⨯==得 K 2/K 1 = 4.69 ⨯ 106 倍13.在570K ,使重氮甲烷32()CH N -的分解反应在30.210dm 的容器中进行,得到下列结果:时间t/min15 30 48 75 CH 3-N 2的分压p/Pa 4826.33999.63319.72573.11476.5已知32CH N -的分解反应为一级反应。
计算此分解反应速率常数1k 的平均值和反应的半衰期。
【解答】根据公式0ln p kt p=,可得: 时间t/min0 15 30 48 75 CH 3-N 2的分压p/Pa 4826.33999.6 3319.7 2573.1 1476.5 lnp/Pa 8.4828.2948.1087.8237.297k/s -12.09×10-4 2.08×10-4 2.08×10-4 2.63×10-4分解反应速率常数1k 平均值=2.25⨯10-4s -1 反应的半衰期1210693/.t k ==3.08⨯103s -114.高层大气中微量臭氧3O 可由以下过程形成:(1)2NO NO O →+(一级反应) 311 6.010k s --=⨯(2)23O O O +→(二级反应) 61312 1.010--=⨯⋅⋅k mol dm s假设由反应(1)产生原子氧的速率等于反应(2)消耗原子氧的速率。
