线栓法大鼠脑缺血再灌注模型(MCAO)制备方法pdf
改良线栓法大鼠脑缺血再灌注损伤模型的建立

改良线栓法大鼠脑缺血再灌注损伤模型的建立作者:陈晓娟肖宗宇潘琪王莉侯倩雷延成吴世政来源:《中国医学创新》2015年第03期【摘要】目的:通过改良线栓法建立稳定的Wistar大鼠大脑中动脉脑缺血/再灌注模型。
方法:60只雄性Wistar大鼠,参考Longa法并适当改进建立大鼠大脑中动脉脑缺血/再灌注模型30只,对照组30只。
实验组结扎右侧颈总动脉近心端,夹闭颈总动脉远心端,颈总动脉剪一小口,从颈总动脉经颈内动脉插入线栓,缺血1 h后,在麻醉状态下完全拔出线栓,并结扎颈内动脉远心端。
对照组结扎右侧颈内动脉近心端及远心端,但不插入线栓。
术后取脑组织行TTC染色,并进行神经功能评定。
结果:经改良线栓法制作脑缺血再灌注损伤模型,成功率达82.75%,平均操作时间约(20.4±5.3)min,模型大鼠右侧眼裂变小,行走时向右侧转圈,模型大鼠神经功能评分均在3~4分,经TTC染色梗死侧大脑半球颜色苍白,脑梗死区范围一致,梗死体积约(34.62±5.32)%;对照组无任何临床症状,无神经功能缺失表现,经TTC染色无梗死灶。
结论:通过改良,成功建立了Wistar大鼠大脑中动脉脑缺血/再灌注模型。
【关键词】线栓法;大鼠;脑缺血;再灌注缺血性脑血管病(Ischemic cerebral vascular disease,ICVD)是神经科的常见病、多发病,缺血后再灌注损伤(ischemia-reperfusion,IR)较为普遍[1]。
目前制备大鼠大脑中动脉缺血再灌注损伤模型中,线栓法大鼠大脑中动脉闭塞(Middle cerebral artery occlusion,MCAO)模型能最大程度模拟人类缺血性卒中发生,被广泛用于实验性脑缺血再灌注(Ischemia-reperfusion,IR)损伤的研究[2]。
传统的线栓法脑缺血再灌注损伤模型,多经颈外动脉插入线栓,通过颈内动脉到达大脑中动脉,以造成大脑中动脉供血区的缺血、梗死,缺血2 h后拔出线栓,形成再灌注损伤,从而成功制作模型[3-4],但该操作需分离颈总动脉、颈内及颈外动脉,操作时间相对较长,对大鼠损伤较重。
大鼠线栓(MCAO)模型+灌注取脑+TTC染色
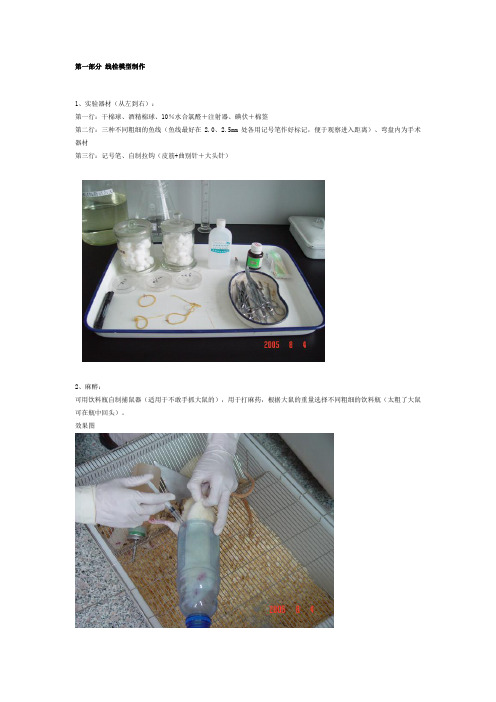
第一部分 线栓模型制作1、实验器材(从左到右):第一行:干棉球、酒精棉球、10%水合氯醛+注射器、碘伏+棉签第二行:三种不同粗细的鱼线(鱼线最好在2.0、2.5mm处各用记号笔作好标记,便于观察进入距离)、弯盘内为手术器材第三行:记号笔、自制拉钩(皮筋+曲别针+大头针)2、麻醉:可用饮料瓶自制捕鼠器(适用于不敢手抓大鼠的),用于打麻药,根据大鼠的重量选择不同粗细的饮料瓶(太粗了大鼠可在瓶中回头)。
效果图3、麻倒后绑在手术台上。
4、剪去颈前的鼠毛,碘伏消毒。
5、沿经部正中切开皮肤。
说明:切开皮肤前最好将结扎动脉的线事先剪好(后面会用到)。
6、钝性分离皮下组织。
如图:大鼠腹侧可见事先剪好的结扎线。
7、分离到气管前肌后,沿右侧胸锁乳突肌腱向下分离,见到颈动脉鞘后可上拉钩。
8、分离动脉鞘。
如图:分离好后见光滑的颈总动脉。
9、分离出颈总、颈外、颈内动脉,结扎颈总、颈外动脉,注意中间那根线不要系紧,用来插鱼线时防止出血的。
10、夹闭颈内动脉,用眼科剪将颈总动脉剪一小口。
11、插入鱼线,鱼线进入颈内动脉后按图中注释方法插(成功率在90%以上)。
说明:(1)这一步鱼线选择是关键,根据大鼠重量(作的多了后根据动脉粗细就可选择了)选鱼线。
我们的经验是:250g以下的选0.26mm的线,250-300g的选0.26mm蘸腊的或0.28的都可以。
(2)如果遇到鱼线怎么也查不进去的情况,可让大鼠休息一会,换细点的鱼线再试,这种情况不一定都是进到翼腭动脉了,我曾解剖过4例这种情况的大鼠,有三例都是在如颅的地方卡住了,可惜我们手里没有0.24mm的鱼线。
(3)通过实践,我们认为结扎或夹闭翼腭动脉没有必要,按我们的方法,熟练的话,从切开到缝合完毕也就是15分钟,算上准备工作(如麻醉、消毒等)半小时也可以搞定了,这样一上午两人作10只大鼠不成问题。
(4)我们体会最好用蘸腊的鱼线作模型,好处是进线深度控制的好,不容易出现蛛网膜下腔出血。
大鼠脑缺血模型及缺血再灌注模型
练程度直接影响实验效果。
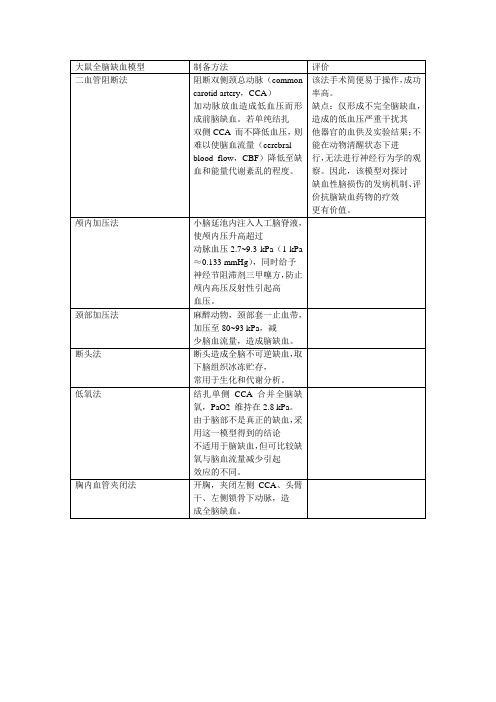
三血管阻断法
Kamegama等[28]通过电灼断基底动脉、同时夹闭
两侧颈总动脉的方法复制全脑缺血模型,由于该方法不
仅阻断了脑供血主干血管,而且也阻断了从脊前动脉来
的侧支血管,与前述四血管阻断模型比较,脑缺血成功
率高且无需再筛选是其主要优点。田鹤邨[29]等在此基
缺点:仅形成不完全脑缺血,造成的低血压严重干扰其
他器官的血供及实验结果;不能在动物清醒状态下进
行,无法进行神经行为学的观察。因此,该模型对探讨
缺血性脑损伤的发病机制、评价抗脑缺血药物的疗效
更有价值。
颅内加压法
小脑延池内注入人工脑脊液,使颅内压升高超过
动脉血压2.7~9.3 kPa(1 kPa≈0.133 mmHg),同时给予
血模型。缺点:需要开颅,创伤性大,闭塞血管后无法
进行再灌性损伤研究。
光化学法
曾报道,Watson等首次建立了光化学法诱导脑皮
层梗塞的动物模型。立体定位仪固定大鼠头部,暴露颅
骨,尾静脉注射光敏材料荧光素,用560 nm波长的特
定光源照射局部头颅,光线透过颅骨与血管内的染料
接触,激发光化学反应,引起照射部位皮层血管内皮细
大鼠全脑缺血模型
制备方法
评价
二血管阻断法
阻断双侧颈总动脉(common carotid artery,CCA)
加动脉放血造成低血压而形成前脑缺血。若单纯结扎
双侧CCA而不降低血压,则难以使脑血流量(cerebral
blood flow,CBF)降低至缺血和能量代谢紊乱的程度。
该法手术简便易于操作,成功率高。
显。进一步改进此方法,可通过降低动脉血压以减少
大鼠线栓(MCAO)模型+灌注取脑+TTC染色

第一部分 线栓模型制作1、实验器材(从左到右):第一行:干棉球、酒精棉球、10%水合氯醛+注射器、碘伏+棉签第二行:三种不同粗细的鱼线(鱼线最好在2.0、2.5mm处各用记号笔作好标记,便于观察进入距离)、弯盘内为手术器材第三行:记号笔、自制拉钩(皮筋+曲别针+大头针)2、麻醉:可用饮料瓶自制捕鼠器(适用于不敢手抓大鼠的),用于打麻药,根据大鼠的重量选择不同粗细的饮料瓶(太粗了大鼠可在瓶中回头)。
效果图3、麻倒后绑在手术台上。
4、剪去颈前的鼠毛,碘伏消毒。
5、沿经部正中切开皮肤。
说明:切开皮肤前最好将结扎动脉的线事先剪好(后面会用到)。
6、钝性分离皮下组织。
如图:大鼠腹侧可见事先剪好的结扎线。
7、分离到气管前肌后,沿右侧胸锁乳突肌腱向下分离,见到颈动脉鞘后可上拉钩。
8、分离动脉鞘。
如图:分离好后见光滑的颈总动脉。
9、分离出颈总、颈外、颈内动脉,结扎颈总、颈外动脉,注意中间那根线不要系紧,用来插鱼线时防止出血的。
10、夹闭颈内动脉,用眼科剪将颈总动脉剪一小口。
11、插入鱼线,鱼线进入颈内动脉后按图中注释方法插(成功率在90%以上)。
说明:(1)这一步鱼线选择是关键,根据大鼠重量(作的多了后根据动脉粗细就可选择了)选鱼线。
我们的经验是:250g以下的选0.26mm的线,250-300g的选0.26mm蘸腊的或0.28的都可以。
(2)如果遇到鱼线怎么也查不进去的情况,可让大鼠休息一会,换细点的鱼线再试,这种情况不一定都是进到翼腭动脉了,我曾解剖过4例这种情况的大鼠,有三例都是在如颅的地方卡住了,可惜我们手里没有0.24mm的鱼线。
(3)通过实践,我们认为结扎或夹闭翼腭动脉没有必要,按我们的方法,熟练的话,从切开到缝合完毕也就是15分钟,算上准备工作(如麻醉、消毒等)半小时也可以搞定了,这样一上午两人作10只大鼠不成问题。
(4)我们体会最好用蘸腊的鱼线作模型,好处是进线深度控制的好,不容易出现蛛网膜下腔出血。
线栓法制作大鼠局灶性脑缺血再灌注模型的研究及体会

Re s e a r c h a n d Ex p e r i e n c e o n Ma k i n g Ra t Mo d e l o f Mi d d l e Ce r e br a l Ar t e r y Oc c l u s i o n / Re p e r f u s i o n b y t h e Th r e a d Oc c l u s i o n Me t h o d Zh a n g
( 5) : 1 2—1 4 ( 收稿 日期 : 2 0 1 3— 0 8—2 0 ) ( 修 回 日期 : 2 0 1 3— 0 9—0 3 )
9
冯 天艳 ,方 荣 , 邓 改 改 ,等 .根 皮 苷 对 小 鼠 C C 1 急 性 肝 损 伤 的保 护作 用 [ J ] .中 药药 理 临床 , 2 0 1 0 , 2 6 ( 5 ) : 4 7— 4 9
鼠随机分为两组 , 组1 体重控 制为 2 3 0~ 2 4 9 g ; 组2 体 重控制为 2 5 0一 , 2 6 9 g , 每组 1 0只 。 以 改 良的 L o n g a 法 使 用 特 定 型 号 栓 线 制 作
大 鼠大 脑 中动 脉 闭 塞 模 型 , 缺血 2 h后 拔 出线 栓 实 现 再 灌 注 , 并 评 估 两组 大 鼠 的 神 经 功 能 缺 损 情 况 , 再 灌注 2 4 h时取 脑行 2 , 3 , 5一 氯 化 三 苯 基 四氮 唑 染 色 , 计 算 并 比较 两 组 大 鼠的 死 亡 率 , 神经功能评分和相对脑梗 死体积。结果 两 组 大 鼠的 死 亡 率 均 为 1 0 %,
5 9 7
1 1 曹 丹 ,薛 冰 洁 ,黄 文 峰 ,等 .湖北 海 棠 总 黄 酮 对 去 势 大 鼠骨 质 疏 松的影响 [ J ] .中药 药 理 与 临 床 , 2 0 1 1 , 2 7 ( 5 ) : 5 6—5 北 海 棠 总 黄 酮 对 成 骨 细 胞 增 殖 分
脑缺血MCAO模型制作及注意事项

脑缺血MCAO模型制作及注意事项广州佳灵生物技术有限公司术前准备:线栓:目前市场上主要有硅胶和多聚赖氨酸两种材质的线栓,另外还有不多的石蜡线栓和指甲油等线栓。
强烈建议大家采用硅胶线栓(可购买广州佳灵生物技术有限公司的硅胶线栓,质量堪比进口线栓,模型质量高),国外很少看到有用多聚赖氨酸线栓的。
这是因为多聚赖氨酸对血管内皮细胞损伤严重,容易引起血小板聚集,导致血栓形成,因此拔出线栓后,用多普勒血流仪检测血流的恢复程度,每只动物血流恢复的程度差异很大(0-70%之间),最终导致梗死差异大。
也有部分动物模型是非再灌模型。
体重与栓线直径:参照佳灵公司的产品介绍(附件1)。
麻醉剂:常用的麻醉剂有:异氟烷(安全性高,撤去麻醉面罩后,动物2分钟可清醒,但是需要配麻醉机,并且异氟烷损耗大,成本较高)、水合氯醛(安全性较好,控制好量可以连续麻醉3 h,缺点是误打入肠道后可引起肠梗阻,导致动物死亡;对动物的提问下降比较明显,需要控制好动物的体温)。
手术器械:工欲善其事必先利其器,实验专配的镊子、剪刀等器械可大大提高实验效率(有些人30分钟一只模型,有些人5分钟一只模型,除了技术水平的差异外,也与手术器械是否顺手有莫大关系)。
广州佳灵生物技术有限公司为脑缺血模型实验准备了专用的器械包,可购买。
保温设备:60W白炙灯照射或者放置于保温垫上,使肛温保持在 37℃。
温度对梗死大小影响非常显著(温度越低,梗死越小),北方的实验室,尤其是冬天做实验的时候,一定要注意保温。
TTC的配制:用0.2mol/L磷酸缓冲液(PBS)配成0.5-2% TTC溶液(pH7.5),避光保存。
实验方法:动物用10%水合氯醛(400 mg/kg)腹腔注射麻醉。
仰卧位固定,颈正中线切口,沿胸锁乳突肌内缘分离肌肉和筋膜,分离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),在CCA 远心端和近心端及ECA处挂线备用。
用微动脉夹暂时夹闭ICA,然后近心端结扎CCA、ECA。
线栓法大鼠脑缺血再灌注模型的制备

线栓法制备大鼠脑缺血再灌注模型的方法研究马贤德1孙宏伟1 柴纪严1 赵金茹1(1 辽宁中医药大学,辽宁沈阳 110032;)摘要①目的建立一种比较系统,操作简单,成功率高的大鼠大脑中动脉缺血(MCAO)再灌注动物模型,达到只要读者根据本文所述的方法操作就能制作出MCAO再灌注模型的目的。
②方法成年健康雄性 SD大鼠40只,参照Longa法并适当改进建立MCAO模型20只,假手术组20只。
本文将详细叙述手术过程以及再灌注时间点的合理选择。
最后利用行为学测试、四氮唑(TTC)染色对模型成功与否进行判定。
③结论线栓法是一种操作简单的制备MCAO 再灌注动物模型的方法,并且此方法的再灌注效果较为明显。
关键词动物模型;脑缺血;再灌注;线栓法Establishment a model of rat ischemia-reperfusion injury with intraluminal sutureMa Xian-de1 Sun Hong-wei1 Chai Ji-yan1 Zhao Jin-ru1(1.Liaoning University of Chinese Traditional Medicine, Shenyang, 110032) Abstract: Objective To establish a model of rat ischemia-reperfusion injury, in terms of the model, the operation will be simple, and the achievement ratio will be high. Methods: 40 Male Sprague-Dawley ( SD ) rats were separated into two groups randomly: 20 were model of rat ischemia-reperfusion injury based on Longa method, and the other 20 were sham-operated group. The process of the operation and the selection of different time point following ischemic-reperfusion were discussed in the paper. What’s more , the model was appraised by behavioral test and Triphenyl Tetrazolium Choloride(TTC)Staining. Conclusion: The operation of intraluminal suture method is very simple for the establishment of model of rat ischemia-reperfusion, what’s more, the effect of reperfusion is very obvious.Key words: Animal Model, ischemia, reperfusion, intraluminal suture脑缺血再灌注动物模型是研究缺血性脑血管病的一条重要途径,因为脑缺血再灌注动物模型具有很好的重复性并能最大程度模拟人类缺血性卒中的发生。
线栓法制备大鼠局灶性脑缺血再灌注模型的手术操作

线栓法制备大鼠局灶性脑缺血再灌注模型的手术操作线栓法制备大鼠局灶性脑缺血再灌注模型的手术操作1 切口位置的选择恰当切口位置的选择,可以使血管暴露充分,有利操作,节约手术时间,减少对动物的刺激,提高术后生存率。
目前国内外学者[ 1 ,2 ]多采用颈部正中切口,国内一些学者[ 3 ,4 ] 经改良后采用颈部旁侧手术入路。
我们在操作中发现,采用颈部旁侧切口不用切开颈阔肌,出血少,便于肌肉分离,手术视野暴露较好,颈内外动脉及其分支的分离易于进行,尤其是分离深在鼓泡处的颈内动脉( ICA) 分支翼腭动脉( PPA) ,如果采用颈部正中切口由于距切口处远而难以分离另外颈部旁侧入口对气管刺激性小,呼吸道分泌物少, 不易出现呼吸道分泌物过多和气管痉挛,手术大鼠病死率低。
我们体会采用颈部旁侧手术入路应注意几点,一是中间稍偏015 cm 即可,切口线正好在颈阔肌和胸锁乳突肌夹隙上方,如果太靠外侧会给分离肌肉带来难度;二是用手术刀切开皮肤时不宜用力太猛,颈侧部静脉血管丰富,切入太深容易引起出血,给手术操作带来一定难度,以刚刚切开皮肤为度,并且切口从上到下稍微斜向内侧,并且切口尽量靠上一些,有利于分离颈外动脉。
2 寻找血管的方法大鼠颈总动脉(CCA) 位于颈阔肌和胸锁乳突肌之间,上升至甲状腺水平高度分出颈内动脉ICA 和颈外动脉( ECA) 。
ECA 在下颌角平面以下分出枕动脉、甲状腺上动脉、咽升动脉、腭升动脉和上颌外侧动脉,在耳下方分出终末支即耳后动脉、颞浅动脉和舌动脉。
ICA 在鼓泡和枕骨之间入颅,在鼓泡内侧发出颅外分支PPA(相当于人类上颌动脉) ,主干继续沿鼓室内侧延伸,进入鼓室与枕骨基板之间的后破裂孔进入颅腔。
选择旁侧手术入路,切开皮肤暴露组织后,用止血钳钝性分离表层软组织和脂肪组织,然后用止血钳插入颈阔肌和胸锁乳突肌之间,并分离之,用镊子翻开颈阔肌即可看到CCA ,仔细向远心端分离出颈内外动脉的分叉处, 朝上走行的是ECA ,朝下内方走行的是ICA ,继续沿ICA 分离,位于鼓泡的后缘可分离出PPA。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
线栓法大鼠脑缺血再灌注模型制备前言相信不少神经内科的研究生都作过或将要作大鼠线栓模型,都有一个从查文献了解方法到跟师兄、师姐学习再到自己体会摸索直至熟练的过程,在模型制作的过程中可能的经历了从模型不成功的郁闷到熟练后成功的喜悦(我们是有这样的感觉)。
为了缩短各位将要作或刚开始作MCAO模型的战友的摸索过程,提高模型制作的成功率,我们愿意将自己的经验与大家分享,相信各位战友看过后将对制作大鼠线栓模型有更深的认识,并以其为乐趣,同时欢迎各位熟练的战友与我们交流经验。
第一部分线栓模型制备理论及经验⒈ 插线法局灶性脑缺血模型简介八十年代 Koizumi 和 Longa 创用了不开颅的大鼠 MCA 可逆性脑梗塞模型,此后,应用插线法制备大鼠局灶性脑缺血再灌注模型的方法不断改进和完善,已渐趋成熟,目前该法已逐渐取代开颅法而成为最流行的方法。
该模型先阻断颈外动脉(ECA)及其分支,且阻断翼腭动脉(PPA),以切断颅外来源的侧副循环血流。
从 ECA 插入尼龙线,经颈内动脉(ICA)到大脑前动脉(ACA),机械性阻断大脑中动脉(MCA)发出处的血供来建立大脑中动脉缺血模型。
此模型可在无麻醉状态下拔出尼龙线,恢复血流,实现再灌注。
1994 年 Huang 等[55]首次将线栓技术应用于小鼠局部永久性脑缺血模型。
1997 年 Hara等[56]将线栓技术改进后应用于小鼠局部暂时性脑缺血模型。
此后不断有学者借助于显微技术和多功能生理监测手段建立小鼠局部线栓脑缺血模型[57,58]。
国内蒋晓帆等[59],王芙蓉等[60]也对该方法进行了研究。
线栓法具有不开颅、效果肯定、可准确控制缺血及再灌注时间的优点,用于研究神经元对缺血的敏感性、耐受性,药物疗效观察以及再灌注损害和治疗时间窗较为理想,同时也具有对全身影响小、动物存活时间长的特点,适于慢性脑损伤的研究。
控制好易变因素,可避免实验结果的不稳定性。
但线栓造模也并非完美无缺,存在着下列不足:①线栓造模过程是非直视下的手术,血流是否完全阻断不能即刻得知。
②动物品系、体重、批次会影响结果。
动物饲养条件好的单位所繁育的动物,可以使影响程度降低。
③操作者的科研训练影响结果。
严格的训练和足够例数的实践可以复制出稳定的结果。
④血管破裂出血。
操作不小心极易刺破血管或拔线栓时引起出血。
轻柔、精细的操作可以减少血管破裂的发生。
2 大鼠颈部及颅内动脉解剖及常用插线位置3 大鼠大脑中动脉阻断实验的总结和心得(来自zhuqing0506战友)本人现在正在做线栓法大鼠大脑中动脉阻断实验(MCAO模型),这方面的资料我查了一些,这个实验我也作了一段时间,不敢说很专业了,不过现在基本上我能在15min左右完成手术,而且手术过程中不出一滴血,造模后缺血程度基本一致。
虽然前面有很多前辈发了很多MCAO的很专业的贴子,不过我觉得比较凌乱,现在我把我的心得体会和以前的贴子的精华部分奉献给大家,希望这会对将要做这个实验的朋友有一丝的帮助。
虽然做实验总会有郁闷的时候,不过风雨之后总会见到彩虹的,这可以也是我的心得体会。
衷心祝福大家能把实验做的成功、完美!!!!实验前准备麻醉剂:水合氯醛(应较好的控制大鼠体温)保温:60W白炙灯高度为37cm直接照射能使肛温保持在37℃ 栓线的制备:1.取熔点为 56℃的固体石蜡一块,在瓷杯中加热熔化。
直径为 o.24mm、长 5cm 的鱼线一端5mm长的一段,垂直在熔化的石蜡中迅速浸入并提起,立即凝固的一薄层石蜡可牢固地粘附在鱼线一端的表面,其直径为0.26mm。
就这样,普通的鱼线即可变成规相一致头端光滑圆钝的栓线。
2.在鱼线 18mm 的位置用涂改液标记一个白色点。
TTC 的配制:用 0.2mol/L 磷酸缓冲液(PBS)配成 2%TTC 溶液(pH7.5),避光保存。
体重与栓线直径:线栓直径0.24mm采用的SD大鼠,体重250-300g。
实验方法:动物用10%水合氯醛(35mg/kg)腹腔注射麻醉。
仰卧位固定,颈正中线切口,沿胸锁乳突肌内缘分离肌肉和筋膜,分离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),在CCA远心端和近心端及ECA处挂线备用。
用微动脉夹暂时夹闭ICA,然后近心端结扎CCA、ECA。
然后在距 CCA 分叉部 4mm 处剪一小口,将拴线插入到 ICA,这时用绕在 CCA 远心端的细线轻轻系牢拴线。
(不可过紧,否则近线困难,但松了又会出血。
)用眼科镊轻推拴线,从血管分叉处开始算距离,当插入深度在18 mm时(一定要将血管放松至原来状态,且保证标记点在分叉处,由于标记的是白色的所以很容易看的),紧紧系牢CCA远心端的细线,此时的关键是动作轻柔,不要使ICA有任何的牵拉,否则栓线会脱出ACA,可能会造成缺血失败。
血管外的栓线不要留得过长,更不要缝在皮外,大鼠醒来后会自己拔出。
缝合伤口,单笼饲养观察。
如果需要再灌的话,就把拴线抽出即可,因为脑底有个动脉环,结扎一侧颈总动脉大脑不会缺血的。
注意事项:1.分离时要层次清楚:正中剪开 SD 大鼠颈部皮肤,分离皮下结缔组织时会发现该组织与颈部两侧鼓泡腺体(很多人误认为那是甲状腺)结合紧密,因此不必分离过于太细,直接在正中两侧鼓泡腺体之间分离,这样能不接触胸锁乳突肌而直接暴露颈前颈群且不会损伤腺体造成过多出血。
下一步是分开颈前肌群,这时候要注意用小钳子作撑开分离动作要在左右肌肉块之间而不是一块肌肉的肌纤维之间,虽然它们看起来很模糊,但这样能保证不会出现较多条索状细肌纤维条影响下一步颈内动脉的寻找与分离,并且能整块地向一侧牵开颈前肌群暴露颈动脉鞘。
见到颈动脉鞘了则要注意细致分离迷走神经,若损伤则可能影响其呼吸而死亡的。
2.分离血管时,要尽量将血管剥离的干净些,这样在用眼科剪剪口时就不会误剪外膜(误剪的话再剪就很容易把口剪大了或者剪断了,要注意口子越小越好插线),且要剪一个斜行的切口(眼科剪与血管约成45度),这样在血液刚流出时仍能看上翻的断口管壁,这样即容易插入栓线且血管受得了插线时一定的牵拉。
当然,切勿牵拉过猛,以免使血管发生痉挛,导致栓线不能顺利进入。
3.注意尽量不要损伤在颈内颈外分叉下的交感神经节。
4.如果你用的是中长效麻醉剂,插线成功后,固定丝线,然后让其俯卧位,而且稍稍抬高其颈部,才能确保模型成功。
5.栓线进入后颈内动脉后即可逐渐插入了,有时候很顺利一插到底,但有时候在中间就怎么也进不去了,这是因为在血管入颅穿过颅骨时有一个狭窄或者角度。
因此,碰上这种明显阻力时,一定不能盲目向前使力插,越插栓线前端变形越进不去且容易损伤血管。
这时候正确的作法是往外抽出较多栓线,也许会有一定的动脉血流出,不必慌,只要顺着血管走行调整一下进线角度轻柔的使劲,一般都能进去,反复试几次还不行最好换根栓线,很可能前端也经变形角度变了!颈内动脉的走向为内上方,可以用眼科镊夹住鱼线插,但进去后要注意,别太用力,要不血管就要破了6.栓线不能在血管里反复进退,否则及容易造成蛛网膜下腔出血,,而且很容易误解为模型成功,因为这时的神经功能改变也很明显,但并不是由于栓塞引起的7.进线时,使栓线有一定程度的弯曲,且只要保证栓线向屋顶方向弯曲,一般都能将线插如颅内,决不会进入翼腭A。
8. 术后一定要注意保暖。
9. 插入线拴要轻柔熟练,速度尽可能快,以避免时间长了血管内血栓形成。
10.手术后评分的主观因素很大,有用4 分制和11 分制的,我个人认为用4 分制比较准些。
其标准是:0 分,无神经损伤症状; 1 分,手术对侧前指不能完全伸展;2 分,向手术对侧行走;3 分,大鼠成追尾状运动。
11. 性激素对脑梗死面积有较大影响,应采用单一性别的动物进行实验。
舍去标准:⑴栓线插入深度不足18 mm,且无明显神经功能缺损表现或症状很轻的大鼠⑵蛛网膜下腔出血、MCA 起始部或其附近的willis 环动脉有凝血块的大鼠,因为这是出血性脑损伤或永久性脑缺血损伤,而非MCAO/Reperfusion 损伤。
3)手术时出血较多,症状很重的动物。
死亡原因分析:首先要找出死亡原因,解剖死亡大鼠的脑,先看是否有蛛网膜下腔出血,如有出血,表明死因是插线太深,以后注意插线深度;如无出血,则还要再看是否有严重的半球水肿,如水肿严重,则表明死因是脑缺血时间太重,需要缩短缺血时间;如既无出血,又无明显的脑水肿,那就要注意动物状态或生活环境是否太差。
附带的其他说明:1..线拴法存在一定的死亡率。
对于这情况我感觉比较头疼,也希望高手指点。
2. 模型成功率和评价指标是相关联的矛盾,手术后可根据动物的表现加以评分,确定模型是否成功,模型成功与否会对结果的评价带来影响。
有可能你模型没成功,结果判断为是药物的作用效果。
所以对手术后模型是否成功应该进行筛选的。
另一方面,如果你做了预防给药,药效的作用也容易被认为是模型不成功,这也需要后边进行脑组织染色和组织血检查进行验证。
脑组织检查时可剔除模型不成功以及SAH 的个例。
故实验在手术后要进行行为学评分,试验结束时应对脑组织进行组织学检查或染色。
TTC 染色是采用的宏观标本染色,确定梗死面积可采用体积法或面积法,但最好用扫描仪将脑组织切片进行扫描,选择合适的软件统计梗死面积。
3.大鼠大脑中动脉永久性闭塞性脑缺血模型,梗死体积出现的最小时间点可能为2h,体积随时间进行性增大,至12h 基本趋于稳定4. 整个试验是很费动物的,存在15-30%的淘汰率(如果你做的好),但注意严格控制自己淘汰的动物(纪录具体情况)。
5. 除了刚才说的蛛网膜下腔出血外,还有一些老鼠肺出血明显,整个肺暗红,我也想不出原因,不知道是不是医学临床所说的脑肺综合症.6.在颈内和颈外之间常常会有一个交通支,其位置也不太相同,一定要万分小心,我曾经因为不知有这个交通支而勿将其破坏,导致大鼠出血不止!4 也谈大鼠MCAO 模型的实验体会(来自bladeflyer 战友)我的课题是关于某药物对缺血性神经疾病的保护作用研究,因此对于动物脑缺血模型尤其是MCAO 模型的制作不得不熟练掌握,于是有了大量郁闷的摸索与重复劳动,也有关于它的提高与体会,虽然前面有很多前辈对于MCAO 的贴子已经很专业了,但我想也许自己也能有此微弱的闪光让后面的朋友们感到少许光明和温暖,哪怕只是一个愿望,呵呵!关于大脑中动脉缺血模型,目前文献能查到的有三种制作方法,应用手术的方法和颈内动脉注射ET-1 的方法都不如线栓法流行,而我自己的实验也证明线栓法制作MCAO 是效果稳定并可行的。
下面谈谈我自己的一些体会,一家之言仅供参考:一)关于实验大鼠的选择:前面我曾查到一篇贴子谈到了大鼠种系选择,而我自己作过wester 鼠和SD 大鼠,感觉从解剖层次上看品系上差别并不是太大,或者说对于造模的影响还不如大鼠体重的选择。
