晶体的类型及性质
晶体的四种基本类型和特点

晶体的四种基本类型和特点晶体是由于原子、分子或离子排列有序而形成的固态物质。
根据晶体的结构特点,晶体可以分为四种基本类型:离子晶体、共价晶体、金属晶体和分子晶体。
1. 离子晶体离子晶体由正离子和负离子通过离子键结合而成。
正负离子之间的电荷吸引力使得离子晶体具有高熔点和脆性。
离子晶体的晶格结构稳定,形成高度有序的排列。
常见的离子晶体有氯化钠(NaCl)、氧化镁(MgO)等。
离子晶体在溶液中能够导电,但在固态下通常是绝缘体。
2. 共价晶体共价晶体由共价键连接的原子或分子组成。
共价键是由原子间的电子共享形成的,因此共价晶体具有很高的熔点和硬度。
共价晶体的晶格结构复杂多样,具有很高的化学稳定性。
典型的共价晶体包括金刚石(C)和硅(Si)。
共价晶体通常是绝缘体或半导体,由于共价键的稳定性,其导电性较弱。
3. 金属晶体金属晶体由金属原子通过金属键结合而成。
金属键是由金属原子间的电子云形成的,因此金属晶体具有良好的导电性和热传导性。
金属晶体的晶格结构常为紧密堆积或面心立方等紧密排列。
金属晶体的熔点通常较低,而且具有良好的延展性和韧性。
典型的金属晶体有铁(Fe)、铜(Cu)等。
4. 分子晶体分子晶体由分子通过弱相互作用力(如范德华力)结合而成。
分子晶体的晶格结构不规则,分子间的距离和角度较大。
由于分子间的相互作用力较弱,分子晶体通常具有较低的熔点和软硬度。
典型的分子晶体有水(H2O)、冰、石英(SiO2)等。
分子晶体在固态下通常是绝缘体,但某些分子晶体在溶液中能够导电。
总结起来,离子晶体由正负离子通过离子键结合,具有高熔点和脆性;共价晶体由共价键连接,具有高熔点和硬度;金属晶体由金属原子通过金属键结合,具有良好的导电性和热传导性;分子晶体由分子通过弱相互作用力结合,具有较低的熔点和软硬度。
这四种基本类型的晶体在结构、性质和应用上都有明显的差异。
研究晶体的类型和特点对于理解物质的性质和应用具有重要意义。
晶体类型及性质

人类对晶体的最初认识也许是从采集石器时 发现外形规则或光彩夺目的天然矿物开始的,进 而把它们作为玩物和饰物。世界各地的考古发掘 表明,人类使用玉类宝石至少已有七千年的历史 。我国西汉时期刘胜夫妇墓葬中的两套金缕玉衣 就用了4600多玉片。唐诗、宋词中更出现了“云 母屏风烛影深”,“水晶帘不下,云母屏开”之类 的佳句。
晶体的性质之三: 各向异性
晶体的物理性质,如电导率、热导率、膨胀系数、折射率等随方
向不同而不同, 称为晶体的异向性, 也称各向异性。
石墨的电导率在两个方向上相差6000倍:平行于层的方向上电导 率高(3×104S .cm-1,2ቤተ መጻሕፍቲ ባይዱoC),且随温度上升而减小,为半金属性 导电; 垂直于层的方向上电导率却很低(5S . cm-1, 25oC),且随 温度上升而增大,为半导体性导电。
(7)分子晶体熔、沸点高低的比较规律 ①分子晶体分子间作用力 越大 ,物质熔、沸点 越高 ,反之 越低 ;具有氢 键的分子晶体,熔、沸点 反常 。如H2O>H2Te>H2Se>H2S。 ②组成和结构相似的分子晶体,相对分子质量越大,熔沸点越高。例如SnH4 >GeH4>SiH4>CH4。
在分子晶体中,分子内的原子间以共价键结合,分子间靠分子间作用力相互 吸引。稀有气体单质是单原子分子,在固态时属于分子晶体,但不存在共价 键,不包含化学键。
9.下列晶体性质的比较中不正确的是 A.熔点:金刚石>碳化硅>晶体硅 C.硬度:白磷>冰>二氧化硅
C( ) B.沸点:NH3>PH3 D.熔点:SiI4>SiBr4>SiCl4
解析 A项中三种物质都是原子晶体,因原子半径r(C)<r(Si),所以键长: C—C<C—Si<Si-Si,故键能:C—C>C—Si>Si—Si。键能越大,原子晶体 的熔点越高,A项正确;因为NH3分子间存在氢键,所以NH3的沸点大于 PH3的沸点,B项正确;二氧化硅是原子晶体,硬度大,白磷和冰都是分子 晶体,硬度较小,C项错误;卤化硅为分子晶体,它们的组成和结构相似, 分子间不存在氢键,故相对分子质量越大,熔点越高,D项正确。
晶体相关知识点总结

晶体相关知识点总结一、基本概念1. 晶体的定义晶体是由原子、离子或分子按照一定的规则排列而形成的固体结构。
晶体具有高度有序性,具有一定的周期性和对称性。
晶体是凝聚态物质的一种主要形式,占据了固态物质的绝大部分。
2. 晶体的种类根据晶体结构的不同,晶体可以分为离子晶体、共价晶体、金属晶体和分子晶体等几种基本类型。
不同类型的晶体具有不同的物理性质和化学性质。
3. 晶体的分类根据晶体的外部形态,晶体可以分为单斜晶、正交晶、菱形晶、六方晶、四方晶、立方晶等几种基本类型。
不同类型的晶体具有不同的外部形态和对称性。
二、晶体结构1. 晶体的晶体结构晶体结构是指晶体中原子、离子或分子的排列方式和规律。
晶体结构可以分为周期性结构和非周期性结构两种形式。
周期性结构是指晶体中原子、离子或分子的排列具有一定的周期性,具有明显的晶格和对称性。
非周期性结构是指晶体中原子、离子或分子的排列没有明显的周期性,没有规则的晶格和对称性。
2. 晶体的晶格晶体的晶格是指晶体中原子、离子或分子所构成的三维空间排列的规则结构。
晶格可以分为周期性晶格和非周期性晶格两种类型。
周期性晶格是指晶格具有明显的周期性,有规则的排列和对称性。
非周期性晶格是指晶格没有明显的周期性,没有规则的排列和对称性。
3. 晶体的晶胞晶胞是指晶体中最小的具有完整晶体结构的基本单位。
晶胞可以分为原胞和扩展晶胞两种类型。
原胞是指晶体中最小的具有完整晶体结构的基本单位,包含了一个或多个原子、离子或分子。
扩展晶胞是指原胞在晶体结构中的重复排列,是构成晶体的基本单位。
三、晶体的生长1. 晶体生长的基本过程晶体生长是指在溶液、熔体或气相中,原子、离子或分子从溶液中萃取并在已生成的晶体上沉积,形成新晶体的过程。
晶体生长的基本过程包括成核、生长和成形几个阶段,成核是指溶液中原子、离子或分子聚集形成晶体的核心;生长是指晶体核心上原子、离子或分子的进一步沉积和排列生长;成形是指晶体的表面形态和结晶过程。
晶体类型和性质.

习题讲练:
1、共价键、离子键和范德瓦耳斯力是构成物 质粒子间的不同作用方式,下列物质中, 只含有上述一种作用的是 ( B ) A.干冰 B.氯化钠 C.氢氧化钠 D.碘
2、在解释下列物质性质的变化规律与物质结构间的因果 关系时,与键作用强弱无关的变化规律是( C D) A.HF、HCI、HBr、HI的热稳定性依次减弱 B.NaF、NaCl、NaBr、NaI的熔点依次减低 C.F2、C12、Br2、I2的熔、沸点逐渐升高 D.H2S的熔沸点小于H2O的熔、沸点
结束
3、PtCl2(NH3)2成平面正方形结构,它可以形 成两种固体。一种为淡黄色,在水中溶解度较小, 则其为___________ 性分子,构型为 ___________ ; 另一种为黄绿色,在水中溶解度较大则其为___________ 性分子,构型为 ___________ 。 4、试解释:钠的卤化物比相应的硅的卤化物熔点高的多 5、在干冰晶体中每个CO2分子周围紧邻的 CO2分子 12 有___________ 个 在晶体中截取一个最小的正方体; 使正方体的四个顶点部落到CO2分子的中心, 4 个C02分子。 则在这个正方形的平面上有___________
结束
◆什么叫分子晶体? ●分子间通过分子间作用力结合成的晶体。 ◆分子晶体的特点? ●有单个分子存在;化学式就是分子式。“相似相溶” ●熔沸点较低,硬度较小,易升华。固体或熔化时不导电 ◆哪些物质可以形成分子晶体? ●卤素、氧气、氢气等多数非金属单质、稀有气体、非金 属氢化物、多数非金属氧化物等。 ◆分子晶体中的化学键与结构 ●有的分晶体中无化学键(如:Ar等),其它一般含共价 键
结束
物质溶沸点高低的比较
(1)不同晶体类型的物质: 原子晶体大于离子晶体大于分子晶体 (2)同种晶体类型的物质: 晶体内粒子间的作用力越大,熔沸点越高 ①对原子晶体:一般是原子半径越小,键能越大,键长 越短共价键越强,晶体的熔沸点越高。 ②对离子晶体:一般是离子半径越小,离子电荷数越多 离子键作越强,晶体的熔沸点越高。 ③对分晶体:A 组成和结构相似的物质,相对分子质量越 大熔沸点越高;B 组成和结构不相似的物质,极性大则熔 结束 沸点高。C有的还与分子形状有关。
晶体类型分类

晶体类型分类晶体类型分类导言:晶体是具有周期性排列的原子、离子或分子的固体物质,它们的结构和性质对于我们理解和应用材料科学非常重要。
由于晶体的种类繁多,如何对其进行分类成为了一个关键问题。
在本篇文章中,我们将探讨晶体类型的分类方法,并深入研究各个分类的特点和应用。
第一部分:基于元素组成的晶体分类1. 金属晶体:金属晶体由金属原子组成,具有高导电性和高热导性。
金属晶体可进一步分为面心立方晶体、体心立方晶体和密堆积晶体等几种不同的结构类型。
这些不同的结构类型决定了金属的性质和应用领域。
2. 离子晶体:离子晶体由阳离子和阴离子组成,它们通过离子键相互吸引而形成稳定的晶体结构。
离子晶体具有高熔点、良好的溶解性和电解性能。
常见的离子晶体包括氯化钠和氧化铁等。
3. 共价晶体:共价晶体由共价键相连的原子构成,这种键的特点是电子对的共享。
共价晶体常见的是碳元素的几种晶体形式,如金刚石和石墨等。
共价晶体通常具有高硬度、高熔点和高热稳定性。
第二部分:基于结构的晶体分类1. 伍德结构分类法:根据晶体的基本结构单元(BPU)的排列方式,晶体可以分为14种不同的布拉维格点群。
这些布拉维格点群包括立方晶系、四方晶系、正交晶系等,每种布拉维格点群都有其独特的晶体结构及性质。
2. 米勒-布拉弗指数:米勒-布拉弗指数是描述晶体晶面方向的一种方法,通过指数确定了晶面的交点位置。
通过分析晶面的指数,我们可以了解晶体的晶面结构以及晶体的对称性。
第三部分:基于物质性质的晶体分类1. 光学性质:晶体对于不同波长的光可以表现出多种不同的性质,如吸收、反射和折射等。
通过研究晶体的光学性质,我们可以了解晶体的结构和成分,从而推断其物理和化学性质。
2. 声学性质:晶体的结构和成分也会影响其声学性质,如声速和声子态密度等。
通过测量晶体的声学性质,我们可以了解晶体的结构和内部缺陷。
结论:晶体的分类方法多种多样,不同的分类方法可以从不同的角度解析晶体的结构和性质。
晶体的类型与性质
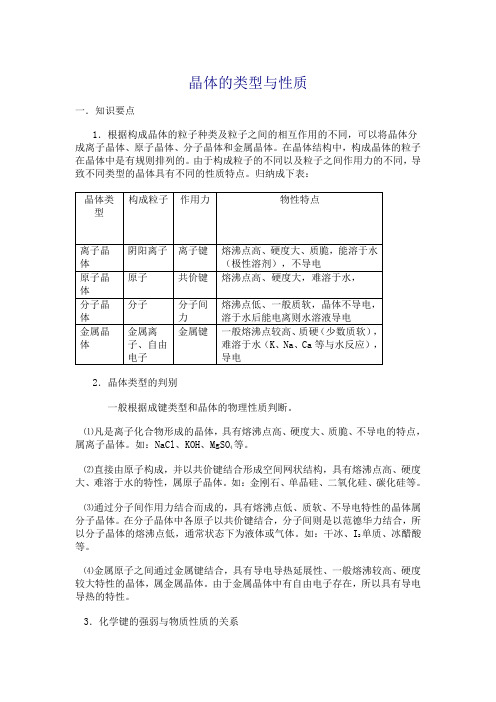
晶体的类型与性质一.知识要点1.根据构成晶体的粒子种类及粒子之间的相互作用的不同,可以将晶体分成离子晶体、原子晶体、分子晶体和金属晶体。
在晶体结构中,构成晶体的粒子在晶体中是有规则排列的。
由于构成粒子的不同以及粒子之间作用力的不同,导致不同类型的晶体具有不同的性质特点。
归纳成下表:2.晶体类型的判别一般根据成键类型和晶体的物理性质判断。
⑴凡是离子化合物形成的晶体,具有熔沸点高、硬度大、质脆、不导电的特点,等。
属离子晶体。
如:NaCl、KOH、MgSO4⑵直接由原子构成,并以共价键结合形成空间网状结构,具有熔沸点高、硬度大、难溶于水的特性,属原子晶体。
如:金刚石、单晶硅、二氧化硅、碳化硅等。
⑶通过分子间作用力结合而成的,具有熔沸点低、质软、不导电特性的晶体属分子晶体。
在分子晶体中各原子以共价键结合,分子间则是以范德华力结合,所单质、冰醋酸以分子晶体的熔沸点低,通常状态下为液体或气体。
如:干冰、I2等。
⑷金属原子之间通过金属键结合,具有导电导热延展性、一般熔沸较高、硬度较大特性的晶体,属金属晶体。
由于金属晶体中有自由电子存在,所以具有导电导热的特性。
3.化学键的强弱与物质性质的关系离子晶体中,离子键键能的大小与离子的半径、离子所带的电荷数、离子的核电荷数有关,一般起决定作用的主要是离子半径的大小。
离子半径小,阴、阳离子间的静电作用力大,离子键键能就大,离子晶体的熔沸点就高,硬度也大。
原子晶体中共价键键能的大小与成键的原子半径有关,原子半径越小,键长越短,键能就越大,晶体的熔沸点就越高,硬度也就越大。
分子晶体中分子与分子之间的作用力为范德华力,其能量较小。
对于组成和结构相似的物质,其分子间的作用力随相对分子质量的增大而增大,熔沸点也随之增高。
还与分子的极性有关,分子极性大,分子间作用力大,熔沸点高。
金属晶体中金属离子半径越小,离子电荷数越大,其金属离子与自由电子间的作用力越强,金属的熔沸点就越高。
4.石墨晶体具有层状结构的特点,层内原子间以共价键的方式形成平面网状结构(相当于原子晶体),层与层之间以范德华力结合(相当于分子晶体),层与层间有自由电子存在,晶体具有导电性(相当于金属晶体),所以石墨是一种过渡性或混合型晶体。
晶体的类型和性质

B A
ABC3
2006年江苏-15
• 下列关于晶体的说法一定正确的 是( B )。
• A.分子晶体中都存在共价键 • B.CaTiO3晶体中每个Ti4+和 • 12个O2-相紧邻 • C.SiO2晶体中每个硅原子与 • 两个氧原子以共价键相结合 • D.金属晶体的熔点都比分子 • 晶体的熔点高
A2BC2
4.常见的离子晶体: 强碱(NaOH、KOH)、活 泼金属氧化物(Na2O、MgO、Na2O2)、大多 数盐类[BeCl2、AlCl3、Pb(Ac)2等除外]。
(二)分子晶体
1.定义:分子间以分子间作用力相结合而形成的晶体。 2.结构特点:
(1)构成粒子:分子。 (2)粒子间的作用:分子间作用力或氢键。 (3)存在单个的分子,有分子式。其化学式就是分子式。
2.由共价键形成的的原子晶体中,原子半径小的,键长 ( 短 ),键能( 大 ),共价键( 强 ) ,晶体的熔沸点就 ( 高 ) 。如:金刚石 > 碳化硅 > 晶体硅。
3.离子晶体中比( 离子键 )强弱。一般地说,阴、阳离子的 电荷数越多,离子半径越小,则离子间的作用力就越 ( 强 ),其晶体的熔、沸点就越( 高 ), 如CsCl < NaCl < MgCl2 < MgO 。
4.分子晶体:组成和结构相似的物质,相对分子质量
越大,熔、沸点就越( 高 ),如HI > HBr > HCl 。
分子间有氢键作用的物质(如HF 、H2O 、NH3 、 低级醇和羧酸等)熔、沸点反常。同分异构体中, 一般地说,支链数越多,熔、沸点就越( ),如沸
点低:正戊烷 异戊烷 >新戊烷; 5>.金属晶体中金
2.结构特点:
晶体的类型与性质

晶体的类型与性质作者:李金洲来源:《神州·中旬刊》2013年第06期摘要:四种晶体所涉及的知识点多,学生经常把性质张冠李戴,本文就知识点加以总结,应用图表把性质、代表物加以分析,并配有练习,能够使学生轻松掌握该知识点。
关键词:离子晶体原子晶体分子晶体金属晶体一、知识点精讲1、晶体类型及性质比较*注意:⑴四种晶体类型的化学式表示的意义不同:离子晶体、原子晶体中化学式表示的分别是阴阳离子最简比和原子最简比,从而有的资料上把离子晶体和原子晶体看成是巨型分子;分子晶体中表示的是单个的分子。
⑵晶体讨论的是固态形式,而我们通常讨论化学性质时,不仅仅讨论其固态形式,包括其液态、气态和其水溶液。
2、化学键与分子间作用力的比较3、化学键和分子间作用力对物理、化学性质的影响(1)不同晶体类型的硬度大小、熔沸点高低等物理性质由于化学键键能比较大,使得其硬度较大和熔沸点较高,所以原子晶体、离子晶体和金属晶体分别大于和高于分子晶体。
但必须注意得是融化过程中原子晶体、离子晶体和金属晶体破坏的是化学键而分子晶体是分子间作用力(有的是氢键)。
(2)晶体性质的比较:比较晶体的硬度大小、熔沸点高低等物理性质的依据是:原子晶体→共价键键能→键长→由原子半径决定。
如:金刚石>晶体硅离子晶体→离子键强弱→离子半径和离子所带电荷数决定。
如:NaCl金属晶体→金属键→金属阳离子半径、所带的电荷数、自由电子的多少而定。
阳离子半径越小,所带的电荷越多,自由电子越多,相互作用就越大,熔点就会相应升高。
如:熔点KNa>K>Rb>Cs。
分子晶体→分子间力→结构相似的情况下由相对分子质量决定(分子有氢键例外)(3)氢键对分子晶体物理性质的影响⑴对溶解度的影响,分子中有氢键的可以在水中溶解,如NH3极易溶于水。
⑵对熔沸点的影响,分子中有氢键的相对而言熔沸点较高,如氧族元素中H2O的熔沸点最高。
⑶解释一些反常现象,如冰的密度小于水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
晶体的类型及性质二. 知识重点:1. 复习有关化学键的知识2. 晶体的类型:(1)离子晶体 (2)原子晶体 (3)分子晶体 (4)金属晶体4. 性质与结构的关系:形成晶体的作用力强弱直接影响晶体的物理性质。
5. 常见的几种晶体模型:(NaCl 、CsCl 、干冰、金刚石及2SiO 等)【典型例题】[例1] 下列物质的熔点由高到低排列,正确的是( )A. Cs K Na Li >>>B. CsCl RbCl KCl NaCl >>>C. 2222I Br Cl F >>>D. 金刚石>硅>碳化硅解析:根据晶体类型判断熔沸点高低的规律为:(一般) 原子晶体>离子晶体>分子晶体而同类晶体内熔、沸点高低判断规律是:原子晶体内原子的半径越小,形成共价键的键长短,键能大则键牢固,熔沸点高。
离子晶体内阴、阳离子的半径越小,离子所带电荷越多则形成的离子键越牢固,熔沸点越高。
相同结构的分子形成晶体,相对分子质量越大,分子间作用力越强,熔、沸点越高。
金属晶体的熔沸点高低取决于金属离子的半径和自由电子数,离子半径小,自由电子数多,则熔沸点高。
故应选A 、B 。
答案:A 、B [例2] 下图表示一些晶体中的某些结构,它们分别是NaCl 、CsCl 、干冰、金刚石、石墨结构中的某一种的某一部分。
A B CD E(1)其中代表金刚石的是 (填编号字母,下同),其中每个碳原子最接近且距离相等。
金刚石属于 晶体。
(2)其中代表石墨的是 ,其每个正六边形占有的碳原子数平均为 个。
mol 1石墨中碳原子数与所形成的共价键数之比为 。
(3)其中表示NaCl 的是 ,每个+Na 周围与它最接近且距离相等的+Na 有 个。
(4)代表CsCl 的是 ,它属于 晶体,每个+Cs 与 个-Cl 紧邻。
(5)代表干冰的是 ,它属于 晶体,每个2CO 分子与 个2CO 分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为: 。
解析:解此题首先要记住几种晶体的基本模型。
金刚石为D ,石墨为E ,干冰为B ,NaCl 为A ,CsCl 为C ,然后根据晶体的组成及空间构型回答后面问题。
值得注意的应为(2)和(3)、(4)、(5)中粒子紧邻的数值关系。
(2)当碳原子通过共用电子对形成六元环时,每一个碳原子被三个环所共用,则形成一个正六边形平均碳原子为:2316=⨯。
同理所成共价键被2个正六边形共同,则形成键数平均为:3216=⨯,二者之比为3:2。
(3)、(4)、(5)中先选择一个原子,寻找等距离且最近的原子。
答案:(1)D ;原子晶体 (2)E ;2;3:2 (3)A ;12(4)C ;离子;8(5)B ;分子;12(6)B C A D E >>>>[例3] 下列化学式表示物质分子的是( )A. 42SO NaB. 2SiOC. 42SO HD. Al解析:在四种晶体中,只有分子晶体才存在真正的分子,所以四个备选答案中只有42:SO H C 才是分子晶体,存在真正的分子。
答案:C[例4] 如图所示晶体结构是一种具有优良的压电、铁电、电光等功能的晶体材料的最小结构单元(晶胞)。
晶体内与每个“Ti ”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )A. 8;128O BaTiB. 8;94O BaTiC. 6;3BaTiOD. 3;32O BaTi△ Ba ○ Ti ● O解析:解此类题要先了解分割法,上图为一个晶胞,它来自一种晶体的一部分,则顶点粒子是切割后只剩81,则Ti 原子个数为:1818=⨯,棱上的粒子是切割后只剩41,则O 原子个数为:34112=⨯,立方体中心(体心)有一个完整的原子,则Ba 原子个数为:1,化学式为:3BaTiO ,由图可见将该晶胞中任一顶点Ti 为中心,补足晶胞,使其由81还原为1,可知有6个O 原子紧邻。
答案:C【模拟试题】一. 选择题:1. 金属的下列性质与自由电子无关的是( )A. 密度大小B. 导电性C. 延展性D. 导热性 2. 下列说法正确的是( )A. NaCl 易溶于水,难溶于汽油B. 4P 具有正四面体结构,所以它是原子晶体C. 分子晶体中分子间作用力越大,其化学性质越稳定D. 离子晶体一般具有较高的熔点和沸点3. 硒有两种同素异形体:灰硒和红硒。
灰硒溶于三氯甲烷,红硒溶于二硫化碳,它们都不溶于水,则灰硒和红硒的晶体是( )A. 原子晶体B. 分子晶体C. 金属晶体D. 以上均有可能4. 共价键、金属键、离子键和分子间作用力都是构成物质的粒子间的不同作用,含有以上所说的两种作用的晶体是( )A. 2SiO 晶体B. 4CCl 晶体C. 2MgCl 晶体D. NaOH 晶体 5. 下列物质按熔点从低到高的顺序排列的是( ) A. F 2、2Cl 、2Br 、2IB. Li 、Na 、K 、RbC. HF 、HCl 、HBr 、HID. Si 、SiC 、2SiO 、NaCl6. 在海洋底部存在大量称为“可燃冰”的物质,其蕴藏量是地球上煤、石油的几百倍,因而是一种等待开发的巨大能源物质。
初步查明可燃冰是甲烷、乙烷等可燃性气体的水合物。
有关可燃冰的下列推测中不正确的是( )A. 高压、低温有助于可燃冰的形成B. 常温、常压下可燃冰是一种稳定的物质C. 可燃冰的微粒间可能存在一种比范德华力更强的相互作用力D. 构成可燃冰的原子间存在极性共价键7. 各晶体中其中任何1个原子都被相邻的4个原子所包围,以共价键形成四面体结构,并向空间伸展形成立体网状结构的是( )A. 甲烷B. 石墨C. 晶体硅D. 水晶 8. 1993年世界10大科技新闻称,中国科学家徐志傅和美国科学家共同合成了世界上最大的碳氢化合物,其中1个分子是由1134个碳原子和1146个氢原子构成。
关于该物质的下列说法中错误的是( )A. 该物质属于烃类B. 常温下呈固态C. 具有类似金刚石的硬度D. 能在空气中燃烧9. 食盐晶体如下图所示。
在晶体中●表示+Na ,○表示-Cl 离子。
已知食盐的密度为3-⋅cm g ρ,NaCl 的摩尔质量为1-⋅mol Mg ,阿伏加德罗常数为N ,则在食盐晶体里+Na 离子和-Cl 离子的核间距大约是( )A.cm N M32ρ B.cm N M32ρ C.cmN N32ρ D.cm N M38ρ10. 下列关系正确的是( )A. 离子半径:++-->>>3Al Na F ClB. 熔点:石英>食盐>冰>干冰C. 结合+H 能力:--->>232324CO SO SOD. 热稳定性:HF HCl S H PH >>>23二. 填空题:11. A 、B 、C 为同周期元素,已知A 元素的原子K 、L 层电子数之和比M 、L 层电子数之和大1,B 元素原子与同周期其他元素的原子相比半径最小,C 元素原子的最外层电子数与核外电子层相同。
(1)写出上述三种元素符号和名称:A : 、B : 、C : 。
(2)B 元素的阴离子的结构示意图为 。
(3)B 元素单质的晶体类型是 ,C 元素的晶体中微粒间较强的相互作用是 ,A 、B 两元素形成的化合物的电子式为 ,其晶体类型为 。
(4)将C 的单质与A 的氧化物的水溶液共热发生反应的离子方程式为 。
(5)在B 与C 形成的化合物的水溶液中,放入少量A 单质的现象为 ,发生反应的离子方程式为 。
12. A 、B 两元素的最外层都只有一个电子。
A 的原子序数等于B 的原子序数的11倍,A 的离子的电子层结构跟周期表中非金属性最强的元素的阴离子的电子层结构相同,元素C 与B 易五形成化合物C B 2,该化合物常温下呈液态。
则:(1)A 的原子结构示意图为 ,在固态时属于 晶体。
(2)C 在固态时属于 晶体。
B 与C 形成化合物C B 2的化学式为 ,电子式为;它是由键形成的分子,在固态时属于晶体。
13. 溴化碘(IBr)是一种卤素互化物,它有很高的化学活性,有许多性质跟卤素单质相似。
它在常温、常压下是深红色固体,熔点41℃,沸点116℃。
固体溴化碘是晶体,含有键。
溴化碘与水反应,生成一种无氧酸和一种含氧酸,反应方程式是。
【试题答案】一.1. A2. AD3. B4. BD5. A6. B7. C8. C9. B提示:NaCl mol 1的体积:mol cm M 3ρ,1个NaCl 晶体的体积:个3cm N M ρ,21个NaCl 晶体的边长:32N Mρ,即等于+Na 与-Cl 的核间距。
注:每一个NaCl 晶体的晶胞含4个NaCl 。
1个NaCl 晶体的体积为晶胞中2个立方体。
10. AB 二. 11.(1)Na 、钠;Cl 、氯;Al 、铝(2)(3)分子晶体;金属键;-∙∙∙∙∙∙∙⨯+][Cl Na ;离子晶体(4)===+-OHAl 22↑+-2232H AlO(5)A 在液面上游动,发出嘶嘶声并有白色沉淀生成;===+++O H Al Na 23626 ++↑+↓Na H OH Al 63)(22312.(1);金属(2)分子;O H 2;H O H ∙⨯∙∙∙∙∙⨯;极性;极性;分子13. 分子;极性;HBr HIO O H IBr +=+2【励志故事】学会感动(接上期)丁大卫的普普通通的话,让我从另一个角度认识了我们的国旗,也让我的眼泪不听话地掉下来。
当崔永元问丁大卫在中国感觉苦不苦时,丁大卫说,很好的,比如这次你们中央台就让我这样一个平凡的人来做嘉宾,而且还让我坐飞机,吃很好的饭菜。
我看见崔永元有些不好意思地脸红了,他幽默地说:"我觉得你挺像我们中国的一个人;雷锋!"丁大卫想了想,说:"还真有点儿像。
"大伙儿"轰"地一声善意地笑开了。
"只是,雷锋挺平常的,他只是一个凭良心做事的人,这样的人不应该只有一个,每个人都应该做得到的!"他认真地补充道。
没有人再笑了,就连崔永元的脸上都显出了小学生的表情。
