分析化学复习试题习题 (4)
《分析化学》复习题及答案解析

《分析化学》复习题及答案解析一、选择题1.根据标准化法,我国标准分为四级,下面不属于这四级的是(D)。
A、国家标准B、行业标准C、企业标准D、卫生标准2.下列标准代号属于国家商业部颁布的推荐性标准是( B )。
A、SH/TB、SB/TC、QB/TD、DB/T3.下列属于重量分析法的是( D )。
A、凯氏定氮法测食品中粗蛋白的含量B、密度瓶测酒精的比重C、斐林试剂法测食品中还原糖的含量D、索氏抽提法测食品中粗脂肪的含量重量分析法主要有沉淀法(被测组分形成难溶化合物沉淀)、气化法(通过加热或用其他方法使样品中某种挥发性组分逸出)、电解法(电解原理,使金属离子在电极上析出)4.一化学试剂瓶的标签为红色,其英文字母的缩写为( B )。
A、GRB、ARC、CPD、LR5.一化学试剂瓶的标签为绿色,其英文字母的缩写为( A )。
A、GRB、ARC、CPD、LR6.滴定管的最小刻度为( A )。
A、0.1mlB、0.01mlC、1mlD、0.02ml7.用于配制标准溶液的试剂的水最低要求为( C )。
A、一级水B、二级水C、三级水D、四级水8.下列溶液中需要避光保存的是( B )。
A、氢氧化钾B、碘化钾C、氯化钾D、硫酸钾9.贮存易燃易爆,强氧化性物质时,最高温度不能高于( C )。
A、20℃B、10℃C、30℃D、0℃10.配制0.2mol/L 的H2SO4溶液,应选用( A )量取浓酸。
A、量筒B、容量瓶C、酸式滴定管D、移液管11.由组批或货批中所抽取的样品称之( B )。
A、采样B、检样C、原始样品D、平均样品12.把许多份检样综合在一起的样品称为( C )。
A、检验样品B、平均样品C、原始样品D、仲裁样品13.可用“四分法”制备平均样品的是( A )。
A、稻谷B、蜂蜜C、鲜乳D、苹果14.对样品进行理化检验时,采集样品必须有( B )。
A、随机性B、代表性C、典型性D、适时性15.湿法消化常用的消化剂是( C )。
分析化学练习题库(附答案)

分析化学练习题库(附答案)一、单选题(共40题,每题1分,共40分)1、由计算器算得2.236×1.1124÷1.036×0.2000的结果为12.004471,按有效数字运算规则应将结果修约为()。
A、12B、12.004C、12.0D、12.00正确答案:D2、pH=9的NH3--NH4Cl缓冲溶液配制正确的是()(已知NH4+的Ka=1×10-9.26)。
A、将35克NH4Cl溶于适量水中,加15mol/L的NH3·H2O,24毫升用水稀释至500mlB、将3克NH4Cl溶于适量水中,加15molmol/L的NH3·H2O207ml用水稀释至500mlC、将60克NH4Cl溶于适量水中,加15mol/L的NH3·H2O1.4ml用水稀释至500mlD、将27克NH4Cl溶于适量水中,加15mol/L的NH3·H2O197ml用水稀释至500m正确答案:A3、pH=5.26中的有效数字是()位。
A、0B、4C、3D、2正确答案:D4、某标准滴定溶液的浓度为0.5010moL/L,它的有效数字是()。
A、2位B、4位C、5位D、3位正确答案:B5、用基准无水碳酸钠标定0.100molL盐酸,宜选用()作指示剂。
A、溴钾酚绿—甲基红B、酚酞C、二甲酚橙D、百里酚蓝正确答案:A6、能用水扑灭的火灾种类是()A、可燃性金属如钾、钠、钙、镁等B、可燃性气体如煤气、石油液化气C、可燃性液体,如石油、食油D、木材、纸张、棉花燃烧正确答案:D7、由分析操作过程中某些不确定的因素造成的误差称为()A、系统误差B、随机误差C、绝对误差D、相对误差正确答案:B8、若弱酸HA的Ka=1.0×10-5,则其0.10mol/L溶液的pH为()。
A、2.00B、3.00C、5.00D、6.00正确答案:B9、酸碱滴定法选择指示剂时可以不考虑的因素()。
分析化学1~4章复习题

分析化学复习题1-41.基准物质不必具备下列那个条件A.稳定B.具有足够的纯度C.物质的组成与化学式完全符合D.易溶解于水2.下列物质中哪些只能用间接法配制一定浓度的溶液,然后再标定。
A.KHC8H4O4B.H2C2O4·2H2O C.NaOH D.Na2CO33.在以KHC8H4O4为基准物标定NaOH溶液时,下列哪些仪器需用操作溶液淋洗三次?A.滴定管B.容量瓶C.锥形瓶D.量筒4.读取滴定管读数时,下列错误的是:A.通常读取弯月面下缘最低点,并使视线与该点在一个水平面上B.在常量分析中,滴定管读数必须读到小数点后第四位C.必须读到小数点后第二位,既要求估计到0.01mlD.读数时,应使滴定管保持垂直5.可用如下哪种试验方法减小分析测定中的随机误差A. 对照试验B. 空白试验C. 多次平行试验D. 回收试验6.有一组测量值,已知其标准值,要检验得到这组数据的分析结果是否可靠,应采用A.Q检验B.t检验C.F检验D.Grubbs 检验7.两组分析数据,要比较它们的精密度有无显著性差异,则应当用A.F检验B.t检验C.Q检验D.相关系数检验8.有一组多次平行测定所得的分析数据,要判断其中是否有可疑值,应采用A.t检验B.方差检验C.F检验D.Grubbs检验9.从精密度好就可断定分析结果可靠的前提是A.偶然误差小B.平均偏差小C.系统误差小D.标准偏差小10.用K2Cr2O7法测定铁,配制K2Cr2O7标准溶液时容量瓶内溶液没有摇匀就被使用,这会对测定结果产生什么影响A.正误差B.负误差C.对准确度无影响D.降低精密度11.现需配制2mol/L的硫酸溶液,请从下列量器中选择一种最合适的来量取浓硫酸A.容量瓶B.量筒C.移液管D.酸式滴定管12.标准溶液是A.不能直接配制的溶液B.浓度已准确知道的溶液C.只能用基准物质配制的溶液D.当天配制、当天标定、当天使用的溶液13.滴定分析中,一般利用指示剂颜色发生突变的那一点来判断化学计量点的到达,这点称A.突跃点B.滴定终点C.理论终点D.化学计量点14.下列操作正确的是A.用移液管移溶液到接受器时,管尖端应靠着容器内壁,容器稍倾斜,移液管应保持垂直B.为了操作方便,最好滴完一管再装操作溶液C.固体物质可以直接在容量瓶中溶解、定容D.读取滴定管读数时,用手拿着盛装溶液的滴定管部分15.从大量的分析对象中采取少量分析试样,必须保证所取的试样具有:A.一定的时间性B.广泛性C.一定的灵活性D.代表性16.测铝合金中的铝,合适的分解用溶剂可以是A.HCL B.HNO3C.H2SO4D.10%NaOH17.分析测定中出现下列情况,属于系统误差的是A.使用工业级试剂B.砝码读错C.滴定管未经校准D.滴定时有溶液溅出18.下列正确的叙述是A.误差是以平均值为标准的,偏差是以真值为标准的B.对某项测定来说,它的系统误差大小是不可以测量的C.对偶然误差来说,正、负误差出现的机会是均等的D.精密度高,系统误差一定小19.分析测定中系统误差的特点,以下不正确的是A.由一些确定原因引起B.增加测定次数可减小系统误差C.重复测定会重复出现D.系统误差可消除或减小20.莫尔法测定Br-含量时,若蒸馏水中含有微量C1-,为得到准确的分析结果,应作A.空白试验B.回收试验C.对照试验D.增加测定次数参考答案:1~5:DCABC;6~10:BADCD;11~15:CBBAD;16~20:DACBA二、填空题1.根据化学反应的不同,滴定分析法可分为、、、等四种。
分析化学练习题

分析化学课堂练习第一章绪论一、单项选择题1.按分析的方法原理分类,分析化学可以分为( C )A.定性分析、定量分析和结构分析B.无机分析和有机分析C.化学分析和仪器分析D.常量分析、微量分析和超微量分析E.理性分析和仲裁分析2.按照分析的领域分类,分析化学可分为(D )A.无机分析和有机分析B.化学分析和仪器分析C.常量组分分析、微量组分分析和痕量组分分析D.卫生分析、药物分析和工业分析等E.无损分析、遥测分析和光学分析3.从分析任务看,分析化学的内容包括( E )A.无机分析和有机分析B.化学分析和仪器分析C.常量分析和微量分析D.重量分析和滴定分析E.定性分析、定量分析和结构分析4.常量分析的称样量一般在(B )A.1g以上B.0.1g以上C.0.01-0.1gD.0.001-0.01gE.0.001-0.0001g5.滴定分析法属于(C )A.定性分析B.仪器分析C.化学分析D.无机分析E.微量分析6.采集试样的原则是试样具有(C )A.典型性B.统一性C.代表性D.随意性E.不均匀性7.电化学分析法属于( B )A.化学分析B.仪器分析C.重量分析D.光学分析E.定性分析8.依据取样量的多少,分析化学任务可分为( A )A.常量分析、半微量分析、微量分析和超微量分析B.重量分析、定量分析、痕量分析C.无机分析、有机分析、定量分析D.化学分析、仪器分析、滴定分析E.定性分析、光学分析、色谱分析9.下列不属于仪器分析法的是( D )A.光学分析法B.电化学分析法C.色谱分析法D.滴定分析法E.永停滴定法10.下列叙述正确的是( A )A.采样试样的原则是“试样具有代表性”B.采样试样的原则是“试样具有典型性”C.化学分析法可以测定任何试样的含量或浓度D.仪器分析法可以测定任何试样的含量或浓度E.化学分析法常用于确定未知化合物的分子结构11.下列叙述错误的是( D )A.化学分析是以待测物质化学反应为基础的分析方法B.仪器分析是以待测物质的物理和物理化学性质为基础的分析方法C.滴定分析是以待测物质化学反应为基础的分析方法D.光学分析是以待测物质的发光性为基础的分析方法E.定性分析是以鉴定物质的化学组成为目的的分析工作二、多项选择题1.分析化学是研究(BD )A.物质性质和应用的科学B.定性、定量、结构分析方法的科学C.物质组成和制备的科学D.分析方法及其理论、实验技术的科学E.以上都正确2.人体体液中待测组分含量常用的表示方法是(ABD )A.mmol/LB.mg/LC.百分浓度D.mg/24hE.体积分数3.完成分析工作任务的一般程序是(ABCDE )A.采集试样B.制备试样C.确定待测组分的化学组成和结构形态D.测定待测组分的相对含量E.处理分析数据、表示分析结果4.化学分析法的特点(AC )A.仪器设备简单、价格低廉B.测定结果准确、适于测定微量组分C.耗时费力,无法测定微量组分D.仪器设备简单、测定时省时省力E.测定误差大、应该废弃5.仪器分析的特点(BDE )A.仪器昂贵、一般不用B.灵敏、快速、准确C.仪器简单、操作方便D.适于测定微量组分E.操作自动化程度高三、判断题1.化学分析是以待测物物质的化学性质为基础而建立的分析方法(√)2.仪器分析是以待测物质的物理或物理化学性质为基础建立的分析方法(√)3. 定性分析的任务是确定待测组分的化学性质(×)4.滴定分析的任务是确定试样组分、存在状态及化学性质等(×)5.光学分析是以光信号为测量参数而建立的分析方法。
分析化学考试复习题及答案

分析化学考试复习题及答案work Information Technology Company.2020YEAR分析化学考试复习题及答案分析化学考试复习题第一部分:误差及分析数据处理一.填空:√1.用丁二酮肟总量法测定Ni的含量,得到下列结果:10.48%、10.37%、10.43%、10.40% 10.47%已求得单次测定结果的平均偏差为0.036% 则相对平均偏差为();标准偏差为();相对标准偏差为()。
√2.滴定管的读数常有±0.01mL的误差,在完成一次测定时的绝对误差可能为()mL;常量分析的相对误差一般要求应≤0.1%,为此,滴定时消耗标准溶液的体积必须控制在( ) mL以上。
√3.定量分析中,影响测定结果精密度的是()误差。
√5.0.908001有()位有效数字,0.024有()位有效数字二.选择:√1.下列有关偶然误差的论述中不正确的是(A)偶然误差具有随机性(B)偶然误差具有单向性(C)偶然误差在分析中是无法避免的(D)偶然误差的数值大小、正负出现的机会是均等的√4.如果要求分析结果达到0.1%的准确度,使用灵敏度为0.1mg的天平称取试样时,至少应称取(A)0.1g (B)0.2g(C)0.05g (D)0.5g三.判断:√1.下面有关有效数字的说法是否正确(A)有效数字中每一位数字都是准确的(B)有效数字中的末位数字是估计值,不是测定结果(C)有效数字的位数多少,反映了测量值相对误差的大小(D)有效数字的位数与采用的单位有关√2.下面有关误差的叙述是否正确(A)准确度高,一定要求精密度高(B)系统误差呈正态分布(C)精密度高,准确度一定高(D)分析工作中,要求分析误差为零√3.判断下列说法是否正确(A)偏差是指测定值与真实值之差(B)随机误差影响测定结果的精密度(C)在分析数据中,所有的“0”均为有效数字(D)方法误差属于系统误差四.回答问题:√1.指出在下列情况下,都会引起哪种误差如果是系统误差,应该采用什么方法避免(1)读取滴定体积时,最后一位数字估计不准(2)试剂中含有微量的被测组分(3)滴定时不慎从锥形瓶中溅出一滴溶液(4)重量分析中,沉淀溶解损失√3.指出下列操作的绝对误差和相对误差(1)用台秤称出10.6g固体试样(2)用分析天平称得坩埚重为14.0857g第二部分滴定分析一.填空:√1.称取纯K2Cr2O7 5.8836g,配制成1000mL溶液,则此溶液的C(K2Cr2O7)为()mol L-1,C(1/6K2Cr2O7)为(),T(Fe/K2Cr2O7)为()g/ mL,T(Fe2O3/K2Cr2O7)为()g /mL,T(Fe3O4/K2Cr2O7)为()g /mL。
分析化学复习题

分析化学复习题(答案在后面)一、判断题专项训练判断题,(正确用√表示,错误用×表示,将答案填入下表中。
(共10小题,每小题1分,总分10 分)第一组训练1.对分析结果的准确度要求越高,即E 越小,采样单元数n越大。
2.滴定分析法中,当滴加的标准溶液与待测组分恰好定量反应完全时的一点,称为化学计量点,也就是滴定终点。
3在高酸度条件下,EDTA是一个六元弱酸,在溶液中存在有六级离解平衡和六种存在形式。
4.醋酸(HOAc)的共轭碱是OAc-,HCO-3是两性物质。
5.配位滴定中的金属指示剂能指示终点,其实质是与待测金属离子形成有色配合物,且K MIn<K MY,才能滴定到化学计量点时,EDTA取代MIn中的In。
6.酸效应系数用来描述溶液H+的浓度对配位滴定剂配位能力的影响,酸效应系数越大,酸效应越严重,配位体的配位能力下降。
7.条件电极电位校正了一定外界因素影响后的实际电位,反映了离子强度与各种副反应影响的总结果。
8.重量分析要求制备纯净的沉淀,应尽量克服共沉淀现象。
9.显色反应中,显色酸度、温度、显色剂用量及其他试剂用量等都是影响显色反应发生的条件,其中最重要的是显色酸度。
10.当T为15%~65%时,即A在0.2~0.8时测量误差≤±2%。
第二组1.筛号也就是网目,它是以每英寸长度上的筛孔数目表示,筛号越大则筛孔直径越小。
( )2.按分析试样的多少,分为常量分析、半微量分析和微量分析,其固体试样量在0.1 ~ 10 mg的分析称为超微量分析。
--------------------------( )3.准确度是测定结果与真值接近的程度,用偏差衡量。
------------( )4.重量分析中杂质被共沉淀,会产生随机误差。
---------------( )5.在高酸度条件下,EDTA是一个六元弱酸,在溶液中存在有六级离解平衡和六种存在形式。
------------------------( )6. 常用的氧化还原反应滴定终点的确定方法有三类:自身指示剂、淀粉指示剂和氧化还原指示剂。
定量分析习题4
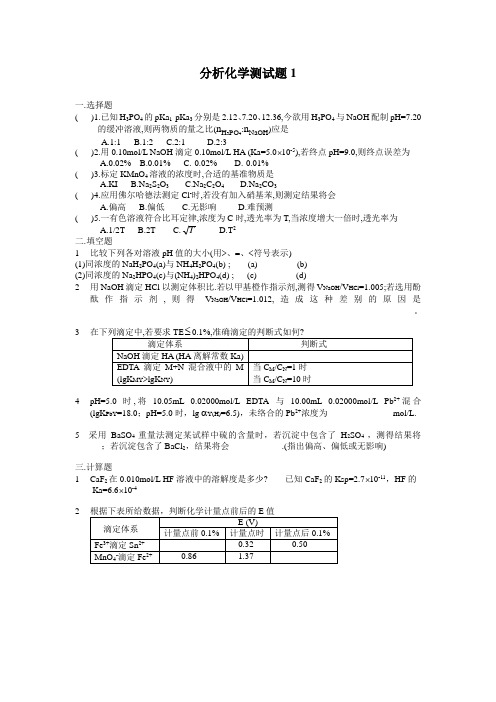
分析化学测试题1一. 选择题( )1.已知H 3PO 4的pKa 1-pKa 3分别是2.12、7.20、12.36,今欲用H 3PO 4与NaOH 配制pH=7.20的缓冲溶液,则两物质的量之比(n H 3PO 4:n NaOH )应是A.1:1B.1:2C.2:1D.2:3( )2.用0.10mol/L NaOH 滴定0.10mol/L HA (Ka=5.0⨯10-5),若终点pH=9.0,则终点误差为A.0.02%B.0.01%C.-0.02%D.-0.01%( )3.标定KMnO 4溶液的浓度时,合适的基准物质是A.KIB.Na 2S 2O 3C.Na 2C 2O 4D.Na 2CO 3( )4.应用佛尔哈德法测定Cl -时,若没有加入硝基苯,则测定结果将会A.偏高B.偏低C.无影响D.难预测( )5.一有色溶液符合比耳定律,浓度为C 时,透光率为T,当浓度增大一倍时,透光率为A.1/2TB.2TC.TD.T 2二. 填空题1 比较下列各对溶液pH 值的大小(用>、=、<符号表示)(1)同浓度的NaH 2PO 4(a)与NH 4H 2PO 4(b) ; (a)_________(b)(2)同浓度的Na 2HPO 4(c)与(NH 4)2HPO 4(d) ; (c)_________(d)2 用NaOH 滴定HCl 以测定体积比.若以甲基橙作指示剂,测得V NaOH /V HCl =1.005;若选用酚酞作指示剂,则得V NaOH /V HCl =1.012,造成这种差别的原因是__________________________________________________________________________。
34 pH=5.0时,将10.05mL 0.02000mol/L EDTA 与10.00mL 0.02000mol/L Pb 2+混合(lgK PbY =18.0;pH=5.0时,lg αY(H)=6.5),未络合的Pb 2+浓度为_______________mol/L.5 采用BaSO 4重量法测定某试样中硫的含量时,若沉淀中包含了H 2SO 4 ,测得结果将______;若沉淀包含了BaCl 2,结果将会____________.(指出偏高、偏低或无影响)三.计算题1 CaF 2在0.010mol/L HF 溶液中的溶解度是多少? 已知CaF 2的Ksp=2.7⨯10-11,HF 的 Ka=6.6⨯10-42。
分析化学复习题

填空题:(每空 1 分,共 20 分)1. 由LaF3单晶片制成的氟离子选择电极, 晶体中是电荷的传递者。
2. 在分光光度法中,宜选用的吸光度读数范围为。
二、选择题:(每题 1 分,共 30 分)1.某一NaOH和Na2CO3混合液,用HCl溶液滴定,以酚酞为指示剂,耗去HCl V1(mL), 继以甲基橙为指示剂继续滴定,又耗去HCl V2(mL),则V1与V2的关系是( )A. V1 = V2B. V1 = 2V2C. 2V2 = V2D. V1> V22. Fe3+与Sn2+反应的平衡常数对数值(lg K)为( )(ϕ(Fe3+/Fe2+)= 0.77 V,ϕ(Sn4+/Sn2+)= 0.15 V)A. (0.77-0.15)/0.059B. 2×(0.77-0.15)/0.059C. 3×(0.77-0.15)/0.059D. 2×(0.15-0.77)/0.059三、简答题(每题5分,共10分)1. 分析化学中常用的分离和富集方法有哪些?(回答不能少于8种方法)。
2. 如果试液中含有Fe3+、Al3+、Ca2+、Mg2+、Mn2+、Cr3+、Cu2+和Zn2+等离子,加入NH4Cl和氨水缓冲溶液,控制pH为9左右,哪些离子以何种形式存在于溶液中?哪些离子以何种形式存在于沉淀中?分离是否完全?四、计算题(共 5 小题,每小题 8分,共 40 分)1.称取某含铅锌镁试样0.4080g, 溶于酸后,加入酒石酸,用氨水调至碱性,加入KCN, 滴定时耗去0.02060mol/L EDTA 42.20mL。
然后加入二巯基丙醇置换PbY,再滴定时耗去0.00765mol/L Mg2+标液19.30mL。
最后加入甲醛, 又消耗0.02060mol/L EDTA 28.60mL计算试样中铅、锌、镁质量分数。
[A r(Pb)=207.2, A r(Zn)=65.38, A r(Mg)=24.31]2.以KIO3为基准物采用间接碘量法标定0.1000 mol·L-1 Na2S2O3溶液的浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(一)选择题
5-1 EDTA(Na2H2Y)水溶液中,无质子弱酸根离子Y4-的酸效应系数a等于:
A.[Y4-]/[Y]总;B.[Y]总/ [Y4-];C.[H+] /[Y]总;
D.[Y]总/ [H4Y];E.[Y]总/ [H2Y2-]。
(式中[Y]总=[H6Y2+]+[H5Y+]+[H4Y]+[H3Y-]+[H2Y2-]+[HY3-]+[Y4-])。
5-2 浓度为c(单位:mol/l)的EDTA溶液,其中Y4-离子的酸效应系数a,在一定酸度[H+]条件下等于:
A.[Y4-]/c;B.c/ [Y4-];C.[H+] /c;
D.c / [H4Y];E.c/ [H2Y2-].
5-3 浓度为c(单位:mol/l)的EDTA溶液,在一定酸度条件下H2Y2-离子的酸效应系数a等于:A.c/ [Y4-];B.c/ [HY3-];C.c/[H2Y2-];
D.c / [H3Y-];E.c/ [H4Y]。
5-4浓度为c(单位:mol/l)的EDTA溶液,其中Y4-离子的分布系数δ,在一定酸度条件下等于:
A.c/ [Y4-];B.[Y4-]/c;;C.c/ [H4Y];
D.c / [H3Y-];E.c/[H2Y2-]。
5-5浓度为c(单位:mol/l)的EDTA溶液,在一定酸度条件下,H2Y2-离子的分布系数δ为:A.[H2Y2-]/c;B.c/[H2Y2-];C.c/ [Y4-];
D.[Y4-]/c;E.[H+] / [H2Y2-]。
5-6 如右图所示,在Ph=4.5的EDTA溶液中,EDTA存在的主要形式是:
A.H4Y;B.H3Y-;C.H2Y2-;
D.HY3-;E.Y4-。
5-7 EDTA随PH的分布图如下图所示,图中哪条曲线代表H2Y2-离子随PH变化的分布状况。
5-8 在EDTA溶液中,Y4-离子随酸度变化的酸效应系数a为:a =1 + ß1[H+] + ß2[H+]2 + ß3[H+]3+ ß4[H+]4+ ß5[H+]5+ ß6[H+]6。
式中ß1 ,ß2 分别代表的是:
A.A.EDTA 酸各级相应的电离常数,Ka1,Ka2,……Ka6;
B.B.EDTA 酸各级电离常数的倒数;
C.C.EDTA 酸各级积累电离常数的倒数;
D.D.EDTA 酸最后一级电离常数(Ka6)为起点的各相应积累电离常数的倒数;
5-9 某EDTA溶液的浓度为c(单位:mol/l),Y4-离子的分布系数δ,则Y4-离子的酸效应系数a等于:
A.A./δ;B.δ/ c; C.cδ;D.1/ cδ;E.1/ δ。
5-10 已知某EDTA溶液中,Y4-离子的浓度为其总浓度的10%,则Y4-离子的酸效应系数等
于:
A.100;B.90;C.50; D.10;E.1.0。
5-11 某EDTA溶液在酸度下的Y4-离子酸效应系数为50 ,则其分布系数等于:A.20%;B.40%;C.2%; D.0.2%;E.5%。
5-12 已知浓度为c(单位:mol/l)的EDTA溶液中,Y4-离子的酸效应系数为a,则Y4-离子的浓度为:
A.a/ c B.ac;;C.c/ a; D.c;E.1/ac。
5-13 已知0.1000mol/lEDTA溶液,在某酸度下的Y4-离子酸效应系数的对数为lga=7.24。
则溶液中[Y4-]等于:
A.10-7.24mol/l; B.107.24mol/l; C.10-8.24mol/l; D.10-6.24mol/l; E.0.0724mol/l; 5-14 浓度为c(单位:mol/l)的EDTA溶液, 在某酸度下的Y4-离子酸效应系数为a,则Y4-离子在总浓度中所占的百分比等于:
A.1/a B。
a;C。
ac; D.a/c;E。
c/a。
5-15 0.1000mol/lEDTA溶液,Y4-离子酸效应系数的对数为lga=1.00。
则该离子的分布百分比为:
A.20%;B.10%;C.0.1%; D.1%;E.0.01%。
5-16 某酸度下的EDTA溶液, H2Y2-离子酸效应系数a=28, 则该离子在溶液中所占的百分比等于:
A.0.36%;B.28%;C.2.8%; D.3.6%;E.36%。
5-17 EDTA溶液中,H2Y2-离子和Y4-离子的酸效应系数之比,即a( H2Y2- )/a(Y4-)等于:A.Ka6/[H+]2;B.Ka5Ka6/[H+]2;C.[H+]2/Ka5Ka6;
D.Ka5/[H+]2;E.Ka5Ka6/[H+]。
式中Ka5,Ka6分别为EDTA的第五和第六级电离常数。
5-18 已知EDTA的pKa5和pKa6分别为6.16,10.26,当PH=4.00时Y4-离子的lga=8.44,则H2Y2-离子酸效应系数的对数为lga等于:
A.16.42;B.8.44;C.4.22; D.0.02;E.4.00。
5-19 EDTA溶液中,HY3-离子和Y4-离子的酸效应系数之比,即a(HY3-)/a(Y4-)等于:A.[H+]/ Ka5;B.[H+]/ Ka6;C.Ka5/[H+];
D.Ka6/[H+];E.[H+]6/ Ka6。
5-20 已知EDTA的pKa6=10.26,若EDTA 溶液的PH=5.0时,Y4-离子的lga=6.45,则H3Y-离子的lga等于:
A.[H+]/Ka5Ka6;;B.[H+]2/Ka5Ka6;;C.Ka5Ka6/[H+]2;
D.Ka5Ka6/[H+];E.Ka5Ka6[H+]2。
(二)填充题
5-1EDTA 在水溶液中有种形式存在,它们分别是。
5-2EDTA的酸效应,一般是指EDTA七种存在形式中的形式,常以符号表示.
5-3EDTA中无质子弱酸根Y4-的酸效应系数a Y与EDTA的浓度c之间的关系为。
5-4 EDTA溶液中,Y4-离子的浓度在其总浓度中所占的比例称为,常以符号表示。
5-5 浓度为cmol/l EDTA溶液中,Y4-离子的浓度与其分布系数(δ)之间的关系式为
5-6 EDTA水溶液中,H2Y2-和Y4-两种形式酸效应系数的关系式为;HY3-离子和Y4-离子的酸效应系数的关系式为;
5-7 EDTA溶液中,H2Y2-和Y4-两种形式分布系数之间的关系式为。
5-8 EDTA溶液中,Y4形式的分布系数δ与其酸效应系数a Y之间的关系式为。
5-9 EDTA配合物的稳定性与其溶液的酸度有关。
酸度愈,稳定性愈。
5-10 钙与EDTA配合物水溶液的酸度愈小,K’CAY的数值愈,CaY2-的稳定性愈。
5-11 (林旁)Ringbom曲线中各金属离子位置所对应的PH值,称为该金属离子EDTA配位滴定的。
5-12 EDTA配位滴定中,滴定反应的条件平衡常数K’MY 随酸度而变化,如果某酸度下Y4-离子的酸效应系数a Y,则K’ MY与a Y之间的关系为。
5-13 当EDTA溶液的PH=6.0时,Y4-离子的lga Y=6.45.若是lgK CAY=10.69时,EDTA滴定Ca2+的K’ CAY= 。
5-14已知某EDTA溶液中H+离子的浓度为[H+]以及EDTA的各级酸式电离常数Ka1,Ka2……Ka6,则Y4-离子的酸效应系数计算公式为a Y,= 。
5-15 当0.0100的mol/lEDTA溶液PH=4.0时,lga Y=8.44.则该溶液中Y4-离子的浓度为mol/l。
5-16滴定分析对滴定反应的主要要求是反应的完成程度,一般等当点时反应的未完成度等于。
5-17 滴定分析对EDTA配位滴定反应的要求,即判别式为。
5-18 某EDTA配位反应的K’MY=108.0 若要求该反应的完成度达99.9%时,反应物的初始浓度至少为mol/l。
5-19 EDTA 配位滴定反应的判别式为cK’ MY >>T-2式中c符号的意义为。
5-20 用0.01mol/lEDTA滴定Fe-3+时,如要达99.9%的反应完成度,则K’FeY至少为以上才行。
已知K’FeY=1025.10该滴定的酸度如以Y4-离子的酸效应表示,则a Y至少为以下才行。
