原电池、电解池、电镀池、电解精炼池的比较
原电池和电解池知识点归纳

原电池和电解池知识点一.原电池和电解池的比较:二.原电池正负极的判断:⑴根据电极材料判断:活泼性较强的金属为负极,活泼性较弱的或者非金属为正极。
⑵根据电子或者电流的流动方向:电子流向:负极→正极。
电流方向:正极→负极.⑶根据电极变化判断:氧化反应→负极;还原反应→正极。
⑷根据现象判断:电极溶解→负极;电极重量增加或者有气泡生成→正极。
⑸根据电解液内离子移动的方向判断:阴离子→移向负极;氧离子→移向正极。
三.电极反应式的书写:*注意点:1.弱电解质、气体、难溶物不拆分,其余以离子符号表示;2.注意电解质溶液对正负极的影响;3.遵守电荷守恒、原子守恒,通过添加H+ 、OH- 、H2O 来配平1。
负极:⑴负极材料本身被氧化:①如果负极金属生成的阳离子与电解液成分不反应,则为最简单的:M—ne-=M n+如:Zn-2 e-=Zn2+②如果阳离子与电解液成分反应,则参与反应的部分要写入电极反应式中:如铅蓄电池,Pb+SO42——2e—=PbSO4⑵负极材料本身不反应:要将失电子的部分和电解液都写入电极反应式,如燃料电池CH4—O2(C作电极)电解液为KOH:负极:CH4+10OH-8 e—=C032—+7H2O2.正极:⑴当负极材料能自发的与电解液反应时,正极则是电解质溶液中的微粒的反应,H2SO4电解质,如2H++2e=H2 CuSO4电解质: Cu2++2e= Cu⑵当负极材料不与电解质溶液自发反应时,正极则是电解质中的O2反正还原反应①当电解液为中性或者碱性时,H2O参加反应,且产物必为OH—,如氢氧燃料电池(KOH电解质)O2+2H2O+4e=4OH—②当电解液为酸性时,H+参加反应,产物为H2O如氢氧燃料电池(KOH电解质) O2+4O2+4e=2H2O四.常见的原电池1.银锌电池:(负极-Zn、正极——Ag2O、电解液NaOH )负极:Zn+2OH––2e-== Zn(OH)2(氧化反应)正极:Ag2O + H2O + 2e-== 2Ag + 2 OH-(还原反应)化学方程式Zn + Ag2O + H2O== Zn(OH)2 + 2Ag2。
原电池与电解池比较

原电池与电解池比较(1)原电池与电解池的区别(2)可逆原电池的充电过程:可逆原电池的充电过程就是电解。
(3)电极名称:不管是原电池还是电解池,只要发生氧化反应的电极就是阳极,只要发生还原反应的就是阴极。
①原电池:A.根据组成原电池两极的材料来判断电极。
两极材料为活泼性不同的金属时, 则活泼性相对较强的一极为负极,另一极为正极。
由一种金属和另一种非金属(除氢外)作电极时,金属为负极,非金属为正极。
B.根据原电池内两极上发生的反应类型或现象来判定电极。
原电池的负极一般为金属,并且负极总是发生氧化反应:,故负极表现为渐渐溶解,质量减小。
由此可判定,凡在原电池工作过程中发生氧化反应或质量减少的一极为负极;凡发生还原反应或有物质析出的一极为正极。
注意:原电池的电极有两套称谓:负极又可称为阳极,正极又可称为阴极(不要把负极称为阴极;正极称为阳极)。
其中正负极一套称谓是对外电路而言,在物理中常用,阴阳极一套称谓是对内电路而言。
原电池也是作为电源向用电器提供电能的,所以一般都用外电路的电极名称,称为正负极而不称为阴阳极。
②电解池:A. 电解池是在外电源作用下工作的装置。
电解池中与电源负极相连的一极为阴极,阳离子在该极接受电子被还原;与电源正极相连的一极为阳极,阴离子或电极本身(对电镀而言)在该极失去电子被氧化。
B. 电解池(或电镀池)中,根据反应现象可推断出电极名称。
凡发生氧化的一极必为阳极,凡发生还原的一极必为阴极。
例如用碳棒做两极电解溶液,析出Cu的一极必为阴极;X匸「府.放出,的一极必为阳极- -4&胡円门。
注意:电解池中,与外电源正极相连的为阳极,与负极相连的为阴极,这一点与原电池的负对阳,正对阴恰恰相反。
•电解池的电极常称阴阳极,不称正负极。
•电镀池是一种特殊的电解池,电极名称的判定同电解池。
4 •电解过程中水溶液的pH变化用铂或石墨等惰性电极电解某些物质的水溶液时,溶液的pH往往发生变化,其原因主要有两个方面。
2024高考化学考点必练专题15电解池知识点讲解

考点十五电解池学问点讲解一. 电解池工作原理及其应用1. 原电池、电解池的判定先分析有无外接电源:有外接电源者为,无外接电源者可能为;然后依据原电池、电解池的形成条件、工作原理分析判定。
2. 电解电极产物的推断:要推断电极反应的产物,必需驾驭离子的放电依次。
推断电极反应的一般规律是:(1) 在阳极上①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不简单在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时,溶液中阴离子的放电依次是:S2- >I- >Br- >Cl- >OH- >含氧酸根>F-(2) 在阴极上:无论是惰性电极还是活性电极都不参加电极反应,发生反应的是溶液中的阳离子。
阳离子在阴极上放电依次是:Ag+ > Fe3+ > Cu2+ > H+(酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+(水)> Al3+ > Mg2+>……3. 用惰性电极进行溶液中的电解时各种变更状况分析典例1(2025届内蒙古赤峰二中高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O 2Al(OH)3+3H2D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D典例2(2025届内蒙古自治区赤峰其次中学高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O2Al(OH)3+3H2↑D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D二. 电解原理在工业生产中的应用1.电解精炼反应原理(电解精炼铜)阳极(粗铜,含Fe、Zn、C等):Cu-2e—=Cu2+,阴极(纯铜):Cu2++2e—=Cu工作一段时间后,溶液中电解质的成分CuSO4、ZnSO4、FeSO4,Cu2+的浓度减小。
高考高中电化学有机化学物质颜色知识小结

电化学小结一、原电池、电解池、电镀池的比较原电池电解池电镀池定义将化学能转变成电能的装置将电能转变成化学能的装置应用电解原理在某些金属表面镀上一层其它金属的装置。
一种特殊的电解池装置举例形成条件①活动性不同的两电极(连接)②电解质溶液(电极插入其中并与电极自发反应)③形成闭合回路①两电极接直流电源②两电极插人电解质溶液③形成闭合回路①镀层金属接电源正极,待镀金属接电源负极②电镀液必须含有镀层金属的离子电极名称负极:较活泼金属;正极:较不活泼金属(或能导电的非金属等)阳极:电源正极相连的电极阴极:电源负极相连的电极阳极:镀层金属;阴极:镀件电极反应负极(氧化反应):金属原子失电子;正极(还原反应):溶液中的阳离子得电子阳极(氧化反应):溶液中的阴离子失电子,或金属电极本身失电子;阴极(还原反应):溶液中的阳离子得电子阳极(氧化反应):金属电极失电子;阴极(还原反应):电镀液中阳离子得电子电子流向负极正极电源负极阴极电源正极阳极电源负极阴极电源正极阳极二、金属的腐蚀:金属或合金跟周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
其本质是金属原子失去电子被氧化的过程。
⑴化学腐蚀与电化腐蚀化学腐蚀电化腐蚀条件金属跟非金属单质直接接触不纯金属或合金跟电解质溶液接触现象无电流产生有微弱电流产生本质金属被氧化较活泼金属被氧化联系两者往往同时发生,电化腐蚀更普遍⑵析氢腐蚀与吸氧腐蚀(以Fe为例)析氢腐蚀吸氧腐蚀条件水膜酸性较强(pH<4.3 水膜酸性很弱或中性电极反应负极Fe-2e—=Fe2+正极2H++2e—=H2↑O2+2H2O+4e—=4OH—总反应式Fe+2H+=Fe2++H2↑2Fe+O2+2H2O=2Fe(OH)2⑶金属防护的几种重要方法①改变金属内部的组成结构,将金属制成合金,增强抗腐蚀能力。
②在金属表面覆盖保护保护层,使金属和周围物质隔离开来。
③电化学保护法:利用电化学反应使金属钝化而受到保护,或者利用原电池反应将需要保护的金属作为电池的正极而受到保护。
原电池和电解池比较

原电池和电解池比较1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀: CO2+H2OH2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2+ H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
总结高考电化学知识点

总结高考电化学知识点很多同学想要学好化学,于是急着去做题、去看书。
但我们首先需要清楚的是,提高化学成绩不是一天两天就能提高上去的。
小编在此整理了相关文章,希望能帮助到您。
总结高考电化学知识点原电池(一)概念:化学能转化为电能的装置叫做原电池。
(二)组成条件:1. 两个活泼性不同的电极2. 电解质溶液3. 电极用导线相连并插入电解液构成闭合回路(三)电子流向:外电路:负极——导线——正极内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。
(四)电极反应:以锌铜原电池为例:负极:氧化反应:Zn-2e=Zn2+(较活泼金属)正极:还原反应:2H++2e=H2↑(较不活泼金属)总反应式:Zn+2H+=Zn2++H2↑(五)正、负极的判断:1. 从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。
2. 从电子的流动方向:负极流入正极3. 从电流方向:正极流入负极4. 根据电解质溶液内离子的移动方向:阳离子流向正极,阴离子流向负极5. 根据实验现象:(1)溶解的一极为负极(2)增重或有气泡一极为正极化学电池(一)电池的分类:化学电池、太阳能电池、原子能电池(二)化学电池:借助于化学能直接转变为电能的装置(三)化学电池的分类:一次电池、二次电池、燃料电池1. 一次电池常见一次电池:碱性锌锰电池、锌银电池、锂电池等2. 二次电池(1)二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。
(2)电极反应:铅蓄电池放电:负极(铅):Pb-2e- =PbSO4↓正极(氧化铅):PbO2+4H++2e- =PbSO4↓+2H2O充电:阴极:PbSO4+2H2O-2e- =PbO2+4H+阳极:PbSO4+2e- =Pb两式可以写成一个可逆反应:PbO2+Pb+2H2SO4 ⇋2PbSO4↓+2H2O(3)目前已开发出新型蓄电池:银锌电池、镉镍电池、氢镍电池、锂离子电池、聚合物锂离子电池3. 燃料电池(1)燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池(2)电极反应:一般燃料电池发生的电化学反应的最终产物与燃烧产物相同,可根据燃烧反应写出总的电池反应,但不注明反应的条件。
高中化学知识点原电池和电解池
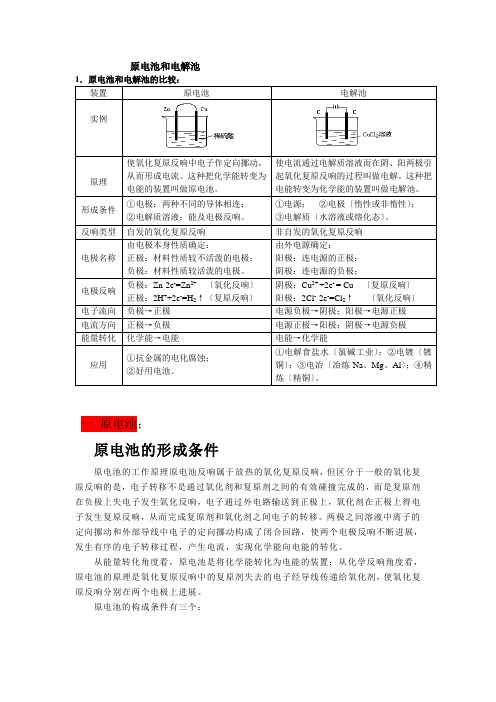
原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化复原反响中电子作定向挪动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化复原反响的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能及电极反响。
①电源;②电极〔惰性或非惰性〕;③电解质〔水溶液或熔化态〕。
反响类型自发的氧化复原反响非自发的氧化复原反响电极名称由电极本身性质确定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源确定:阳极:连电源的正极;阴极:连电源的负极;电极反响负极:Zn-2e-=Zn2+ 〔氧化反响〕正极:2H++2e-=H2↑〔复原反响〕阴极:Cu2+ +2e- = Cu 〔复原反响〕阳极:2Cl--2e-=Cl2↑〔氧化反响〕电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②好用电池。
①电解食盐水〔氯碱工业〕;②电镀〔镀铜〕;③电冶〔冶炼Na、Mg、Al〕;④精炼〔精铜〕。
一原电池;原电池的形成条件原电池的工作原理原电池反响属于放热的氧化复原反响,但区分于一般的氧化复原反响的是,电子转移不是通过氧化剂和复原剂之间的有效碰撞完成的,而是复原剂在负极上失电子发生氧化反响,电子通过外电路输送到正极上,氧化剂在正极上得电子发生复原反响,从而完成复原剂和氧化剂之间电子的转移。
两极之间溶液中离子的定向挪动和外部导线中电子的定向挪动构成了闭合回路,使两个电极反响不断进展,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反响角度看,原电池的原理是氧化复原反响中的复原剂失去的电子经导线传递给氧化剂,使氧化复原反响分别在两个电极上进展。
氧化还原在原电池、电解池、电镀池的对比表格

氧化还原在原电池、电解池、电镀池的对比表格一、负极是活泼金属,发生氧化反应,正极是还原反应…阳极得电子,还原反应,阴极失电子,氧化反应…口决是:升失氧,降得还。
阴阳极的口诀是:阳失氧、阴得还阳极失去电子发生氧化反应,阴极得到电子发生还原反应二、(注意是个表格)原电池、电解池、电镀池的比较①原电池②电解池③电镀池实例CuZn(H2SO4)氯化铜溶液(惰性电极)铁把上镀铜能量转化①化学能转化为电能②电能转化为化学能③电能转化为化学能原理①发生氧化还原反应,从而形成电流(自发)②电流通过引起氧化还原反应(非自发)③电流通过引起氧化还原反应(非自发)形成条件(四条)两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应电源、电极(惰性或非惰性)、电解质、闭合回路电源、电极(cufe)、电解质、闭合回路装置判断①无外加电源②有外加电源③有电源、阳极金属与电解液中金属离子为同一金属元素电极判断①负极:还原性较强的极或电子流出的极或电流流入的极正极:还原性较弱的极或电子流入的极或电流流出的极②阳极:与直流电源正极相连的极阴极:与直流电源负极相连的极③阳极:镀层金属(Cu)与直流电源正极相连的极阴极:被镀物或镀件(Fe)与直流电源负极相连的极电极上的反应①(1)负极本身或还原剂失去电子发生氧化反应(2)正极:溶液中某些阳离子或氧化剂得到电子②(1)阳极发生氧化反应即阳极金属或溶液中阴离子失去电子的反应(2)阴极本身不反应,溶液中的阳离子得到电子发生还原反应③(1)阳极发生氧化反应即阳极金属失去电子的反应(2)阴极本身不反应,溶液中的阳离子得到电子发生还原反应(电解质溶液浓度几乎不变)口诀负极氧化正还原阳极氧化阴还原两极反应①负极:Zn - 2e- =Zn2+(氧化)正极:2H+ +2e- =H2↑(还原)②阳极:2 cl- - 2e- = cl2 (氧化)阴极: Cu2+ + 2e- = Cu (还原)③阳极:Cu - 2e- = Cu2+ (氧化)阴极: Cu2+ + 2e- = Cu (还原)电子流向(三流方向)①负极→外电路→正极②电源负极→由导线→阴极→由溶液→阳极→电源正极③电源负极→由导线→阴极→由溶液→阳极→电源正极电流方向①正极→外电路→负极②电源正极→阳极→阴极→电源负极③电源正极→阳极→阴极→电源负极溶液离子流向①负极→阴离子;正极→阳离子②阳极→阴离子阴极→阳离子③阳极→阴离子阴极→阳离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液中离 阳离子向正极移动; 子的移动 阴离子向负极移动 共性
原电池、电解池、电镀池、电解精炼池的比较
类型 定义 原电池 将化学能转化 为电能的装置 自发反应 没有电源; 两极一般不同 (指电极材料) 电解池 将电能转化为 化学能的装置
ห้องสมุดไป่ตู้电镀池
应用电解原理在金属 上覆盖一层其他金属 非自发反应 有电源; 阳极:镀层金属; 阴极:镀件
铜的电解精炼池 应用电解原理提 炼金属的装置
类型
原电池
电解池 阳极:与电源的 正极相连; 阴极:与电源的 负极相连
电镀池
铜的电解精炼池
负极:较活泼的 电极名称 金属; 正极:较不活泼 及构成 的金属或导电非 金属 电极反应 电子流向 负极:氧化反应; 正极:还原反应 由负极到正极
阳极:镀层金属; 阴极:待镀金属
阳极:粗铜; 阴极:精铜
阳极:氧化反应;阴极:还原反应 由电源的负极到阴极;阳极到电源的正极 阳离子向阴极移动;阴离子向阳极移动 氧化还原反应
反应特征
装置特征
有电源; 两极可同可不同
有电源; 阳极:粗铜; 阴极:精铜; 电解液:硫酸铜 (1)阳极:粗铜; 阴极:精铜; (2)电解液:硫 酸铜
(1)两极连接电 (1)镀层金属接电 (1)活泼性不 源的正极,待镀金属 源两极; 同的两极; 接电源的负极; 形成条件 (2)电解质溶液;(2)电解质溶液; (3)形成闭合回 (3)形成闭合回 (2)电镀液必须含 有镀层金属的离子 路 路
