惰性电极电解酸碱盐溶液规律 (1)
高中化学(选修)最拿分考点系列:考点 电解规律

考点九电解规律【考点定位】本考点考查电解规律,根据电解原理及氧化还原反应的先后规律,准确判断电解产物,并归纳整理和综合运用,提升分析问题和解决问题的能力。
【精确解读】一、电解水惰性电极电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,其实质是电解水,如电解H2SO4、HNO3、NaOH、Na2SO4等溶液;电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可.二、电解质本身被电解惰性电极电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液,如电解盐酸、CuCl2溶液等;电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的原溶质。
如Pt电极电解盐酸一段时间后,恢复原溶液需通入一定量的HCl气体,注意不能加盐酸.三、放出氢气生成碱惰性电极电解活泼金属的无氧酸盐溶液时,电解质和水都有一部分被电解,同时生成氢气和碱溶液;如电解NaCl溶液等。
电解后原溶液中原溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl气体。
四、析出金属放出氧气生成酸惰性电极电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶液等.电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量CuO或Ag2O。
【精细剖析】A B C D甲KOH H2SO4Na2SO4CuSO4乙CuSO4AgNO3HCl HNO3【答案】D【变式训练】用石墨作电极,电解1mol•L-1下列物质的溶液,溶液的pH 保持不变的是( )A.HCl B.CuSO4 C.Na2SO4 D.NaCl【答案】C【解析】A.用石墨作电极电解盐酸,电解过程中,阳极:溶液中阴离子OH—、Cl-移向阳极,放电顺序Cl—>OH—,Cl—放电发生氧化反应,阳极电极反应式:2Cl——2e—═Cl2↑;阴极:溶液中阳离子H+移向阴极放电2H++2e-=H2↑,所以溶液中氢离子浓度逐渐减小,pH 值逐渐变大,故A错误;B.用石墨作电极电解CuSO4溶液,电解过程中,阳极:溶液中阴离子OH—、SO42—移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH—-4e—═2H2O+O2↑;阴极:溶液中阳离子Cu2+、H+移向阴极发生还原反应,电极反应:2Cu2++4e-═2Cu;所以溶液中氢氧离子浓度逐渐减小,氢离子浓度逐渐增大,pH值逐渐变小,故B错误;C.用石墨作电极电解硫酸钠溶液,溶液中氢离子、氢氧根离子放电,阴极:4H++4e—=2H2 ↑,阳极4OH--4e-═2H2O+O2↑;相当于电解水,导致溶液中硫酸钠的浓度增大,但溶液中氢离子和氢氧根离子的浓度不变,所以溶液的pH值保持不变,故C正确;D.用石墨作电极电解氯化钠溶液时,阴极电极反应式为:2H2O+2e-=H2 ↑+2OH-,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl-—2e—=Cl2↑,同时生成氢氧化钠,所以其电池反应式为:2NaCl+2H2O通电2NaOH+H2↑+Cl2↑,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,故D错误;故选C。
例谈惰性电极的电解原理及其判断

例谈惰性电极的电解原理及其判断山东省邹平县长山中学 256206 吴桂志一、电解原理规律:用石墨、Pt 、Au 等惰性材料为电极,电解电解质的水溶液时,溶液中有关离子的放电顺序规律为:阴离子的放电顺序:S 2->I ->Br ->Cl ->OH ->含氧酸根,阳离子的放电顺序:Ag +>Hg 2+>Cu 2+>H +>活泼金属离子。
1、当电解含氧酸、强碱、活泼金属的含氧酸盐(例如:H 2SO 4、NaOH 、K 2SO 4等)时,实际为电解水,即只有水参与电解反应,而电解质不参与电解反应。
阳极反应式:4OH - - 4e - == O 2↑+ 2H 2O阴极反应式:4H + + 4e - == 2H 2↑总反应方程式:2H 2O 2↑+O 2↑2、当电解无氧酸(除HF 外)、不活泼金属的无氧酸盐(氟化物除外)(例如:HCl 、CuCl 2等)时,实际只有电解质参与电解,水不参与电解反应。
阳极反应式:2Cl - - 2e - == Cl 2↑阴极反应式:2H + + 2e - == H 2↑或Cu 2+ +2e -== Cu总反应方程式:HCl H 2 ↑+ Cl 2↑或CuCl 2 Cu + Cl 2↑3、当电解活泼金属的无氧酸盐和不活泼金属的含氧酸盐(例如:NaCl 、CuSO 4等)时,水和电解质均参与电解反应。
阳极反应式:2Cl - - 2e - ==Cl 2↑或4OH - - 4e -==O 2↑+ 2H 2O 阴极反应式:4H + + 4e -==2H 2↑或Cu 2+ +2e -== Cu总反应方程式:2NaCl + 2H 2O 2NaOH + H 2↑+ Cl 2↑或 2CuSO 4 + 2H 2O 2Cu + O 2↑+ 2H 2SO 4二、基本应用 1、判断电解的本质及电解产物电解 电解 电解 电解 电解例1、用惰性电极电解下列各物质的水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液完全恢复到电解前浓度的是()A.AgNO3B. Na2SO4C.CuCl2D.H2SO4解析:从物质的组成来看,电解Na2SO4溶液和H2SO4溶液时,实际为电解水,电解产物分别是氢气和氧气,且物质的量比为2∶1,即当电解一段时间后,向剩余电解质溶液中加入适量水时能使溶液完全恢复到电解前的浓度;而电解AgNO3溶液和CuCl2溶液时,电解产物分别是银、氧气和铜、氯气,当向剩余电解质溶液中加入适量水,不能使溶液完全恢复到电解前浓度,而应分别加入碳酸银和氯化铜。
惰性电极电解酸碱盐溶液规律精编WORD版

类型
电极反应特点
实例
电解对象
电解溶液浓度变化
PH
电解质溶液复原
电解水型
阴极:2H++2e-=H2↑
阳极:4OH--4e-=2H2O+O2↑
H2SO4(含氧酸)
H2O
增大
减小
加水
NaOH(强碱)
H2O
增大
增大
加水
Na2SO4(活泼金属含氧酸盐)
H2O
增大
不变
加水
电解质分解型
电解质电离出的阴、阳离子
分别在两极放电
HCl(无氧酸)
电解质
减小
增大
通HCl
CuCl2(不活泼金属
无氧酸盐)
电解质
减小
加CuCl2
放氢生碱型
阴极:H2O放出H2生成碱
阳极:电解质阴离子放电
NaCl(活泼金属
无氧酸盐)
电解质和水
生成新
电解质
增大
通HCl
放氧生酸型
阴极:电解质阳离子放电
阳极: H2O放出O2生成酸
CuSO4(不活泼金属
含氧酸盐)
电解质和水
生成新
电解质
减小的电解规律(惰性电极)
2020高考化学专题二十一电解电解质溶液的规律

A. X 是负极,丫£丨很 C. CuSQ 溶液的pH 逐渐减小B . Pt 是阴极,Cu 是腐枫D.CuSO4溶液的pH 不变A 一.电解电解质溶液的规律类型i .惰性电极电解水型典例1•用铂作电极电解某种溶液,通电一段时间,溶液的 pH 变小,并且在阳极得到0.56L 气体,阴极得到1.12L 气体(两种气体均在相同条件下测定) 。
由此可知溶液可能是()A. 稀盐酸B . KNO 溶液 C.CuSO 4溶液 D. 稀硫酸【解析】阳极与阴极产生的气体体积比为 需^=2,相当于电解水,PH 变小,说明电解了含氧酸。
【答案】D2•惰性电极电解电解质型典例2.某溶液中含有两种溶质 NaCl 和H 2SQ ,它们的物质的量之比为 3 : 1。
用石墨作 电极电解该混合溶液时,根据电极产物可明显分为三个阶段,下列叙述不正确的是()A.阴极自始至终只析出 H 2 B .阳极先析出C12,后析出Q 2C.电解最后阶段为电解水D.溶液的pH 不断增大,最后为7【解析】电解质溶液中, n (Na +) : n (CI 「): n (H +) : n (SO 2「)= 3 : 3 : 2 : 1,开始电解产 生和Cl 2,随着产生f 和Cl 2的同时,生成的OH 要中和HSQ ,且OH 过量,最后是电解水,因而最后溶液的pH 大于7,阴极只放出H 2。
三个阶段分别相当于电解HC H NaC ZH 2O 。
【答案】D3•惰性电极电解水和电解质型典例3•下图所示装置中,a 、b 都是惰性电极,通电一段时间后, b 电极附近溶液呈红色。
下列说法正确的是(;'培优点二十电解电解质溶液的规律0150’灌液 商口和2.下列装置或操作能达到实验目的的是( )【解析】b 电极附近溶液呈现红色,说明 b 电极处生成了氢氧根离子。
电解饱和食盐水 阳极发生氧化反应产生氯气,阴极发生还原反应产生氢气同时生成氢氧化钠,整个电解过程中电解了 NaCI 和H 20,因此b 电极是阴极,与电源的负极相连,则Y 为负极,X 为正极;铂电极与电源的正极相连,作阳极,铜电极作阴极;电解硫酸铜溶液时,阳极发生氧化反应:氢氧根离 子放电,阴极发生还原反应:铜离子放电,这样溶液中水的电离平衡得到促进, c (H +)>c(OH T ),溶液显酸性,pH 变小。
例谈惰性电极的电解原理及其判断

例谈惰性电极的电解原理及其判断山东省邹平县长山中学 256206 吴桂志一、电解原理规律:用石墨、Pt 、Au 等惰性材料为电极,电解电解质的水溶液时,溶液中有关离子的放电顺序规律为:阴离子的放电顺序:S 2->I ->Br ->Cl ->OH ->含氧酸根,阳离子的放电顺序:Ag +>Hg 2+>Cu 2+>H +>活泼金属离子。
1、当电解含氧酸、强碱、活泼金属的含氧酸盐(例如:H 2SO 4、NaOH 、K 2SO 4等)时,实际为电解水,即只有水参与电解反应,而电解质不参与电解反应。
阳极反应式:4OH - - 4e - == O 2↑+ 2H 2O阴极反应式:4H + + 4e - == 2H 2↑总反应方程式:2H 2O 2↑+O 2↑2、当电解无氧酸(除HF 外)、不活泼金属的无氧酸盐(氟化物除外)(例如:HCl 、CuCl 2等)时,实际只有电解质参与电解,水不参与电解反应。
阳极反应式:2Cl - - 2e - == Cl 2↑阴极反应式:2H + + 2e - == H 2↑或Cu 2+ +2e -== Cu总反应方程式:HCl H 2 ↑+ Cl 2↑或CuCl 2 Cu + Cl 2↑3、当电解活泼金属的无氧酸盐和不活泼金属的含氧酸盐(例如:NaCl 、CuSO 4等)时,水和电解质均参与电解反应。
阳极反应式:2Cl - - 2e - ==Cl 2↑或4OH - - 4e -==O 2↑+ 2H 2O 阴极反应式:4H + + 4e -==2H 2↑或Cu 2+ +2e -== Cu总反应方程式:2NaCl + 2H 2O 2NaOH + H 2↑+ Cl 2↑或 2CuSO 4 + 2H 2O 2Cu + O 2↑+ 2H 2SO 4二、基本应用 1、判断电解的本质及电解产物电解 电解 电解 电解 电解例1、用惰性电极电解下列各物质的水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液完全恢复到电解前浓度的是()A.AgNO3B. Na2SO4C.CuCl2D.H2SO4解析:从物质的组成来看,电解Na2SO4溶液和H2SO4溶液时,实际为电解水,电解产物分别是氢气和氧气,且物质的量比为2∶1,即当电解一段时间后,向剩余电解质溶液中加入适量水时能使溶液完全恢复到电解前的浓度;而电解AgNO3溶液和CuCl2溶液时,电解产物分别是银、氧气和铜、氯气,当向剩余电解质溶液中加入适量水,不能使溶液完全恢复到电解前浓度,而应分别加入碳酸银和氯化铜。
电解规律及其典例分析
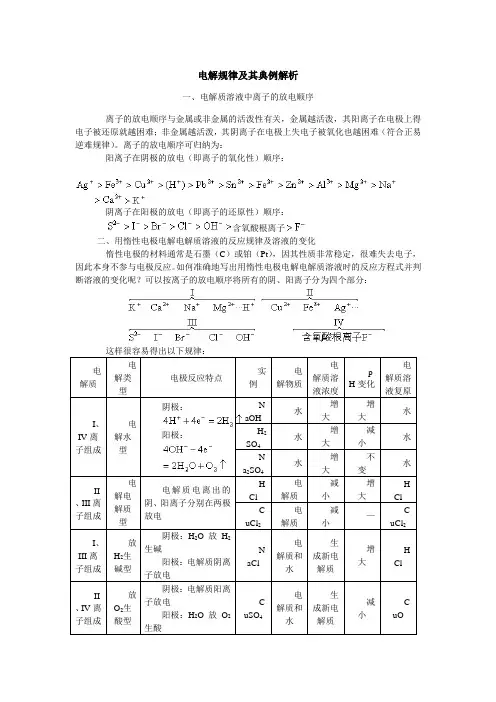
电解规律及其典例解析一、电解质溶液中离子的放电顺序离子的放电顺序与金属或非金属的活泼性有关,金属越活泼,其阳离子在电极上得电子被还原就越困难;非金属越活泼,其阴离子在电极上失电子被氧化也越困难(符合正易逆难规律)。
离子的放电顺序可归纳为:阳离子在阴极的放电(即离子的氧化性)顺序:阴离子在阳极的放电(即离子的还原性)顺序:含氧酸根离子二、用惰性电极电解电解质溶液的反应规律及溶液的变化惰性电极的材料通常是石墨(C)或铂(Pt),因其性质非常稳定,很难失去电子,因此本身不参与电极反应。
如何准确地写出用惰性电极电解电解质溶液时的反应方程式并判断溶液的变化呢?可以按离子的放电顺序将所有的阴、阳离子分为四个部分:这样很容易得出以下规律:电解质电解类型电极反应特点实例电解物质电解质溶液浓度pH变化电解质溶液复原I、IV离子组成电解水型阴极:阳极:NaOH水增大增大水H2SO4水增大减小水Na2SO4水增大不变水II 、III离子组成电解电解质型电解质电离出的阴、阳离子分别在两极放电HCl电解质减小增大HClCuCl2电解质减小—CuCl2I、III离子组成放H2生碱型阴极:H2O放H2生碱阳极:电解质阴离子放电NaCl电解质和水生成新电解质增大HClII 、IV离子组成放O2生酸型阴极:电解质阳离子放电阳极:H2O放O2生酸CuSO4电解质和水生成新电解质减小CuO实际上I、IV中的离子(除、)在水溶液中一般不考虑放电,因为水电离出的、的放电能力比它们强。
溶液的复原就按溶液“少啥补啥”,如用惰性电极电解溶液时两极分别产生、,则Ag与O的物质的量之比为2:1,所以加入可使溶液复原。
三、电解池的阳极为非惰性材料时的电极反应情况非惰性材料的金属阳极比电解质溶液中的阴离子容易放电,所以易失去电子被氧化而溶解,此时溶液中的阴离子不放电。
具体的应用有:电镀和金属的精练。
如铜的电解精练,以精铜作阴极,粗铜作阳极,硫酸铜溶液作电解液,其电极反应为:阳极:进入溶液阴极:沉积在铜片上作为杂质的较活泼的金属氧化后留在电解液中,比铜不活泼的金属杂质则形成阳极泥。
惰性电极电解电解质溶液的四种类型
(2)电解电解质型
电解质类型
电极反应式及总反应式
电解质溶液浓度
溶液pH
电解质溶液复原
无氧酸,如HCl
阴极:2H++2e-===H2↑
阳极:2Cl--2e-===Cl2↑
总反应式:2HCl H2↑+Cl2↑
减小
增大
通入HCl
不活泼金属无氧酸盐,如CuCl2
阴极:Cu2++2e-===Cu
阳极:2Cl--2e-===Cl2↑
总反应式:CuCl2 Cu+Cl2↑
加CuCl2固体
(3)放H2生碱型
电解质(水溶液)
电极反应式及总反应式
电解质浓度
溶液pH
溶液复原
活泼金属的无氧酸盐(如NaCl、KCl)
阳极:2Cl--2e-===Cl2↑
阴极:2H++2e-===H2↑
总反应式:2Cl-+2H2O Cl2↑+H2↑+2OH-
生成新电
解质
增大
通入HCl气体
(4)放O2生酸型
电解质(水溶液)
电极反应式及总反应式
电解质浓度
溶液pH
溶液复原
不活泼金属的含氧酸盐[如CuSO4、Cu(NO3)2]阳极:4来自H--4e-===2H2O+O2↑
阴极:2Cu2++4e-===2Cu
总反应式:2Cu2++2H2O 2Cu+O2↑+4H+
生成新电
解质
惰性电极电解电解质溶液的四种类型
(1)电解水型
电解质类型
电极反应式及总反应式
电解质溶液浓度
溶液pH
电解质溶液复原
含氧酸,如H2SO4
阴极:4H++4e-===2H2↑
阳极:4OH--4e-===O2↑+2H2O
电解池和原电池经典题型讲解与习题
电解池和原电池(讲义)一、知识点睛1.酸碱盐溶液的电解规律(以惰性电极为例)(1)电解电解质型:如电解CuCl2溶液、HCl溶液阳极反应式:__________,阴极反应式:_________。
总反应式:_______________________________。
电解后溶液浓度将______,若要恢复原浓度,只需加入一定量的______即可。
(2)电解水型:如电解Na2SO4溶液、H2SO4溶液、NaOH溶液阳极反应式:__________,阴极反应式:_________。
总反应式:_______________________________。
电解后溶液浓度将______,若要恢复原浓度,只需加入一定量的______即可。
(3)放氢生碱型:如电解NaCl溶液阳极反应式:___________,阴极反应式:_________。
总反应式:_______________________________。
电解后原电解质浓度将______,pH______,若要恢复原来的组成和浓度,需通入一定量的____________。
(4)放氧生酸型:如电解CuSO4溶液、AgNO3溶液阳极反应式:_____________,阴极反应式:_________。
总反应式:_______________________________。
电解后原电解质浓度将______,pH______,若要恢复原来的组成和浓度,需加入一定量____________。
2.电池类型的判断(1)单池装置判断:①若无接加电源,则为_____;②若有外接电源,则为_____。
(2)多池串联装置中电池类型的判断:①无外接电源:一池为_______,其余为________。
②有外接电源:全部为_______。
3.可充电电池Pb+PbO2+2H2SO42PbSO4+2H2O注:放电时为原电池,充电时为电解池;放电时的正极反应式与充电时的阳极反应式互逆;(还原反应)(氧化反应)放电时的负极反应式与充电时的阴极反应式互逆。
化学反应原理—电解—重要基础知识总结
20XX年高二化学专题辅导OOOOOO2NaCl1.标出下列电池的阴阳极,并写出正确的电极方程式阳极:阴极:总反应方程式:NaCl 溶液溶液PH值的变化(填“升高”还是“降低”),加恢复原状态。
2.阳极:阴极:总反应方程式:CuSO4溶液溶液PH值的变化(填“升高”还是“降低”),加恢复原状态。
3.阳极:阴极:总反应方程式:溶液PH值的变化(填“升高”还是“降低”),加恢复原状态。
CuCl2溶液4.HCl溶液溶液PH值的变化(填“升高”还是“降低”),加恢复原状态。
阳极:阴极:总反应方程式:5.溶液PH值的变化(填“升高”还是“降低”),加恢复原状态。
阳极:阴极:总反应方程式: H2SO4溶液6.阳极:阴极:总反应方程式:NaOH溶液溶液PH值的变化(填“升高”还是“降低”),加恢复原状态。
7.阳极:阴极:总反应方程式:NaSO4溶液溶液PH值的变化(填“升高”还是“降低”),加恢复原状态。
8.阳极:阴极:总反应方程式:溶液PH值的变化(填“升高”还是“降低”),加恢复原状态。
9.铁棒上的反应:铜棒上的反应:总反应方程式:石墨1上的反应:石墨2上的反应:总反应方程式:1.下列关于铜电极的叙述正确的是()A.铜锌原电池中铜是正极B.用电解法精炼粗铜时粗铜做阴极C.在镀件上电镀铜时,可用金属铜做阳极 D.电解稀硫酸制H2,O2时铜做阳极2.某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:(1)阳极质量不变;(2)阴极质量增加;(3)电解液pH减小,则应选用的电极是()A.阴、阳两极都用石墨B.铜作阳极铁作阴极C.铁作阳极铜作阴极D.铂作阳极铜作阴极3.某电解池中盛有CuCl2溶液,插入电极进行电解,若达到下列要示:①一电极质量减轻,另一电极质量增加;②电解质的组成不变。
则应选用的电极是()A.阳极铁、阴极铁B.阳极石墨、阴极铜 C.阳极铁、阴极 D.阳极铜、阴极铁4.1LNa2SO4和CuSO4的混合液中,c(SO42-)=2mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中c(Na+)为()A.0.5mol·L-1B.1 mol·L-1C.1.5 mol·L-1D.2 mol·L-15.用惰性电极实现电解,下列说法正确的是()A.电解稀硫酸,实质上是电解水,故溶液pH不变B.电解稀NaOH溶液,要消耗OH-,故溶液pH减小C.电解Na2SO4溶液,在阴极上和阳极上析出产物的物质的量之比为1:2D.电解CuCl2溶液,在阴极上和阳极上析出产物的物质的量之比为1:16.用两支惰性电极插入500mLAgNO3溶液中,通电电解。
酸碱盐溶液电解规律惰性电极
电化学提要1.原电池电极构成:负极: 较活泼金属(电子流出的极);正极: 较不活泼的金属(或能导电的非金属)(电子流入的极)电极反应:负极: 氧化反应, 一般是金属失电子;正极: 还原反应,溶液中的阳离子得电子或者氧气得电子(吸氧腐蚀)溶液中带电粒子移动:阳离子向正极移动;阴离子向负极移动电解池电极构成:阳极:与电源正极相连的极;阴极:与电源负极相连的极电极反应:阳极: 氧化反应, 溶液中的阴离子失电子, 或电极金属失电子;阴极: 还原反应, 溶液中的阳离子得电子溶液中带电粒子移动:阳离子向阴极移动;阴离子向阳极移动电池的两极是正、负极, 电解的两极则是阴、阳极。
实际上,负极和阳极是起氧化反应的电极; 正极和阴极则是起还原反应的电极。
2. 原电池、电解池、电镀池判定规律若无外接电源,可能是原电池,然后依据原电池的形成条件分析判定,主要思路是“三看”。
先看电极:两极为导体且活泼性不同。
再看溶液:两极插入电解质溶液中。
后看回路:形成闭合回路或两极接触。
若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。
当阳极金属与电解质溶液中的金属阳离子相同则为电镀池,其余情况为电解池。
酸、碱、盐溶液电解规律(惰性电极)(1)分解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4、K2SO4等)的电解。
阴极:4H++4e-=2H2↑ 阳极:4OH--4e-=O2↑+2H2O总反应:2H2O2H2↑+O2↑阴极产物:H2;阳极产物:O2。
电解质溶液复原加入物质:H2O。
pH变化情况:原来酸性的溶液pH变小,原来碱性的溶液pH变大,强酸(含氧酸)强碱的正盐溶液pH不变。
(2)分解电解质型:无氧酸(除HF外)、不活泼金属的无氧酸盐(氟化物除外)的电解,如HCl、CuCl2等。
阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑总反应:CuCl2 Cu+Cl2↑阴极产物:酸为H2,盐为金属;阳极产物:卤素等非金属单质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电极反应特点
实例
电解对象
电解液浓度变化
PH
电解质溶液复原
电解水型
阴极:2H++2e-=H2↑
阳极:4OH--4e-=2H2O+O2↑
H2SO4(含氧酸)
H2O
增大
减小
加水
NaOH(强碱)
H2O
增大
增大
加水
Na2SO4(活泼金属含氧酸盐)
H2O
增大
不变
加水
电解质分解型
电解质电离出的阴、阳离子
分别在两极放电
HCl(无氧酸)
电解质
减小
增大
通HCl
CuCl2(不活泼金属
无氧酸盐)
电解质
减小
加CuCl2
放氢生碱型
阴极:H2O放出H2生成碱
阳极:电解质阴离子放电
NaCl(活泼金属
无氧酸盐)
电解质和水
生成新
电解质
增大
通HCl
放氧生酸型
阴极:电解质阳离子放电
阳极: H2O放出O2生成酸
CuSO4(不活泼金属
含氧酸盐)
电解质和水
生成新
电解质
减小
加CuO
CuCO3
酸、碱、盐溶液的电解规律(惰性电极)
