2017年物理化学考研模拟试题及详解(一)【圣才出品】
大连工业大学物理化学考研真题试题2017年

的偏摩尔体积将随浓度的改变而____。
A. 增加
B. 减少
C. 不变
D.不一定
9.反应
2NO + O2 ‡ˆ ˆ †ˆ
2NO2
的
r
H
m
<0,当此反应达平衡后,若要使平衡向产物方向移动,
应该_____。
A.升温升压
B.升温降压
C.降温升压
D.降温降压
10.对恒温恒压只做体积功的反应系统,若 r Gm >0,则___。
r
H
m
=
kJ·mol-1。
大连工业大学 2017 年硕士研究生入学考试自命试题
4.影响 KΘ大小的因素有 ______;影响化学平衡状态的因素有_________ _______________。 5.一定量的 NH4Cl(s)置于真空容器中,加热分解达平衡,系统的组分数为___ ,相数为 ___ ,
科目代码: 805 页
科目名称:
物理化学
共5页第3
自由度数为
。
6.某溶液含 LaCl3 和 NaCl 各为 0.025 mol·kg-1,该溶液离子强度 I = _______ mol·kg-1,25℃ 时 LaCl3 的离子平均活度系数γ± = _______ (用不考虑离子半径修正的德拜-许格尔极限公 式, 常数 A 的值取 0.509)。
D.不一定
A.零级反应
B.一级反应
C.二级反应
D.三级反应
19.下列几种运动中 ____对热力学函数 G 和 A 的贡献不同。
A.电子运动
B.振动运动
C.转动运动
D.平动运动
20.丁达尔效应的强度与入射光波长的_____次方成反比。
华南理工大学2017年硕士学位研究生物理化学考试试卷

华南理工大学2017 年硕士学位研究生考试试卷(试卷上做答无效,请在答题纸上做答,试后本卷必须与答题纸一同交回)科目名称:物理化学(一)适用专业:高分子化学与物理无机化学分析化学有机化学物理化学计算题:1.将装有0.1 摩尔乙醚液体的微小玻璃泡,放入充满氮气(压力为101325 Pa)的恒容恒温(10 dm3,35℃)容器中。
将小玻璃泡打碎后,乙醚完全汽化,此时形成一混合理想气体。
已知乙醚在101325 Pa 时的沸点为35℃,其汽化焓为25.104 kJ·mol-1。
请计算:(1)混合气体中乙醚的分压;(2)氮气变化过程的H,S,G;(3)乙醚变化过程的H,S,G。
(15 分)说明:天大教材习题3.28 与此题类似。
解:(1) p 乙醚=n 乙醚RT/V=(0.1×8.315×308.15/0.01)Pa=25623Pa(2) N2状态变化:(35℃,10 dm3)→ (35℃,10 dm3)即没有变化,故H=0,S=0,G=0(3) 乙醚的状态变化:l(35℃, p1=101325Pa) → g(35℃, p2=101325Pa) → g(35℃, p3=25623Pa) H=H 汽化+H T=0.1×25.104 kJ=2.5104kJS=S 汽化+S T=(H 汽化/T)+nR ln(p2/p3)=(2510.4J/308.15K)+0.1×8.315×ln(101325Pa/25623Pa)=9.290J.K-1G=H - T S=(2510.4-308.15×9.290)J= -352.3J2.某气体的状态方程为(p+a/V m2)V m=RT,式中a 为常数,V m为摩尔体积。
试求1 mol11V V f mf mf mmmm该气体从(2×105 Pa ,10 dm 3,300K )状态恒温可逆变至体积为 40 dm 3 状态时的 W ,Q ,ΔU ,ΔH 。
2017年普通高等学校招生全国统一考试考前演练卷(一)理科综合化学试题含答案

7.化学在生产和日常生活中有着重要的作用。
下列有关说法正确的是A. “地沟油”经过加工处理后,可以用制肥皂B.二氧化硫有漂白性,大量用作棉、麻、纸张和食品的漂白C.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的D. PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶8.以下判断,结论正确的是92CrO Array+10A .常温常压下,5.6L 甲烷中的共价键数目 B.标准状况下.17gD 3中所含分子数目C.向0.2molNH 4Al(SO 4)2溶液中滴加NaOH 溶液至沉淀完全溶解,消耗的OH -教目 D.0.1mol 羟基(—OH)中所含电子数目11.某有机物能使澳的CC 4溶液褪色,也能在一定条件下发生水解生成两种有机物,还能发生加聚反应生成高分子化合物,则此有机物中通常含有的基团的组合是A.卤素原子、碳碳双键 B .羟基、羧基 C .醛基、酯基 D .碳碳双键、酯基 12.甲~庚等元素在周期表中的相对位置如右表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。
下列判断正确的是A.丙与戊的原子序数相差28B.气态氢化物的稳定性:庚<己<戊C.常温下,庚和乙形成的化合物易溶于水D.丁的最高价氧化物不与任何酸反应 13.已知,向相同浓度的醋酸和盐酸中分别加入NaOH 溶液,其pH 与加入的NaOH 溶液的体积变化关系分别如下图I 、II 所示。
室温下,将mol/L 盐酸滴入VmLymol/L 的碱溶液中,溶液pH 和温度随加入盐酸体积变化曲线如下图III 所示。
下列说法正确的是A.该碱溶液可能是Ba(OH)2溶液B.c、d两点对应的盐酸体积不同C.从图中可判断约为1, y小于1D.d点后温度降低,是因为生成的盐发生水解吸热所致26. (14分)FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用下图所示装置制取溴化亚铁。
北京化工大学2017年攻读硕士学位研究生入学考试--物理化学试题

北京化工大学2017年攻读硕士学位研究生入学考试物理化学试题注意事项:1.答案必须写在答题纸上,写在试卷上均不给分。
3.答题必须用蓝、黑水笔或圆珠笔,用红笔或铅笔不给分。
4.101.325kPa≈100kPa=p5.作图用铅笔,且作图题答在指定题号的答题纸上。
一、选择题:(10分)1.气体能被液化的条件是:A 、 T=T C , p<p CB 、T>TC ,p ≥p C C 、 T<T C , p<p *D 、1r T ≤,*p p ≥2. 在αβ、两相中均含有A 、B 两种物质,当达到相平衡时下列化学势关系中正确的是()。
A 、**AB μμ= B 、A A αβμμ=C 、 A B αβμμ=D 、 以上都不对3.右图表示理想气体经历的可逆循环示意图,其中AB 是等温膨胀,BC 是等容降温,CD 是等温压缩,DA 是绝热压缩。
试问:下面以不同坐标表示的可逆循环示意图,哪一个图与 p -V 图所表示的循环相同。
4.将固体3NaHCO 放入一抽空的容器中,发生如下化学反应:323222NaHCO ()Na CO ()CO ()H O()s s g g =++达到平衡时,该系统的组分数C 与自由度F 分别为()。
A 、 4,3B 、 2,1C 、3,2D 、 1,05.某化学反应,当温度每升高1K 时,该反应的速率常数a k 增加1%,则该反应的活化能a E 约为()A 、 2RTB 、 1002RTC 、 102RTD 、 0.012RT6.298K 时,0.002mol ⋅kg -1的2CuCl 溶液的平均活度系数1()γ±与同浓度的4CuSO 溶液的平均活度系数2()γ±之间的关系为()。
A 、 1()γ±>2()γ±B 、 1()γ±<2()γ±C 、 1()γ±=2()γ±D 、 无法比较7.下列问题中哪个不能通过电导实验测定得到解决()。
2017年普通高等学校招生全国统一考试预测密卷(一)理科综合-化学试题含答案
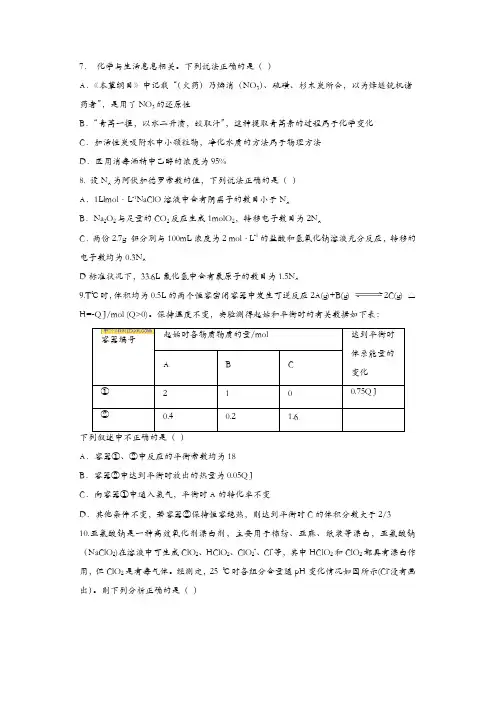
7.化学与生活息息相关。
下列说法正确的是()A.《本草纲目》中记载“(火药)乃焰消(NO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,是用了NO3的还原性B.“青蒿一握,以水二升渍,绞取汁”,这种提取青蒿素的过程属于化学变化C.加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法D.医用消毒洒精中乙醇的浓度为95%8. 设N A为阿伏加徳罗常数的值,下列说法正确的是()A.1Llmol·L-1NaClO溶液中含有阴离子的数目小于N AB.Na2O2与足量的CO2反应生成1molO2,转移电子数目为2N AC.两份2.7g 铝分別与100mL浓度为2 mol·L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3N AD标准状况下,33.6L氟化氢中含有氟原子的数目为1.5N A9.T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应2A(g)+B(g) 2C(g) △H=-Q J/mol (Q>0)。
保持温度不变,实验测得起始和平衡时的有关数据如下表:容器编号A.容器①、②中反应的平衡常数均为18B.容器②中达到平衡时放出的热量为0.05Q JC.向容器①中通入氦气,平衡时A的转化率不变D.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数大于2/3 10.亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。
经测定,25 ℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。
则下列分析正确的是()A.pH=3比PH=4时更适宜做漂白剂B.“有效氯含量”可用衡量含氯消毒剂的消毒能力,指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
则NaClO2的有效氯含量约为1.57C.亚氯酸钠在酸性条件下较稳定D.25℃,pH=3时,NaClO2溶液中:c(Na+)+(H+)=c(ClO2-)+c(OH-)11.电解硫酸钠溶液生产硫酸和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。
傅献彩《物理化学》(第5版)笔记和课后习题(含考研真题)详解(化学动力学基础(二))【圣才出品】

二、过渡态理论 1.过渡态理论基本要点
3 / 52
圣才电子书 十万种考研考证电子书、题库视频学习平台
(1)反应物到产物必须经过一种过渡状态,即反应物分子活化形成活化络合物的中间 状态,反应物与活化络合物之间能很快速成化学平衡。
(2)活化络合物又可分解为产物,活化络合物分解步骤为慢步骤,化学反应速率由活 化络合物分解步骤决定。
Ep (r) De[exp{2a(r r0)} 2exp{a(r r0)}]
计算双原子分子势能 Ep 最常用的经验公式。式中 r0 是分子中双原子分子间的平衡核间
4 / 52
圣才电子书 十万种考研考证电子书、题库视频学习平台
距,De 是势能曲线的井深,a 为与分子结构有关的常数。
③活化络合物,就向产物转化,这步是反应的速决步。
(2)对于一般基元反应,速率常数的计算式为
k kBT f ' exp( E0 )
h fB
RT
B
4.过渡状态理论的优缺点
(1)优点
①形象地描绘了基元反应进展的过程。
②原则上可以从原子结构的光谱数据和势能面计算宏观反应的速率常数。
(3)反应物分子间相互作用势能是分子间相对位置的函数,反应物转化为产物的过程 是体系势能不断变化的过程。
(4)过渡状态理论提供了由物质基本结构系数[υ(振动频率),m(质量),r(核间距) 等]计算反应速率常数的方法。
过渡态理论:由反应物分子变成生成物分子,中间一定要经过一个过渡态,而形成这个过 渡态必须吸取一定的活化能,即反应物分子活化形成活化络合物的中间状态,所以又称为活 化络合物理论。用该理论,只要知道分子的振动频率、质量、核间距等基本物性,就能计算 反应的速率常数,所以又称为绝对反应速率理论。
傅献彩《物理化学》(第5版)(下册)章节题库-化学动力学基础(一)(圣才出品)
【解析】活化焓相等,则活化能也近似相等,活化熵相差 30 J gK −1 gmol −1 ,则根据
k = P exp( S )exp( − Ea )
R
RT
k2
( S2 − S1 )
= exp R R
30
= exp8.314
= 37
k1
8. 某化学反应,当温度每升高 1K 时,该反应的速率常数 k 增加 1%,则该反应的活化
k = Aexp( − Ea ) RT
1 / 74
圣才电子书 十万种考研考证电子书、题库视频学习平台
得
k2
( E1 − E2 )
= exp RT RT
80000
= exp8.314298
= 1014
k1
3.某二级反应,反应物消耗 1/3 需时间 10min,若再消耗 1/3 还需时间为( )。
应的半衰期为 t1/2=1/(kCA,0)=100s。
10.在简单硬球碰撞理论中,有效碰撞的定义是( )。 A.互撞分子的总动能超过 EC B.互撞分子的相对动能超过 EC C.互撞分子的内部动能超过 EC D.互撞分子的相对平动能在连心线上的分量超过 EC 【答案】D 【解析】能导致旧键破裂的碰撞成为有效碰撞。只有相对平动能在分子连心线上的分量 超过临界值的分子对,才能把平动能转化为分子内部的能量,使旧键破裂而发生原子间的重 新组合。
速率常数的温度系数较小。
12.某反应,无论反应物初始浓度为多少,在相同时间和温度时,反应物消耗的浓度为 定值,此反应是( )。
A.负级数反应 B.一级反应 C.零级反应 D.二级反应 【答案】C
【解析】零级反应速率方程式为:cA,0 − cA = kt ,一定温度下,k 为定值,时间也一定 时,等式右边是常数,所以, cA,0 − cA 即反应物消耗的浓度为定值
2017年成人高校招生考试模拟试题物理化学(一)
2017年成人高校招生考试模拟试题物理化学(一)作者:来源:《山西教育·招考》2017年第11期一、选择题:第1~15小题,每小题4分,共60分。
在每小题给出的四个选项中,选出一项符合题目要求的。
1.如图,小明从学校出发回家,有三条不同的路可走。
关于三条不同的路径,下列说法正确的是A.三条不同的路径对应的路程相同B.甲通过的路程最大C.分别走三条不同的路径,位移相同D.小明从学校到家和从家到校的位移相同A.动摩擦因数滋与摩擦力Ff成正比,Ff越大,滋越大B.动摩擦因数滋与正压力FN成反比,FN越大,滋越小C.滋与Ff成正比,与FN成反比D.滋的大小由两物体接触面的情况及其材料决定3.一碗水置于火车车厢内的水平桌面上。
当火车向右做匀减速运动时,水面形状接近于图4.关于功和能,下列说法不正确的是A.滑动摩擦力对物体可以做正功B.当作用力对物体做正功时,反作用力可以不做功C.做曲线运动的物体,由于速度不断地变化,一定有外力对物体做功D.只受重力作用的物体,在运动过程中机械能一定守恒5.弹簧振子在水平方向上做简谐运动的过程中,下列说法正确的是A.在平衡位置时它的机械能最大B.在最大位移时它的机械能最大C.从平衡位置到最大位移处它的动能减小D.從最大位移处到平衡位置它的机械能减小6.如图,在方向垂直于纸面向里的匀强磁场中有一U形金属导轨,导轨平面与磁场垂直。
金属杆PQ置于导轨上并与导轨形成闭合回路PQRS,一圆环形金属线框T位于回路围成的区域内,线框与导轨共面。
现让金属杆PQ突然向右运动,在运动开始的瞬间,关于感应电流的方向,下列说法正确的是A. PQRS中沿顺时针方向,T中沿逆时针方向B. PQRS中沿顺时针方向,T中沿顺时针方向C. PQRS中沿逆时针方向,T中沿逆时针方向D. PQRS中沿逆时针方向,T中沿顺时针方向7.关于光的波粒二象性的理解正确的是A.个别光子的行为往往表现出波动性,大量光子的行为往往表现出粒子性B.光在传播时是波,而与物质相互作用时就转变成粒子C.光在传播时波动性显著,而与物质相互作用时粒子性显著D.高频光是粒子,低频光是波8.古丝绸之路贸易中的下列商品,主要成分属于无机物的是D. N2的电子式:N左N11.在给定的条件下,下列选项所示的物质间转化均能实现的是13.下列实验方案中,不能达到相应实验目的的是14.下图表示某有机反应的过程,该反应的类型是A.取代反应B.加成反应C.氧化反应D.加聚反应15.从化学试剂商店买来的无水乙醇试剂瓶上所贴的危险化学品标志是二、填空题:第16—23小题,每空3分,共63分。
2017年物理化学考研模拟试题及详解(二)【圣才出品】
2017年物理化学考研模拟试题及详解(二)一、选择题(每题3分,共30分)1.对于反应3A +2B→C,当A 耗掉0.6mol 时,反应进度改变值为( )。
A .0.6molB .0.2molC .0.3molD .0.1mol【答案】B【解析】计算如下:。
A 0.60.2 mol ξυ==2.下列中哪一点不能用来衡量液体对固体的润湿程度( )。
A .液体在固体表面铺展系数的大小B .固体在液体中的分散程度C .接触角的大小D .液体对固体粉末润湿热的大小【答案】B【解析】A 项,铺展系数越大,铺展性能越好,即润湿程度越大。
C 项,接触角越小越小,润湿性越好。
D 项,润湿热的大小反应了液固界面转变为液液界面的难易程度,润湿热越小,表明固体更容易溶解,即液体对固体润湿性越好。
3.定温定压下,液态水变为水蒸气,系统的热力学函数()。
A.熵增加,焓减小B.熵减小,焓增加C.熵和焓都减小D.熵和焓都增加【答案】D【解析】由热力学基本方程dH=TdS+Vdp可得,=T>0,即焓与熵同向变化。
液态水变为水蒸气吸热,熵增加,即焓也增加。
4.表面反应控制的气-固相催化反应A→B,其速率方程r=kb A P A/(1+b A P A),在通常压力下,若反应物的吸附很强,则表面为:()。
A.零级反应B.一级反应C.二级反应D.三级反应【答案】A【解析】零级反应特点为反应速率方程与时间无关,由题目中所给的速率方程形式可以看出,表面为零级反应。
5.反应CO(g)+Cl2(g)→COCl2(g)的=kc(CO)c(Cl2)α;当温度及CO的浓度保持不变而Cl2的浓度增至原来的2倍时,反应速率增至原来的2.83倍,则α=()。
B.2.0C.0.5D.0【答案】A【解析】温度及CO的浓度保持不变,即公式=kc(CO)c(Cl2)α(1式),式中K和c(CO)不变,由2.83=kc(CO)·(2C Cl2)α(2式),用(2)式除以(1)式得α=1.5。
2017年辽宁大连工业大学物理化学考研真题
2017年辽宁大连工业大学物理化学考研真题一.选择题(20分,每小题1分):1.下列几种条件下的真实气体,最接近理想气体行为的是 。
A .高温高压B .高温低压C .低温高压D .低温低压2.某绝热系统在接受了环境所做的功后,其温度 。
A .一定升高B .一定降低C .一定不变D .不一定改变3.物质的温度越高,则 。
A .其所含热量越多B .其所含热能越少C .其热容越大D .其分子的热运动越剧烈4.下列物质中不查表就知其燃烧焓的物质是 ,不查表就知其生成焓的物质是 。
A .石墨B .二氧化碳C .甲烷D .金刚石5.从状态A 至状态B 不同的不可逆途径的熵变 。
A .各不相同B .都相等C .不一定相等D .不能确定6.真实气体进行绝热可逆膨胀,其熵变 。
A .ΔS > OB .ΔS < OC .ΔS = OD .不一定7.过饱和溶液中溶质的化学势与纯溶质的化学势比较,高低如何? ______。
A . 低B .高C . 相等D .不可比较8.恒温恒压下,在A 与B 组成的均相系统中,若A 的偏摩尔体积随浓度的改变而增加,则B 的偏摩尔体积将随浓度的改变而____。
A . 增加B . 减少C . 不变D .不一定9.反应 2NO + O 22NO 2的r m H Θ∆<0,当此反应达平衡后,若要使平衡向产物方向移动,应该_____。
A .升温升压B .升温降压C .降温升压D .降温降压10.对恒温恒压只做体积功的反应系统,若r m G Θ∆>0,则___。
A . 反应不能正向进行B .反应能正向进行C .须用r m G ∆判断反应限度后才知反应方向D . 当J a < K Θ时仍能正向进行11.只受环境温度和压力影响的二组分平衡系统,可能出现的最多相数为______。
A . 2B . 3C . 4D .512.碳酸钠与水可形成下列几种水合物:Na 2CO 3·H 2O ,Na 2CO 3·7H 2O ,Na 2CO 3·10H 2O 在101.325kPa ,与碳酸钠水溶液和冰共存的含水盐最多可以有 ____种。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
( )。 A.反应向右进行 B.反应向左进行 C.反应处于化学平衡状态 D.反应进行的方向难以确定 【答案】A 【解析】计算此时的压力 Jp= 1010 0.02 <Kp,,所以反应向右进行直到 Jp= Kp 使
【解析】由麦克斯韦关系式知( S/ V)T=( p/ T)v=f(V)=p/T>0。
2.已知下列两反应所对应电池的标准电动势
则两个 的关系为( )。
【答案】B 【解析】电池的标准电动势与反应方程的系数无关。
3.一个纯物质的膨胀系数 α= 质的摩尔恒压热容 Cp 将( )。
A.与体积 V 无关
【解析】理想气体中 H 是温度 T 的单值函数,所以-( H/p )T=0,由 μJ-T=( T/p )H=-( H/p )T/( H/T )p ,得 μJ-T=0。
6.-5℃,101.325 kPa 下的过冷水,凝固成同温同压下的冰,则此过程有( )。 A.△G=0 B.△S>0 C.△S 孤立>0 D.△S 孤立<0 【答案】C 【解析】过冷水是亚稳相,-4℃是它的相转变温度,所以该过程为不可逆过程,△ G<0,由于转变温度-5℃低于-4℃,所以反应为自发反应,由克劳修斯不等式判据得△ S 孤立>0。
7.杠杆规则适用于二组分相图上的区域为( )。 A.液相区 B.共晶混合物区 C.任意两相平衡区 D.仅适用于液-固平衡区 【答案】C
3 / 19
圣才电子书
十万种考研考证电子书、题库视频学习平
台
【解析】杠杆规则为:两相平衡时,A 相含量与 B 相含量的比值等于相图中 B 相的组
5.碳化钙分解反应平衡物系中,组分数为( )。 【答案】2 【解析】CaCO3→CaO+CO2 ,体系共 3 种物质,但是存在一个化学平衡,所以体系中 独立组分数为 3-2=1。
(
b b
)2
。
10.298K 下,选用适当的催化剂后,使反应活化能比未加催化剂时降低了
8500J·mol-1,则二者速率系数比(kcat/k0)为:( )。
A.31
B.61
C.92
D.4.5
【答案】A
k催
A
exp
Ea,催 RT
【解析】 k非催
A'
exp
Ea,非催 RT
,再结合
Ea,催=Ea,非催-8500
50 100
得反应达平衡为止。
5.焦耳-汤姆逊系数 μJ-T=( T/p )H=-( H/p )T/( H/T )p,则对于理想
气体,有 μJ-T( )。 A.>0 B.<0
2 / 19
圣才电子书
C.=0
十万种考研考证电子书、题库视频学习平 台
D.不能确定
【答案】C
4.有理想气体反应达化学平衡 A(g)+B(g) 3C(g),在恒温下维持系统总 压不变,向系统中加入惰性气体,平衡( )移动;若将气体置于钢筒内,加人惰性气体 后平衡( )移动。
【答案】向右,不 【解析】恒温恒压下加入惰性气体,相当于减小了反应体系的压力,因为平衡向气体 体积增大的方向移动。恒温恒容下加入惰性气体,不改变反应体系的压力,所以平衡不移 动。
1 / 19
(T 为绝对温度),则该物
圣才电子书
B.与压力 P 无关
十万种考研考证电子书、题库视频学习平 台
C.与温度 T 无关
D.与 V、P、T 均有关
【答案】B
【解析】根据
即在等压条件下 V 对 T 的二阶导数,
所以与 P 无关。
4.反应 CO(g)+H2O(g) CO2(g)+H2(g)在 973K 时压力平衡常数
计算即可。
二、填空题(每题 3 分,共 15 分) 1.热力学第二定律的数学表达式为( );其物理含义为( )。
【答案】dS≥δQ/T 或者
;热力学系统熵变总是大于或等于过程的热温商,
不可逆过程系统的熵变大于过程的热温商,可逆过程系统的熵变等于过程的热温商。
2.1 mol NO 的二聚分子 N2O2,在 0 K 时有两种排列方式,其残余熵等于( )。
圣才电子书
十万种考研考证电子书、题库视频学习平
台
2017 年物理化学考研模拟试题及详解(一)
一、选择题(每题 3 分,共 30 分) 1.某气体状态方程为 p=f(V)T,f(V)仅为体积的函数,恒温下该气体的熵随体 积 V 的增加而( )。 A.增加 B.下降 C.不变 D.难以确定 【答案】A
9.溶质 BB 为 ( )。
A. B. C. D. 【答案】A
4 / 19
圣才电子书
十万种考研考证电子书、题库视频学习平
【解析】 b
1
台
b b , aB
a
(
b b
)2
2
5 / 19
圣才电子书
十万种考研考证电子书、题库视频学习平
台
【答案】S 残余=NkBlnΩ=Rln2=5.76 J·mol-1·K-1
3.由克拉佩龙方程导出克-克方程积分式所做的三个近似处理是( );( ); ( )。
【答案】气体视为理想气体;忽略液体或固体体积的变化;相变焓不随温度而变化。 【解析】克拉佩龙方程为 dp/dT=△H/(T△V),对理想气体,忽略液体或固体体积的 变化,可得克-克方程微分形式 dp/dT=p△H/(RT2);假设相变焓不随温度变化,得到积 分式 ln(p2/p1)=-△H(1/T1-1/T2)/R。
成点与基准点的线段长除以相图中 A 相的组成点与基准点的线段长。杠杆规则只要求两相
平衡即可,对这两相组成及相态无要求。
8.CaCO3(s),CaO(s),BaCO3(s),BaO(s)及 CO2(g)形成的平衡系统, 其组分数、相数和自由度数分别为( )。
A.C=5,P=5,f=2 B.C=4,P=5,f=1 C.C=3,P=4,f=1 D.C=3,P=5,f=0 【答案】D 【解析】该相平衡系统的物种数为 S=5,独立的化学平衡数 R=2,没有浓度限制, 则 R’=0,所以组分数 C=S-R-R’=5-2=3;系统中有四种固体,一种气体,故相 数 P=5;则自由度数 f= C+2-P=3+2-5=0。
