《中级无机化学》试题及答案
中级无机化学习题答案已打印

第一章、酸碱理论1.下列化合物中,哪些是路易斯酸,哪些是路易斯碱?BH4-,PH3,BeCl2,CO2,CO,Hg(NO3)2,SnCl2解答:路易斯酸BeCl2,CO2,CO,Hg(NO3)2,SnCl2路易斯碱PH3,CO,SnCl22.写出下列物种的共轭酸和共轭碱:NH2,NH2,H2O,HI,HSO4-解答:共轭酸共轭碱NH3:NH4+ NH2-NH2-:NH3NH2-H2O:H3O+OH-HI:I-HSO4-:H2SO4SO42-3.下列各对中哪一个酸性较强?并说明理由。
(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+ (b) [Al(H2O)6]3+和[Ga(H2O)6]3+(c) Si(OH)4 和Ge(OH)4 (d) HClO3和HClO4(e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4解答:(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+路易斯酸性:前者,中心离子电荷高,吸引电子能力大质子酸性:前者,中心离子电荷高,对O的极化能力大,H+易离解;(b)[Al(H2O)6]3+和[Ga(H2O)6]3+路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(c) Si(OH)4 和Ge(OH)4路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(d) HClO3和HClO4 (e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4均为后者,非羟基氧原子多,酸性越强。
4.应用Pauling规则,(1) 判断H3PO4(pKa=2.12)、H3PO3(pKa=1.80)和H3PO2(pKa=2.0)的结构;(2) 粗略估计H3PO4、H2PO4-和HPO42-的pKa值。
解答:(1)根据pKa值判断,应有相同非羟基氧原子。
(2)H3PO4:一个非羟基氧原子,pKa值约为2;H2PO4-pKa值增加5,约为7;HPO42-pKa约为12。
0049《中级无机化学》模拟测试答案西南大学网络教育20年春季作业参考答案

0049 20201主观题1、在BrF3中,SbF5与KF的反应方程式。
参考答案:SbF5+KF = KSbF62、参考答案:3、参考答案:Fe(C5H5)2 + CH2O + HNCH3‍(C5H5)Fe(C5H4 CH2NCH3)2 + H2O4、Fe3++Eu2+=参考答案:Fe3++Eu2+=Fe2++Eu3+5、Mn2(CO)10+I2=参考答案:Mn2(CO)10+I2=2Mn(CO)5I6、C5H6+NaOH=参考答案:C5H6+NaOH=C5H5Na+H2O7、参考答案:TiO2 + 2C + 2 Cl2TiCl4 + 2 CO8、超酸是哈密特酸度函数Ho()-11.93的酸。
参考答案:< (或“小于”)9、配合物四氢合铝(III)酸锂的化学式为()。
参考答案:Li(AlH4)10、K4[Fe(CN)6]为低自旋配合物,根据晶体场理论,中心离子的电子排布为()。
参考答案:t2g6 e g011、造成第三过渡元素原子半径和第二过渡元素原子半径相接近的原因是()。
参考答案:镧系收缩12、金属酶是能执行催化功能的()蛋白。
参考答案:金属13、根据鲍林规则,估计HOCl的p K a 值为()。
参考答案:≥ 714、[Fe(H2O)6]Cl3为高自旋配合物,根据晶体场理论,中心离子的电子排布为()。
参考答案:t2g3 e g215、二、三过渡系,称为()过渡元素。
参考答案:重单项选择题16、下列物种中,属于N2H5+的共轭碱是()。
.NH3.N2H4.N2H62+.N2H5OH17、按酸碱质子理论,下列分子或离子中为碱的是()。
.SbF5.NaAc.AlCl3.Ac -18、在[Co(NH3)4Cl2]中,Co的氧化数为()。
.0.+1.+2.+319、已知配合物[Pt(NH3)2(NO2) Cl]的空间构型为平面正方形,它的几何异构体数目为()。
. 1. 2. 3. 520、下列不是π-酸配体的是()。
中级无机化学1-5章年习题答案

无机化学习题参考答案第一章1.4.解:〔1〕H 2O 22C〔2〕S 2O 32- 3v C 〔3〕N 2O (N -N -O 方式) v C ∞〔4〕Hg 2Cl 2h D ∞〔5〕H 2C=C=CH 2 2d D 〔6〕UOF 4 C 5v 〔7〕BF 4-d T 〔8〕SClF 54v C〔9〕反-Pt(NH 3)2Cl 22h D〔10〕PtCl 3(C 2H 4)- 2v C1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
〔BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃〕2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3CH 3PF F H 3CH 3B BH 3F 3(该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和〔6配位〕,失去Lewis 酸性4. 吸水后失效 的AlCl 3有什么方法可以脱水?因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。
〔只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用复原氯化法制备,这就不是脱水方法了〕。
第二章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期〔分裂能小〕第六周期〔分裂能大〕P Ni ClP ClClCl P Ptrans cis四面体构型 平面四方形构型〔两种构型〕 只有一种结构 〔P 代表PPh 3〕2.2 解 〔1〕MA 2B 4〔2〕MA 3B 3M A ABB M ABA BM ABAB M A AA Btrans cis fac(面式) mer(经式) D 4h C 2v C 3v C 2v μ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+33Htrans cisCo(en)(NH3)2Cl2+3Cl333NHNH33trans(1) trans(2)cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
《中级无机化学》试题及答案
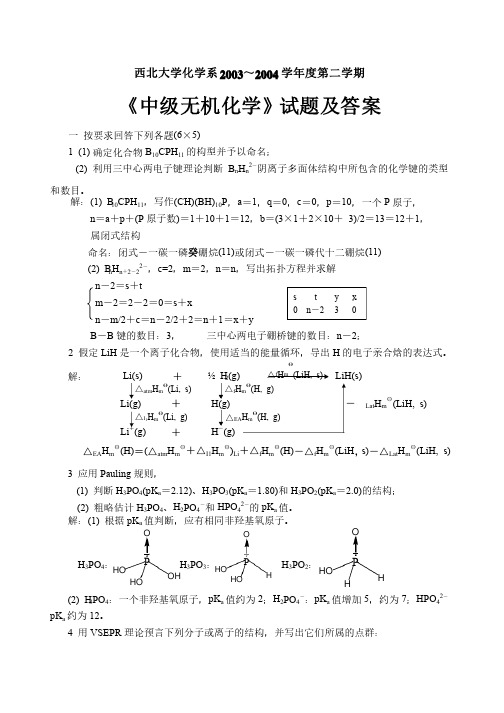
西北大学化学系2003~2004学年度第二学期《中级无机化学》试题及答案一 按要求回答下列各题(6×5)1 (1) 确定化合物B 10CPH 11的构型并予以命名;的构型并予以命名;(2) 利用三中心两电子键理论判断B n H n 2-阴离子多面体结构中所包含的化学键的类型和数目。
和数目。
解:(1) B 10CPH 11,写作(CH)(BH)10P ,a =1,q =0,c =0,p =10,一个P 原子,原子,n =a +p +(P 原子数)=1+10+1=12,b =(3×1+2×10+ 3)/2=13=12+1,属闭式结构属闭式结构命名:闭式-一碳一磷癸硼烷(11)或闭式-一碳一磷代十二硼烷(11)(2) B n H n +2-22-,c=2,m =2,n =n ,写出拓扑方程并求解,写出拓扑方程并求解n -2=s +tm -2=2-2=0=s +xn -m/2+c =n -2/2+2=n +1=x +y B -B 键的数目:3, 三中心两电子硼桥键的数目:n -2;2 假定LiH 是一个离子化合物,使用适当的能量循环,导出H 的电子亲合焓的表达式。
解:解: Li(s) + ½ H 2(g)LiH(s) Li(g)+ H(g) -△Lat H m θ(LiH, s)Li +(g) + H -(g) △EA H m θ(H)=(△atm H m θ+△I 1H m θ)Li +△f H m θ(H)-△f H m θ(LiH ,s)-△Lat H m θ(LiH, s) 3 应用Pauling 规则,规则,(1) 判断H 3PO 4(pK a =2.12)、H 3PO 3(pK a =1.80)和H 3PO 2(pK a =2.0)的结构;的结构;(2) 粗略估计H 3PO 4、H 2PO 4-和HPO 42-的pK a 值。
值。
解:(1) 根据pK a 值判断,应有相同非羟基氧原子。
北京大学中级无机化学答案

无机化学习题参考答案(II) 1.4.解:(1)H2O22C(2)S2O32-3vC(3)N2O (N-N-O方式)vC∞(4)Hg2Cl2hD∞(5)H2C=C=CH22dD(6)UOF4C5v(7)BF4-dT(8)SClF54vC(9)反-Pt(NH3)2Cl22hD(10)PtCl3(C2H4)-2vC1.B(CH3)3和BCl3相比,哪一个的Lewis 酸性强,为什么?一般来说,CH3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。
(BCl3易水解;B(CH3)3不溶于水,在空气中易燃)2.BH3和BF3都可和(CH3)2NPF2生成加合物,在一种加合物中,B原子和N相连,另一种则和P相连,绘出两种结构式,并说明形成两种结构的原因。
(该题可参考史启桢等翻译的"无机化学",作者Shriver等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容)3. 无水AlCl3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在?配位饱和(6配位),失去Lewis酸性4. 吸水后失效的AlCl3有什么方法可以脱水?因为Al3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl,NH4Cl,SOCl2等气氛下加热脱水。
(只能加强热生成 Al2O3后,用高温下用加C和Cl2用还原氯化法制备,这就不是脱水方法了)。
第二章2.1 解:Ni2+ d8组态Pt2+ d8组态第四周期(分裂能小)第六周期(分裂能大)trans cis 四面体构型平面四方形构型(两种构型)只有一种结构(P代表PPh3)2.2 解(1)MA2B4(2)MA3B3trans cis fac(面式) mer(经式)D 4h C 2v C 3v C 2vμ=0 μ≠0 μ≠0 μ≠0μfac >μmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+trans cis Co(en)(NH 3)2Cl 2+trans(1) trans(2) cis 2.4 Co(en)33+Ru(bipy)32+手性分子D 3D 3PtCl(dien)+dien HNCH 2CH 2CH 2NH 2NH 2CH 2基本上为平面分子,无手性2.5 (1) 分别用BaCl 2溶液滴入,有白色沉液出现的为[Co(NH 3)5Br]SO 4,或分别加入AgNO 3溶液,产生浅黄色沉淀的为[Co(NH 3)5SO 4]Br 。
15秋福师《中级无机化学专题》在线作业二 答案

福师《中级无机化学专题》在线作业二一、单选题(共 45 道试题,共 90 分。
)1. 下列关于硼烷的说法不正确的是. 硼烷在常温和常压下大多数为液体或固体. 2H6和4H10是气体. 乙硼烷遇水发生水解,生成硼酸和氧气. 硼烷燃烧时放出大量的热,并生成2O3和H2O正确答案:2. 人体中最丰富的过渡金属是. o. F. Ni. u正确答案:3. 下列锰的化合物中,锰的氧化数最低的化合物是( ). HMn(O)5. Mn(NO)3(O). Mn2(O)10. H3Mn(O)5正确答案:4. 根据路易斯酸碱理论,在u2+ + 4NH3 = u(NH3)42+【方程式左边的3和右边3,4为下标,2+为上标】的反应中,属于酸的物质是(). u2+【2+为上标】. u(NH3)42+【3,4为下标,2+为上标】. NH3【3为下标】. 以上都不是正确答案:5. N规则是说. 金属原子的价层电子数加上配位体所提供的配位电子总数之和等于8时,化合物较稳定. 金属原子的价层电子数加上配位体所提供的配位电子总数之和等于18时,化合物较稳定. 金属原子电子数加上配位体所提供的电子数之和等于18时,化合物较稳定. 金属原子电子数加上配位体所提供的电子数之和等于8时,化合物较稳定正确答案:6. 制备烯烃配合物的主要方法不包括(). 还原配位. 烷基配体的β-阴离子消除. 热分解法. 配位体的取代正确答案:7. 下列说法不正确的是(). 碱金属的活泼性:Li>K>N. 金属的活泼性:Ⅰ<Ⅱ,这与金属原子的活泼性不一致. 金属活泼性是Zn>u. 金属活泼性的相对大小,也可以通过计算来确定正确答案:8. 大气中的氮氧化物主要是. NO 和N2O5. NO2 和N2O. NO和NO2. N2O3 和NO2正确答案:9. 人们首次利用人工核反应合成自然界未发现的新元素是(). Hn.. Np. m正确答案:10. 关于反应SF5 + KF → KSF6,下列说法正确的是【其中数字为下标】(). 该反应可以用质子理论来解释. 该反应是酸碱中和反应,可用溶剂理论来解释. 该反应不是酸碱中和反应,因为没有质子的转移. 该反应不能用质子理论来解释,从溶剂理论观点看,没有生成溶剂的特征阴离子和阳离子,所以不是酸碱中和反应正确答案:11. 根据质子理论,下列水溶液中,碱性最弱的离子是. NO3-【其中数字和负号为上标】. lO4-【其中数字和负号为上标】. O32-【其中2和负号为上标,3为下标】. SO42-【其中2和负号为上标,4为下标】正确答案:12. 根据W规则,o6(O)16的结构应属于. 三角双锥. 四面体. 五角双锥体. 八面体正确答案:13. 化合物[o(NH3)4l2]r的名称是( )【其中数字为下标】. 溴化二氯四氨钴酸盐(Ⅱ). 溴化二氯四氨钴酸盐(Ⅲ). 溴化二氯四氨络钴(Ⅱ). 溴化二氯四氨络钴(Ⅲ)正确答案:14. 关于反应SF5 + KF → KSF6,下列说法正确的是【其中数字为下标】. 该反应可以用质子理论来解释. 该反应是酸碱中和反应,可用溶剂理论来解释. 该反应不是酸碱中和反应,因为没有质子的转移. 该反应不能用质子理论来解释,从溶剂理论观点看,没有生成溶剂的特征阴离子和阳离子,所以不是酸碱中和反应正确答案:15. 缺陷在晶体中延伸范围和形状分类中不包括. 点缺陷. 线缺陷. 面缺陷. 体缺陷正确答案:16. uSO4 . 5H2O中,中心离子的配位数是. 5. 4. 3. 2正确答案:17. M为中心原子,下列配合物中有顺反异构体的是( ). M2(平面四方). M3. M2(四面体). M2(平面三角形)正确答案:18. 制备烯烃配合物的主要方法不包括. 还原配位. 烷基配体的β-阴离子消除. 热分解法. 配位体的取代正确答案:19. 下列不符合硼烷通式的是(). 2H6. 4H10. 6H10. 8H20正确答案:20. 量子尺寸效应不包括(). 宽频带强吸引. K360的超导性. 纳米微粒的发光效应. 蓝移现象正确答案:21. 将浓度相同的Nl,NH4,N和NN溶液,按(H+)从大到小排列顺序为( ). Nl>N>NH4>NN. N>Nl≈NH4>NN. Nl≈NH4>N>NN. NN>N>Nl≈NH4正确答案:22. 下列疾病是由于体内缺硒引起的是(). 地方性甲状腺肿. 克山病. 骨痛病. 夜盲症正确答案:23. 下列离子中半径最小的是【其中数字和正号为上标】(). R+. S3+. Ti4+. Ti3+正确答案:24. 下列命名不正确的是【其中数字为下角标】. 2H6:乙硼烷. 5H9:巢式- 己硼烷. 20H26:蛛网式 - 二十硼烷. 10H14:巢式 - 癸硼烷正确答案:25. 下列命名错误的是(). H2[SiF6] 六氟合硅酸. K4[F(N)6]六氰合铁酸钾. [u(NH3)4]SO4四氨合硫酸铜. [g(NH3)2]OH 氢氧化二氨合银(Ⅰ)正确答案:26. 关于二茂铁的说法不正确的是. 二茂铁为一稳定的橙黄色晶体. 溶于苯等有机溶剂. 易溶于水. 是最早合成并确证的金属夹心型配合物正确答案:27. 在标准条件下石墨燃烧反应的焓变为-393.6kJ/mol,金刚石燃烧反应的焓变为-395.6kJ/mol,则石墨转变成金刚石的焓变为(). -789.3kJ/mol. 0kJ/mol. 1.9kJ/mol. -1.9kJ/mol正确答案:28. 区元素同一族中的第五周期和第六周期元素原子半径非常接近,这主要是由于(). 惰性电子对效应. 价电子构型相似. 它们都是金属元素. 镧系收缩的影响正确答案:29. 关于路易斯酸碱理论,下列说法不正确的是【其中数字和正号为上标】. 是为了说明不含质子的化合物的酸性而提出的. 路易斯酸也叫电子对接受体,路易斯碱也叫电子对给予体. 所有的缺电子物种都可以表现为路易斯酸,所有的富电子物种都可以表现为路易斯碱. Ni2+、o2+、u2+、F3+、Zn2+、r3+、l3+等是比较弱的路易斯酸正确答案:30. 下列关于酸碱强度的说法,不正确的是()【其中数字为下标】. 多聚酸通常比相应的简单酸酸性强. 对于同一周期的各元素所生成的最高氢氧化物,电负性增加和氧化态增高都促使氢氧化物的酸性增强. 当卤素原子的电负性增高时,次卤酸的酸强度随之减弱. 各种基团对于HOX、NH2X和H3X三种酸的酸强度影响大小次序是相同的正确答案:31. 下列配离子属于低自旋的是. Mn(OH2)62+【其中2+为上标】. F(OH2)63+【其中最后的3+为上标】. F(OH2)62+【其中2+为上标】. o(H2O)63+【其中最后的3+为上标】正确答案:32. 如果发现第115号元素,应该位于元素周期表的什么位置. 第八周期Ⅴ族. 第七周期Ⅳ族. 第七周期Ⅴ族. 第七周期Ⅵ族正确答案:33. 下列基团不能取代羰基的是【其中数字为下标,符号为上标】. PF3. R3P. P15. r-正确答案:34. 关于Frnkl缺陷说法不正确的是. Frnkl缺陷属于点缺陷. 是一种整比缺陷. 氯化银(具有Nl晶体结构)晶体中主要存在这类缺陷. 是非整比缺陷正确答案:35. 下列关于炔烃配体的配合物的说法正确的是(). 这种M与=键的结合,相当于M与=的两个原子生成三原子环,从而增强了炔烃的稳定性. 炔烃分子既可提供一对π电子也可提供两对π电子与金属离子成键. M与=键的结合,相当于M与=的两个原子生成三原子环,使炔烃的化学活性减弱. 炔烃也可以和任何金属生成配合物正确答案:36. 根据酸碱质子理论,下列物质不属于两性物质的是( ). HS-. H2O. NH4+. H2PO4-正确答案:37. 金属有机化合物的通式可表示为:MnLm,下列表述不正确的是(). M代表金属原子. L代表配体. L可以是中性的分子. L不能是离子正确答案:38. 按照软硬酸碱理论,下列物质属于硬酸的是. N+. g+. F-. OH-正确答案:39. 由热力学原因而存在的缺陷叫做( ). 固有缺陷. 外赋缺陷. 非整比缺陷. 杂质缺陷正确答案:40. 化合物[o(NH3)4l2]r的名称是【其中数字为下标】(). 溴化二氯四氨钴酸盐(Ⅱ). 溴化二氯四氨钴酸盐(Ⅲ). 溴化二氯四氨络钴(Ⅱ). 溴化二氯四氨络钴(Ⅲ)正确答案:41. 根据晶体场理论,在一个八面体强场中,中心离子电子数为多少时,晶体场稳定化能最大(). 9. 6. 5. 3正确答案:42. Shottky缺陷是指(). 一个原子移出它的晶格位置,留下一个空位,进入一个通常是空着的间隙位置. 氯化银(具有Nl晶体结构)晶体中主要存在的一类缺陷. 离子性晶体中的整比缺陷. 人们为了某种目的,人为地往晶体中掺入杂质所形成的缺陷正确答案:43. 下列配离子属于低自旋的是(). Mn(OH2)62+【其中2+为上标】. F(OH2)63+【其中最后的3+为上标】. F(OH2)62+【其中2+为上标】. o(H2O)63+【其中最后的3+为上标】正确答案:44. 金属羰基化合物的特点不包括. O并不是很强的路易斯碱,但它却能跟金属形成很强的化学键. 在这类配合物中,中心原子M呈现较低的氧化态,通常为零,也有时呈现较低的正氧化态,甚至负氧化态. 金属羰基化合物一般不稳定. 这些配合物大多数服从有效原子序数规则正确答案:45. 下列关于硼烷的说法不正确的是(). 硼烷在常温和常压下大多数为液体或固体. 2H6和4H10是气体. 乙硼烷遇水发生水解,生成硼酸和氧气. 硼烷燃烧时放出大量的热,并生成2O3和H2O正确答案:福师《中级无机化学专题》在线作业二二、判断题(共 5 道试题,共 10 分。
中级无机化学试题及答案

中级无机化学试题及答案一、选择题(每题2分,共20分)1. 下列元素中,哪一个是过渡金属?A. 铁B. 碳C. 氧D. 钠答案:A2. 以下化合物中,哪一个是共价化合物?A. NaClB. HClC. MgOD. Fe答案:B3. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D4. 哪个元素的原子序数是26?A. 铁B. 钴C. 镍D. 锌答案:C5. 以下哪个元素是碱土金属?A. 锂B. 铍C. 钙D. 钡答案:C6. 哪种类型的键是离子键?A. NaCl中的键B. HCl中的键C. O2中的键D. C2H4中的键答案:A7. 以下哪个化合物是超酸?A. HClB. H2SO4C. H3PO4D. H2S答案:B8. 哪个元素属于卤素?A. 氟B. 氯C. 溴D. 碘答案:B答案:A, B, C, D9. 以下哪种化合物是金属有机化合物?A. 四氯化碳B. 四氯化钛C. 四氯化锆D. 四氯化铌答案:B10. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D二、填空题(每题2分,共20分)11. 过渡金属元素通常位于周期表的________区和________区。
答案:d区和f区12. 根据八隅体规则,碳原子最多可以形成________个共价键。
答案:413. 金属键是由________和________之间的相互作用形成的。
答案:金属离子和自由电子14. 元素周期表中,第________周期是最长的周期。
答案:六15. 元素的电负性越大,其非金属性越________。
答案:强16. 金属晶体的堆积方式主要有简单立方堆积、体心立方堆积和________堆积。
答案:面心立方17. 碱金属元素位于周期表的________族。
答案:一18. 元素的原子半径随着原子序数的增加而________(增大/减小)。
中级无机化学习题答案

中级无机化学习题答案。
子原氧基羟非同相有应断判值aKp据根)1( 答解7为约5加增值aKp-4OP2H 2为约值aKp 子原氧基羟非个一4OP3H 2 。
21为约aKp-24OPH案答考参题习后课章一第碱斯易路是些哪酸斯易路是些哪中物合化列下.1 2lCnS 2)3ON(gH OC 2OC 2lCeB 3HP -4HB2lCnS 2)3ON(gH OC 2OC 2lCeB 酸斯易路答解2lCnS OC 3HP 碱斯易路碱轭共和酸轭共的种物列下出写.2-4OSH IH O2H 2HN 2HN碱轭共酸轭共答解-2HN +4HN 3HN-2HN 3HN -2HN -HO +O3H O2H-I IH -24OS 4OS2H -4OSH。
由理明说并强较性酸个一哪中对各列下.3+3]6)O2H(aG[和+3]6)O2H(lA[ )b( +2]6)O2H(eF[和+3]6)O2H(eF[ )a( 4OlCH和3OlCH )d( 4)HO(eG和4)HO(iS )c( 4OS2H和4OP3H )f( 4OnMH和4OrC2H )e(+2]6)O2H(eF[和+3]6)O2H(eF[ )a( 答解大力能子电引吸高荷电子离心中者前性酸斯易路解离易+H 大力能化极的O对高荷电子离心中者前性酸子质+3]6)O2H(aG[和+3]6)O2H(lA[)b(低量能道轨d 小径半子离心中者前性酸斯易路解离易+H 大力能化极的O对小径半子离心中者前性酸子质4)HO(eG和4)HO(iS )c(低量能道轨d 小径半子离心中者前性酸斯易路解离易+H 大力能化极的O对小径半子离心中者前性酸子质4OS2H和4OP3H )f( 4OnMH和4OrC2H )e( 4OlCH和3OlCH )d( 。
强越性酸多子原氧基羟非者后为均则规gniluaP 用应.4构结的)0.2=aKp(2OP3H 和)08.1=aKp(3OP3H、)21.2=aKp(4OP3H断判)1( 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
西北大学化学系2003~2004学年度第二学期《中级无机化学》试题及答案一 按要求回答下列各题(6×5)1 (1) 确定化合物B 10CPH 11的构型并予以命名;(2) 利用三中心两电子键理论判断B n H n 2-阴离子多面体结构中所包含的化学键的类型和数目。
解:(1) B 10CPH 11,写作(CH)(BH)10P ,a =1,q =0,c =0,p =10,一个P 原子,n =a +p +(P 原子数)=1+10+1=12,b =(3×1+2×10+ 3)/2=13=12+1,属闭式结构命名:闭式-一碳一磷癸硼烷(11)或闭式-一碳一磷代十二硼烷(11)(2) B n H n +2-22-,c=2,m =2,n =n ,写出拓扑方程并求解n -2=s +tm -2=2-2=0=s +xn -m/2+c =n -2/2+2=n +1=x +y B -B 键的数目:3, 三中心两电子硼桥键的数目:n -2;2 假定LiH 是一个离子化合物,使用适当的能量循环,导出H 的电子亲合焓的表达式。
解: △Lat H m θ(LiH, s)△EA H m θ(H)=(△atm H m θ+△I 1H m θ)Li +△f H m θ(H)-△f H m θ(LiH ,s)-△Lat H m θ(LiH, s)3 应用Pauling 规则,(1) 判断H 3PO 4(pK a =2.12)、H 3PO 3(pK a =1.80)和H 3PO 2(pK a =2.0)的结构;(2) 粗略估计H 3PO 4、H 2PO 4-和HPO 42-的pK a 值。
解:(1) 根据pK a 值判断,应有相同非羟基氧原子。
H 3PO 4: H 3PO 3: H 3PO 2:(2) H 3PO 4:一个非羟基氧原子,pK a 值约为2;H 2PO 4-:pK a 值增加5,约为7;HPO 42-pK a 约为12。
4 用VSEPR 理论预言下列分子或离子的结构,并写出它们所属的点群: f m θP H HO HO P OH HO HO P H HO HSnCl2SnCl3-ICl2-ICl4-GaCl3TeF5-解:SnCl2SnCl3-ICl2-ICl4-GaCl3TeF5-BP= 2 3 2 4 3 5LP=(4-2)/2=1 (4+1-3)/2=1 (7+1-2)/2=3 (7+1-4)/2=2 (3-3)/2=0 (6+1-5)/2=1 VP= 2 4 5 6 3 6 AB2L1AB3L1AB2L3AB4L2AB3AB5L1V形三角锥直线平面四边形三角形四方锥C2V C3V D∞h D4h D3h C4V5 请用热力学的观点阐明非极性溶质易溶于非极性溶剂(相似相溶)的原因。
解:一种物质溶解时的自由能变△G(溶)=△H(溶)-T△S(溶)即物质的溶解情况取决于溶解时的焓效应和熵效应。
当非极性的溶质溶于非极性溶剂时,溶质与溶剂之间除色散力以外,没有其他的力存在。
色散力是分子间力,数值很小,这就使得溶解过程焓效应很小。
然而,在溶解过程中,因为溶质的分散,溶剂与溶剂之间的弱相互作用被溶质所破坏,使得原来溶质分子之间的有序状态和溶剂分子之间的有序状态都被解体,因而溶解过程是熵增的过程。
熵增有利于溶解,所以非极性溶质在这类溶剂中的溶解度一般比较大。
二请按要求回答下列问题(8×5)1 CO与N2互为等电子体,但为什么后者与过渡金属所生成的配合物不如前者多?为什么双氮配合物的形成是活化氮分子的重要途径?答:同CO相比,N2最高占有轨道的能量比CO低,所以N2是一个较差的σ电子给予体,它给出电子形成σ配键的能力远比CO弱; 另一方面, N2分子的最低未占据空轨道的能量又比CO的高, 所以N2接受金属d电子形成反馈π键的能力也不如CO强。
因此,N2分子配合物的稳定性比金属羰基化合物差,生成的N2分子配合物的数量也远比羰基化合物少。
在N2分子与金属以σ-π键配位后,由于生成了σ键,N≡N之间的成键电子密度减小,而在形成反馈π键时,N2分子的反键轨道中又加入了电子,这意味着降低了N2的键级,所以使N2得到了一定程度的活化。
2试绘出Co(NH3)63+配离子的分子轨道能级图,指出配离子生成前后的电子排布,并联系晶体场理论在能级图上标明分裂能△的位置;答:Co(NH3)63+配离子的分子轨道能级图、配离子生成前△后的电子排布及分裂能△在图中的位置见右图。
3以M(CO)n为例说明为什么CO配位将产生较大的分裂能因而在光谱化学序中CO排在后面;解:CO能同金属形成属于M(t2g)-L(π*)类型的反馈π键。
但因CO的空反键分子轨道的能量较高, 所以π成键使金属的t 2g 轨道成为成键的π分子轨道从而能量降低,结果造成分裂能增大。
所以CO 在光谱化学序中CO 排在后面;4 Pt(NH 3)2Cl 2有两种异构体A 和B ,当A 与硫脲(tu)反应时,生成[Pt(tu)4]2+;B 与硫脲反应时,则生成[Pt(NH 3)2(tu)2]2+。
问A 和B各是什么异构体?为什么?答:A 是顺式异构体和B 是反式异构体。
5 根据EAN 规则,画出Mn 2(CO)10和Co 2(CO)8的结构(提示:前者有一个吸收带,后者有两个吸收带)。
答:按照18电子规则, Mn 2(CO)10有2×7+10×2=34个电子,平均每个Mn 有17个电子,可以预料在他们的分子中必定存在有一条Mn -Mn 金属键,由于Mn 2(CO)10只有一个吸收带,故其CO 应全为端羰基。
在成键时锰进行了d 2sp 3杂化,有六条杂化轨道。
其中5条用以接受来自五个羰基配体的孤对电子,其中还有一条已充填有一个单电子的d 2sp 3杂化轨道与另一个锰原子的同样的轨道重叠形成Mn -Mn 键。
其结构见下左。
由于Co 2(CO)8的价电子数为2×9+8×2=34,平均每个Co 也有17个电子,预期他们中也存在一条金属键,由于Co 2(CO)8有两个吸收带,其CO 分别应为端羰基和桥羰基。
对每一个钴,它的配位数也应是 6,也应是d 2sp 3杂化轨道成键。
从配位数出发,可推断在一个钴的周围有5个羰基和一个钴原子,在5个羰基中3个端羰基两个为桥羰基(3+2/2=4)。
又由于d 2sp 3杂化轨道之间的夹角为90°,可以预料,两个金属必须以弯曲的方式才能进行d 2sp 3-d 2sp 3轨道的重叠。
其结构见上图右。
三 指出在下列配合物中,哪些存在金属-金属四重键。
(2×4)K 2Re 2Cl 8 (NH 4)2Tc 2Cl 8 Re 2Cl 4(PEt 3)4 Mo 2Cl 4(PEt 3)4答:K 2Re 2Cl 8:[2×(7-3)+8×2]/2=12,要满足16e ,差4个电子,故有; Cl Pt NH 3NH 3Cl tu 3Cl Pt NH 3Cl tu tu>Cl tu Pt NH 3tu Cl tu 3tu Pt Cl tu tu Pt tu tu tu Cl Pt H 3N NH 3Cl tu Cl>3tu Pt H 3N NH 3Cl tu tu Pt H 3N NH 3tu (B) (A)OC Mn Mn CO CO CO CO CO COCOCOCO(NH4)2Tc2Cl8:[2×(7-3)+8×2]/2=12,要满足16e,差4个电子,故有;Re2Cl4(PEt3)4:[2×(7-2)+8×2]/2=13,要满足16e,差3个电子,故无;Mo2Cl4(PEt3)4:[2×(6-2)+8×2]/2=12,要满足16e,差4个电子,故有;四在Ni(H2O)62+的光谱图上可观察到9000、14000和25000 cm-1的吸收带,参见右面Orgel图,指出它们对应于何种谱项间的跃迁?计算D o和B’。
(12)解:[Ni(H2O)6]2+, d8组态, 八面体, 可使用上图的左边部分进行计算,其基态为3A2g,自旋允许的跃迁是:3A→3T2g,3A2g→3T1g(F),3A2g→3T1g(P)2g9000cm-114000cm-125000cm-13A→3T2g,ν1=9000cm-1, 相应于O h场中的分裂能,2g于是D o=10D q=9000cm-1,D q=900cm-1,由3A2g→3T1g(F),ν2=14000cm-1=18D q-C,由此得C=18×900-14000=2200cm-1;由3A2g→3T1g(P), ν3=12D q+15B’+C=25000cm-1B’=(25000-12×2200-900)/15=800cm-1五在鉴定NO3—和NO2—时,通常使用“棕色环”反应,“棕色环”是铁的低氧化态八面体配合物[Fe(NO)(H2O)5]2+(SO4)2-,研究表明,该化合物有三个单电子且三个单电子全来源于高自旋的铁。
根据这些信息,请描述该配合物的配位情况,包括配体的形示、中心离子的价态和电子排布以及成键情况等。
(10)解:根据化合物有三个单电子且三个单电子全来源于高自旋的铁,可知铁应为Fe+,电子排布t2g5e g2,NO是以NO+离子配位(NO为三电子配体,应有一个单电子,已知单电子全来源于Fe,故推知为NO+),NO+作为类羰基配位体,以N上的孤电子对与Fe+进行σ配位,同时NO+以其反键π分子轨道接受来自Fe+的反馈d电子生成反馈π键,此外,五个水分子同Fe+进行正常的σ配位。
NO+同Fe+进行的σ-π协同成键的结果使得这个棕色配合物十分稳定。
