理想气体实验定律共34页
气体定律

气体定律物质的状态在一定温度和压力下,物质总是以一定的聚集状态存在。
即存在为气态、液态或固态,条种状态都各有其特性。
在一定条件下,物质总是以一定的聚集状态参加化学反应的。
物质的状态对其化学行为是有重要影响的。
对于给定的反应,由于物质的状态不同,反应的速度和反应的能量关系也有所不同,还会影响反应条件。
本章将叙述气体的特性。
气体的特征是具有扩散性和压缩性。
将气体引入任何大小的容器中,由于气体分子的能量大,分子间引力小,分子在作无规则地运动,因而能自动扩散充满整个容器。
因此,气体没有一定的体各和形状。
又因为气体分子间的空隙很大,对气体加压,其体积就缩小。
同时气体还受到温度、气体的量的影响。
通常一定量的气体所处状态可以用压力、体积、温度来描述。
而反应这四个量的关系的式子就是气体的状态方程式。
理想气体的状态方程一般气体,在密度不太高、压强不太大和温度不太低的实验范围内,遵守玻意耳定律、盖-吕萨克和查理定律。
应该指出,对不同气体来说,这三条定律的适用范围是不同的,不易液化的气体,例如氮气、氢气等适用的范围比较大,而氨气的适用范围就要小得多。
实际上在任何情况下都服从上述三条理论定律的气体是没有的。
我们把实际气体抽象化,提出理想气体的概念,认为理想气体能无条件地服从这三条定律。
在这种情况下,理想气体的状态函数p、V、T之间的关系即理想气体的状态方程。
可以从这三条定律导出当物质的量为n的理想气体处于平衡态时,它的状态方程就是:其中包括了气体的三个状态量:p——压强;V——体积;T——气体的热力学温度。
这个方程就是理想气体的状态方程,只有理想气体才完全遵守这个关系式。
而对于真实气体,必须考虑到分子间的作用力和分子本身体积,将理想气体状态方程式修正后才能应用。
现在我们要关心的问题是式中的常数R,要应用这个方程必须要求出R.这个常数被称为气体常数,它是由实验测得的。
将具有一定物质的量的气体的三个状态量,即压强、体积和温度代入方程就可以求出气体常数。
气体定律实验题探索理想气体状态方程

气体定律实验题探索理想气体状态方程本实验旨在探究理想气体的状态方程,对气体定律进行实验验证,通过实验数据分析,得出实验结果并对理论做出合理解释。
通过本实验的实施,可以深入理解理想气体状态方程的基本原理以及与实验结果的关系。
实验材料与仪器:1. 气缸:用于封闭气体和调节气压。
2. 活塞:用于调节气缸的体积。
3. 温度计:用于测量气体的温度。
4. 压强计:用于测量气体的压强。
5. 大气压力表:用于测量环境的压强。
实验过程:步骤一:准备工作1. 将气缸清洗干净,并与温度计、压强计连接好。
2. 将气缸与大气压力表连接,用于测量环境的压强。
步骤二:探索压强与体积关系1. 调节气缸的活塞,使气缸体积变化,在每次变化后等待气缸内温度恢复平衡。
2. 同时记录下气缸的体积和相应的压强。
步骤三:探索温度与压强关系1. 固定气缸的体积。
2. 调节气缸内气体的温度,等待温度稳定。
3. 同时记录下温度和相应的压强。
数据记录与分析:根据实验过程中所记录的数据,我们可以绘制压强与体积、温度与压强的曲线图。
通过数据的分析,试图归纳出气体状态方程的表达形式。
结果与讨论:基于所获得的实验数据,我们可以得出以下结论:1. 压强与体积的关系符合玛丽特定律,即压强与体积成反比关系。
2. 温度与压强的关系符合查理定律,即温度与压强成正比关系。
3. 结合理想气体状态方程,我们可以得出P×V/T = R(其中P代表压强,V代表体积,T代表温度,R为气体常数)的表达形式。
结论:通过本实验的实施以及对实验数据的分析,我们探索了理想气体的状态方程,并验证了气体定律的准确性。
实验结果与理论相吻合,表明理想气体状态方程的适用范围广泛,并能够准确描述气体的行为。
总结:本实验通过实验验证与数据分析,详细探讨了理想气体状态方程以及气体定律的实验证明。
实验结果的准确性证明了理想气体状态方程的可靠性,对于进一步研究气体行为以及应用于相关领域具有积极的推动作用。
理想气体

盖·吕萨克定律:一定质量的气体,在压强不变的条件下, 温度每升高(或降低)1℃,它的体积的增加 (或减少)量等于0℃时体积的1/273。即V1/T1=V2/T2=C2(常量)。
2.两平衡状态间参数的计算
3.标准状态与任意状态或密度间的换算
4.气体体积膨胀系数
理想气体对外膨胀可以分为两种情况:一、理想气体周围有其他物体。二、理想气体自由膨胀,即周围没有 其他物体。第一种情况下,理想气体做功。第二种情况下,不做功。如果两个容器相连,其中一个容器内充满理 想气体,另一个容器内是真空,将两个容器相连后理想气体膨胀充满两个容器,此时,理想气体不做功,且选取 任何一个中间过程也不做功。一般情况下,如不做特别说明,则认为气体对外膨胀做功。
谢谢观看
综合以上三个定律可得pV/T=常量,这个称为联合气体方程。在此基础再加上阿伏伽德罗定律定律即V/n=恒 量(n表示摩尔数),得到理想气体状态方程。
说明
模型
高压低温
理想气体是一种理想化的模型,实际并不存在。实际气体中,凡是本身不易被液化的气体,它们的性质很近 似理想气体,其中最接近理想气体的是氢气和氦气。一般气体在压强不太大、温度不太低的条件下,它们的性质 也非常接近理想气体。因此常常把实际气体当作理想气体来处理。这样对研究问题,尤其是计算方面可以大大简 化。
推导
指 的 是 克 拉 伯 龙 方 程 来 源 的 三 个 实 验 定 律 : 玻 ( 意 耳 ) - 马 ( 略 特 ) 定 律 、 查 理 定 律 和 盖 ·吕 萨 克 定 律 , 以 及 直 接结论pV/T=常量。
气体实验定律-PPT课件

C.气体分子平均速率变大
D.单位时间单位面积器壁上受到气体分子撞击的次 数减少
小结:
• 一定质量的气体在等容变化时,遵守查理定 律. 一定质量的气体在等压变化时,遵守盖 · 吕萨 克定律.
•
气体实验定律(Ⅱ)
一、等容过程
1.等容过程:气体在体积不变的情况下发 生的状态变化过程叫做等容过程. 2.一定质量气体的等容变化
演示:
• 如图所示,研究瓶中一 定质量的气体,先使U 型管中两侧水银液面等 高,在左侧液面处标上 标记P,然后改变瓶内 气体温度(可分别放入 热水和冰水中),上下 移动A管,使左侧水银 面保持在P处(即使瓶 中气体体积不变).
4.等容线 ( l )等容线:一定质量的某种气体在等容变化 过程中,压强p跟热力学温度 T的正比关系 p- T在直角坐标系中的图象叫做等容线. (2)一定质量气体的等容线 p- T图象,其延长 线经过坐标原点,斜率反映体积大小,如图所 示.
(3)一定质量气体的等容线的物理意义. ①图线上每一个点表示气体一个确定的状态 ,同一根等容线上各状态的体积相 ②不同体积下的等容线,斜率越大,体积越 小(同一温度下,压强大的体积小)如图所 示,V2<V1.
查理定律的微观解释:
一定质量(m)的气体的总分子数(N) 是一定的,体积(V)保持不变时,其单 位体积内的分子数(n)也保持不变,当 温度(T)升高时,其分子运动的平均速 率(v)也增大,则气体压强(p)也增大; 反之当温度(T)降低时,气体压强(p) 也减小。
二、等压过程
1 .等压过程:气体在压强不变的情况下发 生的状态变化过程叫做等压过程. 2.一定质量气体的等压变化.
可得到,气体温度升 高,压强增大;气体 温度降低,压强减小.
气体实验定律及理想气体状态方程的应用PPT课件

典例:如图,一粗细均匀的U形管竖直放置,A侧
上端封闭,B侧上端与大气相通,下端开口处开
关K关闭,A侧空气柱的长度为ɭ1=10.0cm,B侧水 银面比A侧的高h1=3.0cm。现将开关K打开,从U 形管中放出部分水银,当两侧水银面
的高度差h2=10.0cm时将开关K闭合。 已知大气压强P0=75.0cmHg。 (1)求放出部分水银后A侧空气柱的高度ɭ2; (2)此后再向B侧注入水银,使A、B两侧的水
银面达到同一高度,求注入的水银在管内的高度
△h。
【定向导学,分组讨论,合作探究】
通过分组讨论以下问题来理解题意,从而体 会如何寻找的解题的思路及突破口
1、通过读题等效翻译获得的解题信息有哪些? 2、本题的研究对象是一部分气体还是多部分气 体? 3、如何寻找解决第一问的解题思路?即如何找 到解题的难点和突破方法? 4、解决本题第二问时可确定的气体的初态有几 个?最有助于解题的初态是那一个? 5、解决本题第二问时的难点是什么?如何突破 ?
根 据 玻 意 耳 定 律 p 1 V 1 p 1 'V 1 1 代 入 数 据 解 得 p 1 '= 9 0 c m H g
解 : 对 细 管 中 封 闭 气 体
初 态 : p 2p 07 5 cm H g,
V 2l1S1 2 s, T 2
末 态 : p 2 ' p 1 ' p h9 6 cm H g, V 2 ' l2
(1)由如图的U形管可以想起确定封闭气体压强
的方法为 连通器等液面法 。
(2)将粗管管口封闭说明粗管的封闭气体可以作
为 研究对象
。
(3)将细管管口用一活塞封闭说明细管内的封闭
气体也可以作为 研究对象
理想气体实验定律
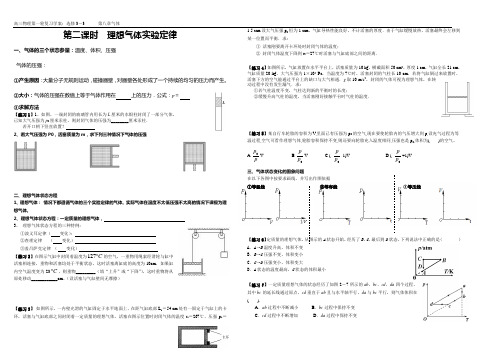
第二课时 理想气体实验定律一、气体的三个状态参量:温度、体积、压强 气体的压强: ①产生原因:大量分子无规则运动,碰撞器壁,对器壁各处形成了一个持续的均匀的压力而产生。
②大小:气体的压强在数值上等于气体作用在 上的压力.公式:p = ③求解方法【练习1】1、如图,一端封闭的玻璃管内用长为L 厘米的水银柱封闭了一部分气体, 已知大气压强为p 0厘米汞柱,则封闭气体的压强为________厘米汞柱. 若开口朝下竖直放置?2、若大气压强为P0,活塞质量为m ,求下列三种情况下气体的压强二、理想气体状态方程1、理想气体: 情况下都遵循气体的三个实验定律的气体。
实际气体在温度不太低压强不太高的情况下课视为理想气体。
2、理想气体状态方程:一定质量的理想气体,3、 理想气体状态方程的三种特例:①波义耳定律( 变化):②查理定律 ( 变化) ③盖吕萨克定律 ( 变化) 【练习2】在图示气缸中封闭着温度为127C ︒的空气,一重物用绳索经滑轮与缸中活塞相连接,重物和活塞均处于平衡状态,这时活塞离缸底的高度为10cm ,如果缸内空气温度变为-23C ︒,则重物_________(填“上升”或“下降”),这时重物将从原处移动____________cm 。
(设活塞与气缸壁间无摩擦)【练习3】 如图所示,一内壁光滑的气缸固定于水平地面上,在距气缸底部L 1=54 cm 处有一固定于气缸上的卡环,活塞与气缸底部之间封闭着一定质量的理想气体,活塞在图示位置时封闭气体的温度t 1=267℃、压强p 1=1.5 atm.设大气压强p 0恒为1 atm ,气缸导热性能良好,不计活塞的厚度.由于气缸缓慢放热,活塞最终会左移到某一位置而平衡.求:① 活塞刚要离开卡环处时封闭气体的温度;② 封闭气体温度下降到t 3=27℃时活塞与气缸底部之间的距离.【练习4】如图所示,气缸放置在水平平台上,活塞质量为10 kg ,横截面积50 cm 2,厚度1 cm ,气缸全长21 cm ,气缸质量20 kg ,大气压强为1×105 Pa ,当温度为7℃时,活塞封闭的气柱长10 cm ,若将气缸倒过来放置时,活塞下方的空气能通过平台上的缺口与大气相通.g 取10 m/s 2,封闭的气体可视为理想气体,在转动过程中没有发生漏气.求:①若气柱温度不变,气柱达到新的平衡时的长度;②缓慢升高气柱的温度,当活塞刚好接触平台时气柱的温度.【练习5】某自行车轮胎的容积为V ,里面已有压强为p 0的空气,现在要使轮胎内的气压增大到p,设充气过程为等温过程,空气可看作理想气体,轮胎容积保持不变,则还要向轮胎充入温度相同,压强也是p 0,体积为( )的空气。
气体实验定律 理想气体
气体实验定律理想气体一、理想气体(1)宏观上讲,把在任何温度、任何压强下都遵从的气体称为理想气体.在压强不太高(不超过大气压的几倍)、温度不太低时(不低于零下几十摄氏度),实际气体可以看做理想气体.(2)微观上讲,理想气体的分子间除碰撞外无其他作用力,因而没有分子势能二、气体的状态参量通常用压强、体积、温度描述一定质量的某种理想气体的状态,这三个物理量称为气体的状态参量.1.气体的压强(1)产生原因:由于气体分子无规则的热运动,大量的分子频繁地碰撞器壁产生持续而稳定的压力.作用在单位面积上的压力叫做气体的压强.(2)决定压强大小的因素从宏观来看,一定质量的气体其压强与气体的和有关.从微观角度说,决定气体压强大小的因素是分子的密集程度及气体分子的.(3)常用单位及换算关系国际单位:帕斯卡,符号:Pa,1 Pa=1 N/m2常用单位:标准大气压(atm);厘米汞柱(cmHg)换算关系:1 atm= cmHg= Pa≈10 m水柱产生的压强2.气体的温度(1)物理意义:宏观上温度表示物体的冷热程度,微观上温度是分子平均动能的标志.(2)国际单位:开尔文,简称开,符号:K(3)热力学温度与摄氏温度的关系:T=t+273.15 K说明:①摄氏温标规定标准大气压下冰的熔点为零度,即0℃,而热力学温标是把摄氏温度的-273.15℃规定为零度,即0K。
所以这两种温标的零度不同,但△T=△t,即每一度的大小是相同的②热力学温度的0K是低温的极限,永远达不到,即热力学温度无负值3.气体的体积气体体积为气体分子所能达到的空间的体积,即气体所充满容器的容积.国际单位:立方米,符号:m3常用单位:升(L)、毫升(mL)换算关系:1 m3=103 L,1 L=103 mL说明:当气体达到平衡态时,容器内各点的压强和温度都不再变化三、三个实验定律1.玻意耳定律(1)数学表达式:p1V1=p2V2或pV=C(常数)(2)微观解释:一定质量的某种理想气体,温度保持不变时,分子的平均动能是一定的。
理想气体(物理化学)
将这三个定律相结合,经过一定的数据处理 参看第三版 参看第三版), 将这三个定律相结合,经过一定的数据处理(参看第三版 ,可 得到理想气体状态方程: 得到理想气体状态方程 pV=nRT 或 pVm=RT 或
m pV = RT M
(R为摩尔气体常数 为摩尔气体常数) 为摩尔气体常数 为气体的摩尔体积) (Vm为气体的摩尔体积) 为气体的相对摩尔质量) (M为气体的相对摩尔质量) 为气体的相对摩尔质量
即混合气的平均摩尔质量是其中所有各组分的摩尔分数与 其摩尔质量乘积之和。
2. 道尔顿定律与分压力 道尔顿定律与分压力(part pressure) 气体的压力是分子对容器器壁碰撞的结果,混合气的压力是 构成该混合气的各组分对压力所作贡献之和, 因此在热力学计 算中,人们提出了一个分压力的概念: 分压力pB:混合气中任一组分对压力所作贡献。 p = ∑ pB 混合气总压力 B 且有 pB = y B p 或 y B =
物理量 ,如上图及下表 如上图及下表: 如上图及下表 单位
p/MPa
…………
………… pVm/J . mol-1 ↑ ↑ 表头中物理量的表示: 物理量 表中均为纯数
单位
低压气体可近似视作为理想气体。 ⑶ 低压气体可近似视作为理想气体。 即低压气体可近似使用理想气体状态方程计算p、T、V 关系。
理想气体的微观模型( ) 二 理想气体的微观模型(p9)
按照分子运动论,理想气体微观模型应该是: 1. 分子间无作用力; 分子间无作用力; 2. 分子本身没有体积 3. 分子不停顿地作无规则的热运动 分子不停顿地作无规则的热运动。 低压气体,气体密度小,分子间距离大,分子间作用 力及分子本身的体积均可忽略,故可当作理想气体处 理。
低压混合气(理想气体混合物) 三 低压混合气(理想气体混合物)(ideal gas mixture)(p11) ( ) 在工业生产中所遇到的气体在很多情况下为混合气体,实 验表明,低压混合气也服从理想气体状态方程,即低压混合气 可视为理想混合气处理
理想气体与热力学第一定律
理想气体与热力学第一定律一、理想气体模型与克拉珀龙方程。
⒈气体实验定律。
玻‐马定律pV = p0V0= C pV查理定律 p = p0(1+αp t)盖·吕萨克定律 V = V0(1+αV t)αp、αV分别为气体压强系数和体胀系数,且αp≈αV≈1/273.15℃⒉克拉珀龙方程。
比较气体实验定律中的查理定律和盖·吕萨克定律,可以很容易地看到共同之处。
如果我们改变温标的零点,令纯水的三相点为273.16K(1K=1℃),αp=αV=1/T0,则p = p0 T/T0V = V0 T/T0即p/T=p0/T0=C pT,V/T=V0/T0=C VT∴pV/T=p0V0/T0= C这样我们就得出了理想气体状态方程,即克拉珀龙方程pV=nRT。
例⒈⑴计算空气泡在水下多深处不会上浮(忽略温度变化)。
⑵试定量分析半杯水加纸盖后翻转的平衡态。
⒊理想气体模型。
实验表明,温度高、压强低的气体与气体实验定律符合得较好。
可以引入一个理想化模型,称为理想气体,它严格服从气体实验定律,且αp=αV=1/273.15℃。
理想气体被描述为这样一群粒子:⑴永不停歇地进行着无规则热运动。
⑵具有无限的可压缩性,即粒子本身的体积忽略不计。
⑶粒子间作用力为零。
⑷粒子不断相互碰撞或与器壁碰撞(产生压力),两次碰撞间粒子做匀速直线运动。
由理想气体模型可以得出理想气体状态方程。
考虑一边长为l的立方体容器,内盛N个质量为m的粒子,其平均速度为u,分子数密度为n*=N/l3。
粒子与器壁碰撞后动量改变量mu-(-mu)=2mu在t时间内与容器某一个面碰撞的粒子数n*utl2/6粒子与器壁碰撞产生压强p=2mu·n*utl2/6tl2=n*mu2/3=2n*(mu2/2)/3=2n*E K/3 粒子平动动能E K=3kT/2∴p=n*kT∵k=R/N A,n*=N/V∴pV=NRT/N A=nRT理想气体模型也可以类比于拥有大量运动粒子的系统,例如所谓的电子气、光子气等;在宇宙尺度上可与星系运动类比。
理想气体的状态方程 课件
答案:(1)330 K (2)1.1p0 (3)见解析图 解析:(1)活塞刚离开 B 处之前的状态变化可看做等容变化。
初状态:p1=0.9p0,T1=297 K,V1=V0;
末状态:p2=p0,T2=TB,V2=V0;
由查理定律p1
T1
=
p2 T2
得
0.9������0 297������
(盖—吕萨克定律)
由此可见,三个气体实验定律是理想气体状态方程的特例。
2.应用理想气体状态方程解题的一般步骤
ቤተ መጻሕፍቲ ባይዱ(1)明确研究对象,即一定质量的气体;
(2)确定气体在始末状态的参量 p1、V1、T1 及 p2、V2、T2;
(3)由理想气体状态方程列式求解;
(4)讨论结果的合理性。
目录 退出
二、气体的状态变化图象
目录 退出
迁移与应用 1
如图所示,粗细均匀、一端封闭一端开口的 U 形玻璃管,当 t1=31 ℃、 大气压强 p0=76 cmHg 时,两管水银面相平,这时左管被封闭的气柱长 L1=8 cm,求:
(1)当温度 t2 是多少时,左管气柱 L2 为 9 cm; (2)当温度达到上问中的温度 t2 时,为使左管气柱长 L 为 8 cm,应在 右管中加入多长的水银柱。 答案:(1)78 ℃ (2)11.75 cm
目录 退出
解析:(1)初状态:p1=p0=76 cmHg,
V1=L1S,T1=304 K; 末状态:p2=p0+2 cmHg=78 cmHg,
V2=L2S,T2=?
根据理想气体状态方程p1V1
T1
=
p2V2 T2
代入数据得 T2=351 K,t2=78 ℃。
(2)设应在左管中加入 h cm 水银
