氟离子选择性电极测定水样中氟离子含量
最新离子选择性电极法测定水样中氟离子的含量

氟元素简介
☺ 人体必需的微量元素之一,可以坚固骨骼和 牙齿,预防龋齿。
轻度氟中毒症状:氟斑牙,牙齿变黄,变黑。 重度氟中毒症状:氟骨症,骨头变形,丧失
劳动和生活自理能力。 一旦中毒,终生成疾。
三、实验步骤
1、仪器的连接 将氟离子选择性电极与饱和甘汞电极分别与酸
直接电位法中加入的一种不含被测离子、不污损电 极的浓电解质溶液,由固定离子强度、保持液接电位稳 定的离子强度调节剂、起pH缓冲作用的缓冲剂、掩蔽干 扰离子的掩蔽剂组成。
NaCl: 0.1mol/L, HAc:0.25mol/L, NaAc0.75 mol/L, 柠檬酸钠 0.001 mol/L pH=5.0, 总离子强度为1.75
四、数据处理
标准曲线法:
绘制E~pF曲线,查出pFx, 则 pF= pFx-1,求出F-的浓度。
一次标准溶液加入法:
CsVs
Cx=
(10△E/S-1)-1 (mol/L)
Vx+Vs
总离子强度调节缓冲溶液(total ionic strength adjustment buffer, TISAB):
度计的接口相连接,开启仪器开关,预热仪器。 2、清洗电极
取二次水50mL置于烧杯中,放入搅拌磁子, 插入氟离子选择性电极与饱和甘汞电极,开动电磁 搅拌器,清洗至读数恒定。
3、用标准曲线法对试样进行测定 A)标准溶液的配制及试样的处理
准确移取pF=1.00的NaF标准溶液5.00mL置于50 mL容量瓶中,加入TISAB 5.00mL, 定容,摇匀,得 pF=2.00的NaF标准溶液。
B)电动势的测定
将标准溶液分别倒入塑料烧杯中,放入搅拌磁子, 插入洗净的两支电极,待读数不变稳定2min后记录电动 势的值。按照浓度由低到高的顺序逐次测定,每测量一 份溶液,无需清洗电极,只需用滤纸沾去电极上的水珠 即可, 分别用E6、E5、E4、E3、E2表示。
氟离子选择电极法测定氟离子的实验报告

分析化学实验报告题目:氟离子选择电极法测定氟离子院系:化学化工学院专业年级:姓名:学号:2015年10月26日离子选择电极法测定氟离子一、实验目的1.了解氟离子选择电极的构造及测定自来水中氟离子的实验条件;2.掌握离子计的使用方法。
二、实验原理1.氟离子选择电极的构造将LaF单晶(掺入微量氟化铕Ⅱ以增加导电性)封在塑料管的一端,管内装0.1mol/L NaF和30.1 mol/L NaCl溶液,以Ag-AgCl电极为内参比电极,构成氟离子选择电极。
-即E与αF-的对数成正比。
氟离子选择电极一般在1-10-6mol/l范围内符合能斯特方程。
2.自来水中氟离子测定的实验条件①氟离子选择电极具有较好的选择性。
常见的阴离子NO3- 、SO4-、PO4-、Ac-、CL -、Br-、I -、HCO3-等不干扰,主要干扰物质是OH-。
产生干扰的原因,很可能是由于在膜表面发生如下反应:LaF3 + 3OH-═ La(OH)3+ 3F-产物F-因电极本身影响造成干扰,使得测量浓度偏小。
而在较高的酸度时由于形成HF-2而使得F-离子活度降低,因此测定时需控制试液PH在5~6之间。
②控制试液离子强度(加入大量电解质如氯化钠等作为掩蔽剂控制离子强度。
原因是:F-与Fe3+,Al3+易形成稳定配合物使氟离子浓度降低。
)综上所述:用氟离子选择电极测定氟离子时,应加入总离子强度调节缓冲溶液(TISAB),以控制试液pH和离子强度以消除干扰。
3.实验意义氟化物在自然界广泛存在,又是人体正常的组织之一,人每日从食物中以及饮食中获取一定量的氟离子。
摄入过量的氟离子,对人体有害,可导致急性,慢性中毒(慢性中毒表现为如氟牙斑釉和氟骨症)。
综合考虑饮用水中氟含量对牙齿的轻度影响,以及对我国广大的高氟区饮水进行除氟或更换水源所负的经济代价,1976年,我国颁布的《生活饮水卫生标准》规定饮用水中氟离子含量不超过1mg/L.4.总离子强度缓冲剂组成:乙酸钠-乙酸、柠檬酸钠、氯化钠作用:控制试液PH、消除干扰、控制离子浓度三、实验仪器与试剂实验仪器:离子计、氟离子选择电极、饱和甘汞电极、电磁搅拌器、100mL容量瓶 7只、100mL烧杯2个、10mL移液管。
离子选择性电极法测定氟离子

自来水中氟含量的测定(氟离子选择性电极法)一、实验目的1、掌握氟离子选择电极测定水中氟离子含量的原理、方法。
2、了解总离子强度调节缓冲溶液的组成和作用。
3、熟悉用标准曲线法和标准加入法测定水中氟的含量。
二、实验原理用氟离子选择性电极测定水样时,以氟离子选择电极作指示电极,以饱和甘汞电极作参比电极,组成的测量电池为氟离子选择性电极︱试液‖SCE如果忽略液接电位,电池的电动势为:E=b-0.0592loga F-即电池的电动势与试液中的氟离子活度的对数成正比。
由此可采用标准曲线法和一次性标准加入法测定氟含量或浓度。
三、仪器与试剂(自己整理)四、实验步骤(自己整理)(1)电极的准备(2)标准曲线制作(3)水样中氟含量的测定①标准曲线法②标准加入法五、实验数据结果处理(自己整理)六、思考题:1用离子选择性电极法测定氟离子时加入TISAB的组成和作用各是什么?2标准曲线法和标准加入法各有何特点,比较本实验用这两种方法测得的结果是否相同,如果不同说明原因。
答:⑴.标准曲线法:可以适用于多次测量,并且要求标准溶液和样品具有恒定的离子强度,并维持在适宜的pH 范围内.调节离子强度所用电解质不应对测定有干扰,调节离子强度的溶液,也常加入适当的络合剂或其他试剂以消除干扰离子的影响。
⑵.标准加入法:是在其他组分共存情况下进行测量的,因此实际上减免了共存组分的影响,古这种方法适合于成分不明或是组成复杂的试样的测定。
标准加入法比标准曲线法操作简便,这两种方法测得的实验结果在排除误差的影响时基本相同。
3为什么控制PH5.0—6.0原因?较高碱度时,主要的干扰物是-OH 。
在膜的表面发生如下反应:-3-33F La(OH)3OH LaF +====+反应产生的氟离子干扰电极的响应,同时使氟离子浓度偏高;在较高酸度时由于形成HF 2-而降低F -的离子活度,测定结果偏低。
离子选择性电极法测定水样中氟离子的含量

离子选择性电极法测定水样中氟离子的含量一、测定目的掌握离子选择电极法的测定原理及测定方法学会正确使用氟离子选择性电极二、测定原理1. 氟电极与饱和甘汞电极组成的电池可以表示为:NaCl(0.3 mol·L-1) ︱AgCl‖F-试液︱LaF3(10-3mol·L-1), NaF(10-3mol·L-1),2. 电池电动势E与氟离子浓度度的关系式为:E=Eo-2.303RT/F·lgc-=Eo-0.059 lgc-E 和lgc-成直接关系,2.303RT/F为直线的斜率,即电极的斜率。
3. 电动势E与lg[F-]成线性关系。
因此作出E对lg[c-]的标准曲线,即可由水样测得的E, 从标准曲线上求得水样中氟离子浓度。
三.仪器与试剂1. 仪器(1)离子计或pH/mV计(PHS-25型酸度计),(2)氟离子选择性电极,(使用前用去离子水浸泡)(3)饱和甘汞电极。
(4)100ml聚乙烯杯每组7个(5)移液管10ml,5ml各一个(6)容量瓶1000ml,100ml,50ml2. 试剂(1)盐酸2mol/L(2)硫酸1.84g/L(3)总离子强度缓冲液(TASBI)。
量取约500ml水于1L烧杯内,加入57毫升冰乙酸,58克氯化钠,和4.0g环乙二胺四乙酸,搅拌溶解,置于冷水浴中并搅拌加入6mol/L氢氧化钠,使pH为5.0---5.5之间,转入1000毫升容量瓶中,稀释至刻线,摇匀。
(4)氟化钠标准溶液,称取0.2210g氟化钠(预先在105—110摄氏度处理2小时或500—650摄氏度处理40分钟,在干燥器内冷却)用去离子水溶液溶解并稀释至1L,摇匀。
储存于聚乙烯瓶中,备用为100ug/mL。
(5)氟化物标准溶液用无分度吸管吸取氟化钠标准储备液10.00ml于100ml容量瓶加去离子水至标线,摇匀储存于聚乙烯瓶中,浓度为10.0ug/L。
(6)NaF(10-3mol·L-1),四、测定步骤1. 将氟电极和甘汞电极接好,开通电源,预热2. 清洗电极:取去离子水50~60mL至100mL的烧杯中,放入搅拌磁子,开启搅拌器,直到读数大于规定值260mV。
离子选择性电极法测定水中氟离子

离子选择性电极法测定溶液中氟离子一、实验目的1、了解电位分析法的基本原理。
2、掌握电位分析法的操作过程。
3、掌握用标准曲线法测定水中微量氟离子的方法。
4、了解总离子强度调节液的意义和作用。
二、实验原理一般氟测定最方便、灵敏的方法是氟离子选择电极。
氟离子选择电极的敏感膜由LaF 3单晶片制成,为改善导电性能,晶体中还掺杂了少量0.1%~0.5%的EuF 2和1%~5%的CaF 2。
膜导电由离子半径较小、带电荷较少的晶体离子氟离子来担任。
Eu 2+、Ca 2+代替了晶格点阵中的La 3+,形成了较多空的氟离子点阵,降低了晶体膜的电阻。
将氟离子选择电极插入待测溶液中,待测离子可以吸附在膜表面,它与膜上相同离子交换,并通过扩散进入膜相。
膜相中存在的晶体缺陷,产生的离子也可以扩散进入溶液相,这样在晶体膜与溶液界面上建立了双电层结构,产生相界电位,氟离子活度的变化符合能斯特方程:--=F a FRT K E lg 303.2 氟离子选择电极对氟离子有良好的选择性,一般阴离子,除OH -外,均不干扰电极对氟离子的响应。
氟离子选择电极的适宜pH 范围为5-7。
一般氟离子电极的测定范围为10-6~10-1mol /L 。
水中氟离子浓度一般为10-5mol /L 。
在测定中为了将活度和浓度联系起来,必须控制离子强度,为此,应该加入惰性电解质(如KNO 3)。
一般将含有惰性电解质的溶液称为总离子强度调节液(total Ionic strength adjustment buffer ,TISAB)。
对氟离子选择电极来说,它由KNO 3、柠檬酸三钠溶液组成。
用离子选择电极测定离子浓度有两种基本方法。
方法一:标准曲线法。
先测定已知离子浓度的标准溶液的电位E ,以电位E 对lgc 作一工作曲线,由测得的未知样品的电位值,在E-lgc 曲线上求出分析物的浓度。
方法二:标准加人法。
首先测定待分析物的电位E1,然后加人已知浓度的分析物,记录电位E2,通过能斯特方程,由电位E1和E2可以求出待分析物的浓度。
离子选择电极法测定水中氟的含量

实验五离子选择电极法测定水中氟的含量一、目的要求1.掌握直接电位法的测定原理和方法。
2.学会正确使用氟离子选择电极和pH计。
二、方法原理自从氟离子选择电极问世以来,用该电极直接电位法测定各种水样中的氟便是一种普遍、方便和准确的方法。
氟离子选择电极简称为氟电极.其敏感膜是LaF3单晶。
以氟电极为指示电极,饱和甘汞电极(或银-氯化银电极)为参比电极,插入试液中,组成一个测量电池:氟离子选择电极│F-试液│饱和甘汞电极当试液的离子强度为定值时.电池的电动势E与试液的F-浓度C F一有确定的关系:E与lgC F一成线性关系,因此可以用直接电位法测定F-的浓度。
本实验用标准工作曲线法、直读法和连续标准加入法测定水中氟离子的含量。
测量的pH值范围为5.5-9,加入含有柠檬酸钠、硝酸钠及盐酸的总离子强度调节缓冲剂(TISAB)以控制酸度、保持一定的离子强度和消除干扰离子对测定的影响。
三、仪器与试剂仪器:PHS-3CT型pH计;电磁搅拌器;氟离子选择电极和饱和甘汞电极各1支;玻璃器皿一套。
试剂:1. 0. 1000 mol.L-1的氟标准溶液:准确称取经105℃下烘2h的NaF 4.199 g,用二次去离子水溶解后定容于1L容量瓶中。
贮存于聚乙稀瓶中备用。
2. 总离子强度调节缓冲剂:称取二水柠檬酸钠58.8g和硝酸钠85 g,溶于约800 ml二次去离子水中,用(1十1)盐酸调节pH值为5. 5~6. 0,然后稀释至1L。
四、实验步骤1.标准工作曲线法(l)标准系列溶液的配制及电动势的测量在5个100 ml的容量瓶中配制含总离子强度调节缓冲剂均为10. 00 mL、氟浓度分别为1. 000 × 10-2~1.000×10-6 mol.L-1的标准系列溶液。
将适量标准系列液(能浸没电极即可)分别倒入烧杯中,放入磁转子,插入干净的氟电极和饱和甘汞电极,连接好测量仪器线路,开启电源,由稀至浓分别测量标准系列溶液的电动势值。
使用氟离子选择性电极测定水中氟离子含量

使用氟离子选择性电极测定水中氟离子含量1.相关标准《GB/T 5750-2006 生活饮用水标准检验方法离子选择性电极法测氟化物》《GB/T 7484-1987 水质氟化物的测定离子选择电极法》《HJ 480-2009 环境空气氟化物的测定滤膜采样氟离子选择电极法》《NY/T 838-2004 茶叶中氟含量测定方法氟离子选择电极法》2.测量原理氟化镧单晶对氟离子有选择性,在氟化镧电极膜两侧的不同浓度氟溶液之间存在电位差,这种电位差通常称作膜电位。
膜电位的大小与氟化物溶液的离子活度有关。
氟离子与饱和甘汞电极组成一对原电池。
利用电动势与离子活度负对数值的线性关系直接求出水样中氟离子浓度。
3.仪器设备实验仪器:PXSJ-216F或其他型号离子计,JB-1磁力搅拌器实验电极:PF-1-01氟离子选择性电极、232-01参比电极(甘汞电极)其他一般实验室仪器。
4.试剂和溶液4.1氢氧化钠溶液(400g/L): 40g溶于100mL水中4.2盐酸溶液(1+1):将盐酸(ρ=1.19g/mL)与纯水等体积混合4.3离子强度缓冲液I (TISAB I):称取348.2g柠檬酸三钠(Na3C6H5O7·5H2O),溶于纯水中,用盐酸溶液(1+1)调节至pH=6后,用纯水稀释至1000mL。
4.4离子强度缓冲液II(TISAB II):称取59g氯化钠,3.48g柠檬酸三钠(Na3C6H5O7.5H2O)和57mL冰乙酸,溶于纯水中,用氢氧化钠溶液调节至pH=5.0-5.5后,用纯水稀释至1000mL。
4.5氟化钠系列标准溶液:精确称取称取经105℃干燥2h的氟化钠4.20g分析纯氟化钠,溶于蒸馏水中,稀释至1000 mL,贮存于塑料瓶中。
此溶液为1×10-1 mol/L F-。
氟化钠标准溶液的准确浓度可按式(1)计算:(1)式中:c(NaF),氟化钠标准溶液的浓度,单位为摩尔每升(mol/L);m,称取氟化钠的质量,单位为克(g)V, 配制溶液的体积,单位为升(L)取1×10-1mol/L F-溶液100ml,稀释至1000ml配制成浓度1×10-2 mol/L F-。
用氟离子选择性电极测量水中微量氟
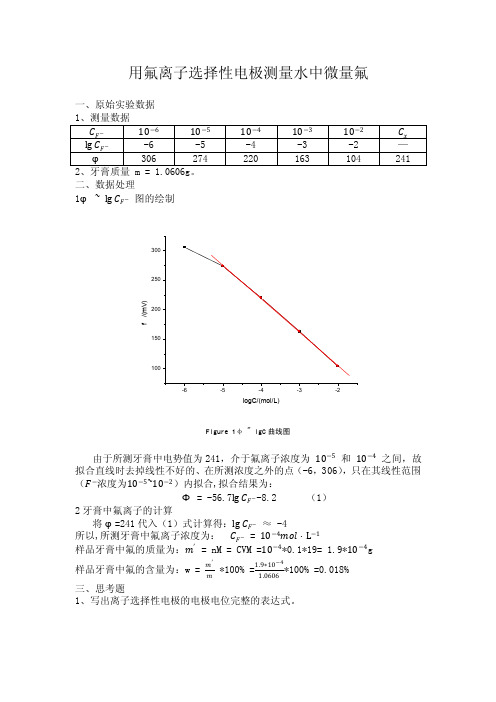
用氟离子选择性电极测量水中微量氟一、原始实验数据二、数据处理1φ ~ lg C F − 图的绘制f /(m V )logC/(mol/L)Figure 1φ ~ lgC 曲线图由于所测牙膏中电势值为241,介于氟离子浓度为 10−5 和 10−4 之间,故拟合直线时去掉线性不好的、在所测浓度之外的点(-6,306),只在其线性范围(F −浓度为10−5~10−2)内拟合,拟合结果为:Φ = -56.7lg C F −-8.2 (1)2牙膏中氟离子的计算将φ=241代入(1)式计算得:lg C F − ≈ -4所以,所测牙膏中氟离子浓度为: C F − = 10−4mol ·L −1样品牙膏中氟的质量为:m ′ = nM = CVM =10−4*0.1*19= 1.9*10−4g 样品牙膏中氟的含量为:w = m ′m *100% =1.9∗10−41.0606*100% =0.018%三、思考题1、写出离子选择性电极的电极电位完整的表达式。
E F− = K- 2.303RTlg a F−F2、为什么要加入离子强度调节剂?答:离子强度调节剂TISAB主要包含乙酸、NaCl、柠檬酸钠等。
乙酸缓冲溶液调节溶液的PH,加入NaCl是为了增强溶液离子强度,从而使离子活度系数恒定。
加入柠檬酸进行掩蔽干扰离子:阴离子,OH-,阳离子,Fe3+ Al3+ 、Sn。
四、做好本实验的几点建议1、各浓度标准液的配制每份溶液在保证浓度准确的情况下,所加入离子强度调节剂的量也得一致!如果从所配高浓度溶液(如10−2)依次提取配制次高浓度(10−3)的溶液,则每次配制时均需补加离子强度调节剂。
2、每次测量时保证测量环境和处理方式一致每次测量时均不变的条件包括:搅拌子转速、所测标准液的体积、电极在标准液中的高度、每次测完后冲洗氟电极的水量等。
3、实验开始前将氟电极用10−4mol·L−1标准液浸泡30分钟,实验全部结束后用蒸馏水清洗氟电极10min,期间换水三次。
