《高中化学》-电化学基础课件
合集下载
人教高中化学选修4课件:第4章 电化学基础

练习:把a、b、c、d四块金属浸入稀硫酸中,用
导线两两相连组成原电池。若
a、b相连时,a为负极;
a >b
c、d相连时,电流由d到c;
c>d
a、c相连时,c极产生大量气泡,
a>c
b、d相连时,溶液中的阳离子向b极移动。
d>b
则四种金属的活泼性顺序为: a>c > d > b 。
原电池原理应用:
(2)比较反应速率 当形成原电池之后,反应速率加快,如实验室制H2时, 纯Zn反应不如粗Zn跟酸作用的速率快。
负极
e-
正极
A
Zn-
Cu
Zn2+
负极
H+ H+ SO42-
阳离子
阴离子
正极
组成原电池的条件
1.内部条件:能自发进行氧化还原反应 2.外部条件:
(1)有两种活泼性不同的金属(或一种是 非金属单质或金属氧化物)作电极。 (2)电极材料均插入电解质溶液中。 (3)两极相连形成闭合电路。
两极一液成回路,氧化还原是中心
负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
ZnCl2溶液
FeCl3溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
2.依据氧化还原反应: 2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原 电池如图所示。
盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),
将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将 KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。
人教版高考化学复习课件-电化学基础

3.正、負極的判斷
4.電極反應式的書寫 第一步:列物質、標得失。 按照負極發生氧化反應,正極發生還原反應,判斷出電極 反應產物,找出得失電子的數量。 第二步:看環境、配守恆。 電極產物在電解質溶液的環境中應能穩定存在,如鹼性介 質中生成的 H+應讓其結合 OH-生成水。 電極反應式要遵守電荷守恆和品質守恆、電子守恆等加以 配平。 第三步:兩式加、驗總式。 兩電極反應式相加,與總反應離子方程式對照驗證。
(2) 電化學腐蝕:不純的金屬跟電解質溶液接觸發生 ____原__電__池____反應,較活潑的金屬被氧化的腐蝕。
(3)兩種腐蝕往往__同__時____發生,但_電__化__學___腐蝕更普遍, 速度快,危害更重。
2.電化學腐蝕的分類(以鐵的腐蝕為例)
吸氫腐蝕
吸氧腐蝕
條件
水膜__呈__酸__性__
第21講 電化學基礎
考綱定位
選項示例
ห้องสมุดไป่ตู้
1.瞭解原電池的工作原理,能 寫出電極反應和電池反應方 程式。 2.瞭解常見的化學電源的種類 及工作原理。 3.瞭解電解池的工作原理及應 用,能寫電極反應和電池反 應方程式。 4.發生電化學腐蝕的原因、危 害及防止措施。
1.在外電路中,電子從負極流向 正極。(2010年廣東高考T23-C) 2.氯堿工業中,陽極發生的反應 為:2Cl--2e-===Cl2↑。 (2011年廣東揭陽模擬T12-D) 3.海輪外殼上鑲入鋅塊,可減緩 船體的腐蝕。(2011年廣東湛江 模擬T12-B)
考點1 原電池工作原理及電極反應式的書寫 1.原理圖示
2.原電池的判定方法 (1)先分析有無外接電源,有外接電源者為電解池,無外接 電源者可能為原電池;再依據原電池的形成條件分析判定,主 要思路是“四看”:一看電極,兩極為導體且活潑性不同(燃料 電池的電極一般為惰性電極);二看溶液,兩極插入電解質溶液 中;三看回路,形成閉合回路或兩極接觸;四看本質:有無氧 化還原反應發生。 (2)多池相連。無外接電源時,兩極活潑性差異最大的一池 為原電池,其他各池可看作是電解池。
高中化学第四章电化学基础第三节电解池课件选修4高中选修4化学课件

答案:C
第十九页,共三十三页。
解题归纳 有关电解习题的解题步骤
1.明确电极反应规律。 (1)阴极:得电子,还原反应。 (一般)电极本身不参加反应;一定是电解质溶液中阳 离子“争”得电子。 (2)阳极:失电子,氧化反应。 若为金属(非惰性,Au、Pt 除外)电极,电极失电子; 若为惰性电极,电解质溶液中阴离子“争”失电子。
答案:D
第十页,共三十三页。
3.用石墨作电极,电解 1 mol·L-1 下列物质的溶液,
则电解前后溶液的 pH 保持不变的是( )
A.H2SO4
B.NaOH
C.Na2SO4
D.NaCl
解析:A、B、C 实质上是电解水,溶液浓度增大,
A 的 pH 减小,B 的 pH 增大,C 的 pH 不变;用石墨作
2H2↑+
水
O2↑
电解 质溶 溶液 液浓 pH 度的 变化 变化
减小 增 增大 大
不变
第十五页,共三十三页。
电 无氧
解
HCl
酸
电
解 不活泼
质 金属无 CuC 型 氧酸盐 l2
2H++2e- ===H2↑
Cu2++2e- ===Cu
2HCl
2Cl--2e- 电解
增
===Cl2↑ =====H2↑ 电
总反应方程式:2NaCl+2H2O=电==解==2NaOH+H2↑ +Cl2↑。
2.电镀与电解精炼。 (1)装置。
第五页,共三十三页。
(2)电解精炼铜的电极反应。
阳极:Zn-2e-===Zn2+、Fe-2e-===Fe2+、
Cu-2e-===Cu2+;
阴极:Cu2++2e-===Cu。
3.电冶金。
第三十页,共三十三页。
第十九页,共三十三页。
解题归纳 有关电解习题的解题步骤
1.明确电极反应规律。 (1)阴极:得电子,还原反应。 (一般)电极本身不参加反应;一定是电解质溶液中阳 离子“争”得电子。 (2)阳极:失电子,氧化反应。 若为金属(非惰性,Au、Pt 除外)电极,电极失电子; 若为惰性电极,电解质溶液中阴离子“争”失电子。
答案:D
第十页,共三十三页。
3.用石墨作电极,电解 1 mol·L-1 下列物质的溶液,
则电解前后溶液的 pH 保持不变的是( )
A.H2SO4
B.NaOH
C.Na2SO4
D.NaCl
解析:A、B、C 实质上是电解水,溶液浓度增大,
A 的 pH 减小,B 的 pH 增大,C 的 pH 不变;用石墨作
2H2↑+
水
O2↑
电解 质溶 溶液 液浓 pH 度的 变化 变化
减小 增 增大 大
不变
第十五页,共三十三页。
电 无氧
解
HCl
酸
电
解 不活泼
质 金属无 CuC 型 氧酸盐 l2
2H++2e- ===H2↑
Cu2++2e- ===Cu
2HCl
2Cl--2e- 电解
增
===Cl2↑ =====H2↑ 电
总反应方程式:2NaCl+2H2O=电==解==2NaOH+H2↑ +Cl2↑。
2.电镀与电解精炼。 (1)装置。
第五页,共三十三页。
(2)电解精炼铜的电极反应。
阳极:Zn-2e-===Zn2+、Fe-2e-===Fe2+、
Cu-2e-===Cu2+;
阴极:Cu2++2e-===Cu。
3.电冶金。
第三十页,共三十三页。
电化学基本概念ppt课件
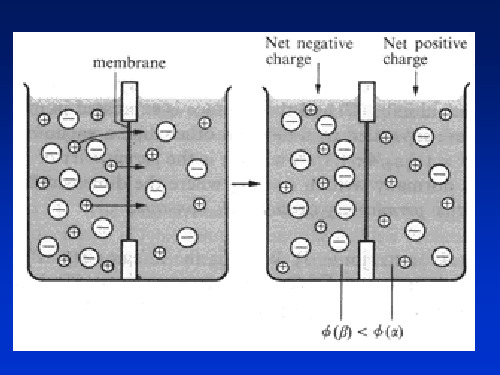
i i
两相间建立平衡电势
电极(Electrode)
电极材料/电解质
Zn|Zn2+, SO42Pt|H2,H+ Fe|Fe3O4|Fe2O3|水溶液
电极(Electrode)
电极材料/电解质 •传递电荷
Zn|Zn2+,SO42-,
•氧化或还原反应
Pt|H2,H+
的地点
•“半电池”
Fe|Fe3O4|Fe2O3|水溶液
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联)
e-
i
H2
Cl2
Na+
Cl-
Ag
Ag+
ei
Ag+
Ag+
H+
OH-
阴极
阳极
H+
NO3-
银阴极 银阳极
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联) 4. 适用于单个电化学装置的多个反应(并联)
I
负极 e
e 正极
-2e Pb
Pb2+ PbSO4
H2O H+
SO4= SO4= H+
硫酸
+2e PbO2
Pb2+ PbSO4
铅酸蓄电池 (1860年--)
充电
(吸收电能)
负极 e
e 正极
Pb2+ PbSO4
+2e
Pb
Pb2+
H2O
PbSO4
高中化学第四章电化学基础2化学电源课件新人教版选修4

19
课件新人教版选修4
(2)酸性电解质
电极反应为:
负极: 2H2-4e-===4H+
;
正极: O2+4H++4e-===2H2O
;
总反应:2H2+O2===2H2O
2021/4/17
高中化学第四章电化学基础2化学电源
20
课件新人教版选修4
2021/4/17
高中化学第四章电化学基础2化学电源
21
课件新人教版选修4
探究点一 燃料电池电极反应式的书写 1.燃料电池的组成 (1)电极:惰性电极。 (2)燃料:包括 H2、烃(如 CH4)、醇(如 C2H5OH)、肼(N2H4)
等。 (3)电解质:①酸性电解质溶液,如 H2SO4 溶液;②碱性电
解质溶液,如 NaOH 溶液;③熔融氧化物,如 Y2O;④熔融碳 酸盐,如 K2CO3 等。
②电极材料一般不参加化学反应,只是一个催化转化元件。 ③书写电极反应式时,要分清电解质溶液的酸碱性。在碱 性电解质溶液中,电极反应式中不能出现 H+;在酸性电解质溶 液中,电极反应式中不能出现 OH-。
2021/4/17
高中化学第四章电化学基础2化学电源
30
课件新人教版选修4
④正、负两极的电极反应式在得失电子守恒的前提下,相 加后的电池反应必然是燃料燃烧反应和燃烧产物与电解质溶液 反应的叠加反应式,如甲烷燃料电池。
2021/4/17
高中化学第四章电化学基础2化学电源
22
课件新人教版选修4
2.书写燃料电池反应式的基本步骤
(1)第一步:写出电池总反应式。
燃料电池的总反应与燃料的燃烧反应一致,若产物能和电
解质反应,则总反应为加和后的反应。
如氢氧燃料电池的总反应为 2H2+O2===2H2O;甲烷燃料电 池(电解质溶液为 NaOH 溶液)的反应:
化学课件《电化学基础》优秀ppt8(10份打包) 人教课标版4

(2)原电池电极反应式的书写: ①一般电极反应式的书写:
②复杂电极反应式的书写
复杂电
较简单一极的
极反应式 = 总反应式 - 电极反应式
如:CH4 酸性燃料电池中: 总反应式:CH4+2O2===CO2+2H2O, 正极反应式:2O2+8H++8e-===4H2O, 则:负极反应式=总反应式-正极反应式,
阳极:阳极材料是活泼电极时阳极材料放电,否则是溶液中阴离 子放电,放电顺序是:活泼金属>S2->I->Br->Cl->OH->SO24->F-。
阴极:一般是溶液中的阳离子放电,金属活动性顺序的逆顺序。 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+>H+ (水)>活泼金属阳离子。
【答案】 D 【点拨】 近年来高考中对化学电源的考查趋向于以新型电池为 素材,这类试题具有取材新颖、信息陌生、情景综合等特点,侧重于 考查运用所学知识解决实际问题的能力。这类题起点很高,但落点还 是在基础知识和基本规律上,且设错通常较为明显。因此,面对新颖
的化学电源,不要因其电极材料和电极反应、电池反应陌生而感到无 所适从,依据放电、充电的基本知识和规律审题,即可化生为熟、化 难为易。
[例 4] 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意 图如下:
下列说法不正确的是( )
A.在阴极室,发生的电极反应为:2H2O+2e-===2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区 H
+浓度增大,使平衡 2CrO24-+2H+
Cr2O27-+H2O 向右移动
【答案】 D 【点拨】 首先根据外接电源的正负极判断电解池的电极,其次
第十一章电化学基础-PPT精品
半反应式加合为一个配平的离子反应式。
2Fe2+ + Cl2 = 2Fe3+ + 2Cl➢ 如果在半反应中反应物和产物中的氧原子数不同,可在半反应式中加H+(
酸性)或OH-(碱性)和H2O,使两侧的氧原子数和电荷数均相等。 ➢ 除了正确的配平方法外,必须熟悉该反应的基本化学事实。
2020/6/5
例:用离子-电子法配平
这类电极中氢电极特别重要。
2020/6/5
例如 (-) Pt|H2(100KPa)|H+(1.0mol·L-1)‖Cr2O72-(10mol ·L-
1),Cr3+(1.0mol·L-1), H+(1.010-2mol ·L-1)|Pt (+) 负极: H2 ⇌ 2H+ + 2e正极: Cr2O72- +14H+ +6e- ⇌ 2Cr3++7H2O 总反应:Cr2O72- + 13H2 + 8H+ = 2Cr3+ +7H2O
10HClO3 + 3P4 + 18H2O === 10HCl + 12H3PO4 ➢ 如果反应反程式两边的氧原子数相等,即证明反应反程式已配平。
再如: 3As2S3 + 28HNO3 = 6H3AsO4 + 9H2SO4 + 28NO
2020/6/5 2MnO4- + 10Cl- + 16H+ = 2Mn2+ + 5Cl2 + 8H2O
(3) 若出现分数,可调整为最小正整数:
2 KMnO4 +10 FeSO4 + H2SO4 = 2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + H2O
高中化学 第四章 电化学基础 第四节 金属的电化学腐蚀与防护课件高中选修4化学课件
2021/12/8
A.④>②>①>③ B.②>①>③>④ C.④>②>③>① D.③>②>④>① 思路点拨:解答本题的基本思路如下: (1)根据所给装置判断是原电池还是电解池;
第二十三页,共二十七页。
2021/12/8
(2)根据金属的活动性以及电源的正、负极判断原电 池的正、负极,电解池的阴、阳极;
(1)加保护层
A.钢闸门与直流电源
负极相连
(2)牺牲阳极的阴极保护法 B.电线外面包塑料法
(3)外加电流的阴极保护法 C.普通钢制镍铬钢
(4)改变内部结构
D.轮船外壳装上锌块
答案:(1)-B (2)-D (3)-A (4)-C
2021/12/8
第十一页,共二十七页。
3.相同材质的铁在下图中的各情形下最不易被腐蚀 的是( )
水膜中含有 O2,呈极弱 酸性或中性
水膜酸 性较强
有微弱电流
第十四页,共二十七页。
负极:Fe-2e-===Fe2+
反应式 2Fe+ 3Cl2===2FeCl3
正极:
2H2O+O2 +4e- ===4OH-
正极:2H+ +2e- ===H2↑
联系
(1)本质相同,都是金属失去电子,被氧化 (2)两种腐蚀同时发生,电化学腐蚀更普遍、 危害更大;吸氧腐蚀比析氢腐蚀普遍
2021/1பைடு நூலகம்/8
第十七页,共二十七页。
解题归纳 解答此类题目主要从以下三个方面分析: (1)正确判断金属的腐蚀是化学腐蚀还是电化学腐蚀。 (2)如果是电化学腐蚀,判断出正、负极,较活泼的金 属为负极被腐蚀,较不活泼的金属为正极被保护。 (3)电化学腐蚀中根据电解质溶液的酸碱性确定腐蚀的 类型,若是酸性溶液则发生析氢腐蚀,若是中性或弱酸性 溶液则发生吸氧腐蚀。
电化学基本知识ppt课件
电池过程
阴极
阳极
ZnSO4
CuSO4
Zn
Cu
盐桥
1.1 V
典型电化学过程
e
电化学过程的特点
Zn(s) + CuSO4(aq) ZnSO4(aq) + Cu(s) 半反应: Zn(s) Zn2+ + 2e- 阳极反应 Cu2+ + 2e- Cu(s) 阴极反应 电子不能在离子导体中运动 离子不能在电子导体中运动 即:电子与离子间必定在界面处发生了转化,这个转化就发生在离子导体和电子导体的界面处。
高频区为电极反应动力学(电荷传递过程)控制,低频区由电极反应的反应物或产物的扩散控制。
从图可得体系R、Rct、Cd以及参数,与扩散系数有关,利用它可以估算扩散系数D。由Rct可计算i0和k0。
扩散阻抗的直线可能偏离45,原因:
电极表面很粗糙,以致扩散过程部分相当于球面扩散; 除了电极电势外,还有另外一个状态变量,这个变量在测量的过程中引起感抗。
盐桥
1. 可以同时测量极化电流和极化电位; 2. 三电极两回路具有足够的测量精度。
三电极的优点
1.2.5.1 辅助电极的作用 实现WE导电并使WE电力线分布均匀。 1.2.5.2 辅助电极的要求 ①辅助电极面积大; 为使参比电极等势面,应使辅助电极面积增大,以保证满足研究电极表面电位分布均匀,如是平板电极: ; ②辅助电极形状应与研究电极相同,以实现均匀电场作用。
参比电极
常见的参比电极 ①甘汞电极; Hg|Hg2Cl2|Cl- 由于Hg+→Hg2+ (亚汞不稳定,高温时易变成Hg2+,受温度影响大。<70℃,另外,[Cl-]要饱和,防止 发生变化)。
电化学基础(4).ppt
Zn→Zn2+(aq)+2e另一方面,溶液中的水合离子有从金属表面获得 电子,沉积到金属上的倾向:
Zn2+(aq)+2e-→Zn 金属的溶解和沉积能形成动态平衡。
原电池
如果金属表面附近的溶液中,维持着一定数量的 正离子;在金属表面上,则保留着相应数量的自由 电子(对于不同的电极,可能出现不同的情况)。 这样,在金属和溶液之间就产生了电势差。
氧化还原反应
二、氧化还原反应半式
为了分析氧化还原反应,特别是将氧化还原 反应与电子得失、电流相联系,可以把氧化还 原看做是两个“半反应”连接而成的,即:氧 化还原反应的化学方程式可分解成两个“半反 应式”,例如:
氧化还原反应 Cu2++Zn=Cu+Zn2+
半反应 Cu2++2e-=Cu 还原反应
Zn-2e-=Zn2+ 氧化反映
影响电极电势差的因素有电极的本性、温度、介 质、离子浓度等。
当外界条件一定时,电极电势差的高低就取决于 电极的本性。对于金属电极,则取决于金属离子化 倾向的大小。
MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O 这种配平方法称为离子一电子法,只适于水溶液中
11-2 原电池
一、氧化还原反应和电子转移 1、氧化数变化和电子转移 金属锌置换Cu2+的氧化还原反应如下: Zn+Cu2+===Zn2++Cu Zn和Cu2+在反应中氧化数发生了变化,根据它
原电池
2、原电池
将锌和锌盐溶液与铜和铜盐溶液分开为两个半电 池,即锌半电池和铜半电池;外电路用导线接通, 半电池用盐桥沟通,这样就得到了一个Cu-Zn原电 池。产生电流的方向和大小可由检流计测出。
Zn2+(aq)+2e-→Zn 金属的溶解和沉积能形成动态平衡。
原电池
如果金属表面附近的溶液中,维持着一定数量的 正离子;在金属表面上,则保留着相应数量的自由 电子(对于不同的电极,可能出现不同的情况)。 这样,在金属和溶液之间就产生了电势差。
氧化还原反应
二、氧化还原反应半式
为了分析氧化还原反应,特别是将氧化还原 反应与电子得失、电流相联系,可以把氧化还 原看做是两个“半反应”连接而成的,即:氧 化还原反应的化学方程式可分解成两个“半反 应式”,例如:
氧化还原反应 Cu2++Zn=Cu+Zn2+
半反应 Cu2++2e-=Cu 还原反应
Zn-2e-=Zn2+ 氧化反映
影响电极电势差的因素有电极的本性、温度、介 质、离子浓度等。
当外界条件一定时,电极电势差的高低就取决于 电极的本性。对于金属电极,则取决于金属离子化 倾向的大小。
MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O 这种配平方法称为离子一电子法,只适于水溶液中
11-2 原电池
一、氧化还原反应和电子转移 1、氧化数变化和电子转移 金属锌置换Cu2+的氧化还原反应如下: Zn+Cu2+===Zn2++Cu Zn和Cu2+在反应中氧化数发生了变化,根据它
原电池
2、原电池
将锌和锌盐溶液与铜和铜盐溶液分开为两个半电 池,即锌半电池和铜半电池;外电路用导线接通, 半电池用盐桥沟通,这样就得到了一个Cu-Zn原电 池。产生电流的方向和大小可由检流计测出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
正极 2H+ + 2e-=H2 反应
负极 Fe - 2e-=Fe2+ 反应
负极(Pt):2H2- 4e-+ 4OH- = 4H2O 正极(Pt):O2 + 2H2O + 4e- = 4OH-
电极名称:
原电池
相对活泼的电极为负极 相对不活泼的电极为正极 与电源负极相连的电极为阴极
电解池
与电源正极相连的电极为阳极
―负极出电子,电子回正极” 定向移动方向:电子、离子
必发生 失电子 的 氧化反应 原电池
电 极 反 应
溶液 的浓 度
阳极: M-ne- = Mn+ 阴极: Mn+ + ne- = M
改变
基本不变
一、原电池原理的应用
化学电池: 1.普通锌锰电池 2.碱性锌锰电池 3.铅蓄电池 4.燃料电池 一次电池 二次电池
介质 电池反应: 2H2 +O2 = 2H2O
酸性
负极
正极
2H2 - 4e-= 4H+ O2 + 4H+ + 4e- = 4H2O 2H2 + 4OH- - 4e- = 4H2O O2 + 2H2O + 4e-= 4OH-
①活动性不同两电极 ②自发的氧化还原反应 ③电解质溶液(有选择性) ④两电极必须插入电解质溶液中 (或两电极相靠)形成闭合回路 负极:较活泼金属 正极:较不活泼金属(或能导电 的非金属等) ①两电极接直流电源(两电极活 动性可相同,也可不同) ②电解质溶液或者熔融电解质 ③两电极必须插入电解质溶液中 形成闭合回路
形成 条件 电极名称 电极判断
阳极:电源正极相连 阴极:电源负极相连
阳极:发生氧化反应(电极或溶 液中的阴离子移向阳极失电子) 阴极:发生还原反应(溶液中的 阳离子移向阴极失电子) 负极 阴极 ; 阳极 正极
负极(内电路为阳极): 电极反应 发生氧化反应(失电子) 正极(内电路为阴极): 得失电子 发生还原反应(溶液中的阳离 子移向正极得电子) 电子流向
负极
碱性
正极
1.普通干电池总反应: Zn + 2MnO2 + 2NH4Cl = 2MnOOH + ZnCl2 + 2NH3 负极(Zn):Zn – 2e- = Zn2+ 正极(MnO2和C): 2MnO2 + 2NH4+ + 2e- = 2MnOOH + 2NH3 表示方法: (–)Zn│NH4Cl + ZnCl2│MnO2,C(+)
燃料电池——氢氧燃料电池
(-) Pt│H2│H+│O2│Pt (+) 电池总反应:2H2 + O2 = 2H2O 负极(Pt):2H2 - 4e- = 4H+ 正极(Pt):O2+ 4H+ + 4e- = 2H2O (-) Pt│H2│OH-│O2│Pt (+)
电池总反应:2H2 + O2= 2H2O
必发生 得电子 的 还原反应
电解池
必发生 失电子 的 氧化反应
思考:写出下列原电池的电极反应式。
Al Cu 浓硝酸 A B Al Mg
氢氧化 钠溶液
A
负极:Cu-2e- = Cu2+
正极:4H+ + 2NO3- + 2e- = 2H2O + 2NO2
负极:2Al + 8OH--6e- = 2AlO2- + 4H2O 正极: 6H2O + 6e- = 6OH- + 3H2
电解池
还原反应: 2H + +2e - = H2↑ 氧化反应:
负极
Zn
阳极
(内电路)
e
e
H + OH– SO4 2 –
正极
Cu
阴极
(内电路)
C 阴极
+ - e 电源
H + OH– SO4 2 –
4OH– + 4e - = O2↑+2H2O
e C 阳极
H2SO4溶液
H2SO4溶液
原电池
定义
电解池
化学能转变成电能的装置。 将电能转变成化学能的装置。
河北省宣化县第一中学 栾春武
一、原电池、电解池原理
1.原电池:通过自发氧化还原反应把化学能转化为电能。 2.电解:连接电源,使电流通过电解质溶液在阴阳两极上被迫发 生非自发氧化还原反应,从而把电能转化为化学能。 原电池
氧化反应: Zn-2e- = Zn2+ 还原反应: 2H++2e - = H2↑
B
思考:写出下列原电池的电极反应式。
Fe C Fe C
稀盐酸
A B
氯化钠 溶液
A
负极:Fe-2e- = Fe2+ 正极:2H+ + 2e- = H2 负极:Fe-2e- = Fe2+ 正极: 2H2O + O2+ 4e-= 4OH-
B
钢铁的析氢腐蚀和吸氧腐蚀的比较
析氢腐蚀 条件 水膜酸性较强 吸氧腐蚀 水膜呈弱酸性或中性 2H2O + O2 + 4e-=4OH-
负极
正极
池 型 装 置 特 征
电解池
(应用电解原理)
电镀池
铜的精炼池
(应用电解原理)
阳极: 镀层金属(M) 阳极、阴极 阴极: 镀件 和电解质溶液 电镀液:含镀层金属 离子(Mn+)
阳极: 氧化反应, 失电子,化合价 升高 阴极:还原反应, 得电子,化合价 降低
阳极: 粗铜(含Zn、Fe、 Ni、Ag、Pt、Au等 ) 阴极: 精铜 电解液: CuSO4溶液 阳极:Cu-2e-= Cu2+ (Zn-2e- = Zn2+ Fe-2e- = Fe2+等) 阴极:Cu2++2e-= Cu (Ag、Pt、Au成为 “阳极泥” ) 基本不变
2. 碱性锌锰电池总反应: Zn + 2MnO2+ 2H2O = 2MnOOH + Zn(OH)2
负极(Zn): Zn + 2OH- -2e- = Zn(OH)2 正极(MnO2):2MnO2+2H2O+2e-=2MnOOH+2OH-
表示方法:(-) Zn│KOH│MnO2 (+)
放电过程总反应: Pb(s)+PbO2(s)+2H2SO4(aq) = 2PbSO4(s)+2H2O(l) 充电过程总反应: 2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq) ①放电过程 负极:氧化反应 Pb(s)+SO42-(aq)-2e-=PbSO4(s) 正极:还原反应 PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4 (s) +2H2O(l) ②充电过程 阴极(接电源负极):还原反应 PbSO4(s)+2e- = Pb(s)+SO42-(aq) 阳极(接电源正极):氧化反应 2PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq)
