双荧光素酶测试系统及海肾类对照报告基因载体
dual-luciferase

双荧光素酶报告系统作者:windyrain 2008-05-29 21:54:33标签:杂谈双荧光素酶报告基因测试∶结合萤火虫和海洋腔肠荧光素酶先进的共报告基因测试技术在用萤火虫荧光素酶定量基因表达时,通常采用第二个报告基因来减少实验的变化因素。
但传统的共报告基因(比如CAT,β-Gal,GUS)不够便利,因为各自的测试化学,处理要求,检测特点存在差异。
Promega提供一种先进的双报告基因技术,结合了萤火虫荧光素酶测试和海洋腔肠荧光素酶测试。
双荧光素酶报告基因测试系统,结合pRL载体系统,表达第二个报告基因海洋腔肠荧光素酶,在单管中进行双荧光素酶报告基因测试,快速,灵敏,简便。
系统还提供PLB裂解液,用来裂解在多孔板中培养的哺乳细胞,不需操作单个样品。
对于正在使用萤火虫荧光素酶报告基因载体的研究人员。
双荧光素酶报告基因测试系统将使他们立即体会到该系统的便利。
介绍有内参照双报告基因用于实验系统中作相关的或成比例的检测, 通常一个报告基因作为内对照, 使另一个报告基因的检测均一化。
检测基因表达时双报告基因通常用来瞬时转染培养细胞,带有实验报告基因的载体共转染带有不同的报告基因作为对照的第二个载体。
通常实验报告基因偶联到调控的启动子, 研究调控基因的结构和生理基础。
报告基因表达活力的相对改变与偶联调控启动子转录活力的改变相关,偶联到组成型启动子的第二个报告基因,提供转录活力的内对照, 使测试不被实验条件变化所干扰。
通过这种方法, 可减少内在的变化因素所削弱的实验准确性, 比如, 培养细胞的数目和活力的差别, 细胞转染和裂解的效率。
使用萤火虫荧光素酶,结合氯霉素乙酰转移酶(CAT), β-半乳糖苷酶(β-Gal), 或葡萄醛酸糖苷酶(GUS)的双报告基因,近几年已普遍使用。
但这些双报告基因组合削弱了荧光素酶操作的优势, 比如荧光素酶测试和定量可在几秒钟内进行, 但CAT, β-Gal和GUS测试法, 则在定量前需要长时间的保温。
pRL 家族海肾荧光素酶对照报告基因载体系列
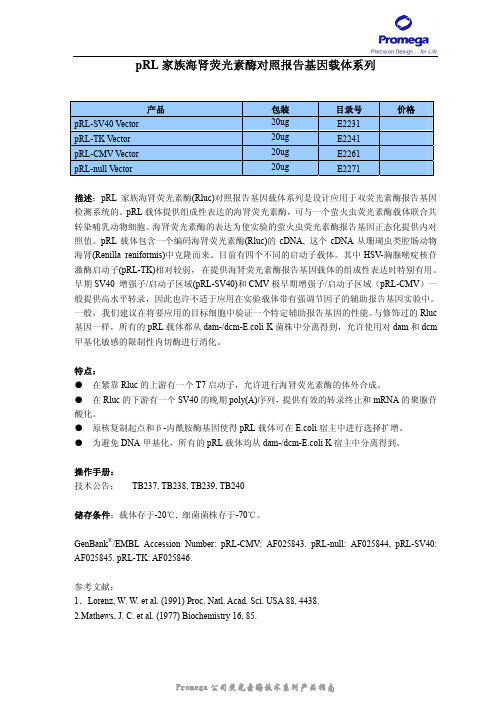
pRL家族海肾荧光素酶对照报告基因载体系列产品包装目录号价格pRL-SV40 Vector 20ug E2231pRL-TK Vector 20ug E2241pRL-CMV Vector 20ug E2261pRL-null Vector 20ug E2271描述:pRL家族海肾荧光素酶(Rluc)对照报告基因载体系列是设计应用于双荧光素酶报告基因检测系统的。
pRL载体提供组成性表达的海肾荧光素酶,可与一个萤火虫荧光素酶载体联合共转染哺乳动物细胞。
海肾荧光素酶的表达为使实验的萤火虫荧光素酶报告基因正态化提供内对照值。
pRL载体包含一个编码海肾荧光素酶(Rluc)的cDNA, 这个cDNA从珊瑚虫类腔肠动物海肾(Renilla reniformis)中克隆而来。
目前有四个不同的启动子载体。
其中HSV-胸腺嘧啶核苷激酶启动子(pRL-TK)相对较弱,在提供海肾荧光素酶报告基因载体的组成性表达时特别有用。
早期SV40 增强子/启动子区域(pRL-SV40)和CMV极早期增强子/启动子区域(pRL-CMV)一般提供高水平转录,因此也许不适于应用在实验载体带有强调节因子的辅助报告基因实验中。
一般,我们建议在将要应用的目标细胞中验证一个特定辅助报告基因的性能。
与修饰过的Rluc 基因一样,所有的pRL载体都从dam-/dcm-E.coli K菌株中分离得到,允许使用对dam和dcm 甲基化敏感的限制性内切酶进行消化。
特点:●在紧靠Rluc的上游有一个T7启动子,允许进行海肾荧光素酶的体外合成。
●在Rluc的下游有一个SV40的晚期poly(A)序列,提供有效的转录终止和mRNA的聚腺苷酸化。
●原核复制起点和β-内酰胺酶基因使得pRL载体可在E.coli宿主中进行选择扩增。
●为避免DNA甲基化,所有的pRL载体均从dam-/dcm-E.coli K宿主中分离得到。
操作手册:技术公告:TB237, TB238, TB239, TB240储存条件:载体存于-20℃, 细菌菌株存于-70℃。
双荧光素实验报告

一、实验目的1. 掌握双荧光素酶实验报告系统的基本原理和操作方法。
2. 学习利用双荧光素酶报告系统检测基因表达和调控。
3. 理解双报告基因在实验中的作用及其对实验结果的影响。
二、实验原理双荧光素酶实验报告系统是一种常用的分子生物学实验方法,用于检测基因表达和调控。
该系统利用两种荧光素酶——萤火虫荧光素酶(Firefly Luciferase, FLUC)和海肾荧光素酶(Renilla Luciferase, Rluc)——作为报告基因。
FLUC在生物发光反应中具有较高的光强度和较宽的线性范围,而Rluc则具有较长的发射波长,可以作为内对照,确保实验结果的准确性和可比性。
在双荧光素酶实验中,通常将带有实验报告基因的载体共转染带有Rluc的载体到细胞中。
通过检测两种荧光素酶的活性,可以评估实验组与对照组之间基因表达和调控的差异。
三、实验材料1. 细胞系:HEK293细胞2. 载体:带有实验报告基因的载体和带有Rluc的载体3. 转染试剂:脂质体转染试剂4. 检测试剂:荧光素酶底物和荧光素酶检测仪器四、实验步骤1. 细胞培养:将HEK293细胞接种于6孔板,培养至对数生长期。
2. 载体构建:将实验报告基因克隆到带有荧光素酶报告基因的载体中,构建双荧光素酶报告基因载体。
3. 转染:按照脂质体转染试剂说明书进行细胞转染,将双荧光素酶报告基因载体和带有Rluc的载体共转染到细胞中。
4. 细胞培养:转染后继续培养细胞,收集细胞样品。
5. 荧光素酶活性检测:按照荧光素酶底物说明书进行荧光素酶活性检测,分别检测FLUC和Rluc的活性。
6. 数据分析:将FLUC和Rluc的活性进行比较,分析实验组与对照组之间基因表达和调控的差异。
五、实验结果1. 荧光素酶活性检测:通过荧光素酶底物检测,成功检测到FLUC和Rluc的活性。
2. 数据分析:实验组与对照组相比,FLUC活性显著提高,而Rluc活性无明显变化。
六、实验讨论1. 双荧光素酶实验报告系统是一种有效的基因表达和调控检测方法,可以用于研究基因功能、信号通路和细胞反应。
Dual-Luciferase 双荧光素酶报告基因检测系统
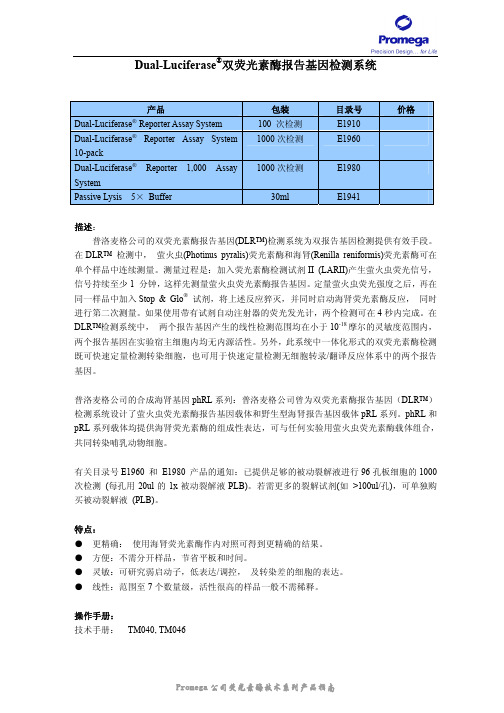
Dual-Luciferase®双荧光素酶报告基因检测系统产品包装目录号价格Dual-Luciferase® Reporter Assay System 100 次检测E19101000次检测E1960Dual-Luciferase® Reporter Assay System10-pack1000次检测E1980Dual-Luciferase® Reporter 1,000 AssaySystemPassive Lysis 5× Buffer 30ml E1941描述:普洛麦格公司的双荧光素酶报告基因(DLR™)检测系统为双报告基因检测提供有效手段。
在DLR™ 检测中,萤火虫(Photinus pyralis)荧光素酶和海肾(Renilla reniformis)荧光素酶可在单个样品中连续测量。
测量过程是:加入荧光素酶检测试剂II (LARII)产生萤火虫荧光信号,信号持续至少1 分钟,这样先测量萤火虫荧光素酶报告基因。
定量萤火虫荧光强度之后,再在同一样品中加入Stop & Glo®试剂,将上述反应猝灭,并同时启动海肾荧光素酶反应,同时进行第二次测量。
如果使用带有试剂自动注射器的荧光发光计,两个检测可在4秒内完成。
在DLR™检测系统中,两个报告基因产生的线性检测范围均在小于10-18摩尔的灵敏度范围内,两个报告基因在实验宿主细胞内均无内源活性。
另外,此系统中一体化形式的双荧光素酶检测既可快速定量检测转染细胞,也可用于快速定量检测无细胞转录/翻译反应体系中的两个报告基因。
普洛麦格公司的合成海肾基因phRL系列:普洛麦格公司曾为双荧光素酶报告基因(DLR™)检测系统设计了萤火虫荧光素酶报告基因载体和野生型海肾报告基因载体pRL系列。
phRL和pRL系列载体均提供海肾荧光素酶的组成性表达,可与任何实验用萤火虫荧光素酶载体组合,共同转染哺乳动物细胞。
双荧光素酶报告数据分析(3篇)

第1篇摘要:双荧光素酶报告系统(Dual Luciferase Reporter Assays, DLRA)是一种广泛应用于生物科学研究中的细胞功能检测技术。
通过分析荧光素酶的活性,可以评估细胞内信号通路的激活情况,从而研究基因表达调控、细胞增殖、细胞凋亡等多种生物学过程。
本文将对双荧光素酶报告数据分析的方法、注意事项以及结果解读进行详细阐述。
一、引言双荧光素酶报告系统是一种基于荧光素酶活性的细胞功能检测技术,具有灵敏度高、特异性强、操作简便等优点。
荧光素酶是一种在细胞内自然存在的酶,能够将荧光素底物催化生成荧光物质。
在双荧光素酶报告系统中,通常使用两种荧光素酶:萤火虫荧光素酶(Firefly Luciferase, FL)和海肾荧光素酶(Renilla Luciferase, RL)。
FL的荧光强度通常作为报告基因的活性,而RL的荧光强度则作为内参基因,用于校正实验误差和细胞活力。
二、实验原理双荧光素酶报告系统的基本原理是:将目的基因与荧光素酶基因(FL或RL)的启动子连接,构建报告基因质粒。
将报告基因质粒转染到细胞中,细胞内荧光素酶的活性与目的基因的表达水平成正比。
通过检测细胞内两种荧光素酶的荧光强度,可以评估目的基因的表达水平。
三、实验方法1. 构建报告基因质粒(1)设计荧光素酶基因(FL或RL)的启动子序列,并与目的基因序列连接。
(2)将连接好的基因序列克隆到载体质粒中,构建报告基因质粒。
2. 细胞培养与转染(1)培养细胞至对数生长期。
(2)用脂质体或电穿孔等方法将报告基因质粒转染到细胞中。
3. 荧光素酶活性检测(1)收集转染后的细胞,用荧光素酶底物进行孵育。
(2)使用荧光光度计检测细胞内FL和RL的荧光强度。
4. 数据分析(1)计算FL和RL的相对荧光强度(RFU)。
(2)计算目的基因的表达水平(FL/Rlu)。
四、数据分析方法1. 相对荧光强度(RFU)计算RFU = 荧光强度 / 标准曲线斜率2. 目的基因表达水平计算目的基因表达水平 = FL/Rlu其中,FL为FL的相对荧光强度,Rlu为RL的相对荧光强度。
双萤光素酶报告基因技术

Dual-Glo assay-选择性淬灭萤火虫萤光
Selective quench of firefly luminescence
Dual-Glo™萤光素酶检测系统
试剂盒组成
• Dual-Glo™萤光素酶缓冲液 • Dual-Glo™萤光素酶底物(冻干粉) • Dual-Glo™Stop-Glo®缓冲液 • Dual-Glo™Stop-Glo®底物
载体 - 萤火虫萤光素酶载体
•pGL3 家族
✓pGL3-Basic ✓pGL3-Control ✓pGL3-Enhancer ✓pGL3-Promoter
pGL3-Basic Map
pGL3-Control Map
pGL3-Enhancer Map
pGL3-Promoter Map
内对照载体可能存在的问题
Gal ,的两个报告基因的检测都灵敏而快速.
双萤光素酶报告基因系统比用CAT和ß-Gal做内对照 的优点
• 速度
– 样品不需预处理,不需孵育。两次检测在几秒种内 完成
• 灵敏
– 两个萤光素酶的线性范围超过7个酶浓度数量级。内 源萤光素酶背景极低
• 方便
– 一管完成检测,样品不必分份ห้องสมุดไป่ตู้
用两个萤光素酶做报告基因 (萤火虫+海肾)
• 步骤
前一天:接种细胞,六孔板X3 第二天:共转染:pGL3-Try14A和pRL-SV40 (分成两组)
pGL3-Control 和 pRL-SV40 pGL3-Basic 和 pRL-SV40
裂解细胞,测量萤光
Dual-Glo™萤光素酶检测系统
检测特点 •均质检测,为高通量检测而设计 •萤光信号稳定,2hrs内检测 •自发萤光低于检测水平
双荧光素酶报告基因

双荧光素酶报告基因启动子活性分析(双荧光素酶报告基因实验)一、实验目的:分析启动子活性二、实验原理:荧光素酶报告基因的活性用Dual-Luciferase?Reporter AssaySystem(Promega)试剂盒来检测。
利用单通道多标记荧光检测仪测定荧光素酶活性。
在双荧光素酶系统中,除了用于检测启动子活性的萤火虫荧光素酶外,另外一种组成型表达的Renilla荧光素酶质粒PRL-TK也被同时转染入细胞内作为内参。
三、实验材料:Dual-Luciferase?Reporter Assay System (Promega)试剂盒,PBS,细胞裂解液,96孔,四、实验设备:单通道多标记荧光检测仪五、实验方法及步骤:1)启动子萤光素酶报告载体与共转染质粒按照质量等比例、总量0.8μg的原则转染细胞,36h后收获细胞;2)96孔板吸弃细胞培养基,PBS冲洗细胞一次,加入1×PLB细胞裂解液20μl,置于室温震荡裂解20min;3)轻轻吹打细胞,取10μl细胞裂解液加入50μl Luciferase Assay Reagent,轻轻震荡混匀,立刻置于单通道多标记荧光检测仪中测定Firefly Luciferase活性;4)读数后立即加入50μl Stop & Glo?Reagent轻轻震荡混匀,读取Renilla Luciferase活性;5)所得的结果为各个实验样品的Firefly Luciferase活性与Renilla荧光素酶活性的比值。
每个实验组重复3-4孔,整个实验独立重复3次。
实验结果均为3次独立的实验结果的平均值。
所有的结果均以平均值±标准差(mean±S.D.)表示。
六、注意事项1.做好对照。
2.多做几个复孔,求平均值。
七、补充知识点双荧光素酶报告基因实验1.试剂盒:Dual-Glo TM Luciferase Aassy System(promega E2920)组成如下:? Dual-Glo?萤光素酶缓冲液Dual-Glo?萤光素酶底物(冻干粉)Dual-Glo?Stop-Glo?缓冲液Dual-Glo?Stop-Glo?底物2.报告基因的作用细胞信号转导途径启动子/增强子受体结合病毒/细胞相互作用转录因子药物诱导作用或“效果”3.原理–制备含有luc/ R luc的DNA–转染–提供刺激–测量荧光–用海肾萤光素酶作对照归一实验变化归一反应=实验的(萤火虫萤光素酶)/ 对照的(海肾萤光素酶)4.载体- 萤火虫萤光素酶载体pGL3 家族pGL3-BasicpGL3-ControlpGL3-EnhancerpGL3-Promoter海肾萤光素酶报告基因载体pRL-TK5.试剂制备–将Dual-Glo? 萤光素酶缓冲液倒入Dual-Glo? 萤光素酶底物中,Dual-Glo? 萤光素酶试剂,分装后-70℃保存,避免反复冻融–用Dual-Glo? S top &Glo? 缓冲液按1:100 稀释Dual-Glo? Stop &Glo? 底物(现用现配)–所有的缓冲液存于室温, 所有的底物存于–20°C两步加入试剂:加,读,加,读6.检测步骤:实验前,将Dual-Glo? 萤光素酶试剂平衡到室温1.确认使用的细胞板可以用于荧光检测2.测萤火虫荧光素酶活性:向待测细胞板每孔中加入与培养基等体积的Dual-Glo? 萤光素酶试剂,混匀。
分子生物学专题luciferase核心实验技术:实验原理

分子生物学专题luciferase核心实验技术:实验原理荧光素酶(Luciferase)是自然界中能够产生生物发光的酶的统称,不同的能够控制发光的生物体用不同的荧光素酶来催化不同的发光反应。
萤光生成反应通常分为以下两步:萤光素+ atp→萤光素化腺苷酸(luciferyladenylate)+ PPi萤光素化腺苷酸+ O2→氧萤光素+ AMP +光荧光素酶的基因可以被合成并插入到生物体中或转染到细胞中,将不同类型的细胞(骨髓干细胞、T细胞等)标记上(即表达)荧光素酶,就可以用高敏感度的CCD相机进行对动物体内进行活体观察而不会伤害到动物本身。
在荧光素酶中加入正确的萤光素底物就可以放出荧光,而发出的光子可以被光敏感元件,如萤光探测器或改进后的光学显微镜探测到。
这就使得对包括感染在内的多种生命活动进程进行观察成为可能。
荧光素酶分析可应用于启动子研究中分析顺式作用元件和反式作用因子、药物筛选、sirna和miRNA筛选、分泌途径及蛋白定位报告基因检测、活细胞的实时动态研究、信号转导通路分析、难转染的细胞(包括干细胞和原代细胞)的研究、RNA剪接研究。
萤光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性萤光素酶,一旦转录完成立刻就生成功能性的萤光素酶。
单报告基因实验往往会受到各种实验条件的影响,而双报告基因则通过共转染的“对照”作为内参为试验提供一基准线,从而可以在最大程度上减小细胞活性和转染效率等外在因素对实验的影响,使得数据结果更为可信。
Dual-Luciferase?双萤光素酶报告基因检测系统在细胞中同时表达萤火虫萤光素酶和海肾萤光素酶,两者没有种源同源性并对应不同的反应底物,故而没有交叉干扰。
得益于超强的光信号和超高的信噪比,本系统被广泛用于miRNA靶基因验证。
转录因子是一种具有特殊结构、行使调控基因表达功能的蛋白质分子,也称为反式作用因子。
某些转录因子仅与其靶启动子中的特异序列结合,这些特异性的序列被称为顺式因子,转录因子的DNA结合域和顺式因子实现共价结合,从而对基因的表达起抑制或增强的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
双荧光素酶测试系统及海肾类对照报告基因载体
1.什么是双荧光素酶报告基因测试系统(DLR)
DLR测试系统灵敏,方便,在一个系统中用于测量两个单独的荧光素酶报告基因,萤火虫荧光素酶及海洋海肾荧光素酶(Renilla reniformis),DLR测试系统可用于细胞裂解物及无细胞的翻译系统。
2.有哪些海肾荧光素酶载体
海肾荧光素酶载体pRL用于在转染的哺乳细胞中组成性地表达海肾荧光素酶。
这类载体还有T7启动子,可用T7RNA聚合物在体外合成海肾荧光素酶,有4个不同的载体:
A pRL-SV40载体??? pRL-SV40载体含SV40增强子及早期启动子区域,可在多种细胞中组成性地高表达海肾荧光素酶。
pRL-SV40载体还含有SV40的复制起始区,可在表达SV40大T抗原的细胞中,如COS-1,COS-7细胞中,瞬时及附加体似地复制。
B pRL-CMV载体pRL-CMV载体含有CMV极早增强子及启动子,可在多种细胞中组成性地高表达海肾荧光素酶。
a pRL-TK载体
pRL-TK载体含HSV胞嘧啶激酶启动子区域,在多种细胞中组成性地弱表达海肾荧光素酶。
b pRL-null载体
pRL-null载体缺真核启动子及增强子,在海肾荧光素酶基因的上游含有多克隆位点。
3.用双报告基因有何优点
一般地说,实验报告基因用于测试实验条件下基因的表达,而另一个报告基因作为内对照,以提供实验报告基因测试的归一化。
将实验报告基因的活力与内对照报告基因的活力作归一化可消除实验中不同测试间所固有的变化,这些变化减弱实验准确度,其中包括培养细胞的数目及活力的差异,细胞转染及裂解的效率。
海肾荧光素酶可用作对照报告基因及实验报告基因。
在双荧光素酶报告基因测试中,将萤火虫荧光素酶作为实验报告基因,海肾荧光素酶作为对照报告基因。
4.相比用CAT或β-半乳糖苷酶对表达数据作归一化,双荧光素酶报告基因测试系统有何优点
用双荧光素酶报告基因测试(DLR)有几个优点:
∙快速
∙DLR测试不需保温或对样品作预处理。
用被动裂解液将共转染有萤火虫及海肾荧光素酶基因的细胞裂解,制备细胞抽提物。
加入Stop&Glo试剂后,可同时湮灭萤火虫荧光素酶活力并激活海肾荧光
素酶发光,需立即测试海肾荧光素酶活性。
在几秒钟内可完成荧光素酶测试实验并作定量测试。
而其
他一些如CAT及β-gal的报告基因系统在定量前需要长时间的保温。
∙灵敏度
∙萤火虫及海肾荧光素酶的测试线性范围,是酶浓度的7个对数。
其他报告基因的灵敏度及线性应答受限。
通常不存在内源荧光素酶使背景活力低。
∙方便
∙在单管中完成测试,不需拆分样品,可用被动裂解液将培养在96孔板中的细胞快速裂解。
5.海肾荧光素酶与萤火虫荧光素酶相比的相对活性如何
在ATP,镁,及氧存在时,萤火虫荧光素酶作用于甲虫荧光素,而来源于海洋腔肠(Renilla reniformis)的荧光素酶在氧的存在下作用于海肾荧光素。
6.将两个报告基因载体作共转染应用什么条件
当用双荧光素酶报告基因测试系统来测量等重量的萤火虫荧光素酶及海肾荧光素酶时,可观察到它们释放的光几乎相等。
萤火虫荧光素酶的分子量为61kD,而海肾荧光素酶的分子量为36kD,当测试等重量的两个酶时,所测的海肾荧光素酶分子实际多69%。
如以每摩尔为基础,据实验确定,用双荧光素酶报告基因试剂测试的萤火虫荧光素酶的荧光强度比海肾荧光素酶强大约53%。
共转染质粒所含启动子间的反式效应有可能会影响到报告基因的表达。
当对照或实验报告基因载体含有很强的启动子/增强子时,需要特别加以注意。
载体pRL上的TK,SV40,CMV调节因子据报道可在大多数哺乳类细胞中表达,但它们在不同细胞中的表达水平不同。
载体pRL-TK中HSV胞嘧啶激酶启动子相对较弱,使海肾荧光素酶的组成性表达成低到中度水平。
早SV40极早CMV的增强子/启动子转录水平高,当实验载体所具有的调节因子较强时,这类启动子不太适用于双报告基因实验。
为使实验报告基因及对照报告基因的基因表达相对独立,每次实验时转染混和液中载体DNA的量及共转染报告基因载体的比例需作优化。
可采用实验载体与共转染报告基因载体的组成比在10:1到50:1或更大的范围,这有利于抑制启动子间的交互作用。
有时为有利于实验,共转染混和液中的实验载体应选择为少量部分。
7.需用荧光测试仪对双荧光素酶报告基因测试系统的荧光素酶作测定吗
作DLR测试时应使用荧光测试仪。
液闪仪的灵敏度相比太低,不易获得可重复的结果。
8.作荧光素酶报告基因测试时,如何使用单或双加样的荧光测试仪
对于单加样的荧光测试仪,在管子中预先加入荧光素酶测试试剂II,再加入细胞裂解物并测萤火虫荧光素酶的活力,接下来,用荧光测试仪上的加样管加入Stop&Glo试剂,并测海肾荧光素酶的活力。
对于双加样的荧光测试仪,在管子中加入细胞裂解物后,放入荧光测试仪中,从加样管I中加入荧光素酶测试试剂II并测萤火虫荧光素酶的活力,从加样管II中加入Stop&Glo试剂,并测海肾荧光素酶的活力。
需对背景作预测试的荧光测试仪需关闭这一功能。
9.如何从荧光测试仪中清理Stop&Glo试剂
Stop&Glo试剂中的一个荧光素酶湮灭成份对塑料物质有一定的亲和力。
这一组份对于自动加样管的塑料管及吸管的内壁有可逆结合。
接触过Stop&Glo试剂的加样管如没充分清洗,会将残留的湮灭试剂遗漏到随后通过加样管的溶液中。
如这样的情况发生,则非常少量的污染湮灭试剂就会极大地抑制萤火虫荧光素酶的活力。
因此在使用萤火虫荧光素酶测试中,如要用自动法加样LARII,则需对已接触Stop&Glo试剂的加样管作充分的清洗。
如荧光测试仪有两个加样管,则要将每个管子固定加样一种溶液。
在完成一次实验后必须彻底清洗,请按下面的步骤清洗管子并维修仪器。
普通加样管清洗步骤:
1,用3倍于吸管箱体积的去离子水反复清洗加样管子以除去Stop&Glo试剂。
2,准备70%的乙醇作为清洗试剂,用5ml70%的乙醇将箱及加样管完全清洗,可将加样管浸泡在这一溶液30分钟后,再用去离子水清洗。
3,注意:构造加样管子的材料有很大差异,有的吸管浸泡清洗试剂的时间需超过30分钟。
配有Teflon管子的荧光测试仪不会有太大问题,而其他如Tygon浸泡清洗试剂的时间需超过12-16小时(过夜)以完全除去Stop&Glo试剂。
4,用3倍于吸管箱体积的去离子水反复清洗加样管子以除去乙醇。
Turner Designs TD –20/20荧光测试仪中加样管的清洗: TD –20/20荧光测试仪需5次预循环以100%地将加样吸管中的溶液完全清除,然后按下列方法清除残留的Stop&Glo试剂:
1.用去离子水清洗吸管10次,清除残留的Stop&Glo试剂。
2.再用70%乙醇清洗10次,并用清洗液将管子浸泡30分钟。
3.再用去离子水清洗10次,清除残留的乙醇。
10.如何保存Stop&Glo试剂
将一定体积的Stop&Glo试剂保存在玻璃管及硅化的聚丙烯管子中,放在-70o C。
在未作处理的塑料管中,这一试剂不稳定。
11.50×Stop&Glo底物储存液的保存条件已作改变!1999二月。
Stop&Glo底物溶于Stop&Glo底物试剂中,所得50×贮液在-20o C会沉淀。
当沉淀发生时,50×贮液的颜色会改变,如用于测定海肾荧光素酶,则酶活力会降低。
最好新鲜配制50×贮液,并立即使用,如需保存,则将50×贮液保存-70o C达4周,活力不会改变。
12.被动裂解液与报告基因裂解液及细胞培养裂解试剂有何差别这三种裂解液能同双荧光素酶报告基因测试系统(DLR)一同使用吗
被动裂解液经特别配方以最有效地减小海肾荧光素酶底物海肾荧光素的自发荧光水平。
两个荧光素酶在被动裂解液中,室温可保存6小时。
报告基因裂解液原则上可用于制备细胞裂解物,并用于DLR测试,但实际上这不可行,因较被动裂解液会导致高一些的海肾荧光素的自发荧光水平。
细胞培养裂解试剂的海肾荧光素的自发荧光水平很高,不能被采用于制备DLR测试系统的细胞裂解物。
13.被动裂解液能裂解培养的植物细胞吗它能裂解哺乳动物组织所得的初级细胞吗
被动裂解液不能裂解植物细胞。
它能裂解一些类型的哺乳初级细胞。
一种细胞能否被它裂解需作测试。
14.加入Stop&Glo试剂后,还残留有萤火虫荧光素酶活性吗
萤火虫荧光素酶能立即被Stop&Glo试剂湮灭,残留有萤火虫荧光素酶活性低于0.001%。
15.荧光素酶测试试剂II是否是荧光素酶测试系统的同一试剂
荧光素酶测试试剂II不是荧光素酶测试系统的同一试剂。
荧光素酶测试试剂II经特定配方与Stop&Glo试剂混合,以最有效地测试海肾荧光素酶活性。
普通荧光素酶测试试剂不能替代用于DLR系统。
?
16.在测试阶段海肾荧光素酶活性的逐步丧失会使结果有何波动
当用自动加样管加Stop&Glo试剂时,不会带来波动。
用手动加Stop&Glo试剂时,据观察,海肾荧光素酶测试结果的波动可被忽约。
