第 6 章 1 可燃固体的燃烧
燃烧学 复习重点
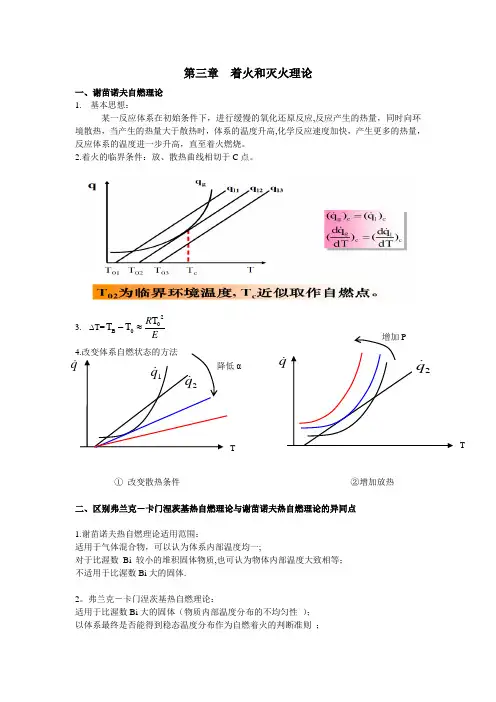
第三章 着火和灭火理论一、谢苗诺夫自燃理论 1. 基本思想:某一反应体系在初始条件下,进行缓慢的氧化还原反应,反应产生的热量,同时向环境散热,当产生的热量大于散热时,体系的温度升高,化学反应速度加快,产生更多的热量,反应体系的温度进一步升高,直至着火燃烧。
2.着火的临界条件:放、散热曲线相切于C 点。
3.∆T=ER 20B T T T ≈-① 改变散热条件 ②增加放热二、区别弗兰克-卡门涅茨基热自燃理论与谢苗诺夫热自燃理论的异同点1.谢苗诺夫热自燃理论适用范围:适用于气体混合物,可以认为体系内部温度均一;对于比渥数 Bi 较小的堆积固体物质,也可认为物体内部温度大致相等; 不适用于比渥数Bi 大的固体.2。
弗兰克-卡门涅茨基热自燃理论:适用于比渥数Bi 大的固体(物质内部温度分布的不均匀性 ); 以体系最终是否能得到稳态温度分布作为自燃着火的判断准则 ;Tq αT自燃临界准则参数 δcr 取决于体系的几何形状。
三、链锁自然理论 1。
反应速率与时间的关系 2.运用链锁自燃理论解释着火半岛现象 在第一、二极限之间的爆炸区内有一点P(1)保持系统温度不变而降低压力,P 点则向下垂直移动自由基器壁消毁速度加快,当压力下降到某一数值后,f < g, φ < 0 -—-------———-—--—--——-第一极限(2)保持系统温度不变而升高压力,P 点则向上垂直移动自由基气相消毁速度加快,当压力身高到某一数值后,f 〈 g , φ 〈 0 —-——-——-——————-—-—-———第二极限(3)压力再增高,又会发生新的链锁反应导致自由基增长速度增大,于是又能发生爆炸。
---3.基于f (链传递过程中链分支引起的自由基增长速率)和g (链终止过程中自由基的消毁w0w123M HO M O H +→++⋅22⋅⋅+→+OH O H H HO 222速率 )分析链锁自燃着火条件a.在低温时, f 较小(受温度影响较大),相比而言,g 显得较大,故:这表明,在 的情况下,自由基数目不能积累,反应速率不会自动加速,反应速率随着时间的增加只能趋势某一微小的定值,因此,f<g系统不会着火。
第六单元:《燃烧与燃料》知识汇总精讲(解析版)--九年级化学期末考点(鲁教版)

第六单元:《燃烧与燃料》知识汇总精讲【考点精讲】考点一、燃烧与灭火(1)定义:可燃物跟氧气发生的剧烈的发光、发热的氧化反应。
(2)条件:①物质具有可燃性; ②可燃物跟氧气充分接触;③可燃物的温度达到着火点以上(着火点:可燃物燃烧所需要的最低温度,是物质的固有属性,不能改变;着火点越低,越易燃烧);三者同时具备才可以燃烧。
(3)促进燃烧的方法:①增大氧气的浓度;②增大可燃物与氧气的接触面积; 燃烧分类:①充分燃烧:氧气充足;②不充分燃烧:氧气不足。
例如:(1)乙炔:(2)碳:氧气充足,化学方程式:C+O 2CO 2 ;氧气不充足2C+O 22CO ;(CO 中毒:与血红蛋白结合,失去运氧能力)2、灭火原理:破坏燃烧所需的条件,(只要破坏其中一个燃烧条件,就可灭火)。
方法:①隔绝氧气(如沙土覆盖); ②移走可燃物(如关闭煤气阀门); ③降低温度到着火点以下(如用水灭火)。
3、爆炸(1)分类:①物理爆炸:如气球吹爆、爆胎、锅炉爆炸等;②化学爆炸:燃放鞭炮、甲烷爆炸等。
(2)化学爆炸的条件:①可燃性气体或粉尘在空气中的含量达到爆炸极限; ②遇明火燃烧;③气体体积在有限的空间内急剧膨胀。
典例1 【2020云南】下列有关燃烧和灭火的说法正确的是( )乙炔 充分燃烧不充分燃烧 条件 氧气充足 氧气不充足现象 蓝色火焰、放热 黄色火焰、放热、浓烈黑烟 生成物 二氧化碳和水 一氧化碳(或炭黑)、水 方程式2C 2H 2+5O 22H 2O+4CO 2 2C 2H 2+3O 22H 2O+4COA.熄灭酒精灯时,用嘴吹灭B.通电的电热毯着火时,用水浇灭C.篝火晚会时,把木柴架空,有利于木柴充分燃烧D.只要可燃物的温度达到着火点,可燃物就能燃烧【答案】C【解析】A、熄灭酒精灯时,不能用嘴吹灭,应用灯帽盖灭,错误,不符合题意。
B、通电的电热毯着火时,不能用水浇灭,用水浇灭,会有触电的危险,错误,不符合题意。
C、篝火晚会时,把木柴架空,使木柴与空气充分接触,有利于木柴充分燃烧,正确,符合题意。
燃料与燃烧知识点归纳

第六章 燃烧与燃料第一节 燃烧与灭火一.燃烧的条件(重点)1.燃烧:是可燃物跟氧气发生的剧烈的发光、发热的氧化反应。
(1)燃烧的现象:发光、发热,反应剧烈。
(2)燃烧的反应类型:氧化反应,不一定是化合反应。
(3)燃烧的反应物:常见的燃烧都是可燃物跟氧气发生反应,但是,不是所有的燃烧都一定有氧气参加。
例如,镁就能在二氧化碳中燃烧:2Mg+CO 2点燃C+2MgO ;钠能在氯气中燃烧:2Na +Cl 2点燃2NaCl(4)燃烧的反应条件:点燃 (5)燃烧的分类及燃烧的产物注意:① “完全燃烧”和“不完全燃烧”又叫“充分燃烧”和“不充分燃烧” ② 要掌握含C 、H 、O 等元素的燃料完全燃烧的化学方程式: 2.燃烧的条件:①物质具有可燃性 ②可燃物要与氧气接触;③可燃物的温度达到其自身的着火点(即可燃物燃烧所需要的最低温度) 燃烧必须要同时满足三个条件,才能发生燃烧的现象。
二.灭火的原理:①.移走可燃物可燃物 ②.隔绝氧气③.使温度降到着火点以下1.灭火原理实质就是破坏物质燃烧的条件,三者破坏其一即可灭火。
2.几种常见的灭火方法:(1) 移走可燃物可燃物:森林火灾开辟隔离带,管道煤气着火先关掉阀门,釜底抽薪等; (2)隔绝氧气:酒精灯用等冒盖灭,油锅着火用用锅盖盖灭,向着火的木柴上覆盖沙子,少量酒精燃烧用湿抹布盖灭等;(3)使温度降到着火点以下:用水等大量的冷却剂灭火,用嘴将灯吹熄,(4)用灭火器灭火:①泡沫灭火器:可用于扑灭木材、棉布等燃烧而引起的一般火灾,不能用于扑灭电器火灾;②干粉灭火器:除了用来扑灭一般火灾外,还用于扑灭电器、油、气等燃烧引起的火灾;③液态二氧化碳灭火器:用于扑灭图书档案、贵重设备、精密仪器的火灾。
3.二氧化碳与灭火(1)原理:二氧化碳不能燃烧也不能支持燃烧,且密度比空气大。
(2)灭火器主要是用二氧化碳灭火,二氧化碳不能扑灭所有的火灾:如镁带燃烧就不能用二氧化碳扑灭。
4火灾处置、自救 (1)火警电话:119(2)电器、管道煤气、天然气着火,首先要关闭电源或气阀。
6.2固体废物的燃烧

⑺焚烧温度
焚烧过程到达的实际温度称为焚烧温度,指固体废物在 燃烧室内着火、分解、燃烧的温度水平,它比固体废物 的着火温度高得多。燃烧室及燃烧流程上温度水平不同。 提高焚烧温度有利于废物中有机有毒物质的分解和破坏。 通常,大多数有机固体废物的焚烧温度在800~1100℃之 间。
⑻停留时间
固体废物在焚烧炉中的燃烧停留时间为进入燃烧室加热干 燥至起燃的加热时间与固体废物燃尽的燃烧反应时间之和。 该时间受固体废物的粒径与密度的制约,粒径越大,停留 时间越长,而对于同种物料,密度决定于粒径大小。为使 焚烧停留时间缩短,投料前应预先经破碎处理。
物料所含水分越大,干燥时间越长,吸收的热量越多, 很容易降低炉膛内的温度,从而使着火难度增大。因 此干燥阶段需要很好的控制温度,如投入辅助燃料燃 烧,提高炉温,改善着火条件。
⒉ 燃烧阶段 当物料完成干燥后,如果炉膛内的温度足够高,且又有 足够的氧化剂,物料就会很快地进入燃烧阶段。燃烧阶 段包括了三个同时发生的化学反应模式:强氧化反应、热 解、原子基团碰撞。
yz yz Cx H y Clz x O xCO zHCl H 2O 2 2 4 2
式中 x、 y、z 分别为 C、 H、Cl 的原子数。 以上几个典型的氧化反应都是表示完全氧化反应的最终结果,其中还有若干中间反应。
⑵热解
热解是在缺氧或无氧条件下,利用热能破坏含碳高分子 化合物元素间的化学键,使含碳化合物破坏或者进行化 学重组的过程。 焚烧炉热解发生原因:由于物料组分的复杂性和其它因 素的影响,即使炉膛内具有过剩的空气量,在燃烧过程 中仍会有不少物料没有机会与氧充分接触,从而形成无 氧或缺氧条件。这部分物料在高温条件下就会发生热解。
6.2.6 影响固体废物燃烧的因素
第六章 生物质的直接燃烧
第6章生物质的直接燃烧燃料是通过燃烧将化学能转化为热能的物质,由燃料获取的热能在技术上是可以被利用的,在经济上是合理的。
生物质的燃烧是最普通的生物质能转换技术,它大体上可以分为炉灶燃烧、炕连灶燃烧和锅炉燃烧、炉窑燃烧等,其主要目的就是取得热量。
而燃烧过程产生的热量的多少,除与生物质本身的热值有关外,还与燃烧的操作条件和燃烧装置的性能密不可分。
因此,本章在介绍燃料燃烧计算的基础上,介绍几种生物质的燃烧设备。
6.1生物质燃烧的反应热力学和化学平衡所谓燃烧就是燃料中的可燃成分和氧化剂(一般为空气中的氧气)进行化合的化学反应过程;在反应过程中强烈放出热量,并使燃烧产物的温度升高。
尽管可燃成分并不是以元素形式存在,而是复杂的化合物,与氧发生燃烧反应产生一系列的化合分解反应,伴随热量的释放,但是作为物质平衡和能量平衡,可以通过可燃质元素及其化合物的热化学方程式计量,这些热化学方程式仅表示反应物与生成物之间的数量变化关系,与实际的反应历程无关。
6.1.1燃烧热力学生物质主要由碳、氢、氧三种主要元素和其他少量元素如硫、氮、磷、钾等组成。
在生物质中,磷、钾两种元素含量少且通常以氧化物的形式存在于灰分中,一般计算时不考虑。
由于氧不属于可燃成分,所以生物质的燃烧计算实际上是生物质中碳、氢、硫、氮及其化合物的反应与燃烧的计算。
生物质燃烧中,由于温度较低,一般认为大部分氮元素以N2的形式析出。
而硫的含量极低,有的生物质、甚至不含硫,所以生物质燃烧实际上就是C、H元素的化学反应和燃烧反应。
生物质燃烧时,生物质中C、H元素可能发生的化学反应及其反应热,见表6-1。
表6-1 生物质中的C、H元素的化学反应及反应热6.1.2化学反应平衡由于生物质中C、H、O元素占绝大多数,其他元素如N、S等数量较少,但后者经氧化反应后,产物是NOx、SOx。
这些产物对环境产生严重污染。
因此,尽管在热力学上研讨NO/空气、NO/ NO 2、SO 2/ SO 3的平衡也是同等重要的,但由于它们的真实含量是非常低的,所以在生物质的燃烧中通常不对这些组分的平衡关系加以讨论。
可燃固体定义

可燃固体定义【原创实用版】目录1.引言2.可燃固体的定义3.可燃固体的分类4.可燃固体的特性5.可燃固体的应用6.可燃固体的储存和运输7.结论正文【引言】在众多化学品中,可燃固体是一种特殊的物质,它既有固体的稳定性,又具有可燃性。
了解可燃固体的定义、特性、分类、应用、储存和运输对于科研、生产和安全管理具有重要意义。
本文将对可燃固体进行详细阐述。
【可燃固体的定义】可燃固体是指在常温下以固体状态存在,遇火源能燃烧或经过摩擦能产生可燃气体并燃烧的物质。
可燃固体可以是天然的,也可以是人造的。
它们在燃烧过程中会释放大量的能量,并产生大量的有害气体。
【可燃固体的分类】可燃固体可以根据其化学成分和性质进行分类。
常见的分类包括:1.有机可燃固体:如煤、棉花、木材、纸张等。
2.无机可燃固体:如硫磺、磷、钾、钠等。
3.混合型可燃固体:如炸药、火药等。
【可燃固体的特性】可燃固体的特性主要表现在以下几个方面:1.燃烧性:可燃固体在遇到火源或高温时能燃烧,产生大量的热和有害气体。
2.毒性:可燃固体燃烧时产生的气体可能对人体和其他生物造成毒害。
3.腐蚀性:部分可燃固体在燃烧或遇水时能产生腐蚀性物质,对环境和设备造成损害。
4.稳定性:可燃固体在常温下一般具有较好的稳定性,但在高温、高湿、氧化剂等条件下易发生自燃。
【可燃固体的应用】可燃固体在生产和生活中有广泛应用,如能源、化工、医药、农业等领域。
合理利用可燃固体的特性,可以提高生产效率,促进社会发展。
【可燃固体的储存和运输】由于可燃固体具有燃烧性,因此在储存和运输过程中需要严格遵守安全规定,防止事故发生。
具体措施包括:1.储存:可燃固体应储存在通风、干燥、远离火源的地方,并根据物质特性采取相应的防护措施。
2.运输:运输可燃固体的车辆应具有良好的密封性能,运输过程中要避免剧烈震动和撞击。
同时,要严格按照运输规定路线行驶,避免进入人口密集区。
【结论】可燃固体是一种具有燃烧性和潜在危险的化学品。
第6章 燃料的燃烧计算
6.2.1 理论烟气量和实际烟气量
标准状态下,l kg固体及液体燃料在理论空气 量下完全燃烧时所产生的燃烧产物的体积称为固 体及液体燃料的理论烟气量,用下式表示:
V VCO2 VSO2 V V
0 y 0 N2
0 H2O
Vy0 —标准状态下理论烟气量,m3/kg;
VCO2 —标准状态下 CO2 的体积,m3/kg;
2C+ O2 2CO 9270 kJ/kg(碳)
说明:
燃烧计算即燃烧反应计算,是建立在燃烧化学反应 的基础上的。在进行燃烧计算时,将空气和烟气均 看 作 为 理 想 气 体 , 即 每 kmol 气 体 在 标 准 状 态 ( t =273.15K, P =0.1013MPa)下其体积为 22.4m3,燃 料以 1kg 固体及液体燃料或标准状态下 1m3 干气体 燃料为单位。按照国家质量技术监督局规定,“标准 状态”不标在单位上,而是写在文字中。
VSO2 —标准状态下 SO2 的体积,m3/kg;
0 3 — 标准状态下理论 体积, m /kg; N VN 2 2
V
3 0 H2O —标准状态下理论水蒸气体积,m /kg。
13
22.4 1.866 m3 的 标准状态下,1 kg 的碳完全燃烧后产生 12 22 .4 0.7 m3 的 SO2 。 标准状态下, 1 kg 硫完全燃烧后产生 CO2 。 32
第6章 燃料的燃烧计算
6.1 燃烧所需空气量 燃烧是一种化学反应。
C+ O2 CO2 + 32860 kJ/kg(碳)
2H2 + O2 2H2O+120370
S+ O2 SO2 9050
kJ/kg(氢)
新编:第六单元 燃烧与燃料
第六单元燃烧与燃料第一节燃烧与灭火(第一课时)一、学习目标1、掌握燃烧的方法和灭火方法2、了解促进燃烧的方法3、初步掌握对获得的事实进行分析得出结论的科学方法。
二、重点:燃烧的的条件和灭火方法难点:燃烧条件的探究三、学习过程预习案请预习课本P118-121回答下列问题:1、燃烧的条件(1)燃烧:可燃物与发生的一种、、的剧烈的。
○1;(2)燃烧的条件:○2;○3达到燃烧所需的(即)注意:燃烧必须同时满足三个条件,有的燃烧不一定需要氧气,如:2Mg + CO22MgO + C2、灭火的方法(1)原理:破坏,使燃烧反应停止。
○1清除或使与其他物质隔离;(2)灭火的方法:○2隔绝;○3使温度降低到以下。
(1)增大;3、促进燃烧的方法(2)增大。
探究案探究活动一:探究燃烧的条件和灭火的方法学生活动一:在日常生活中,你知道哪些方法可以灭火?为什么这些方法可以灭火?小组内交流讨论,然后全体同学间展示。
学生活动二:把同学们想到的灭火方法按照主要目的进行分类,并填入下表灭火的方法采取这些方法的主要目的降低温度隔绝氧气移走可燃物学生活动三:反思:根据灭火的原理都是阻止燃烧反应的发生,你认为燃烧应具备的条件是什么?学生活动四:交流共享:回想一下前面学过的物质跟O2反应的现象,结合上面的内容,你认为什么是燃烧呢?学生活动五:尝试练习:1、使物质燃烧应具备的条件()A、只要有充分的氧气B、只要是可燃物质C、只要是可燃物达到了一定的温度D、可燃物达到了一定的温度,并有充足的氧气2、用水可以熄灭着火的木材,这是因为()A、水蒸发吸热,降低了木材的着火点B、水的密度比木材大C、水蒸发吸热,提高了木材的着火点D、水蒸发吸热,使温度降低到木材的着火点以下,且水蒸气还使木材与空气隔绝3、下列情况下所采取的灭火方法中,不恰当的是( )A、炒菜时油锅着火,立即盖上锅盖B、酒精灯不慎打翻起火时,用湿抹布扑盖C、电器因短路着火时,用水浇灭D、用液态二氧化碳灭火器扑灭图书、档案室的火灾探究活动二:探究促进燃烧的方法学生活动六:我们遇到过这样一些现象:(1)铁丝在空气中加热不能燃烧,但是在纯氧中加热能剧烈燃烧:(2)一张纸被揉成一团时燃烧不旺,而打开时燃烧很旺;(3)湿稻草不宜燃烧,且冒烟,干稻草却燃烧很旺。
第6章 固体废物热处理-1
• 空气系统 助燃空气系统,供氧,冷却炉排,混合物料,控制烟气气 流
一次助燃空气:炉排下送入的火焰下空气,空气量的 60~80% 助燃,冷却炉排,搅动炉料
二次助燃空气:火焰上空气,2次燃烧室空气 助燃,控制气量的湍流程度
• 烟气系统 主要污染源。
颗粒污染物:重力沉降,静电除尘,袋除尘 气体污染物:NOx,SOx,HCl等,吸收,吸附,氧化还原
6 焚烧技术
• 层状燃烧 稳定,成熟。广泛 垃圾在炉排上燃烧,炉排,气流带动垃圾层松动,下落,
翻转。改善透气性。 影响因素:炉型的设计,配风设计 • 流化燃烧 利用空气流,烟气流带动固废处于流化态 需要对原料破碎,热强度高,适合处理低热值,高含水
率垃圾 • 旋转燃烧 回转窑焚烧炉:筒体转动对物料进行翻动
2.工艺方案
(2)生产线配置 垃圾焚烧处理生产线(包括烟气净化)3条,
汽轮发电机组2组
二 固体废物的燃烧工艺 1、概述 固体废物焚烧的产物
可燃的固体废物基本是有机物,由大量的碳、氢、
氧元素组成。有些还含有氮、硫、磷和卤族等元素 。(与氧反应生成各种氧化物或部分元素的氢化物 ) • 有机碳→CO2 • 有机物中的氢→H2O • 有机硫和有机磷→SO2、SO3、P2O5 • 有机氮化物→气态氮+氮氧化物[可忽略不计] • 有机氟化物→HF(CF4、COF2) • 有机氯化物→HCI
7、影响固体物质燃烧的因素 (一)固体废物 •粒度:燃烧需要的时间大约与粒度的1~2次方正比。 •含水率: •热值:能源结构,生活水平习惯,季节,地理 •成分:可燃性,污染物质
(二)温度的影响 温度高,停留时间短。对减量化,无害化有决定影响
不少有毒物质需要高温才能有效分解,焚烧 一般要求温度在850~950,医疗垃圾,危险废物>1150 有难氧化分解危险废物时,甚至加入催化剂
第六章固体废物的热处理
系
–余热锅炉后,200~280℃
统
16
1
焚烧处理
PCDDs:
A 控制燃烧
焚
TCDDs PCDFs
温度和停留 时间; B 减少烟气
催化氧化 化学吸收
反应器
烟
烧
酸性气体: HF、 SOX、NOX、HCl
200~500℃ 氧化还原 停留时间; 湿式洗涤 C 有效净化 物理吸附
洗涤塔 吸附塔
气
工 重金属 汞、镉、铅
流化燃烧技术
旋转燃烧技术
焚
– 过程稳定、技术 – 较成熟,可处理 – 较成熟、效率高
成熟、应用广
低热值、高水分 – 回转窑焚烧炉
烧
– 固定炉排焚烧炉、 废物,但对入料 水平机械焚烧炉、 要求均匀化、细
– 滚筒、抄板
倾斜机械焚烧炉
小化
技等
– 流化床焚烧炉
– 辐射、烟气对流, – 空气流和烟气流
术
翻转及搅动 – 炉型设计和配风
热 解
造气
常
用
工
艺
造油
双塔循环式 转窑式
管式快速热解 电炉法
28
2 固体废物热解处理
SW热解造气是使其在一定温度下转变成
气体燃料。
热 解 常
1、双塔循环式工艺: 1)原料定量投入热解炉内;
热 解
用 2)与来自燃烧炉返回的砂混合;
造
工 3)热解炉内400-700℃热解生成燃气。 气
艺 4)气体进入净化系统,一部分供燃烧炉,
油
气液分离后,得到热解油和可燃气。
SW
一次破碎
5㎝
风选
干燥 金属类、玻璃
筛分
二次破碎 0.36 ㎜
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对于一定厚度无限大固体,可用下式估算: 对于一定厚度无限大固体,可用下式估算:
& = εσT 4 + K ⋅ TS − T0 Ql i αt
Gcr与 ϕ 有如下关系: 有如下关系:
h 3000 Gcr = ⋅ 1 + c ϕ ⋅ ∆H C
h为火焰和固体间的对流换热系数,c为空气热容量 为火焰和固体间的对流换热系数, 为空气热容量 为火焰和固体间的对流换热系数
常见高分子物质的自燃点
物质名称 棉花 报纸 白松
7
自燃点(℃) 物质名称 255 230 260 聚乙烯 聚氯乙烯 有机玻璃
自燃点(℃) 349 454 450~462
物质名称 聚酰胺 醋酸纤维素 硝酸纤维素
自燃点(℃) 424 475 141
氧指数测定仪
1—试样; 试样; 试样 3—点火器; 点火器; 点火器 5—支架; 支架; 支架 7—钢底盘; 钢底盘; 钢底盘 2—夹具; 夹具; 夹具 4—金属丝网; 金属丝网; 金属丝网 6—柱内玻璃珠; 柱内玻璃珠; 柱内玻璃珠 8—三通管; 三通管; 三通管
(τA) ⋅ ρ ⋅ c ⋅ dT dt = A ⋅ h ⋅ (T∞ − 2T + T0 )
T0
15
T∞
T∞ − T0 ⋅ ln ti = T + T − 2T h i ∞ 0
τρc
(4)当物体一面受热通量为的辐射加热,另一面绝热时 )当物体一面受热通量为的辐射加热, 假设物体吸收率为α,在时间间隔 内 假设物体吸收率为 ,在时间间隔dt内,能量平衡方程可写成
18
6.1.3.2 固体火焰传播理论
燃烧起始表面 — 指固体火焰传播时正在 燃烧的火焰与未燃物质 之间的界面, 之间的界面,穿过该界 面的传热速率决定了火 焰传播或火灾蔓延的速 度。 V
& Q
根据能量守恒方程, 火焰传播的基本方程” 根据能量守恒方程,“火焰传播的基本方程”为
& ρ ⋅ V ⋅ ∆h = Q
T∞ − T0 ⋅ ln ti = T −T h i ∞
τρc
(3)如果物体单面受热,另一面不绝热 )如果物体单面受热,
A ⋅ h ⋅ (T∞ − T ) ⋅ dt = (τA) ⋅ ρ ⋅ c ⋅ dT + A ⋅ h ⋅ (T − T0 )dt
A ⋅ h ⋅ (T∞ − 2T + T0 ) ⋅ dt = (τA) ⋅ ρ ⋅ c ⋅ dT
4
)(极限 (5)(极限)氧指数(LOI,OI) )(极限)氧指数( , 定义: 定义:刚好维持物质燃烧时的混合气体中最低氧含量的体积百分 数。 氧指数越小的高聚物,火灾危险性越大。 氧指数越小的高聚物,火灾危险性越大。 氧指数小于22的属易燃材料; 氧指数小于 的属易燃材料; 的属易燃材料 氧指数在22- 之间的属难燃材料 之间的属难燃材料; 氧指数在 -27之间的属难燃材料; 而氧指数大于27的属高难燃材料。 而氧指数大于 的属高难燃材料。 的属高难燃材料
相关参数: = × 相关参数:α=1.1×10-7 m2/s,K=0.19w/(m.K), , , , , △HC=26.2 KJ/g,LV=1.62 KJ/g,Gcr=3.2g/(m2.s) ψ=0.27,着火点Ti=543K,环境温度 =293K ,着火点 = ,环境温度T0=
13
薄片状固体( 数较小): 薄片状固体(Bi=hL/K数较小): 数较小 如窗帘、 如窗帘、幕布之类 估算薄物的引燃时间 假设一薄物体的厚度、密度、 假设一薄物体的厚度、密度、热容和它与周围环境间的对流换热系 数分别为τ、 、 、 数分别为 、ρ、c、和 h; ; 薄物体的燃点和环境温度(或物体初温)分别为 Ti和T0。 薄物体的燃点和环境温度(或物体初温) (1)当薄物体两边同时受温度为 ∞的热气流加热 )当薄物体两边同时受温度为T
& A ⋅ α Q 'r' ⋅ dt − h ⋅ A ⋅ (T − T0 )dt = τAρcdT
dt =
Qr
( )
& αQ − h(T − T0 )
'' r
τρc
dT
对该式从T 对该式从 0到Ti积分得引燃时间为
T0
& αQr'' τρc ti = ⋅ ln '' & − h(T − T ) h i 0 αQr
11
一些高聚物的Gcr和ϕ值
物质名称 聚甲醛 聚甲基丙烯酸甲酯 聚乙烯 聚丙烯 聚苯乙烯 Gcr g/(m2·s) 3.9 3.2 1.9 2.2 3.0 ϕ 物质名称 Gcr g/(m2·s) 4.4 6.5 5.6 5.4 6.0 ϕ
0.45 酚醛泡沫(GM—57) 0.27 1.9 2.2 3.0 聚乙烯—42%Cl 聚氨酯泡沫 聚异氰酸酯泡沫 聚乙烯—25%Cl
9—截止阀; 10—支持器内小孔; 截止阀; 支持器内小孔; 截止阀 支持器内小孔 11—压力表; 压力表; 压力表 12—精密压力调节器 精密压力调节器 13—过滤器; 14—针形阀; 过滤器; 针形阀; 过滤器 针形阀 15—转子流量计 转子流量计
8
表6-3 -
物质名称 聚苯乙烯 聚乙烯醇 聚氯乙稀 聚苯氧 聚砜 氧指数 18 22 45 28 32
2 A ⋅ h ⋅ (T∞ − T ) ⋅ dt = (τA) ⋅ ρ ⋅ c ⋅ dT
dT dt = ⋅ 2h T∞ − T
积分: 到 积分:t=0到ti;T=T0到Ti T∞
14
τρc
T∞ − T0 ti = ⋅ ln T −T 2h i ∞
τρc
(2)如果物体单面受热,另一面绝热,引燃时间为 )如果物体单面受热,另一面绝热,引燃时间为
某些常见高聚物的氧指数
物质名称 聚苯并咪唑 聚酰甲胺 聚糖醇 酚醛树脂 环氧树脂 氧指数 41 41 31 35 20 物质名称 氯丁橡胶 硅橡胶 缩醛共聚物 聚碳酸酯 聚四氟乙烯 氧指数 26 26~39 ~ 15 27 >95
9
6.1.3 固体着火燃烧理论
6.1.3.1 固体引燃条件和引燃时间
16
(5)如果一面受辐射热,另一面不绝热,则有 )如果一面受辐射热,另一面不绝热,
& A ⋅ α Q 'r' ⋅ dt − 2h ⋅ A ⋅ (T − T0 )dt = τAρcdT
& αQr'' ti = ⋅ ln '' & − 2h(T − T ) 2h i 0 αQr
( )
19
& Q V= ρ ⋅ ∆h
6.2 几类典型固体的燃烧
6.2.1 高聚物的燃烧
塑料、 塑料、橡胶和纤维 热塑型、 热塑型、热固型 高聚物着火的过程分为受热软化熔融、热分解、着火燃烧等阶段 高聚物着火的过程分为受热软化熔融、热分解、着火燃烧等阶段 受热软化熔融 热塑料物质容易软化熔融 高聚物燃烧的普遍性特点, 高聚物燃烧的普遍性特点,可以概括为三个方面 (1)发热量较高、燃烧速度较快 )发热量较高、 (2)发烟量较大,影响能见度 )发烟量较大, 由于高聚物的分子结构中含碳量普遍较高, 由于高聚物的分子结构中含碳量普遍较高 , 因此在其燃 包括热分解)过程中发烟量较大。 烧(包括热分解)过程中发烟量较大。
0.17 0.12 0.11 0.11 0.19
12
例 1: :
用一温度为1300℃的火焰紧靠表面照射一厚度为50mm的有机玻 ℃的火焰紧靠表面照射一厚度为 用一温度为 的有机玻 璃,如果表面温度达到燃点(约需6s)后移走火焰,判断该玻璃 如果表面温度达到燃点(约需 )后移走火焰, 板能否引燃? 板能否引燃?
20
烟密度箱
1—光电倍增管罩 ; 2—试验箱 ; 光电倍增管罩; 试验箱; 光电倍增管罩 试验箱 3—送风板; 送风板; 4—带窗的活动 送风板 带窗的活动 排气口控制器; 门 ; 5—排气口控制器 ; 6—辐 排气口控制器 辐 射仪输出插孔; 温度( ) 射仪输出插孔 ; 7—温度 ( 壁 )) 温度 指示器; 自耦变压器; 指示器 ; 8—自耦变压器 ; 9— 自耦变压器 炉子开关; 10—电压表 ; 11— 炉子开关 ; 电压表; 电压表 熔断器; 熔断器 ; 12—辐射仪空气流量 辐射仪空气流量 燃气和空气流量计; 计 ; 13—燃气和空气流量计 ; 燃气和空气流量计 14—流量计截流阀 ; 15—样品 流量计截流阀; 流量计截流阀 样品 移动调节器; 光源开关; 移动调节器 ; 16—光源开关 ; 光源开关 17—光源电压插孔 ; 18—线路 光源电压插孔; 线路 光源电压插孔 开关; 箱基; 指示灯; 开关 ; 19—箱基 ; 20—指示灯 ; 箱基 指示灯 21—微光度计 ; 22—光学体系 微光度计; 微光度计 光学体系 光学体系下透光窗; 杆 ; 23—光学体系下透光窗 ; 光学体系下透光窗 24—排气口调节器 ; 25—进气 排气口调节器; 排气口调节器 进气 口调节器;26—入口孔 口调节器; 入口孔
引燃条件: 引燃条件:
& & ϕ ⋅ ∆H C Gcr + Q E ≥ LV ⋅ Gcr + Q l & & S = (ϕ ⋅ ∆H C − LV ) ⋅ Gcr + Q E − Q l ≥ 0
如果 S<0,固体不能被引燃或只能发生闪燃; ,固体不能被引燃或只能发生闪燃; 如果 S>0,固体表面接受的热量除了能维持持续燃烧,还有多余 ,固体表面接受的热量除了能维持持续燃烧, 部分。这部分热量可以使可燃气的释放速率进一步提高, 部分。这部分热量可以使可燃气的释放速率进一步提高,为固 体持续燃烧创造更好的条件; 体持续燃烧创造更好的条件; S=0 固体能否被引燃的临界条件。 固体能否被引燃的临界条件 临界条件。
