基础物理化学实验
《物理化学基础实验》溶胶的制备及电泳实验

《物理化学基础实验》溶胶的制备及电泳实验一、实验目的1.学会制备和纯化Fe(OH)3溶胶。
2.掌握电泳法测定Fe(OH)3溶胶电动电势的原理和方法。
二、实验原理1.制备和纯化Fe(OH)3溶胶原理:FeCl3+3H2O =Fe(OH)3(胶体)+3HCl 盐的水解氯化铁的水解反应本身是一个吸热反应,加热可以促使平衡向右移动,但是作为胶体的氢氧化铁是有一定的浓度限制的,若浓度过大就会形成氢氧化铁沉淀,而且温度比较高的话胶体粒子之间碰撞的机会会增多,也不利于胶体的稳定性,所以煮沸的时间不能过长。
制成的胶体体系中常有其它杂质存在,而影响其稳定性,因此必须纯化。
常用的纯化方法是半透膜渗析法。
2.电泳在胶体分散体系中,由于胶体本身的电离或胶粒对某些离子的选择性吸附,使胶粒的表面带有一定的电荷。
同时在胶粒附近的介质中必然分布有与胶粒表面电性相反而电荷数量相同的反离子,形成一个扩散双电层。
当胶体相对静止时,整个溶液呈电中性。
但在外电场的作用下,胶体中的胶粒和分散介质反向相对移动时,胶粒向异性电极定向泳动,这种胶粒向正极或负极移动的现象称为电泳。
荷电的胶粒与分散介质间的电势差称为电动电势,用符号ξ表示。
ζ电势是表征胶粒特性的重要物理量之一,在研究胶体性质及实际应用中有着重要的作用。
它与胶体的稳定性有关, ζ绝对值越大,表明胶粒电荷越多,胶粒间斥力越大,胶体越稳定。
界面移动法:测量溶胶的 电位是通过测定在两铂电极间外加一定直流电场,胶体溶液与辅助溶液间可见界面在单位时间内的移动距离来测定电动电势。
在电泳仪的两极间加上电位差E (V )后,在t (s )时间内溶胶界面移动的距离为D (m ),即胶粒的电泳速度U (m •s -1)为: D U t = (1)相距为l (m )的两极间的电位梯度平均值H (V •m -1)为: E H l = (2)从实验求得胶粒电泳速度后,可按照下式求出ζ(V )电位: K U H πηζε=⋅ (3)式中K 为与胶粒形状有关的常数,对于本实验中的氢氧化铁溶胶,胶粒为棒形,有1022113.610K V s kg m --=⨯⋅⋅;而ε为介质的介电常数(无单位),η为介质的粘度(Pa •s )。
物理化学实验
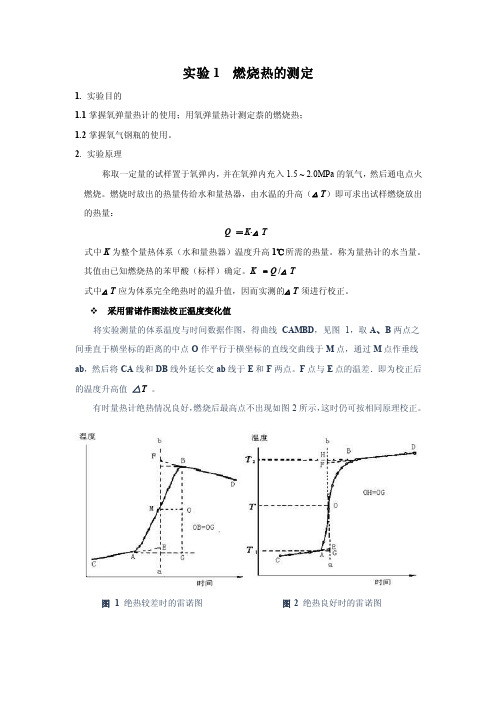
实验1 燃烧热的测定1. 实验目的1.1掌握氧弹量热计的使用;用氧弹量热计测定萘的燃烧热;1.2掌握氧气钢瓶的使用。
2. 实验原理称取一定量的试样置于氧弹内,并在氧弹内充入1.5 ~ 2.0MPa的氧气,然后通电点火燃烧。
燃烧时放出的热量传给水和量热器,由水温的升高(△T)即可求出试样燃烧放出的热量:Q=K·△T式中K为整个量热体系(水和量热器)温度升高1℃所需的热量。
称为量热计的水当量。
其值由已知燃烧热的苯甲酸(标样)确定。
K =Q /△T式中△T应为体系完全绝热时的温升值,因而实测的△T须进行校正。
采用雷诺作图法校正温度变化值将实验测量的体系温度与时间数据作图,得曲线CAMBD,见图1,取A、B两点之间垂直于横坐标的距离的中点O作平行于横坐标的直线交曲线于M点,通过M点作垂线ab,然后将CA线和DB线外延长交ab线于E和F两点。
F点与E点的温差.即为校正后的温度升高值△T。
有时量热计绝热情况良好,燃烧后最高点不出现如图2所示,这时仍可按相同原理校正。
图 1 绝热较差时的雷诺图图2 绝热良好时的雷诺图3. 仪器与试剂3.1试剂:分析纯苯甲酸(QV=26480 J·g-1);待测样;引火丝(Ni-Cr丝,QV=8.4 J·cm -1)3.2仪器:HR-15A数显型氧弹量热计一台;压片机(苯甲酸和萘各用一台);精密贝克曼温差温度计(精确至0.01 ℃,记录数据时应记录至0.002 ℃);台秤一台;分析天平一台。
4. 实验步骤4.1水当量的测定(1)打开控制箱预热。
(2)量取10 cm引火丝并准确称重。
(3)在台秤上粗称试样1 g ~ 1.2 g;用压片机压片,同时将燃烧丝压入。
准确称重,减去引火丝重量后即得试样重量。
注意压片前后应将压片机擦干净;苯甲酸和待测试样不能混用一台压片机。
(4)将氧弹盖放在专用架上,将点火丝两端固定在氧弹电极上点火丝切勿接触坩锅,以防短路。
(5)取少量(~2 mL)水放入氧弹中(吸收空气中的N2燃烧而成的HNO3),盖好并拧紧弹盖,接上充气导管,慢慢旋紧减压阀螺杆,缓慢进气至表上指针为1.5 ~ 2.0 MPa。
物理化学实验

实验一、异丙醇——环己烷双液系相图1.标准曲线的绘制2.用阿贝折射仪测量已知组成的异丙醇—环己烷标准溶液的折射率(已配好),绘制标准曲线(横坐标浓度,纵坐标折射率)2. 相图的测定(一起12组数据)2.1. 25ml异丙醇加入1ml环己烷,加热至沸腾,温度基本保持不变时记录沸点T,分别测量气相成分和液相成分的折射率,得第一组数据;待样品冷至室温,再加入1ml,测量沸点,气、液相的折射率,得第二组数据;再加入1ml环己烷(第三组数据);再加1ml(第四组数据);再加1ml(第五组数据);再加5ml(第六组数据)。
2.2. 25ml环己烷分别加入1ml、2ml、3ml、4ml、5ml、10ml异丙醇,同步骤2,得到六组数据。
3.绘制相图(圆滑曲线,适当取舍某些误差很大的点)4.4. 从相图上得出恒沸温度和恒沸组成,与理论值进行对比分析,求出误差并分析其原因。
5. 该实验要求掌握好阿贝折射仪的正确使用(参见实验教材P260)实验二、乙酸乙酯皂化反应实验操作步骤1.实验准备准确读取室温并记录5.2. 电导率仪的调节2.1 开机预热10min; 2.2 选择双向开关调到校正(按下为校正);2.3 调节温度为25℃; 2.4 调节合适的量程(×1);2.5调节电极标准电导率值(标准值见电极标签)。
3. κ0的测量 3.1 将50ml烧杯洗净,用0.0100mol.L-1NaOH溶液淋洗2-3次,再加入适量0.0100mol.L-1NaOH溶液;3.2 用0.0100mol.L-1NaOH溶液淋洗电极2-3次后放入待测溶液;3.3连接电导率仪,选择双向开关调到测量; 3.4 调节量程至电导率仪正确显示;3.5 温度补偿,将温度调至室温;3.6 准确读数并记录(数值和单位准确);3.7 每隔2min读数一次,共读三次,清洗电极,准备下一步实验。
4. κt的测量4.1 正确清洗电极和双管电导池,方法同上;4.2 准确移取NaOH和CH3COOC2H5溶液至双管电导池;4.3 A管盖上装好电极的橡皮塞,B管盖上带洗耳球的橡皮塞;4.4 将B管中的CH3COOC2H5溶液压至A管中,不要用力过猛;4.5 压入一半时开始计时,反复压几次,使溶液混合均匀;4.6 每隔2min读数一次,直至电导率数值变化不大时停止实验;4.7 准确读数并记录。
基础物理化学实验

基础物理化学实验
基础物理化学实验是一种重要的实验,它是物理化学学习的
基础。
它可以帮助学生更好地理解物理化学的基本原理,并且可
以帮助学生更好地掌握实验技能。
基础物理化学实验的内容包括:温度测量、溶液浓度测量、
溶液滴定、溶液混合、溶液沉淀、溶液沉淀检测、溶液沉淀抽滤、溶液沉淀洗涤、溶液沉淀结晶、溶液沉淀沉淀等。
基础物理化学实验的目的是帮助学生更好地理解物理化学的
基本原理,并且可以帮助学生更好地掌握实验技能。
它可以帮助
学生更好地理解物理化学的基本原理,并且可以帮助学生更好地
掌握实验技能。
基础物理化学实验的实施需要学生具备一定的实验技能,包
括实验室安全、实验设备的使用、实验步骤的掌握、实验数据的
记录和分析等。
基础物理化学实验是一种重要的实验,它可以帮助学生更好
地理解物理化学的基本原理,并且可以帮助学生更好地掌握实验
技能。
它可以帮助学生更好地理解物理化学的基本原理,并且可
以帮助学生更好地掌握实验技能。
此外,它还可以帮助学生更好
地理解物理化学的基本原理,从而更好地应用物理化学知识。
《物理化学基础实验》银-氯化银电极的制备及热力学函数的测定实验

《物理化学基础实验》银-氯化银电极的制备及热力学函数的测定实验一、实验目的1.测定化学电池在不同温度下的电动势,计算电池反应的热力学函数r G m、rH m和rS ;2.学会银—氯化银电极的制备方法; 3.掌握电位差计的测量原理和使用方法。
二、实验原理电池除可用作电源外还可以用来研究构成此电池的化学反应的热力学性质,从化学热力学知道,在恒温,恒压,可逆的条件下,其电池的吉布斯自由能增量r G m与电池电动势E 有以下关系:zFE G m r -=∆ (1)根据吉布斯-亥姆霍兹公式,rG m 反应热rH m ,熵变rS m 和温度T 的关系为:m r pmr m r m r S T TG T H G ∆-=⎪⎪⎭⎫⎝⎛∂∆∂=∆-∆ (2) 带入(1)式可得p m r T E zFT zEF H ⎪⎭⎫⎝⎛∂∂+-=∆ (3)pm r T E zF S ⎪⎭⎫⎝⎛∂∂=∆ (4)因此,在恒压下(一般在常压下),测量一定温度T 时的电池电动势E ,即可求得电池反应的rG m 。
测定不同温度下的电动势,最后以电动势对温度作图, 即可从曲线求得电池的温度系数pT E ⎪⎭⎫⎝⎛∂∂。
利用(3)和(4)式,即可求得rH m 和rS m 。
如果电池反应中,反应物和生成物的活度系数均为1,温度为298K ,则所测定的电动势和热力学函数即为:E θ,mr H θ∆和r m S θ∆。
例如,电池:Ag|AgCl|KCl(a)|Hg 2Cl 2|Hg 在放电时,左边为负极,起氧化反应Ag+Cl -(a)= AgCl +e -其电极电势为:ϕAgCl/Ag =θϕAgCl/Ag –(RT/F )lna(Cl -) 右边为正极,起还原反应 1/2 Hg 2Cl 2+ e-= Hg + Cl -其电极电势为:Hg Cl Hg /22ϕ=θϕHgCl Hg /22–(RT/F )lna(Cl -) 总的电池反应为:Ag+1/2 Hg 2Cl 2= AgCl + Hg电池电动势为:E = Hg Cl Hg /22ϕ-ϕAgCl/Ag =θϕHgCl Hg /22-θϕAgCl/Ag =E θ由此可知,若在298K 测定该电池电动势,即可求得E θ,由(1)式求得G θ。
《物理化学基础实验》差热分析实验

《物理化学基础实验》差热分析实验一、实验目的1.用差热-热重分析仪绘制CuSO4·5H2O的差热图谱。
2.了解差热-热重分析仪的工作原理及使用方法。
二、实验原理物质在受热或冷却过程中,当达到某一温度时,往往会发生熔化、凝固、晶型转变、分解、化合、吸附、脱附等物理或化学变化,并伴随着有焓的改变,因而产生热效应,其表现为物质与环境(样品与参比物)之间有温度差。
差热分析(Differentiai Thermal Analysis,简称DTA)就是通过温差测量来确定物质的物理化学性质的一种热分析方法。
记录时间-温度(温差)的图就称为差热图谱。
从差热图谱上可清晰地看到差热峰的数目、位置、方向、宽度、高度、对称性以及峰面积等。
峰的数目表示物质发生物理化学变化的次数;峰的位置表示物质发生变化的转化温度;峰的方向表明体系发生热效应的正负性;峰面积说明热效应的大小:相同条件下,峰面积大的表示热效应也大。
在相同的测定条件下,许多物质的差热图谱具有特征性:即一定的物质就有一定的差热峰的数目、位置、方向、峰温等,因此,可通过与已知的差热谱图的比较来鉴别样品的种类、相变温度、热效应等物理化学性质。
因此,差热分析广泛应用于化学、化工、冶金、陶瓷、地质和金属材料等领域的科研和生产部门。
理论上讲,可通过峰面积的测量对物质进行定量分析,但影响因素较多。
本实验仅做定性分析。
三、仪器和试剂仪器:差热-热重分析仪(HCT-2型) 、坩埚、药匙药品:CuSO4·5H2O(分析纯)、α-Al2O3(分析纯)四、实验步骤1. 打开仪器电源,预热30 min,接通冷却水。
2. 装样品:在干净的坩埚内装入约1/2~2/3坩埚高度的CuSO4·5H20粉末并将其颠实,准确称量样品质量。
将其放在样品托的右托盘上。
另取一只坩埚装入等量的α-Al2O3,将其放在样品托的左托盘上,盖好保温盖。
3.打开热分析软件,点击新采集,将升温速率设定为10 ℃·min-1,最高温度450 ℃,填好样品相关信息,点击确定,开始升温。
基础化学实验(物理化学)_湖南大学中国大学mooc课后章节答案期末考试题库2023年

基础化学实验(物理化学)_湖南大学中国大学mooc课后章节答案期末考试题库2023年1.有两位同学进行蔗糖水解实验时,所用盐酸溶液浓度为c1,蔗糖溶液浓度为c2。
他们分别用等体积的盐酸与蔗糖溶液混合,不等体积的盐酸与蔗糖溶液混合,他们所测得的反应终止时体系旋光度分别为α1和α2,则:答案:α1¹α22.对旋光度不变的某样品,若用长度为 10 cm, 20 cm 的旋光管测其旋光度,测量值分别为α1,α2,则:答案:2α1=α23.蔗糖水解反应为:C12H22O11+H2O———>C6H12O6(葡萄糖)+C6H12O6(果糖) 下列说法正确的是:答案:该反应为一级反应, H2O在反应前后浓度变化很小4.某同学做蔗糖转化实验时,记录反应数据的时间偏晚,对测定反应速率常数k值有无影响?答案:无影响5.溶液的旋光度与下列哪个因素无关?答案:压力6.乙酸乙酯皂化反应的动力学实验中,为了测定乙酸乙酯的浓度变化,可用物理法,选用的测量仪器是:答案:电导率仪7.对于乙酸乙酯皂化反应下列哪种说法是不正确的?答案:在此反应溶液中,CH3COONa是不完全电离的8.在极化曲线测定的实验装置中,都配有鲁金毛细管, 它的主要作用是:答案:降低溶液欧姆电位降9.一般的氢超电势由下列部分组成:答案:欧姆超电势、浓差超电势、活化超电势10.丙酮碘化反应是:答案:复杂反应11.使用分光光度计测量吸光度,为了使测得的吸光度更精确,则应:答案:选择合适的波长,比色皿及溶液浓度,使吸光度值落在 0 ~ 0.8 区间内12.用最大气泡压力法测定溶液表面张力的实验中,对实验实际操作的如下规定中哪一条是不正确的?答案:毛细管垂直插入液体内部,每次浸入深度尽量保持不变13.溶液表面张力实验中,某一组实验发现,所测最大压力差明显偏大,且无气泡产生,最可能的原因是:答案:毛细管尖端被堵住14.在用最大气泡法测定表面活性物质水溶液的表面张力实验时,当气泡所承受的压力差达到最大时,气泡的曲率半径r与毛细管的内径R之间的关系为:答案:r=R15.常温下一般液体的表面张力不大,毛细管的内径为:答案:0.2-0.3mm16.在测定毛细管常数K时,标准物质的表面张力与待测液体的表面张力要在相同的温度下尽可能接近。
《物理化学基础实验》旋光法测定蔗糖转化反应的速率常数实验

《物理化学基础实验》旋光法测定蔗糖转化反应的速率常数实验一、实验目的了解蔗糖转化反应体系中各物质浓度与旋光度之间的关系;测定蔗糖转化反应的速率常数和半衰期;了解旋光仪的基本原理,掌握其使用方法。
二、实验原理蔗糖转化反应为:C12H 22O 11(蔗糖)+H 2O → C 6H 12O 6(葡萄糖) + C 6H 12O 6(果糖)为使水解反应加速,常以酸为催化剂,故反应在酸性介质中进行。
由于反应中水是大量的,可以认为整个反应中水的浓度基本是恒定的。
而H +是催化剂,其浓度也是固定的。
所以,此反应可视为准一级反应。
其动力学方程为dckc dt-= (1) 式中,k 为反应速率常数;c 为时间t 时的反应物浓度。
将(1)式积分得:0ln c kt ln c =-+ (2)式中,C 0为反应物的初始浓度。
当C=1/2C 0时,t 可用t 1/2表示,即为反应的半衰期。
由(2)式可得:12ln 20.693t k k== (3) 蔗糖及水解产物均为旋光性物质。
但它们的旋光能力不同,故可以利用体系在反应过程中旋光度的变化来衡量反应的进程。
溶液的旋光度与溶液中所含旋光物质的种类、浓度、溶剂的性质、液层厚度、光源波长及温度等因素有关。
为了比较各种物质的旋光能力,引入比旋光度的概念。
比旋光度可用下式表示:[]tD lcαα= (4)式中,t 为实验温度(℃);D 为光源波长;α为旋光度;l 为液层厚度(m);c 为浓度(kg ·m -3)。
由(4)式可知,当其它条件不变时,旋光度α与浓度c 成正比。
即:Kc α= (5)式中的K 是一个与物质旋光能力、液层厚度、溶剂性质、光源波长、温度等因素有关的常数。
在蔗糖的水解反应中,反应物蔗糖是右旋性物质,其比旋光度[]︒=6.6620D α。
产物中葡萄糖也是右旋性物质,其比旋光度[]︒=5.5220D α;而产物中的果糖则是左旋性物质,其比旋光度[]︒-=9.9120D α。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Northwest University
化学国家级实验教学示范中心
五、实验总结
(二) 讨论
旋光度对温度比较敏感,温度升高会使旋光管的长度 增大,但使液体的密度有所降低,有时还会涉及旋光物质 分子不同构型平衡态之间的改变,以及溶剂-溶质分子之 间相互作用的改变等内在因素。在要求不太高的测量中可 以将旋光仪放在空气恒温箱内,用普通的样品管进行测量, 但要求被测试样预先恒温,然后注入样品管,再恒温3~5 min进行测量。
时间间隔? 什么时候结 束反应?
???多少mL蔗 糖与多少mL,浓 度为?的盐酸溶液
混合。
Northwest University
化学国家级实验教学示范中心
四、注意事项
1.旋光管管盖只要旋至不漏液即可,不可过度旋压。旋得 过紧会造成小玻璃片损坏,或因玻片受应力而产生一种 附加的假偏振作用,给测量造成误差。。
Northwest University
化学国家级实验教学示范中心
基础化学实验Ⅲ (物理化学实验)
旋光法测定蔗糖转化反 应的速率常数
Northwest University
化学国家级实验教学示范中心
知识点及实验技能训练要点
知识点:
速率常数、半衰期、旋光性、旋光与浓度关系。
实验技能训练要点:
旋光仪的使用、恒温水浴的使用(均为首次训练)
反过来添加? 3. 在测量蔗糖转化速率时,选用长的旋光管好,还是短的旋
光管好? 4. 旋光度与哪些因素有关??
2.在混合蔗糖和盐酸溶液时,将盐酸加到蔗糖溶液,不能 将蔗糖加到盐酸溶液中。为什么?
3.旋光管装样时其中不能有气泡。
Northwest University
化学国家级实验教学示范中心
五、实验总结
(一) 数据处理
根据实验数据,以ln(αt-α∞) 对t作图,得一直线,从直
线的斜率计算反应速率常数k值,并计算反应半衰期。用微 机处理。
Northwest University
化学国家级实验教学示范中心
六、实验延伸
活化能测定:
测定不同温度下的速率常数,根据阿仑尼乌斯方程
可求算反应的活化能E。
Northwest University
化学国家级实验教学示范中心
七、思考题
1. 配置蔗糖溶液时称量不够准确,对测量结果是否有影响 ? 2.蔗糖和盐酸反应时,是将哪个溶液加入到哪个溶液中?可否
Northwest University
化学国家级实验教学示范中心
三、实验步骤
1. 旋光仪的零点校正
用蒸馏水校正旋光仪的零点,样品管装满蒸馏水,管 内不应有气泡。将旋光管放入仪器样品室中,按下“清 零”键,使读数显示为零。
2. 溶液的配制
溶液需要配多少? 浓度为多少?浓
度需要精确配置
吗?
在锥形瓶内,称取 20.0 g 蔗糖,加入100 mL蒸馏水,
值。
该实验用旋光仪来间接测定x值。
Northwest University
化学国家级实验教学示范中心
半衰期:
t1/ 2
ln 2 k
0.693 k
说明:H+离子起催化作用;水大量存在的,尽管有
部分参加反应, 但在整个反应过程中仍可近似地
认为其浓度恒定。因此蔗糖转化反应可看作为准
一级反应;蔗糖是右旋性物质,其比旋光度[α]D20 =66.60; 葡萄糖是右旋性物质,其比旋光度[α]D20 =52.50;果糖是左旋性物质, 其比旋光度[α]D20 =91.90; [α]D20 =100α/(c.l),c单位为100ml溶液所 含样品质量(g)。
c
c
该反应的动力学方程式为:
dx k(c x)(55.55 x) k(c - x),(55.55>>c) dt
Northwest University
化学国家级实验教学示范中心
积分得:
k为反应速率常数。如 果测得不同时刻t的x
ln c kt c-x
值(???),则可求出相 应的k。若k值为常数, 则证明该反应为一级
旋光度与物质浓度成正比,所以有:
反应。
t=0 体系旋光度 α0=βc t=∞ 体系旋光度 α∞=γc t=t 体系旋光度 αt=β(c-x)+γx
若以 (αt-α∞)对t
作图得一直线, 证明是一级反
将以上关系代入一级动力学积分式,有: 应,并可从直
线的斜率求出k
ln(t - ) ln(0 - ) - kt
Northwest University
化学国家级实验教学示范中心
一、实验目的 二、实验原理 三、实验步骤 四、注意事项 五、实验总结 六、实验延伸 七、思考题
Northwest University
化学国家级实验教学示范中心
一、实验目的
1、测定蔗糖转化反应的速率常数和半衰期; 2、了解反应的反应物浓度与旋光度之间的关系; 3、了解旋光仪的基本原理,掌握旋光仪的正确使
用方法。
Northwest University
化学国家级实验教学示范中心
二、实验原理
蔗糖在水中转化成葡萄糖与果糖,其反应为:
C12H22O11(蔗糖) H2O H C6H12O(6葡萄糖) C6H12O(6果糖)
t=0 c
55.55
0
0
t = t c-x
55.55-x
x
x
t →∞ 0
55.55-c
使蔗糖完全溶解。若溶液混浊,则需要过滤。
Northwest University
化学国家级实验教学示范中心
3.反应过程的旋光度测定
将恒温水浴和恒温箱都调节到反应所需的温度,蔗糖、 盐酸恒温一段时间,盐酸加入到蔗糖中,开始反应计时, 并测定反应过程中的旋光度。
将反应液放入50-60 oC水浴中反应,冷至实验温度下测 试旋光度,即得α∞ 。
