物理化学相平衡(精选)
物理化学-相平衡

= = =
p1 T1 m1 p2 T2 m2
(3) 相平衡:任一物质B各相化学势相等
m相1(B)=m相2(B) = ···=m相P(B) (P–1)等式
S 种物质存在 S(P-1) 关系,应扣 S(P-1)
恒 p 时,知 pA*(T) 和 pB*(T),可算 xB, yB
相平衡
典型相图 与p-x(y)图相比,形状相当于上下倒转
点: 单相区:如点a ,
相点与系统点一致
两相区:如点b,相
点与系统点不一致
线:气相线称露点线 液相线称泡点线
区域: 单相: P=1,F=2 两相: P=2,F=1
t/℃
110 C 100 90
形成固溶体时与液相类似。
注意: 某相存在的量很少可忽略时,则可不算。 如:凝聚系统不考虑气相。
相平衡
5. 相律F=C-P+2中的 2 表示系统T , p 可变
若T 或 p 之一不变时,只有1个强度量 可变,相律式变为
F = C-P + 1
二组分系统相图分析或凝聚系统 压力影响小可略时,常用此式。
相平衡
相平衡
本章要点
掌握:相律,单组分、双组分系统的典型 相图,杠杆规则的应用
相图:会分析,能画(稍难)
应用:多组分系统的分离、提纯 均匀性(多相性) 控制产品的质量
相平衡
5.1 相 律
问题:封闭 系统中影响相态的因素有哪些? 例如:盐与水系统达相平衡时存在多少相?
什么时候出现固相(盐析出)?为什么?
露
t
l+g 泡
点 线
物理化学课件第六章节相平衡

热力学性质测定
利用热力学仪器测量物质的热容、 熵、焓等热力学性质,推算相平衡 常数。
相分离实验
观察不同条件下物质是否发生相分 离,确定相平衡状态。
计算方法
热力学模型法
利用热力学模型计算相平衡常数, 如van der Waals方程、 Redlich-Kister方程等。
表达式
ΔU = Q + W
应用
计算封闭系统中能量的变化,以及热量和功之间的转换关系。
热力学第二定律
热力学第二定律定义
自然发生的反应总是向着熵增加的方向进行,即系统总是向着更 加混乱无序的状态发展。
表达式
ΔS ≥ 0
应用
判断反应自发进行的方向,以及热量传递和转换的方向。
热力学第三定律
热力学第三定律定义
液液相平衡的应用
液液相平衡是指两种不同物质液体之 间达到平衡状态的过程。
液液相平衡在工业上有广泛应用,如 石油工业中的油水分离、化学工业中 的萃取过程等。
液液相平衡的原理
当两种液体混合达到平衡时,各组分 的浓度不再发生变化,系统达到动态 平衡状态。
05 相平衡的实验测定与计算 方法
实验测定方法
蒸气压测定
分子模拟法
利用计算机模拟分子运动,计算 分子间的相互作用力和相平衡常
数。
统计力学法
利用统计力学原理计算相平衡常 数,如Maxwell
分子动力学模拟
模拟分子在相平衡状态下的运动轨迹,分析分子 间的相互作用和排列方式。
Monte Carlo模拟
通过随机抽样方法模拟分子在相平衡状态下的分 布和排列,计算相平衡常数。
界面张力
相界面上的物质传递是相平衡的重要特征之一,界面张力的大小对于物 质在相界面上的吸附、溶解和传递等过程具有重要影响。研究界面张力 有助于深入理解相平衡的机制和规律。
物理化学 第五章 相平衡

一、基本概念和公式 (一)几个基本概念 1. 相和相数 (1)相 (phase) 系统内部物理和化学性质完全均匀的部分称为相。 特点 相与相之间在指定条件下有明显的界面, 在界面上宏观性质的改变是飞跃式的。 (2)相数 (number of phase) 系统中相的总数称为相数,用 表示。 气体:
(三)二组分系统的相图及应用
(3) 同时具有最高、最低会溶温度 (4) 不具有会溶温度
(三)二组分系统的相图及应用
4. 不互溶双液系 (1) 特点 如果A,B 两种液体彼此互溶程度极小,以致可忽略 不计。则A与B共存时,各组分的蒸气压与单独存在时一 样,液面上的总蒸气压等于两纯组分饱和蒸气压之和。 * * 即: p pA pB 当两种液体共存时,不管其相对数量如何,其 总蒸气压恒大于任一组分的蒸气压,而沸点则恒低 于任一组分的沸点。 (2) 水蒸气蒸馏
CaF2 ( A)
0 .6
0 .8
1 .0 CaCl2 ( B)
(三)二组分系统的相图及应用
(3) 相合熔点 A和B形成的化合物有确定的熔点,完全熔化时不 分解,在熔点时液相和固相的组成相同,所以稳定化 合物的熔点称为相合熔点。 (4) 不相合熔点 因为C没有自己的熔点,将C加热,到O点温 度时分解成 CaF2 (s) 和组成为B的熔液,所以将O点 的温度称为转熔温度(peritectic temperature)也 叫异成分熔点或不相合熔点。
(四)三组分系统的相图及其应用
(d) 如果代表两个三个组分 系统的D点和E点,混合成新 系统的物系点O必定落在DE 连线上。哪个物系含量多, O点就靠近哪个物系点。 O点的位置可用 杠杆规则求算。
mD OD mE OE
物理化学相平衡

物理化学相平衡在我们生活的这个世界里,物质以各种各样的形式存在着,它们之间的相互转化和共存遵循着一定的规律,这就是物理化学中的相平衡。
相平衡研究的是在不同条件下,物质的不同相之间的平衡关系。
它不仅是物理化学的重要组成部分,也在许多实际领域,如化工、材料科学、地质科学等,发挥着关键作用。
让我们先来理解一下什么是“相”。
简单来说,相是指系统中物理性质和化学性质完全均匀的部分。
比如说,一杯水就是一个单相系统,因为水的性质在整个杯子中是均匀的。
但如果在水里加入油,就形成了水相和油相两个不同的相。
相平衡的概念可以通过一些常见的现象来理解。
比如,在一个封闭的容器中,水会不断蒸发变成水蒸气,而水蒸气也会不断凝结成水。
当蒸发和凝结的速率相等时,就达到了气液两相的平衡状态。
再比如,在冬天,湖面上的水会结冰,而冰和水在一定温度下能够稳定共存,这也是一种相平衡。
那么,相平衡是如何实现的呢?这就涉及到热力学的知识。
热力学第一定律告诉我们能量是守恒的,而热力学第二定律则指出了自发过程的方向和限度。
在相平衡中,系统的自由能会达到最小值,从而使得相的组成和性质保持稳定。
相律是描述相平衡系统的重要规律。
它由吉布斯提出,表达式为 F= C P + 2 ,其中 F 表示自由度,C 表示组分数,P 表示相数。
自由度是指在不改变相的种类和数目时,可以独立改变的强度性质的数目,比如温度、压力、浓度等。
通过相律,我们可以对相平衡系统进行分析和计算。
比如说,对于一个单组分系统,如水的气液平衡,组分数 C = 1 ,相数 P = 2 (气相和液相),那么自由度 F = 1 2 + 2 = 1 。
这意味着在温度和压力两个变量中,只有一个可以独立变化。
比如,在一定压力下,水的沸点是固定的,改变压力,沸点也会随之改变。
多组分系统的相平衡就更加复杂了。
以盐水溶液为例,盐和水构成了两个组分。
当盐的浓度不同时,可能会出现不同的相态,如溶液相、固相(盐结晶)等。
物理化学之 相平衡

(2)自由度和自由度数 自由度是指维持系统相数不变情况下,可以独立改变的 变量(如温度、压力、组成等),其个数为自由度数, 用F 表示。 纯水气、液两相平衡系统: 变量:T,p 但
F = 1
p = f (T )
F 任意组成的二组分盐水溶液与水蒸气两相平衡系统: = 2
变量:T,p,x 但
p = f (T , x )
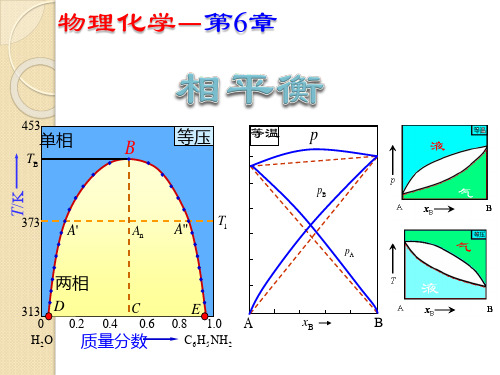
固定T : p x (压力 组成图) 平面图: 固定p : T x (温度 组成图)
二组分凝聚系统:T—x 图
二组分系统相图:气—液平衡相图 液态完全互溶系统 p-x、t-x图 理想系统 真实系统 一般正偏差 最大正偏差 一般负偏差 最大负偏差
液态部分互溶系统 t-x图
气相组成介于两液相之间
线:F =1
OC:水的饱和蒸气压曲线(蒸发)
斜率
dp vap H m 0 dT T gVm l
C点:临界点374.15℃, 22120Pa OB:冰的饱和蒸气压曲线 斜率 OA:冰的熔点曲线 斜率
l dp s H m 0 l dT T sVm
g dp s H m 0 g dT T s Vm
——均成直线关系 液相线:气相总压p与液相组成xB之间的关系曲线
气相线:总压p与气相组成yB之间的关系曲线
甲苯(A)—苯(B)系统:
* * pA p pB
对易挥发组分苯B: yB xB ——易挥发组分在气相中的组成 大于它在液相中的组成
甲苯(A)—苯(B)系统
总组成xM,系统点a 恒温降压过程分析:
§6-6 二组分液态部分互溶及完全不互溶系统的 气—液平衡相图 1.部分互溶液体的相互溶解度
共轭溶液:两个平衡共存的液层
MC——苯酚在水中的溶解度曲线 NC——水在苯酚中的溶解度曲线 系统点a→b 系统点d→e C点——高临界会溶点或高会溶点: 当高于C点温度时,苯酚和水 可以按任意比例完全互溶
物理化学:相平衡

相平衡是热力学在化学领域中的重要应用之一。研究 多相体系的平衡在化学、化工的科研和生产中有重要的 意义,例如:溶化、蒸馏、重结晶、萃取、提纯及金相 分析等方面都要用到相平衡的知识。
一、基本概念
第一节 相律
1、 相(phase) 体系内部物理和化学性质完全均匀的 部分称为相。相与相之间在指定条件下有明显的界面, 在界面上宏观性质的改变是飞跃式的。体系中相的总数 称为相数,用Φ表示。
三、自由度数(f)
自由度: 确定平衡体系的状态所必须的独立强度变量的
数目称为自由度,用字母 f 表示。这些强度变量通常是
压力、温度和浓度等。
以水为例〔注意是商量平衡态〕∶ a. 当φ=1时,例如液态水的T、p可在肯定范围内改变, φ不变 ∴ f=2 b. 当φ=2时,例如气-液平衡,指定p外,则Tb确定; 而指定T,则水有确定的平衡蒸气压p,∴ f=1 c. 当φ=3时,即气-液-固三相平衡共存时〔三相点〕,T、 p是确定的〔273.16K、6.1×102Pa、由水的性质所决定〕, ∴ f=0,如果变化T或p,则不可能三相共存〔即φ≠3〕。
一、水的相图 水的相图是依据实验绘制的。图上有:
水 的 相 图
(1) 气、液、固单相区∶f=1-1+2=2
(2) 两相平衡线∶
f=1-2+2=1
OC线∶气-液平衡
T与液态水的饱和蒸气压p蒸气的关系
或沸点Tb与p外的关系
OA线∶液-固平衡 凝固点Tf与p外的关系
OB线∶气-固平衡
T与冰的饱和蒸气压p蒸气的关系
dp/dT=ΔHm / T·ΔVm 此方程适合于任何纯物质的两相平衡
2、对于气-液或气-固两相平衡体系 近似处理∶a. 假设蒸气遵守理想气体状态方程
物理化学6相平衡资料
水的相图
p / Pa
C
水f
A
冰
P
610.62 D O
q
B
水蒸气
OC 是液-固两相平衡线
273.16
TC T / K
• OC线不能任意延长:当C点延长至压力大于2.07×108Pa时, 相图变得复杂,有不同结构的冰生成。
OA,OB,OC线 p / Pa 的斜率都可以用克-
E
超 临
C
水
界 水
F
A
f
克方程或克拉佩龙方
例如:对于没有气相存在的凝聚系统,可以忽略压力
f * f 1
多相系统平衡的一般条件――吉布斯相律
对具有 个相系统的热力学平衡,实际上包
含了如下四个平衡: (1) 热平衡
(2) 力学平衡 (3) 相平衡
(4) 化学平衡
某平衡系统中有 S 种不同的化学物种,有 个
相,需要多少独立强度变量(f)才能确定系统的状 态?
物种数(S):系统中存在的化学物种数。 组分数(K):构成平衡系统所需的最少物种数。
K=S- R- R′
R表示独立的化学反应数, R′表示独立的浓度限 制条件数。物质在不同相之间保持一定的数量关 系,不能算作浓度限制条件。
平衡系统 NH4Cl (s) =NH3 (g) + HCl (g)中, S = 3, R = 1, R′= 1,K=1
K=S- R- R′=5- 0- 1=4
若考虑可能析出固体,以K+、Na+、 SO42-、NO3-、H2O和K2SO4、Na2SO4、 KNO3、NaNO3为对象 S=9 R=4,4个独立的化学平衡 R′=1,溶液保持电中性
K=S- R- R′=9- 4- 1=4
物理化学第5章相平衡

(2) 保持压力不变,得 T-x 图 常用
这三个变量通常是T,p 和组成 x。所以要表示二组分系统状态图,需用三个坐标的立体图表示。
一. 合金体系 1、相图绘制—— 热分析法 §5.7 具有简单低共熔混合物的固液二组分系统 Cd-Bi二元相图
①对拉乌尔定律有较大正偏差:
在T-x图上就有最低点,这最低点称为最低恒沸点
最低恒沸混合物是混合物而不是化合物,它的组成在定压下有定值。
在标准压力下, 的最低恒沸点温度为351.28 K,含乙醇 95.57 。
改变压力,最低恒沸点的温度也改变,它的组成也随之改变。
属于此类的系统有:
5.8 有化合物生成的固液二组分系统
5.4 完全互溶的双液系统
5.2 单组分系统的克-克方程
5.9 三组分系统
5.7 具有简单低共熔混合物的固液二组分系统
5.1 相律
5.3 水的相图
第五章 相平衡
相平衡是热力学在化学领域中的重要应用之一 研究多相系统的平衡在化学、化工的科研和生产中有重要的意义,例如:溶解、蒸馏、重结晶、萃取、提纯及金相分析等方面都要用到相平衡的知识 相律(phase rule);相图(phase diagram)
2、分析相图
区:图上有4个相区 ( 1) AEH线之上, 熔液(l)单相区 (2) ABE之内, Bi(s)+ l 两相区 (3) HEM之内, Cd(s)+ l 两相区 (4)BEM线以下, Bi(s)+Cd(s)两相区
线:有三条多相平衡曲线
(1)ACE线,Bi(s)+熔液 共存时的熔液组成线。
组成为F的气体冷到E
有组成为x1的液体出现
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水的相图
水的相图是根据实验绘制的。图上有:
三个单相区 在气、液、固三个
单相区内,F 1, f 2,温度和
压力独立地有限度地变化不会引起 相的改变。
三条两相平衡线 F 2, f 1,压力与温度只能改变
一个,指定了压力,则温度由体系自定。
水的相图
水的相图
OA 是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点 T 647K, p2.2107 Pa ,这时气-液界面消失。高于临界温 度,不能用加压的方法使气体液化。
T T T F
(2)压力平衡条件:达到平衡时各相的压力相等
pp pF
5.2 多相体系平衡的一般条件
(3) 相平衡条件: 任一物质B在各相中的化学 势相等,相变达到平衡
BB F B
(4) 化学平衡条件:化学变化达到平衡
BB 0
B
5.3 相律
独立组分数(number of independent component)
定义: CSRR'
在平衡体系所处的条件下,能够确保各相组成所 需的最少独立物种数称为独立组分数。它的数值等于 体系中所有物种数 S 减去体系中独立的化学平衡数R, 再减去各物种间的浓度限制条件R'。
5.3 相律
相律(phase rule)
fFC2
相律是相平衡体系中揭示相数 ,独立组分数C和
自由度 f 之间关系的规律,可用上式表示。式中2
气体,不论有多少种气体混合,只有一个气相。 液体,按其互溶程度可以组成一相、两相或三 相共存。 固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)。
5.1 引言
自由度(degrees of freedom) 确定平衡体系的状 态所必须的独立强度变量的数目称为自由度,用字 母 f 表示。这些强度变量通常是压力、温度和浓度 等。
OA线
dlnp H vap m dT RT2
v H ap m 0 斜率为正。
OB线 dlnpfusHm
dT RT2
三相点与冰点的区别
三相点与冰点的区别
冰点温度比三相点温度低 0.01 K 是由两种因素造成的:
(1)因外压增加,使凝固点下降 0.00748K;
(2)因水中溶有空气,使凝固点下降 0.00241K。
两相平衡线的斜率
三条两相平衡线的斜率均可由Clausius-Clapeyron 方程或Clapeyron方程求得。
水的相图
水的相图
(2)到达P点时,气相出现, 在气-液两相平衡时,f 1 。 压力与温度只有一个可变。
(3)继续降压,离开P点时, 最后液滴消失,成单一气相,
f 2 。 通常只考虑(2)的情况。
三相点与冰点的区别
三相点是物质自身的特性,不能加以改变, 如H2O的三相点 T 2 7 3 .1 6 K ,p 6 1 0 .6 2 P a . 冰点是在大气压力下,水、冰、气三相共存。当大 气压力为105 Pa时,冰点温度为273.15K ,改变外压, 冰点也随之改变。
O点 是三相点(triple point),气-液-固三相
共存,F 3, f 0。三
相点的温度和压力皆由 体系自定。
H2O的三相点温度为273.16 K,压力为610.62 Pa。
水的相图
两相平衡线上的相变过程 在两相平衡线上的任何
一点都可能有三种情况。如 OA线上的P点:
(1)处于f点的纯水,保持 温度不变,逐步减小压力, 在无限接近于P点之前,气 相尚未形成,体系自由度为2。 用升压或降温的办法保持液相 不变。
通常指T,p两个变量。相律最早由Gibbs提出,所以 又称为Gibbs相律。如果除T,p外,还受其它力场影
响,则2改用n表示,即:
fFCn
5.4 单组分体系的相图
相点 表示某个相状态(如相态、组成、温度 等)的点称为相点。
物系点 相图中表示体系总状态的点称为物系点。 在T-x图上,物系点可以沿着与温度坐标平行的垂线 上、下移动;在水盐体系图上,随着含水量的变化, 物系点可沿着与组成坐标平行的直线左右移动。
OB 是气-固两相平衡线,即 冰的升华曲线,理论上可延长 至0 K附近。
OC 是液-固两相平衡线,当C点延长至压力大于 2108 Pa时,相图变得复杂,有不同结构的冰生成。
水的相图
OD 是AO的延长线,是过冷水和水蒸气的介稳平衡 线。因为在相同温度下,过冷水的蒸气压大于冰的蒸 气压,所以OD线在OB线之上。过冷水处于不稳定状 态,一旦有凝聚中心出现,就立即全部变成冰。
相图(phase diagram) 表达多相体系的状态如何 随温度、压力、组成等强度性质变化而变化的图形, 称为相图。
5.1 引言
相(phase) 体系内部物理和化学性质完全均匀 的部分称为相。相与相之间在指定条件下有明显 的界面,在界面上宏观性质的改变是飞跃式的。 体系中相的总数称为相数,用 表示。
第五章 相平衡
5.1 引言 5.2 多相体系平衡的一般条件 5.3 5.4 单组分体系的相图 5.5 二组分体系的相图及其应用 5.6 三组分体系的相图及其应用 5.7 * 二级相变
5.1 引言
相平衡是热力学在化学领域中的重要应用之一。 研究多相体系的平衡在化学、化工的科研和生产中 有重要的意义,例如:溶解、蒸馏、重结晶、萃取、 提纯及金相分析等方面都要用到相平衡的知识。
在单相区,物系点与成由对应的相点 表示。
5.4 单组分体系的相图
单组分体系的相数与自由度
C 1
f F 3
当 F 1
单相
f 2
F 2 两相平衡
f 1
双变量体系 单变量体系
F 3 三相共存
f 0 无变量体系
单组分体系的自由度最多为2,双变量体系 的相图可用平面图表示。
如果已指定某个强度变量,除该变量以外的其它强
度变量数称为条件自由度,用 f *表示。
例如:指定了压力,
f * f 1
指定了压力和温度, f ** f 2
5.2 多相体系平衡的一般条件
在一个封闭的多相体系中,相与相之间可以有热 的交换、功的传递和物质的交流。对具有F 个相体系 的热力学平衡,实际上包含了如下四个平衡条件: (1)热平衡条件:设体系有,, ,F 个相,达到平衡 时,各相具有相同温度
