北京化工大学05年物化真题及答案
北京化工大学2005考研物理化学试题

二、填空题(20 分) 1. 13.38 J·K-1 (T 未变) 2. 3. 4. 5. 6. 7. 8. 9. yB=
P≤5,4,T,p,xA,xB
1 3
Kp =4.916×10-3
简并度(或统计权重) 0.06188min-1 消失,为 0
aB = a 2
10.旋光,旋光系数,右旋,左旋,旋光仪。 三、(20 分) 燃烧反应:C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)
Kp =____________________,(己知该反应的 K =0.773)。
5. 微观粒子的某一能级所包括的量子态数称为该能级的_____________________。 6. 某一级反应每分钟反应物转化掉 6%,则该反应的速率常数 k=____________。 7. 在临界状态下,由于气液界面__________,所以液体的表面张力__________。 8. 强电解质 MgCl2 水溶液,其离子平均活度 a 与电解质活度 a B 之间的关系为________。 9. 请在下列图中画出 A 点各界面张力(s-g,s-l,g-l)的方向和接触角 。
2.
=0 p
T=769.1K
3.
=rH m -T r S m =0 rGm
4. 在 298K、 p 下, r G m =4184-5.44×298.15=2562 J·mol-1>0
是 型稳定。 5. 在 525℃时,T=789.15K
=4184-5.44×789.15=-157.936 J·mol-1 rGm
四、(10 分) 1. dU=TdS-pdV
U S = T -p V T V T
北京化工大学物理化学试题

北京化工大学物理化学试题《物理化学》试题开卷()闭卷(√ )适用专业年级:2004级(环工、药物、药学、制药)姓名学号专业班级本试题一共3道大题,共5页,满分100分。
考试时间120分钟。
总分题号一二三四五题分得分阅卷人核分人注:1.答题前,请准确、清楚地填各项,涂改及模糊不清者、试卷作废。
2.试卷若有雷同以零分计。
(以下为试题正文)一、选择题(每小题只有一个正确答案,请把正确答案填在答卷上。
每题2分共20题)1.第一定律说明,封闭体系的()A.吸热Q是状态函数B.对外做功W是状态函数C.Q是状态函数D.热力学能U是状态函数 W+2.一理想气体在恒外压下从10膨胀到,同时吸收热量125,则此过程的21.0110kPa×3dm316dmJHΔ应为多少?()A: B: 215J+125J.C: D: 215J.125J+3.11612625()2807()1367cmcmCHOsHKJmolCHOHlHKJmolφφ..Δ=..Δ=..已知;如果用葡萄糖发酵制2mol乙醇()的反应为: 25CHOH61262522(2CHOCHOHCOg→(水溶液)水溶液)+若忽略各物质的溶解热,则在℃、101325Pa条件下由上述反应制得1mol时的热效应为(2525CHOH1KJmol..):A: 73 B: 73C: 36.5 D:-36.5任课教师:王显祥系(教研室)主任签字:黄乾明4.理想气体与温度为T的大热源接触,做等温膨胀吸热Q, 而所做的功是变到相同终态最大功的,则体系的熵变为:() 20%A: 5QSTΔ= B: QSTΔ=C:5QSTΔ= D: QSTΔ=.5.在恒温恒压不做其它功条件下,一封闭体系经过自发过程并在该条件下达平衡,则体系的自由能(G)值: ( )A: 达最大 B: 达最小C: 不能确定 D: 不变6.在下列过程中,哪个过程可以应用公式dGSdTVdP=.+ ()A: 气体无限缓慢地膨胀,始终保持化学平衡 3SO'3221()()(),02SOgSOgOgW+=..B: 当无化学变化地进行膨胀 3()SOgC: 水在℃,101325Pa条件下结冰 5.D: 在反应体系中发生化学反应2N223()3()2()NgHgNHg+..7.无水乙醇在正常沸点的气化,则该过程中()A: 0HΔ= B: 0SΔ=C: 0GΔ= D: 0UΔ=8.25℃纯液体A的,纯液体B的,二者组成理想溶液,当气液平衡时,液相中4410ApΦ=×4610ApΦ=×0.6Ax=,在气相中B的摩尔分数By为:()A: 0.40 B: 0.25C: 0.50 D: 0.659.298K时,已知下列化学反应方程的平衡常数1222;22ABCKDECK++....则DBEAK++..为()A: 21K2K(B: 221KK1()C: 21KK2( D: 21KK10.物质A与B可形成低共沸混合物E,已知纯A的沸点小于纯B 的沸点,若将任意比例的AB+混合物在一个精馏塔中精馏,在塔顶的馏出物是()A: 纯A B: 纯BC: 低共沸混合物 D: 都有可能11.液体A与液体B不相混溶,在一定温度T,当有B存在并且达到平衡时,液体A的蒸汽压为:()A: 与体系中A的摩尔分数成比例 B: 等于T温度纯A的蒸汽压C: 大于T温度下纯A的蒸汽压 D: 等于体系的总压12. 在一般情况下,电位梯度只影响()(A) 离子的电迁移率 (B) 离子迁移速率(C) 电导率 (D) 离子的电流分数13.基元反应在298K以及的容器中进行,若某时刻反应进度随时间的变化率为23ADG+→32dm10.3mols..,则此时G的生成速率(单位3moldms....):()A: 0.15 B: 0.9 C: 0.45 D: 0.214.已知某复杂反应的反应过程为11kkAB...→←..,2kBD+..→,则B的浓度随时间的变化率[]dBdt.是:()A: B: 12[][][]kAkDB.112[][][][]kAkBkDB...C: D: 112[][][][]kAkBkDB..+112[][][][]kAkBkDB..++15.夏季有时久旱无雨,甚至天空有乌云仍不下雨。
现代化学基础实验试题答案(2005年秋)

现代化学基础实验试题答案(2005年秋A卷)一、填空题(每空0.5分,共7分)1.切断电源后,用泡沫灭火器扑灭2.磷酸一氢铁,磷酸锌3.钨灯,石英玻璃4.18mol/L,14mol/L,12mol/L5.绿色,红色,蓝色,浅绿色6.稀硫酸,棕色酸式滴定管二、选择题(每题0.5分,共3分)1. B2.C3.A B4.A5.C6.B三、简答题(每题2分,共20分)1.NaOH应装在带橡皮塞的玻璃瓶中(0.5分)NH4F对玻璃有腐蚀作用,一般装在塑料瓶中。
(0.5分)AgNO3见光分解,应装在棕色的玻璃试剂瓶中。
(0.5分)水银一般装在瓷瓶(或铁罐)中,并在水银上加水密封。
(0.5分)2.先加BaCl2除去SO42-,过量的Ba2+加Na2CO3可除去。
若先加Na2CO3除去Ca2+、Mg2+,再加BaCl2除去SO42-时,过量的Ba2+还得想办法除去。
(1分)生成的BaSO4沉淀若不过滤就加Na2CO3,则在较大量的Na2CO3存在的情况下,BaSO4有可能转化为BaCO3:BaSO4+ Na2CO3= BaCO3↓+Na2SO4这样就达不到除去SO42-的目的。
(0.5分)因为Ksp BaCO3≈50 Ksp BaSO4,因此只要在体系中[CO32-]>50[SO42-]时,BaSO4就可能转化为BaCO3。
(0.5分)3.重结晶是提纯固体物质常用的重要方法之一,它适用于溶解度随温度有显著变化的化合物的提纯。
(1分)其方法是在加热的情况下使被纯化的物质溶于尽可能少的溶剂中,形成饱和溶液,趁热过滤,除去不溶性杂质。
然后使滤液冷却,被纯化的物质即结晶析出,而杂质留在母液中。
这样第二次得到的晶体纯度就较高。
(1分)4.(1)滤纸先要润湿,大小应略小于漏斗内径。
(2)布氏漏斗下端的斜面应与吸滤瓶的支管相对。
(3) 溶液不能超过漏斗容积的2/3。
(4)过滤完毕,应先拔掉橡皮管,后关水泵,防止倒吸。
(5)滤液应从吸滤瓶的上口倒出,不能从支管倒出。
北京化工大学2004~2005(二)72学时有机化学考试试卷(A)
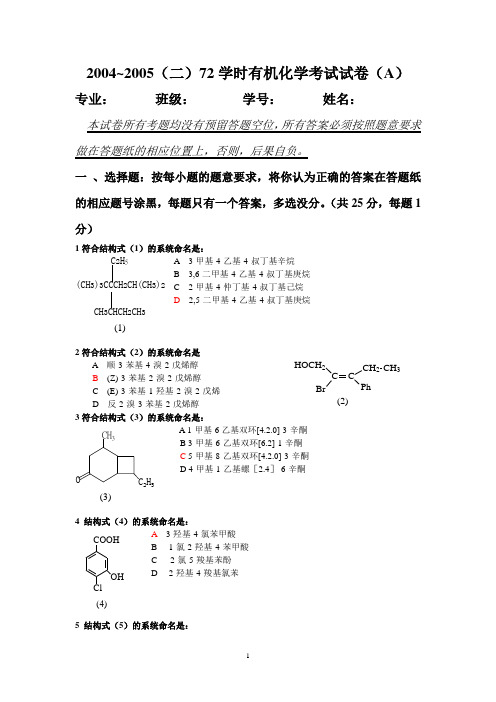
2004~2005(二)72学时有机化学考试试卷(A )专业: 班级: 学号: 姓名:本试卷所有考题均没有预留答题空位,所有答案必须按照题意要求做在答题纸的相应位置上,否则,后果自负。
一 、选择题:按每小题的题意要求,将你认为正确的答案在答题纸的相应题号涂黑,每题只有一个答案,多选没分。
(共25分,每题1分)1符合结构式(1)的系统命名是:A 3-甲基-4-乙基-4-叔丁基辛烷B 3,6-二甲基-4-乙基-4-叔丁基庚烷C 2-甲基-4-仲丁基-4-叔丁基己烷D 2,5-二甲基-4-乙基-4-叔丁基庚烷2符合结构式(2)的系统命名是A 顺-3-苯基-4-溴-2-戊烯醇B (Z)-3-苯基-2-溴-2-戊烯醇C (E)-3-苯基-1-羟基-2-溴-2-戊烯D 反-2-溴-3-苯基-2-戊烯醇3符合结构式(3)的系统命名是:A 1-甲基-6乙基双环[4.2.0]-3-辛酮B 3-甲基-6-乙基双环[6.2]-1-辛酮C 5-甲基-8-乙基双环[4.2.0]-3-辛酮D 4-甲基-1-乙基螺[2.4]-6-辛酮4 结构式(4)的系统命名是:A 3-羟基-4-氯苯甲酸B 1-氯-2-羟基-4-苯甲酸C 2-氯-5-羧基苯酚D 2-羟基-4-羧基氯苯5 结构式(5)的系统命名是:CH 3CHCH 2CH 3C 2H 5(CH 3)3CCCH 2CH(CH 3)2(1)C CH 2CH 3Ph HOCH 2Br (2)(3)O CH 3C 2H 5COOHOH Cl(4)A 5-乙基-1-萘磺酸B 5-乙基-2-萘磺酸C 4-乙基-1-萘磺酸C6-磺酸基-1-乙基萘6结构式(6)的系统名称是:A 2-甲基-1-环己基-3-丁酮B 3-甲基-4-环己基-2-丁酮C 2-环己烷甲基-3-丁酮D 2-甲基-1-环己基-3-羰基丁烷7(7)的系统命名名称是:A N ,O, 6-三甲基-3-庚胺B 2-甲基-4-甲氧基-5-甲氨基庚烷C 2-甲基-5-甲氧基-6-氨甲基庚烷D 6-甲基-3-甲氨基-4-甲氧基庚烷8结构式(8)的系统命名是:A (2S ,3S )N-苯基-3-氯-2-溴丁酰胺B (2R ,3R )3-氯-2-溴丁酰苯胺C (2S ,3R )3-氯-2-溴丁酰苯胺D (2R ,3S )3-氯-2-溴丁酰苯胺9 与(S )-α-碘代丁醛成对映异构体的结构是:3I CH 3H H OHCCOHCI3HHABC10 顺-1-甲基-4-异丙基环己烷的优势构象是:11 下列自由基的稳定性由大到小的顺序为:.SO 3H(5)(6)CH 2CH CH 3C OCH 3(7)CH 3CH 2CHCHCH 2CH 2CH(CH 3)2NHCH 3OCH 3(8)3ClH BrH CONHPh 3HHCH(CH 3)2CCH(CH 3)2HCH 3A CH(CH 3)2HH3DHHCH 3CH(CH 3)2B.CH 3CH 2CCH 2CH 2CH 2CH 3CH 3CH 2CHCHCH 3CH 2CH 3CH 3CH 2CCH 2CH 3CH 2CH 3(1)(2)(3)A. (1)>(2)>(3)B. (2)>(1)>(3)C. (3)>(2)>(1) 12 下列化合物中,具有光学活性的的化合物是:Cl HCl H COOH3CH 3Br ABCDCOOHCOOHNO 213.下列化合物发生亲电取代反应的活性由大到小的顺序为:C 2H 5COOH NO 2Cl(1).(2)..(3).(4).A. ⑴>⑵>⑶>⑷B. ⑵>⑴>⑶>⑷C. ⑷>⑵>⑴>⑶D. ⑴>⑷>⑵>⑶14.根据H ückel 规则,下列单体物质中具有芳香性的是:(1)(3)(4)(2)NCH 3CH 3OO (5)15. 下列化合物在NaI 的CH 3COCH 3溶液中反应的快慢顺序为: (1). 3-溴-1-丙烯 (2). 溴乙烯 (3). 1-溴丁烷 (4). 2-溴丁烷A. ⑴>⑵>⑶>⑷B. (1)>(3)>(4)>(2)C. ⑵>⑴>⑶>⑷D. ⑶>⑴>⑵>⑷ 16. 下列各组化合物与AgNO 3的乙醇溶液反应速率快慢顺序为:CH 2CH 2BrCH 2BrCH CH 3Br(1).(2).(3).(4).A⑵>⑴>⑶>⑷ B. ⑶>⑵>⑴>⑷ C. ⑵>⑴>⑶>⑷ D. (1)>(3)>(4)>(2) 17. 下列化合物的酸性强弱顺序是:OH NO 2COOH(1) .(2) .(3).(4).CF 3COOHCH 3CH 2OHA.⑶>⑷>⑴>⑵B. ⑶>⑴>⑵>⑷C.⑴>⑵>⑷>⑶D. (2) >(1)> (4)>(3) 18. 与HCN 加成反应活性大小顺序为:(1)(2). PhCHO PhCOCH 3O(3)CH 3CH 2CHO(4)A. ⑵>⑴>⑶>⑷B. ⑶>⑵>⑴>⑷C. ⑴>⑵>⑷>⑶D. (4)> (1) > (3) > (2) 19.下列不属于S N 1反应特征的是:A 反应速率与亲核试剂浓度无关;B 反应物有多种重排产物C 空间位阻影响反应时间D 极性溶剂有利于反应进行 20 下列四个物种的亲核性顺序是:O-CH 3COO -CH 3CH 2O -OH -(2)(1)(3)(4)A ⑵>⑴>⑶>⑷ B. ⑶>⑷>⑵>⑴ C. ⑷>⑴>⑶>⑵ D. (4)>(1)>(2)>(3) 21 下列引入卤素的反应中,属于亲电取代历程的反应是:A 甲苯上甲基的卤化B 苯的卤化C 酸催化醛酮的α位卤代D 烯烃加次卤酸 22. 下列四个化合物的碱性由大到小的顺序为:. (1).NH 3(2).CH 3CH 2NH 2(3).PhNH 2(4). PhNHCOCH 3A. ⑴>⑷>⑵>⑶B. (3)>(2)>(4)> (1)C. ⑵>⑷>⑶>⑴D. ⑷>⑵>⑴>⑶ 23. 理论上判断,下列化合物沸点从高到低的顺序应为: (1). 对苯二酚 (2) 甲苯 (3) 对氯苯酚 (4). 苯甲醚A. ⑴>⑶>⑷>⑵B. (1) >(3)>(2)> (4)C. ⑵>⑷>⑶>⑴D. ⑵>⑴>⑶>⑷ 24. 下列化合物在水中溶解度从大到小的顺序,理论上判断应为: ⑴.苯甲酸 ⑵.丙三醇 ⑶. 乙酸乙酯 ⑷. 乙苯A. ⑴>⑵>⑷>⑶B.⑴>⑵>⑶>⑷C. ⑵>⑴>⑶>⑷D. (4)>(1)>(2)>(3) 25 下列哪一个描述对于E2反应是不正确的: A 试剂的碱性增强可以加快E2反应。
北京化工大学00—08年研究生入学考试物理化学

北京化工大学2000考研物理化学试题(填空16分,选择题9分,计算5题75分共100分) 注意事项:答案写在答题纸上,101.325kPa ≈100kPa=p,作图用铅笔。
一、填空题(16分)1. 1mol 双原子理想气体由始态370K 、100kPa 分别经(1)等压过程,经(2)等容过程加热到473K ,则(1),(2)两个过程下列物理量的关系是Q 1_____Q 2,W 1_____W 2,△H 1_____△H 2,△S 1_____△S 2。
(填大于、小于或等于) 2. 200℃时,Ag 2O 的分解反应为:Ag 2O(s)→2Ag(s)+21O 2(g) 己知200℃时固体Ag 2O 的分解压为137.8kPa 。
今让1mol Ag 2O(s)在200℃分解达平衡,则该过程△G=_______,K =_________,反应过程系统与环境交换的功W=______(忽略固体体积,并设气体为理想气体。
3. 根据电池反应设计原电池。
己知电池反应:AgCl(s)+I -(-I a )=AgI(s)+Cl -(-Cl a )所设计的原电池为__________________________________________。
4. 有理想气体反应: A(g)+2B(g)→C(g)在等温和总压不变的条件下进行,若原料气中A 与B 的物质的量之比为1:2,达平衡时系统的组分数C=_______,自由度数f=_______。
当温度一定时,增大压力则K _______(填增大、减小或不变),平衡将________移动(填向左、向右或不)。
5. 在一个锥形容器中,放入一滴液体,如下图所示。
试画出接触角θ。
因θ____900(填大于、小于或等于),则该液体对容器______润湿(填能或不能)。
6. 有(N 、E 、V)确定的理想气体,设分子的运动形式只有三个可及的能级,它们的能量和简并度分别为:k1ε=0K ,g 1=1k2ε=100K ,g 1=3 k3ε=300K ,g 1=5(式中k 为玻尔兹曼常数)当温度为200K 时,分子的配分函数值为_______。
考研基础物理化学真题2005年

考研基础物理化学真题2005年(总分:150.01,做题时间:90分钟)一、是非题(总题数:12,分数:24.00)1.一定温度下化学反应的Δr G m一定大于Δr A m。
(分数:2.00)A.正确B.错误√解析:既是物质B的化学势又是物质B的偏摩尔量。
(分数:2.00)A.正确√B.错误解析:3.用ΔG<0判断变化方向,适用于任何系统的任何变化。
(分数:2.00)A.正确B.错误√解析:4.稀溶液的凝固点一定比纯溶剂的凝固点低。
(分数:2.00)A.正确B.错误√解析:5.因为溶胶在一定条件下能存在很长时间,所以它是热力学稳定系统。
(分数:2.00)A.正确B.错误√解析:6.在大气压下,水银在玻璃毛细管中的沸点高于其正常沸点。
(分数:2.00)A.正确B.错误√解析:7.NaCl水溶液在表面层的浓度高于其溶液本体浓度。
(分数:2.00)A.正确B.错误√解析:8.物质B总是从高浓度相自发转移到低浓度相。
(分数:2.00)A.正确B.错误√解析:9.在化学反应中,所有反应物分子实现化学反应都经过反应的最低能量途径。
(分数:2.00)A.正确B.错误√解析:10.超电势的存在,使原电池的输出电压变小。
(分数:2.00)A.正确√B.错误解析:11.NaOH水溶液的摩尔电导率与其浓度有关。
(分数:2.00)A.正确√B.错误解析:12.气体在固体表面的吸附只能是单层的。
(分数:2.00)A.正确B.错误√解析:二、选择题(总题数:8,分数:16.00)13.Na 2 CO 3与H 2 O可以生成如下几种化合物Na 2 CO 3·H 2 O,Na 2 CO 3·7H 2 O,Na 2 CO 3·10H 2 O,在标准压力下与Na 2 CO 3水溶液、冰平衡共存的水合物最多能有几种:______(分数:2.00)A.1种;√B.2种;C.3种。
解析:14.在一密闭恒温容器内,有大小不同的两个微小汞滴,经过足够长时间后,容器内仍有液体汞存在。
2005-2006学年第一学期

《物理化学》 (上册)期末考试试卷
班级:
题号 满分 得分 一、选择题(将答案填在下面表中) 1.恒容下,一定量理想气体,当温度升高时热力学能将: A. 降低 B. 增加 C. 不变 D. 不能确定 2.一定量理想气体从同一始态出发,分别经(1)等温压缩、 (2)绝热压缩到具有相同压力的 终态,以 H1、H2 分别表示两个终态的焓值,则有: A. H1>H2 B. H1=H2 C. H1<H2 D. H1≥H2 3.气体的临界压力是指: A. 气体可以液化的最高压力; B. 气体可以液化的最低压力; C. 临界温度下气体液化的最高压力; D 临界温度下气体液化的最低压力。 4. 由水(1)和甲醇(2)组成的二元溶液,下列各式不是甲醇在此溶液中化学势的是: A. 一 12
c NH3 (H 2 O) c NH3 (CCl 4 )
6.已知某反应 300℃,低压下的 K Θ =3.8×10-3,当该反应在 300℃,高压下进行时 K Θ p = , (已知该反应的 Kφ=0.773) 。 三、已知 A 在 100℃,100kPa 下的摩尔蒸发焓∆vapHm(A)=40.0kJ·mol-1 ,现有 1molA(l) 在 100℃,100kPa 下可逆变为同温同压下的 A(g) ,再等温向真空膨胀到压力为 50kPa 的终态, (气体视为理想气体,液体体积与气体相比可以忽略) 求全过程的∆U,∆H,∆S,∆G,Q,W。 四、证明: (1)
姓名:
二 20 三 18
学号:
四 15 五 20
分数:
六 15 总计 100
∂H ∂n 2 ∂A ∂n 2
S , p , n1 T ,V , n1
物理化学2005-2006学年第二学期期末试卷B.doc含答案

………………………………密………………………封…………………………线………………………………………………学院2005-2006学年第二学期期末考试化学、应用化学专业03 级《物理化学》试卷(B)一、选择正确答案在括号内(每小题2分,共30分)1.以下叙述正确的是:( )(A)对于单分子反应理论和酶催化反应理论,反应物在高浓度时为一级反应,在低浓度时为二级反应;(B)对于单分子反应理论和酶催化反应理论,反应物在高浓度时为二级反应,在低浓度时为一级反应(C)对于单分子反应理论,反应物在高浓度时为一级反应,在低浓度时为二级反应;酶催化反应理论,反应物在高浓度时为一级反应,在低浓度时为二级反应(D)对于单分子反应理论,反应物在高浓度时为一级反应,在低浓度时为二级反应;酶催化反应理论,反应物在高浓度时为零级反应,在低浓度时为一级反应2.已知电极电位:φ (Cl2/Cl-) = 1.36 V,φ (Br2/Br-) = 1.07 V,φ (I2/I-) = 0.54 V,φ (Fe3+/Fe2+) = 0.77 V,标准状态下,Fe与卤素组成电池,下面判断正确的是:( )(A) Fe3+可氧化Cl- ;(B) Fe3+可氧化Br-;(C) Fe3+可氧化I-;(D) Fe3+不能氧化卤离子。
3.某反应只有一种反应物,其转化率达到75%的时间是转化率达到50%的时间的两倍,反应转化率达到64%的时间是转化率达到x%的时间的两倍,则x为:( )(A) 32 ;(B) 36 ;(C) 40 ;(D) 60 。
4.同一体系,比表面自由能和表面张力都用σ表示,它们:( )(A) 物理意义相同,数值相同; (B) 数值和单位完全相同;(C) 物理意义相同,单位不同; (D) 物理意义不同,数值相同。
5.用I=0.025A的电流通过Au(NO3)3溶液,当阴极上有1.20g Au(s)析出时,通过的电量为C ;阳极上放出氧气的摩尔数为mol;(已知Au的摩尔质量为197.0 g/mol)( )(A)1763、4.57×10-3(B)1763、1.83×10-2(C)588、1.14×10-3 (D)588、6.09×10-3………………………………密………………………封…………………………线………………………………………………6.对于浓差超电势,下列叙述不正确的是:( )(A) 浓差超电势的产生在于电极反应速率大于离子迁移速率 ; (B) 可用升温或搅拌的方法减小或消除浓差超电势 ; (C) 浓差超电势的大小与电流密度无关 ; (D) 电极极化程度与浓差超电势的大小有关 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京化工大学2005年招收硕士生入学试题(选择题10题20分,填空题10题20分,计算题6题100分,证明1题10分,共150分)注意事项:答案写在答题纸上,用红色或铅笔不计成绩。
一、选择题(20分)1. 当理想气体反抗一恒外压作绝热膨胀时,则:A. H ∆=0;B. △U=0;C. △H>0;D. △U<02. 从热力学基本关系式可导出VS U ⎪⎭⎫⎝⎛∂∂=( ) A. T V A ⎪⎭⎫⎝⎛∂∂ B. p S H ⎪⎭⎫⎝⎛∂∂>0 C. SV U ⎪⎭⎫⎝⎛∂∂ D pT G ⎪⎭⎫ ⎝⎛∂∂ 3. A 、B 两组分可以形成固溶体,若在组分A 中加入B ,可以使固溶体的熔点提高,当固-液两相达平衡时,则组分B 在此固溶体中的含量必( ) 组分B 在液相中的含量。
A. 大于 B. 小于 C. 等于 D. 不能确定4. 某固体氧化物的分解反应是吸热反应,当温度升高时,固体氧化物的分解压力将: A.增大 B. 减小 C. 不变 D. 不能确定5. 分子的平动、转动和振动的能级间隔可以表示为t ε∆、r ε∆和v ε∆,第一激发态与基态能量的差的大小顺序为: A.vε∆>t ε∆>r ε∆B.、v ε∆>r ε∆>t ε∆C. t ε∆>vε∆>rε∆D. r ε∆>t ε∆>vε∆6. 某化学反应在一定条件下的平衡转化率为66%,当加入合适的催化剂后,反应速率提高10倍,则其平衡转化率将:A. 大于66%B. 小于66%C. 不变D. 不能确定 7. 下列分散系统中丁达尔效应最强的是:A. 空气B. 蔗糖水溶液C. 高分子溶液D. 硅胶溶液8. 醌-氢醌电极电势与溶液中氢离子的活度有关,称为氢离子指示电极。
实验中测量溶液pH值时该电极在一定范围内电极电势较稳定,稳定范围的pH 值应是: A.大于8.5 B. 小于8.5 C. 等于8.5 D. 没有限定9. 有二级反应,在一定温度下反应物消耗1/2需时间10min ,若再消耗1/2还需时间为:A.10minB. 20minC. 30minD. 40min 10. 3 433聚沉值/mol ·dm -3500.810.095该胶粒的带电情况为:A. 带负电B. 带正电C. 不带电D. 无法确定二、填空题(20分)1. 1mol 理想气体从p 1=0.5Mpa 节流膨胀到p 2=0.1Mpa 时的熵变为△S=__________。
2. 60℃时,某液体A 的饱和蒸气压是液体B 饱和蒸气压的2倍。
A 、B 两液体形成理想液态混合物,当气液平衡时,若液相中A 的摩尔分数为0.5,则气相中B 的摩尔分数为_______。
3. 对ABC 组成的三组分系统中,最多相数为_______;最大自由度数为________;它们分别是___________________________变量。
4. 己知某气体反应300℃,低压下的θK =3.8×10-3,当该反应在300℃,高压下进行时θp K =____________________,(己知该反应的ϕK =0.773)。
5. 微观粒子的某一能级所包括的量子态数称为该能级的_____________________。
6. 某一级反应每分钟反应物转化掉6%,则该反应的速率常数k=____________。
7. 在临界状态下,由于气液界面__________,所以液体的表面张力__________。
8. 强电解质MgCl 2水溶液,其离子平均活度±a 与电解质活度B a 之间的关系为________。
9. 请在下列图中画出A 点各界面张力(s-g,s-l,g-l)的方向和接触角θ。
(画在答题纸指定位置上)10. 在酸性介质中蔗糖水解反应为:C 12H 22O 11+H 2OH +C 6H 12O 6+C 6H 12O 6蔗糖 葡萄糖 果糖由于蔗糖及其水解产物具有__________性质,随着水解反应进行,体系的__________逐渐由__________变到__________。
实验中采用__________(仪器)进行测量。
三、(20分)25℃条件下,密闭恒容的容器中有1mol 葡萄糖C 6H 12O 6(s)在O 2(g)中完全燃烧,生成同温下的CO 2(g)和H 2O(l)。
过程放热2808 kJ ·mol -1。
若产生的气体可视为理想气体,已知298.15K下该反应的标准摩尔熵变θm r S ,∆=182.4 J ·K -1·mol -1。
己知下列物质的标准熵:CO 2(g) H 2O(l) O 2(g) θm S ,/ J ·K -1·mol -1213.7469.91205.141. 计算298K 时C 6H 12O 6(s)的标准熵θm S 。
2. 计算298K 时C 6H 12O 6(s)的标准摩尔燃烧焓θm r H ∆。
3. 计算298K 时利用上述反应所能得到的最大功W max 。
四、(10分)某气体遵从状态方程pV m =RT+bp ,且恒容热容C V 不随温度变化。
1. 证明:T V U ⎪⎭⎫⎝⎛∂∂=VT p T ⎪⎪⎭⎫ ⎝⎛∂∂-p ; 2. 导出此气体的绝热可逆过程方程。
五、(26分)有晶形转变过程:α-H 2S(s,红)→β-H 2S(s,黑) 己知上述过程θm r G ∆=[4184-5.44(T/K)] J ·mol -1。
1. 试求某温度下晶形转变过程的θm r H ∆,θm r S ∆; 2. 计算α-H 2S(s,红)→β-H 2S(s,黑)的恒压热容差θm p r C ,∆; 3. 试求p=100 kPa 时晶形转变达平衡时的温度; 4. 在298K ,θp 下H 2S(s)稳定态是α型还是β型? 5. 计算在525℃时,两相处于平衡时系统的压力。
己知:ρ(α,红)=8.1 g ·cm -3,ρ(β,黑)=7.7 g ·cm -3,且不随压力变化。
六、(12分)己知I 2的下列有关数据:三相点O 临界点C 正常熔点a 正常沸点b t/℃ 113 512 114 184 p/Pa12116001009131. 画出I 2的示意相图,在图上标明O ,C ,a ,b 点的位置和各区域的相态;(画在答题纸的指定位置上)2. 结合示意图完成下表;(填在答题纸的指定表中)七、(22分)有电池(A),(B)(A) Pt,H 2(θp )|H 2SO 4(b=7mol ·kg -1)|Hg 2SO 4(s),Hg(l),Pt (B) Pt,H 2(θp )|H 2SO 4(b=7mol ·kg -1)|PbSO 4(s),Pb 2O 4(s)在298.15K 时测得上述电池电动势分别为E A =0.5655V ,E B =1.7501V 。
已知:(A)和(B) 电池的标准电动势分别为θA E =0.6152V ,θB E =1.6849V 。
组分数C 相数P 自由度数F 区域OC 线1. 写出电池(A)和(B)的电极反应与电池反应;2. 计算298.15K 时H 2SO 4水溶液(b=7mol ·kg -1) 中水的活度。
八、(12分)某对行反应机理如下:A B在某温度下,己知k 1=8.0×10-3min -1,k 2=2.0×10-3min -1,今由纯A 开始反应,试问:A,B 达到相同浓度时的反应时间?九、(8分)有N 个粒子的某定域子系统,仅有三个非简并能级(0ε,1ε,2ε),己知相邻能级间隔值ε∆等于100 K 时的kT 值。
若粒子在能级上的分布服从玻尔兹曼分布。
当温度为100K 时: 1. 粒子在各能级上与基态能级分布之比01n n ,02n n。
2. 若能量基准定在基态能级,100 K 时粒子的配分函数0q ? 3. 100 K 时系统的摩尔热力学能0m U ?北京化工大学2005参考答案一、选择题(20分) 1. D 2. B 3. A 4. A 5. B 6. C 7. D 8. B 9. B 10. A二、填空题(20分)1. 13.38 J ·K -1 (T 未变)2. y B =313. P ≤5,4,T,p,x A ,x B4. θp K =4.916×10-3 5. 简并度(或统计权重) 6. 0.06188min -1 7. 消失,为0 8.B a =±a 29.10.旋光,旋光系数,右旋,左旋,旋光仪。
三、(20分)燃烧反应:C 6H 12O 6(s)+6O 2(g)→6CO 2(g)+6H 2O(l)1. θm r S ∆=6×213.74+6×69.91-6×205.14-θm S ,(葡萄糖)=182.4θm S ,(葡萄糖)=288.66 J ·K -1·mol-12. θm r U ∆=-2808 kJ ·mol -1θm c H ∆=θm r H ∆=θm r U ∆+g r n ∆RT=θm r U ∆=-2808 kJ ·mol -13. θm r A ∆=θm r U ∆-T θm r S ,∆=-2808×103-298.15×182.4=-2862 kJ ·mol-1恒T 、V 下,W max =θm r A ∆=-2862 kJ四、(10分)1. dU=TdS -pdVT V U ⎪⎭⎫⎝⎛∂∂=TV S T ⎪⎪⎭⎫ ⎝⎛∂∂-p ① 又dA==-SdT -pdV T V S ⎪⎪⎭⎫⎝⎛∂∂=VT p ⎪⎪⎭⎫⎝⎛∂∂ ② ②代入①中得:T V U ⎪⎭⎫⎝⎛∂∂=VT p T ⎪⎪⎭⎫ ⎝⎛∂∂-p 证毕 2. p (V m -b)=RT绝热可逆过程有:dU=-pdV=-bV RTm -dV m dU=C V ,m dTRTC m V ,dT+bV m -1dV m =0 RC m V ,ln12T T +ln bV b V m m --1,2,=常数 T(V m -b)(r-1)= 常数 ①又由V m -b=pRT代入①得T γγ-1p =常数 ②①和②即此气体的方程五、(26分)晶形转变:α-H 2S(s,红)→β-H 2S(s,黑) θm r G ∆=[4184-5.44(T/K)] J ·mol -1。
1. θm r G ∆=θm r H ∆-T θm r S ∆,当θm p r C ,∆=0时θm r H ∆及θm r S ∆不随T 变,才会有此式。
