常见金属元素及其化合物
常见金属元素及其化合物

常见金属元素及其化合物金属元素是指具有金属性质的化学元素,通常具有良好的电导性、热导性、延展性和可塑性。
金属元素被广泛应用于各个领域,例如建筑、电子、冶金、汽车等。
下面将为您介绍一些常见金属元素及其化合物。
铁(Fe)是一种常见的金属元素,其化合物主要有氧化铁、硫化铁、碳酸铁等。
氧化铁是一种红棕色的固体物质,在建筑和石材制作中常用作颜料。
硫化铁是一种黑色的矿石,常用于制备铁和钢。
碳酸铁是一种白色的结晶物质,常见于自然界中的石灰岩和大理石。
铜(Cu)是另一种常见的金属元素,其化合物主要有氧化铜、硫化铜、碳酸铜等。
氧化铜是一种黑色的固体物质,在电子和电器制造中常用作导电材料。
硫化铜是一种蓝色的矿石,常用于制备铜和铜合金。
碳酸铜是一种绿色的结晶物质,常见于自然界中的矿石和矿山。
铝(Al)是一种轻便耐腐蚀的金属元素,其化合物主要有氧化铝、氯化铝、硫酸铝等。
氧化铝是一种白色的固体物质,在建筑和电子制造中常用作绝缘材料和搅拌器。
氯化铝是一种无色的液体,常用于制备有机化合物。
硫酸铝是一种无色的液体,常用于制备矾石和其他铝盐。
锌(Zn)是一种重要的金属元素,其化合物主要有氧化锌、硫化锌、氯化锌等。
氧化锌是一种白色的固体物质,常见于生活用品和化妆品中。
硫化锌是一种白色的矿石,常用于制备锌和锌合金。
氯化锌是一种无色的固体,常用作催化剂和腐蚀抑制剂。
钠(Na)是一种常见的金属元素,其化合物主要有氯化钠、碳酸钠、亚硝酸钠等。
氯化钠是一种无色的晶体,是普通食盐的主要成分。
碳酸钠是一种白色的晶体,常用于制备碱性溶液和中和酸性物质。
亚硝酸钠是一种无色的晶体,常用于食品加工和防腐剂。
钢是一种由铁和碳组成的合金,常用于建筑和制造业。
除了碳,钢中还可以含有其他金属元素,如锰、铬、钼等。
这些金属元素能够提高钢的强度、硬度和耐腐蚀性。
总结起来,常见的金属元素及其化合物有铁(氧化铁、硫化铁、碳酸铁)、铜(氧化铜、硫化铜、碳酸铜)、铝(氧化铝、氯化铝、硫酸铝)、锌(氧化锌、硫化锌、氯化锌)、钠(氯化钠、碳酸钠、亚硝酸钠)等。
常见金属元素单质及其重要化合物PPT

• (3)Na2S溶液中离子浓度由大到小的顺序 为________,向该溶液中加入少量固体 CuSO4,溶液pH______(填“增大”“减 小”或“不变”),Na2S溶液长期放置有 硫析出,原因为 _________________________________ ________ __ __ ___________________________(用离子 方程式表示)。
(3)Na2S在溶液中完全电离,其电离方程式为: Na2S===2Na++S2-,该溶液存在的水解和电离平衡 有:S2-+H2O===HS-+OH-,HS-+H2O H2 O H2S+OH-,
H++OH-,由于S2-的水解是微弱的且OH-的来源
有三部分,因此,c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。 加入CuSO4后,由于发生反应:CuSO4+ Na2S===CuS↓+Na2SO4使得溶液中S2-的浓度减小,尽管 其水解程度增大了,但溶液中的c(OH-)减小,故pH减小。
•第1讲 常见金属元素单质 •及其重要化合物
• 考纲解读 • 1.了解常见金属的活动顺序。 • 2.了解常见金属(钠、镁、铝、铁、铜等) 及其重要化合物的主要性质及其应用。 • 3.了解合金的概念及其重要应用。 • 4.了解金属的通性,金属的冶炼原理。
• 考情探究 • 近五年来,在新课标地区的高考试题中,对金 属性质及应用的考查共出现21次,其中,2011 年出现5次,例如:2011全国理综27题,2011 年山东理综29题。对金属及其化合物的实验题 的考查共出现9次,其中,2011年出现3次,例 如:2011年福建理综24题。金属性质及应用的 考查题型以选择题的形式出现14次,分值一般 为4~6分。综合推断题的形式出现7次,分值一 般为8~15分。 • 高考试题对本专题内容能力点的考查以知识的 识记、物质性质的探究及应用为主,试题一般 以容易或中档题为主。
完整版)高中化学知识点总结:金属元素及其化合物

完整版)高中化学知识点总结:金属元素及其化合物高中化学知识点总结:金属元素及其化合物一、金属元素概述1.金属元素在周期表中的位置及原子结构特征金属元素分布在周期表的左下方,目前已知的112种元素中有90种金属元素。
金属元素最外层电子数一般小于4个,仅有Ge、Sn、Pb有4个,Sb、Bi有5个,Po有6个。
金属原子半径较同周期非金属原子半径大。
金属元素形成的金属单质固态时全是金属晶体。
2.金属的分类1)按冶金工业上的颜色分:黑色金属有Fe、Cr、Mn (其主要氧化物呈黑色),有色金属则是除Cr、Mn以外的所有金属。
2)按密度分:轻金属密度小于4.5g/cm³,如Na、Mg、Al;重金属密度大于4.5g/cm³,如Fe、Cu、W。
3)按存在丰度分:常见金属如Fe(4.75%)、Al(7.73%)、Ca(3.45%)等;稀有金属如锆、铪、铌等。
3.金属的物理性质1)状态:除汞外,其他金属通常为固态。
2)金属光泽:多数金属具有金属光泽。
3)易导电和导热:由于金属晶体中自由电子的运动,使金属易导电、导热。
4)延展性:金属可以压成薄片,也可以抽成细丝。
5)熔点及硬度:金属晶体中金属离子和自由电子的作用强弱决定其熔点和硬度,最高的是钨(3413℃),最低的是汞(-39℃)。
4.金属的化学性质1)与非金属单质作用。
2)与H2O作用。
3)与酸作用。
4)与碱作用,只有Al、Zn可以。
5)与盐的作用。
6)与某些氧化物的作用。
5.金属的冶炼1)热分解法(适用于不活泼金属):2HgO=2Hg+O²,2Ag2O=4Ag+O²。
2)热还原法(常用还原剂CO、H2、C活泼金属等):Fe2O3+3CO=2Fe+3CO2,Cr2O3+2Al=2Cr+Al2O3.3)电解法(适用于非常活泼的金属):2Al2O3=4Al+3O2,2NaCl=2Na+Cl2.二、碱金属元素1.钠及其化合物1)钠的物理性质:钠是一种柔软、银白色,有金属光泽的金属,具有良好的导电、导热性,密度比水小,比煤油大,熔点较低。
常见金属元素及其化合物专题

专题复习常见金属元素及其化合物[高考关键词]单质——氧化物(碱性氧化物)——氢氧化物(碱)——盐(阳离子)。
1•钠:活泼、还原性(保存);过氧化钠:结构特点、与水及C02反应特点;烧碱。
2•铝:还原性、与强碱反应、合金;氧化铝、氢氧化铝:两性; AI3+ :水解、净水、离子共存、铝三角转化。
3•铁: 腐蚀、变价;Fe2+ :还原性、离子共存、保存、检验;Fe3+ :氧化性、水解、离子共存、检验;Fe2+、Fe3+的相互转化。
4•铜:不活泼、冶炼;氧化物、Cu2+:颜色。
丁核心考点回扣---------------------------------------------------------------- 1.熟记几种物质的颜色Na2O2 是__________ ; Fe2°3 是 ______ ;AI(OH) 3、Fe(OH) 2 均是____________________ ;Fe(OH)3是__________; CuSO4是__________ ;FeCl3 ________ 。
答案淡黄色红棕色白色红褐色白色棕黄色2.熟悉4类特殊反应(1)Fe在CI2中燃烧,无论CI2是否过量,产物均为___________ 。
(2)Na在氧气中燃烧,无论 O2是否过量,产物均为___________ 。
(3)与水接触产生气体单质的物质有 _________ 。
(4)与水接触产生气体化合物的物质有 _________ 。
答案 (1)FeCI3⑵Na2O2⑶Na、K、Na2O2等⑷Al 2S3、Mg 3N 2、CaC23.典型元素及其化合物的特征性质(1)Na、AI、Fe、Cu四种元素的单质中:①能与水剧烈反应的是_____________ ,反应的离子方程式:___________________________ ;②能与 NaOH溶液反应的是_________ ,反应的离子方程式:____________________________ , 其中作氧化剂的是_______________________________________________________________ ;③Cu在潮湿的空气中被腐蚀的化学方程式:______________________④与氧气反应条件不同,反应产物不同的是(2)上述四种金属的氧化物中:①_______________________ 能用作供氧剂的是,写出一个化学方程式:②___________________________________________________________ 既能溶于酸溶液又能溶于强碱溶液的是______________________________________________________ ,离子方程式分别为_________________________________________________________③_________________________________________________________ 常温下为黑色固体的是_________________________________________________________________ 。
常见金属元素及其化合物—配位化合物稳定性及变化

[Fe(CO)5] CO
常见的配体
阴离子:X-、OH-、CN中性分子:NH3、H2O、CO、RNH2(胺)
配位原子——配体中提供孤电子对与形成 体形成配位键的原子。
常见的配位原子:N、O、S、C、卤素原子
如
[Cu(NH3)4]2+
配体
NH3
配位原子
N
[Fe(CO)5] CO C
配体:根据一个配体中所含配位原子个数 分为单齿配体和多齿配体。
配合物
2.配位化合物的组成
[ Cu (NH3)4 ] SO4
中心原子 配体 内界
外界
配合物
注意 ●内层:是配合物的特征部分,在书写化学式时,需用方括
号括起来;
●内、外层之间以离子键结合,在水溶液中完全解离。
●配位分子没有外层。
[Cu(NH3)4]SO4
┌──┴──┐
内界
外界
[Cu(NH3)4]2+ SO42- ┌──┴──┐ 中心离子 配体
氯化二氯·四氨和钴(Ⅲ)。 四氯合金(Ⅲ)酸
五羰基合铁(0) 四氯·二氨合铂(Ⅳ)
类型
化学式
配位酸
H[BF4]
H3[AlF6]
配位碱 [Zn(NH3)4](OH)2
[Cr(OH)(H2O)5](OH)2
配
K[Al(OH)4]
位
盐
[Co(NH3)5(H2O)]Cl3
[Pt(NH3)6][PtCl4]
CH2 CH2
CO CH2 CH2
O
CO
同一中心原子形成的螯合个体的稳定性, 一般比组成和结构相近的非螯合配位个体的稳 定性高,这种现象称为螯合效应。
螯合个体的稳定性与中心原子和配体所形 成的螯环的大小和数目有关。含五元环和六元 环的螯合个体是稳定的,而小于五元环或大于 六元环的螯合个体是不稳定的。
常见金属元素及其化合物

常见金属元素及其化合物金属元素是指具有金属性质的化学元素,常见金属元素包括铁、铜、铝、锌、镁、钙、锡等。
这些金属元素具有良好的导电性、导热性、延展性、韧性等特点,被广泛应用于工业、建筑、电子、汽车等领域。
以下将对常见金属元素及其化合物进行介绍。
铁是最常见的金属元素之一,它在地壳中含量很丰富。
铁具有良好的韧性和可塑性,广泛应用于钢铁制造、建筑、机械加工、电子设备等领域。
铁的化合物有很多,常见的有氧化铁(Fe2O3)和硫化铁(FeS2)等。
氧化铁是一种重要的无机颜料,用于制造红、橙、黄等颜色的油漆、颜料和陶瓷;硫化铁常用于制造火柴的火头。
铜是另一种常见的金属元素,具有良好的导电性和导热性。
铜广泛应用于电子设备、电线、管道等领域。
铜的化合物有氧化铜(CuO)、硫化铜(CuS)等。
氧化铜常用作无机颜料、催化剂和电池材料;硫化铜可用于制备农药和矿石浮选剂。
铝是一种轻质金属元素,密度低、延展性好。
铝广泛用于飞机、汽车、建筑等领域。
铝的主要化合物有氧化铝(Al2O3)和硫化铝(Al2S3)等。
氧化铝是一种重要的工业原料,广泛用于制造陶瓷、搪瓷、耐火材料等;硫化铝用于制备染料和催化剂。
锌是一种重要的工业金属,具有抗腐蚀性好、导电性能优良等特点。
锌广泛应用于电镀、电池制造、建筑材料等领域。
锌的主要化合物有氧化锌(ZnO)和硫化锌(ZnS)等。
氧化锌常用于生产橡胶、涂料、油漆、化妆品等;硫化锌是一种重要的矿石,在锌冶炼过程中起着重要的作用。
镁是一种轻质金属元素,密度低、质轻。
镁广泛应用于轻金属合金、烟火制造、航空航天等领域。
镁的主要化合物有氧化镁(MgO)和硫化镁(MgS)等。
氧化镁是一种重要的耐火材料,广泛用于高温炉窑、电解槽等;硫化镁可用于制备染料和防腐剂。
钙是一种重要的金属元素,广泛存在于生物体内。
钙广泛应用于建筑材料、电子材料、钢铁冶炼等领域。
钙的主要化合物有氧化钙(CaO)和氯化钙(CaCl2)等。
氧化钙是一种重要的建筑材料,用于制备水泥、石灰等;氯化钙常用于融雪剂、防止水泥凝固等。
普通化学第3章 常见金属元素及其化合物

2010-3-17
三课时
讲授内容
• 一、钠及其化合物 • 二、铝及其化合物 • 三、铁及其化合物 • 四、硬水的软化
• IA族的元素的氧化物对应的水化物都是可溶 于水的碱,所以称作碱金属。
• 碱金属元素包括:锂、钠、钾、铷、铯。 以钠为代表,学习钠的有关知识。
一、钠及其化合物
Al
熔点/℃
660
Al2O3 2050
(2)铝的化学性质
4Al+3O2=2Al2O3
与硫、卤素的反应(学生自己写化学方程式)
2Al+6HCl=2AlCl3+3H2↑ H+
Al2O3+6HCl=2AlCl3+3H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ OH-
Al2O3+2NaOH=2NaAlO2+H2O
剂。
腐植酸钠
腐植酸钠是一种高分子非均一 的芳香族,是多羟基、羧酸的 钠盐,外观为黑色粉状、晶状 固体。溶于水,呈碱性。具有 离子交换、吸附、络合、螯合、 絮凝、粘结等多种功能。
主要规格:
腐植酸 (干基计) ≥60.0% 水不溶物(干基计) ≤15.0%
水 份 ≤15.0% PH 8.0-10.0
•主要用途: 工业方面:用于陶瓷增效剂,钻井泥浆降失水剂, 混凝土早强减水剂,废水处理剂、软水染色剂,离子交换剂、 锅炉水处理剂等。 其他方面:主要用于土壤改良剂、植物生长调节剂、养殖池水 处理剂、饲料添加剂及兽药制剂等。
• C. 宝石:红宝石——铬元素
•
蓝宝石——铁、钛等元素
(2)氢氧化铝Al(OH)3
• 为白色胶状沉淀,是两性氢氧化物,既能 与酸反应生成铝盐,又能与碱反应生成偏 铝酸盐。 Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3 +NaOH=NaAlO2+2H2O
常见金属元素及其重要化合物
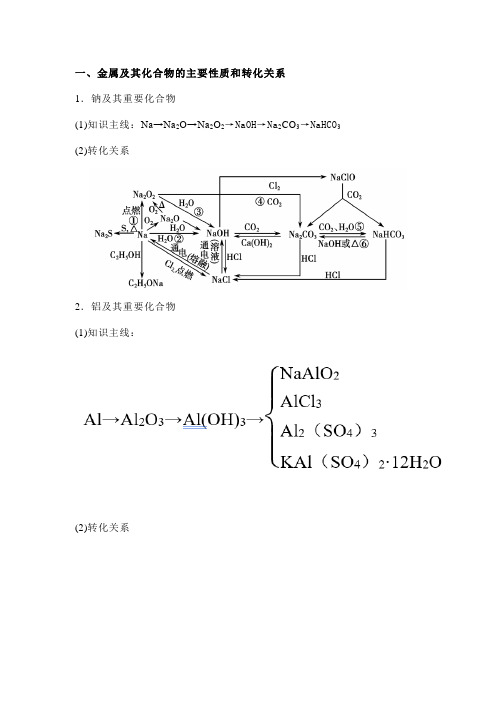
一、金属及其化合物的主要性质和转化关系1.钠及其重要化合物(1)知识主线:Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3(2)转化关系2.铝及其重要化合物(1)知识主线:(2)转化关系3.铁及其重要化合物(1)知识主线(2)转化关系4.铜及其重要化合物(1)知识主线:(2)转化关系:二、常见阳离子的检验与判断常见阳离子的检验1.用NaOH溶液检验Cu2+产生蓝色沉淀Fe3+产生红褐色沉淀Fe2+产生白色沉淀,迅速变成灰绿色,最后变成红褐色Al3+产生白色沉淀,继续加入NaOH溶液,白色沉淀溶解NH4+共热生成能使湿润的红色石蕊试纸变蓝的气体2.特殊检验法Fe3+加入KSCN溶液呈红色,加苯酚溶液呈紫色Fe2+加入KSCN溶液无现象,滴加新制氯水或双氧,水后溶液呈红色3.焰色反应用焰色反应可检验出溶液中的K+和Na+K+火焰呈紫色(透过蓝色钴玻璃观察)Na+火焰呈黄色三、金属元素单质及其化合物1.无机化工流程题常见设问方向(1)反应速率与平衡理论的运用;(2)氧化还原反应的判断、化学方程式或离子方程式的书写;(3)利用控制pH分离除杂;(4)化学反应的能量变化;(5)实验基本操作:除杂、分离、检验、洗涤、干燥等;(6)流程中的物质转化和循环,资源的回收和利用;(7)环境保护与绿色化学评价。
2.无机化工流程题的审题技能化工生产流程题中经常会出现一些表述性词语,这些表述性词语就是隐性信息,它可以暗示我们审题所应考虑的角度。
常见的有:(1)“控制较低温度”——常考虑物质的挥发,物质的不稳定性和物质的转化等。
(2)“加过量试剂”——常考虑反应完全或增大转化率、产率等。
(3)“能否加其他物质”——常考虑会不会引入杂质或是否影响产品的纯度。
(4)“在空气中或在其他气体中”——主要考虑O2、H2O、CO2或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。
(5)“判断沉淀是否洗净”——常取少量最后一次洗涤液于试管中,向其中滴加某试剂,以检验其中的某种离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
状元之路 高考热点专题专练·二轮钻石卷 化学
(6)根据氢氧化物的颜色特征可鉴别某些金属离子。例 如,Cu(OH)2:蓝色沉淀;Fe(OH)3:红褐色沉淀;Fe(OH)2: 白色沉淀→灰绿色→红褐色(有O2存在时)。
考源教学资源网 www.
第15页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
第2页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
考纲要求 1.常见金属元素(如Na、Al、Fe、Cu等)。 (1)了解常见金属的活动性顺序。 (2)了解常见金属及其重要化合物的主要性质及其应用。 (3)了解合金的概念及其重要应用。
考源教学资源网 www.
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
(2)两性氧化物既能与强酸反应,又能与强碱反应。 如Al2O3+6HCl===2AlCl3+3H2O, Al2O3+2NaOH===2NaAlO2+H2O。 (3)过氧化物的性质(以Na2O2为例) ①与H2O反应,如2Na2O2+2H2O===4NaOH+O2↑; ②与酸性氧化物反应,如2Na2O2+2CO2===2Na2CO3+ O2; ③与酸反应,如2Na2O2+4HCl===4NaCl+2H2O+ O2↑;
③化学方程式:2Na2O2+2H2O===4NaOH+O2↑;
④化学方程式:2Na2O2+2CO2===2Na2CO3+O2;
状元之路 高考热点专题专练·二轮钻石卷 化学
2.氢氧化物的化学性质。 (1)碱的通性。 ①可溶性碱能使指示剂变色; ②可溶性碱能与酸性氧化物反应,如2NaOH+ CO2===Na2CO3+H2O; ③与酸发生中和反应,如2Fe(OH)3+3H2SO4===Fe2(SO4)3 +6H2O; ④可溶性碱能与某些可溶性盐发生复分解反应, 如Ca(OH)2+Na2CO3===CaCO3↓+2NaOH。
(4)Fe2O3与HI反应时,注意考虑三价铁的氧化性, 如Fe2O3+6H++2I-===2Fe2++I2+3H2O。 (5)FeO与O2、氧化性酸反应时,注意考虑二价铁的还原 性,如6FeO+O2==△===2Fe3O4。
考源教学资源网 www.
ห้องสมุดไป่ตู้
第14页
返回导航
第一部分 专题九
第5页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
考源教学资源网 www.
第6页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
考源教学资源网 www.
第7页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
考源教学资源网 www.
第11页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
(2)碱的热稳定性。 溶于水的碱受热难分解,难溶于水的碱受热易分解,如
△ 2Fe(OH)3=====Fe2O3+3H2O。 (3)两性氢氧化物既能与强酸反应,也能与强碱反应。 如Al(OH)3+3HCl===AlCl3+3H2O, Al(OH)3+NaOH===NaAlO2+2H2O。
热点二 金属的氧化物和氢氧化物 1.金属氧化物的化学性质。 (1)碱性氧化物的通性。 ①可溶性氧化物能与水反应; ②能与强酸反应,如Fe2O3+6HCl===2FeCl3+3H2O; ③能与酸性氧化物反应,如Na2O+CO2===Na2CO3。
考源教学资源网 www.
第8页
第3页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
热点归纳整合
理热点 查遗漏 寻规律
考源教学资源网 www.
第4页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
热点一 金属活动性顺序表及应用
考源教学资源网 www.
O··:
O····:]2-Na+,晶体中既有离子键又有非极
性共价键,阴、阳离子数目比为1:2。
考源教学资源网 www.
第13页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
(3)Na2O2与具有还原性的酸性氧化物、酸及盐反应时,注 意考虑Na2O2的强氧化性,如2Na2O2+2SO2===2Na2SO3+ O2(×),Na2O2+SO2===Na2SO4(√)。
知识点三 金属单质及其化合物间的转化关系 1.钠及其重要化合物间的转化关系。
考源教学资源网 www.
第16页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
图中标号反应的化学方程式或离子方程式:
点燃 ①化学方程式:2Na+O2=====Na2O2;
②离子方程式:2Na+2H2O===2Na++2OH-+H2↑;
考源教学资源网 www.
第12页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
3.金属氧化物或氢氧化物的特殊结构、性质。
(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定
是碱性氧化物,如Mn2O7。
(2)Na2O2的特殊结构。
电子式为Na+[:
··
考源教学资源网 www.
第9页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
④与盐溶液反应,如2Na2O2+2CuSO4+ 2H2O===2Cu(OH)2↓+2Na2SO4+O2↑。
考源教学资源网 www.
第10页
返回导航
第一部分 专题九
状元之路 高考热点专题专练·二轮钻石卷 化学
第一部分 专题知识突破
考源教学资源网 www.
第1页
返回导航
第一部分 专题知识突破
状元之路 高考热点专题专练·二轮钻石卷 化学
专题九 常见金属元素及其化合物
热点归纳整合
热点题型突破
考源教学资源网 www.
