大学化学高分子有机化学第十二章羧酸详解演示文稿
合集下载
羧酸 课件

化学方程式为 Na2CO3+2CH3COOH 离子方程式为
2CH3COONa+H2O+CO2↑,
2CH3COOH+CO32— 2CH3COO − +CO2↑+H2O。
(2)酯化反应(或取代反应)。
如乙酸与乙醇的反应: CH3COOH+CH3CH2OH
CH3COOC2H5+H2O。
一、酯化反应 1.规律
点拨实验室中利用该反应制取乙酸乙酯时,需注意以下几点: ①实验中浓硫酸起催化剂和吸水剂作用。
②盛反应混合液的试管要向上倾斜约45°,主要目的是增大反应 混合液的受热面积。
③导管应较长,除导气外还兼起冷凝作用。导管末端只能接近饱 和Na2CO3溶液的液面而不能伸入液面以下,目的是防止发生倒吸 现象。
知识点2 酯化反应实验 【例题2】可用图示装置制取少量乙酸乙酯(酒精灯等在图中均 已略去)。请回答下列问题:
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺
序及操作是
。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施
是
。
(3)实验中加热试管a的目的是:
①;②。
(4)试管b中加有饱和Na2CO3溶液,其作用是
① (产物可以继续反应)
②
+2H2O )为例]: +H2O
+2H2O
二、常见有机物中羟基活性的比较
醇、酚、羧酸的分子结构中均含有—OH,可分别称之为“醇羟 基”“酚羟基”和“羧羟基”。由于这些—OH相连的基团不同,—OH受 相连基团的影响不同,故羟基上的氢原子的活泼性也就不同,表现 在化学性质上也有较大差别,具体比较见下表:
D.
课件有机化学第12章 羧酸及衍生物

O H3C C O
H H
O C O
6
CH3
乙酸的二缔合体
12.2 羧酸的化学性质
7
12.2 羧酸的化学性质
1. 酸性
R C O R C O
• 酸性比醇强得多 O O • 仍是一种弱酸 • 一元饱和脂肪族羧酸的pKa值一般在3~5之间
pKa
HCl -7
CH3COOH CH3CH2OH 4.72 16
H+
-H 2O
OH C OCH 2 CH 3
-H +
O C OCH 2 CH 3
14
加成-消除机理
Example
O C OH H2SO4 O C OC2 H5
+ C2H5OH
+ H2O
CH3 CH2 CH2 CH3COCl 或 (CH3CO)2O
O C ONa
+ CH3I
CH3 CH2 CH2 O C OC2 H5
酸性
8
取代基对羧酸酸性的影响
Structure pKa 1.26 2.85 4.72
• 吸电子取代基使酸性增强 • 给电子取代基使酸性减弱
Cl2CHCOOH ClCH2COOH CH3COOH
O
吸电子基
O
给电子基
C O
C O
吸电子取代基 提高羧酸盐稳定性
给电子取代基 降低羧酸盐稳定性
9
羧酸的酸性反应
H2SO4
CH3CO2CH2CH3 + H2O
O HOCH2CH2CH2COH
O O
13
反应机理(掌握)
O C OH H+ OH C OH 慢 OH C H OH 2 C OH OCH 2 CH 3 OH O CH 2 CH 3 CH 3 CH 2 OH
《有机化学~羧酸》课件

酸碱性质
羧酸可作ቤተ መጻሕፍቲ ባይዱ酸,产生质子,也可以作为酸盐,失去质子与碱反应。
反应机理
羧酸的反应机理涉及酸碱中和、质子转移、共振和氢键等复杂的化学过程。
羧酸与金属离子的络合作用
由于羧酸中的羧基可以与金属离子形成络合物,这种络合作用对催化、药物和材料科学具有重要意义。了解羧 酸与金属离子的相互作用可以拓展其应用领域。
羧酸可发生一系列典型的化学反应,如
酯化、酰化、酰氯化、缩合和加成反应,
形成各种有机化合物。
3
pH反应
由于羧酸中的羧基,它们在溶液中呈酸 性,可以与碱发生中和反应,产生盐和 水。
羧酸的产生和应用领域
羧酸可以通过多种方法合成,例如氧化、酸催化和酯水解等。由于其特殊的结构和性质,羧酸在许多不同的领 域中具有广泛的应用。
羧基结构
羧基由碳、氧和氢构成,形成一个含氧的酸基团。
分子结构
羧酸通过共价键连接碳原子,形成一个含有羧基的 有机分子。
羧酸的命名方法
为了准确命名羧酸,有一套特定的系统命名法。羧酸的命名方法基于其分子结构和官能团,使其易于辨识和描 述。
IUPAC命名法
羧酸根据IUPAC规则进行命名,包括根据碳链长 度、取代基、官能团等因素进行命名。
《有机化学~羧酸》PPT课 件
这个PPT课件将为您介绍有机化学中的羧酸相关知识,包括定义、命名方法、 物理性质、化学性质等内容,帮助您深入了解这个有趣的化合物。
羧酸的基本结构
羧酸由羧基(-COOH)与其他基团组成,具有特殊的分子结构,这种结构使羧酸具有独特的性质和反应。了解 羧酸的基本结构对理解其特点非常重要。
常见名称
一些羧酸有常用的名称,可以根据它们的特定 结构或应用而命名。
羧酸可作ቤተ መጻሕፍቲ ባይዱ酸,产生质子,也可以作为酸盐,失去质子与碱反应。
反应机理
羧酸的反应机理涉及酸碱中和、质子转移、共振和氢键等复杂的化学过程。
羧酸与金属离子的络合作用
由于羧酸中的羧基可以与金属离子形成络合物,这种络合作用对催化、药物和材料科学具有重要意义。了解羧 酸与金属离子的相互作用可以拓展其应用领域。
羧酸可发生一系列典型的化学反应,如
酯化、酰化、酰氯化、缩合和加成反应,
形成各种有机化合物。
3
pH反应
由于羧酸中的羧基,它们在溶液中呈酸 性,可以与碱发生中和反应,产生盐和 水。
羧酸的产生和应用领域
羧酸可以通过多种方法合成,例如氧化、酸催化和酯水解等。由于其特殊的结构和性质,羧酸在许多不同的领 域中具有广泛的应用。
羧基结构
羧基由碳、氧和氢构成,形成一个含氧的酸基团。
分子结构
羧酸通过共价键连接碳原子,形成一个含有羧基的 有机分子。
羧酸的命名方法
为了准确命名羧酸,有一套特定的系统命名法。羧酸的命名方法基于其分子结构和官能团,使其易于辨识和描 述。
IUPAC命名法
羧酸根据IUPAC规则进行命名,包括根据碳链长 度、取代基、官能团等因素进行命名。
《有机化学~羧酸》PPT课 件
这个PPT课件将为您介绍有机化学中的羧酸相关知识,包括定义、命名方法、 物理性质、化学性质等内容,帮助您深入了解这个有趣的化合物。
羧酸的基本结构
羧酸由羧基(-COOH)与其他基团组成,具有特殊的分子结构,这种结构使羧酸具有独特的性质和反应。了解 羧酸的基本结构对理解其特点非常重要。
常见名称
一些羧酸有常用的名称,可以根据它们的特定 结构或应用而命名。
有机化学第12章羧酸及其衍生物PPT课件

O
O
2 0 o C
C l C H 2C O C 2 H 5 + N H 3 H 2 O C l C H 2C N H 2+ C H 3 C H 2 O H
酸酐也能发生氨解:
( C H 3 C O ) 2 O + H 2 N O C 2 H 5 C H 3 C O N H O C 2 H 5 + C H 3 C H 2 O H
一、亲核加成-消去反应
1.机理
O
RC
L
Nu
O
慢
RC
L
亲核加成
Nu
四面体中间体
O
RC
L
O 快
RC
Nu + L
消去
Nu
(1)反应活性取决于羰基碳原子正电性,反应活性:酰卤>酸酐>酯>酰胺
吸电子诱导效应(-I):X > OCOR’ > OR > NH2
给电子共轭效应(+C): X < OCOR’ < OR < NH2
O H +C H 3 C O C lN (C H 2 C H 3 )3
O
O C C H 3
19
羧酸通过酰氯再与醇反应比直接酯化产率高:
( C H 3 ) 3 C C O O H S O C l 2( C H 3 ) 3 C C O C lC 6 吡 H 5 啶 O H ( C H 3 ) 3 C C O O C 2 H 5 80%
O + H2O + CO2 状聚酐
13
12.3 羧酸的制法*
一、氧化法
1.醛和伯醇的直接氧化得到同碳原子数的羧酸;
(1 )K M n O 4 ,O H -
大学有机化学课件--羧酸

COOH bP 249 0C
PCL5
160 0C
升华
PCl5 SOCl2
O
3CH3CCl H3PO3
52 0C
200 0C 分解
蒸出
O
C Cl POCl3 HCl
197 0C
107 0C
蒸出
O
R C OH SOCl2
O
R C Cl SO2 HCl
21
3、成酰胺和成腈的反应
O
R COH +NH3
O
R CO NH4
CN
丙二酸二乙酯的制备参:P53
30
第五节:二元羧酸
思考题:
(P18)
1、为什么二元羧酸的 K1> K2? 2、为什么顺丁烯二酸的 K顺1 > K反1,
而 K顺2<K反2?
31
二元羧酸的热分解反应(p20)
O
乙二酸 HOOCCOOH
HCOH + CO2
失羧
丙二酸 HOOCCH2COOH
CH3COOH+ CO2
6
二、光谱性质
IR
单体
VC=O
1770~1750cm-1
VO H
~3550cm-1
VC—O
NMR:
=
1320~1210cm-1
O R—CH2—C—O—H δ: 2-2.6 10-12
二缔合体 1725~1700cm-1 3400~2500cm-1
7
第三节 羧酸的结构与酸性
一、结构
O HC
OH
0.124nm 0.131nm
4.05
CH2CH2CH2COOH Cl
4.52
10
d、诱导效应具有加和性
羧酸.PPT
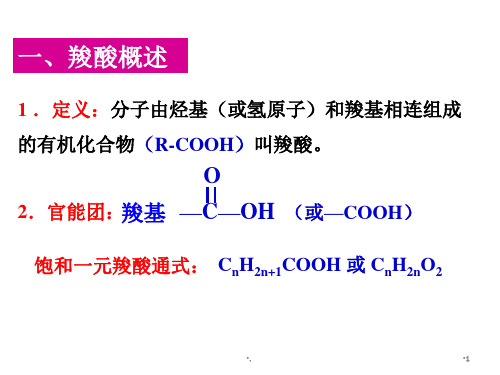
•10
三、几种常见的羧酸
名称
结构简 式 俗名
甲酸 HCOOH 蚁酸
色态
无色液体
溶解性
与水、乙醇、乙 醚、甘油等互溶
苯甲酸
安息香酸 白色针状晶体 微溶于水,易溶 于乙醇和乙醚
乙二酸
HOOC— COOH
草酸
无色透明晶 体
能溶于水 和乙醇
•.
•11
1 .甲酸(HCOOH) ——俗称蚁酸
根据其结构可推断出甲酸具有些什么性质?
可能存在H——易取代
•.
•5
1 .酸性
受羰基影响,羟基上 的氢变得活泼
R—COOH
R—COO- + H+
使紫色的石蕊溶液变红
Байду номын сангаас
具 有
与活泼金属(如Na、Mg等)反应放出氢气
酸 的
与金属氧化物(如Na2O、CaO等)
通 与碱(如NaOH、KOH等)发生中和反应
性 与部分盐(如碳酸盐等)反应
例如:
2RCOOH
A.新制生石灰
B.银氨溶液
C.浓溴水
D.新制Cu(OH)2
解析:可用新制Cu(OH)2来鉴别四种溶液。其实验现象 是:向四种溶液中加入新制Cu(OH)2,仅乙酸、甲酸 使Cu(OH)2溶解而溶液不浑浊,再将两组溶液分别加 热时,乙醛、甲酸能产生砖红色沉淀,从而将它们
区别开来。
答案:D
•.
•15
+ Na2CO3
→ 2RCOONa •.
+
CO2↑ + H2O•6
不同衍生物中的羟基的活泼性
羟基中氢 物质 结构简式 原子的活
泼性
酸性
与金属 与NaOH 钠反应 反应
有机课件-第12章羧酸

再靠近一点后究竟会怎样?
即:比一般-OH 更易脱去H+,原因何在?
是产物稳定? Yes ! But….
应该说是反应物的特殊结构所致:
O
H3C
.O. H
对于取代醛酮, -C=O与-OH距离越近,相 互作用越强。靠近到同碳时,生成了另一种 特殊的化合物——羧酸。
*** 一元羧酸的物理性质
化 学 性 质
NH4+ + OHHSO4- + NH3
NH3 + H2O NH4+ + SO42-
OH
OH
OH
O-
+ H3O+
+ H2O
+ OH-
+ H2O
NH2
+N H3
NH2
NH2
酸碱可以带正电荷或带负电荷或为中心分子, 在一个反应中是 酸,而在另一个反应中可以是碱。
平衡主要趋向形成更弱的酸和更弱的碱。
HCl(气) + H2O
补充——不饱和羧酸和取代羧酸
——R-COOH中,R与COOH的相互作用
*** 取代羧酸
一
上 述 讨 论 说 明 了 什 么 ?
相 距 越 远 , 影 响 越 小 , 醇 酸 已 几 无 影 响 。
-
减少一个碳
二、
Sp3——sp2
桥头碳难成 平面结构的 sp2杂化状态
2. 路易斯(lewis)酸碱电子论 酸是电子对的接受体,碱是电子对的给予体。
lewis酸碱反应形成配位键,产生加合物。
lewis 酸 + lewis 碱
加合物
BF3 + O(CH2CH3)2
F CH2CH3 F BO
即:比一般-OH 更易脱去H+,原因何在?
是产物稳定? Yes ! But….
应该说是反应物的特殊结构所致:
O
H3C
.O. H
对于取代醛酮, -C=O与-OH距离越近,相 互作用越强。靠近到同碳时,生成了另一种 特殊的化合物——羧酸。
*** 一元羧酸的物理性质
化 学 性 质
NH4+ + OHHSO4- + NH3
NH3 + H2O NH4+ + SO42-
OH
OH
OH
O-
+ H3O+
+ H2O
+ OH-
+ H2O
NH2
+N H3
NH2
NH2
酸碱可以带正电荷或带负电荷或为中心分子, 在一个反应中是 酸,而在另一个反应中可以是碱。
平衡主要趋向形成更弱的酸和更弱的碱。
HCl(气) + H2O
补充——不饱和羧酸和取代羧酸
——R-COOH中,R与COOH的相互作用
*** 取代羧酸
一
上 述 讨 论 说 明 了 什 么 ?
相 距 越 远 , 影 响 越 小 , 醇 酸 已 几 无 影 响 。
-
减少一个碳
二、
Sp3——sp2
桥头碳难成 平面结构的 sp2杂化状态
2. 路易斯(lewis)酸碱电子论 酸是电子对的接受体,碱是电子对的给予体。
lewis酸碱反应形成配位键,产生加合物。
lewis 酸 + lewis 碱
加合物
BF3 + O(CH2CH3)2
F CH2CH3 F BO
高鸿宾羧酸详解演示文稿

CH3
,
,
CH3
CH3
第十六页,共29页。
(2) 羧酸的结构与酸性的关系
O
O
R C OH O
RC O
R C O + H+ O
RC O
R
1
O2
1
C O2
sp2杂化、p ,π–共轭
甲酸:
甲酸钠:
0.120 nm O H C O H 0.134 nm
0.127 nm
O
H C-
O
R
C
O O
烷基R上连有的取代基的电子 H 效应:诱导效应: +I、 -I
O2N O
O2N O
COH + SOCl2
亚硫酰氯
C Cl + Shloride) (90%~98%)
(2) 酸酐的生成
2 分子羧酸 OO
脱水剂:
O
P2OO5、乙酸酐
2 RCO2H CH3COCCH3 R C O C R + 2CH3COOH
用于大分子对称的酸酐合成 乙酸沸点低
(CH3)3C MgCl + O C O
O
C(CH3)3
H3O+
C O MgCl
(CH3)3CCOOH
反应特点:
• RX RCOOH
• 增长1个C的碳链
•
限制:底物分子中不能含有–OH, –SH 或C=O等基团
–
NH2,
第九页,共29页。
Br
Mg 乙醚
MgBr
①CO2 ②H3O+
COOH
12.3.5 酚酸的合成
酯化反应(esterification) O
CH3COOH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O CH3CH2 C
丙酰基
O C
苯甲酰基
§12-2 羧酸的物理性质和光谱性质
一、物理性质
1. 物态:低级脂肪酸,1C~3C是液体,具有刺鼻的酸味, 中级脂肪酸,4C~10C为油状液体,具有难闻的气味, 高级脂肪酸是蜡状固体,挥发性低,无气味。
2. 沸点:羧酸的沸点比分子量相近的醇高,这是由于羧 酸的分子常以两个氢键缔合起来形成二聚体。
丙二酸 丁二酸 顺丁烯二酸
(E)-HOOCCH=CHCOOH 反丁烯二酸
普通(俗名)命名 草酸 缩苹果酸 琥珀酸 马来酸 富马酸ຫໍສະໝຸດ 含有二个羧基的羧酸称为二元酸。
2. 脂肪族羧酸的系统命名 开链的一元羧酸称为脂肪酸
❖选含有羧基的最长碳链为主链,根据主链的碳原子数 目称为某酸,编号从羧基开始。
❖英文名称是将相同碳原子数烃的词尾-e去掉,加上oic acid。
OH
(甲酸)
0.1245nm 0.1312nm 电子衍射实验证明
❖羧酸酸性的强弱取决于电离后所形成的羧酸根负离 子的相对稳定性。
O R C OH
O R C O-
❖羧酸的主要反应有:
O RC -
O
两个碳氧键等长,完全离域。
脱羧反应 -氢的反应
HO RCCOH
H
酸性 羟基被取代
NO2
对硝基苯甲酸 4-nitrobenzoic acid
CH2COOH Cl
CH3 CHCH2COOH
α-萘乙酸 α-naphthylacetic acid
3-对氯苯基丁酸 3-(4-chlorophenyl)butanoic acid
羧酸分子中除去羧基中的羟基后,余下的部分称为酰 基,可按原来的酸的名称称作“某酰基”。如:
CH3(CH2)14COOH
软脂酸(棕榈酸) palmitic acid
CH CHCOOH
CH3(CH2)16COOH
硬脂酸 stearic acid
COOH
肉桂酸 cinnamic acid
安息香酸 benzoic acid
二元酸
系统命名
HOOCCOOH
乙二酸
HOOCCH2COOH HOOC(CH2)2COOH (Z)-HOOCCH=CHCOOH
CH3(CH2)7CH CH(CH2)7COOH
CH3C CHCOOH CH3
9-十八碳烯酸(油酸)
3-甲基-2-丁烯酸
9-octadecenoic acid(oleic acid) △9-十八碳烯酸(油酸)
3-methyl-2-butenoic acid
❖羧酸也常用希腊字母标明位次,与羧基直接相连的碳 原子为,其余依此为、γ……等。
C=O吸收峰:脂肪酸:1725~1700cm-1; 芳香或不饱和酸:1700~ 1680 cm-1 。
CH3CH2COOH
2990
1720
C—O
O—H伸缩振动:中心在3000cm-1附近; C = O伸缩振动:在1720cm-1; C-O :1200cm-1
2.核磁共振谱:羧基上H的值为10.5~12。 ❖丙酸的核磁共振谱:
❖p-共轭的存在,使羧酸中的羰基对亲核试剂的活性降低, 不能和HCN、NH2OH等加成; ❖p-共轭作用,使得羧基不是羰基和羟基的简单加合,所 以羧基中既不存在典型的羰基,也不存在着典型的羟基, 而是两者互相影响的统一体。
醛酮中 醇中
CO 键长 0.122nm
C OH 键长 0.143nm
O HC
c. a.
b.
a. b. c. CH3CH2COOH
a.1.1 b.2.3 c.11.65
§12-3 羧酸的化学性质
❖羧基是由羰基和羟基组合而成的。
sp2杂化
O
··
RCOH
p-共轭
·
RC
·
O
··
OH
❖由于 p-共轭,使羧基中的羟基氧原子上的电子云向 羰基移动,氧氢键的电子云更靠近氧原子,增强了氧氢 键的极性,有利于氢原子的离解,使羧基具有酸性。
大学化学高分子有机化学第十二章 羧酸详解演示文稿
优选大学化学高分子有机化学第十 二章羧酸
§12-1 羧酸的分类和命名
一、羧酸的分类
1. 根据和羧基相连的烃基种类,可分为: 脂肪族羧酸、芳香族羧酸; 饱和酸、不饱和酸。
2. 根据羧基的数目,可分为: 一元酸、二元酸……
一元酸 二元酸
饱和酸 乙酸 乙二酸
COOH
-4.3 ℃ 对称性高
-59 ℃
COOH
4. 水溶性:羧酸分子中羧基是亲水基团,可以和水分子 形成氢键,烃基是憎水基团。
低级酸易溶于水,高级羧酸随分子量增大(R↑),而 在水中的溶解度减小。
二、光谱性质
1.红外光谱:O—H在3200~2500cm-1 (峰尖对着3000cm-1 ) 有一个强的宽吸收带。
❖距羧基最远的碳原子,在超过10个碳且仅在最后一个 碳上有取代基时,可标为ω位。
CH3CHCOOH
OH
-羟基丙酸 -hydroxypropanoic acid
BrCH2(CH2)9COOH
ω-溴十一酸 ω-bromoundecanoic acid
3. 芳香族羧酸的系统命名
COOH OH
COOH
邻羟基苯甲酸(水杨酸) 2-hydroxybenzoic acid(salicylic acid)
O HO
CH3 C OH
C CH3 O
分子量相近的化合物 的沸点由高到低顺序: 酸>醇>醛酮>烃
0.104nm
0.163nm
3. 熔点:直链饱和一元酸的熔点随碳原子数增加而升高, 显锯齿状变化,即含偶数碳原子羧酸的熔点比前后两个相 邻的含奇数碳原子酸的熔点要高。
熔 点
碳原子数
\℃
原因:偶数个碳的羧酸对称性高,在晶体中容易排列整 齐而排列较紧密。
CH3CHCH2CHCOOH CH3 CH2CH3
4-甲基-2-乙基戊酸 2-ethyl-4-methylpentanoic acid
CH2CH CHCH2COOH Cl
5-氯-3-戊烯酸 5-chloro-3-pentenoic acid
CH3CHCHCH2COOH H3C CH3
3,4-二甲基戊酸 3,4-dimethylpentanoic acid
不饱和酸 丙烯酸 顺丁烯二酸
芳香酸 苯甲酸 邻苯二甲酸
二、羧酸的命名
1. 俗名 许多羧酸是从天然产物中得到的,俗名通常根据来源而得。
HCOOH
蚁酸 formic acid
CH3CH2CH2COOH
酪酸 butyric acid
CH3COOH
醋酸 acetic acid
CH3(CH2)12COOH
月桂酸 lauric acid
