元素周期表知识点总结
元素周期表个知识点归纳

人教版化学必修2第一章第一节元素周期表38个知识点归纳1、元素定义:核电荷数相同的同一类原子的总称,一种元素可能有多种形式的原子存在形式,如:氢元素的几种形式:H、D21H、T31H、H+、H- ;2、元素符号:在元素周期表中每个小格分四层,元素符号在第一层,黑色字体,用拉丁文大写字母表示,当大写字母相同时,加一个小写字母予以区别;例如:H氢、He氦; C碳、Cl氯、Ca钙;N氮、Ne氖、Na钠;Al铝、Ar氩;3、元素名称:在元素周期表中每个小格分四层,元素名称在第二层,黑色字体,大多数元素的名称是由形声字构成,气态非金属的名称有气字头,固态非金属的名称有石头旁,液态非金属用三点水旁溴,液态金属用水字底汞,金属的名称都有金字旁,个别的元素的名称不是形声字,例如:氮不读“炎”音;4、元素分类:1按元素所在的周期分类:同周期元素和不同周期元素同周期元素共同点:电子层数相同,在元素周期表中处于同一行中,处于左右关系;不同周期元素不同点:电子层数不相同,在元素周期表中不处于同一行中;2根据元素的原子序数分类:前20号元素或第n号元素3按元素所在的族分类:主族元素、副族元素、第VIII族元素、0族元素4按元素周期表新课标人教版化学必修2分类:金属、非金属、过渡元素其中金属元素专指主族元素的金属元素,非金属包括主族非金属和稀有气体,过渡元素是指所有副族金属元素和Ⅷ族金属元素,;5、元素的特有数值:元素的原子序数和元素的相对原子质量;1原子序数=核电荷数=质子数,原子序数在核组成符号中处于元素符号的左下角位置,在元素周期表中每个小格内的第一层,位于元素符号的左下角,数字呈鲜红色;2元素的相对原子质量就是按照元素各核素原子的相对原子质量所占的一定百分比,元素的相对原子质量在元素周期表中每个小格内的第四计算出的平均值见课本P10层,通常保留有效数字4位,数字呈黑色;6、元素周期表1将化学元素依照某种特有数值从小到大顺序依次排成一行,并将化学性质相似的元素依照某种特有数值从小到大排成一列所形成的表格叫元素周期表;2元素周期表中特有数值:原子序数和相对原子质量;3门捷列夫的元素周期表依照的特有数值是相对原子质量,现行的元素周期表依照的特有数值是原子序数;7、元素周期表的结构:由七行和十八列构成,其中每一行为一个周期,从左到右第8、9、10列合起来为VIII族,其余每一列为一族,所以元素周期表由7个周期和16个族构成;8、周期的定义:将电子层数相同的元素依照核电荷数由小到大的顺序从左往右排成一行形成一个周期;9、周期的序数规定:周期序数=电子层数10、7个周期对应的元素种类数11、周期的分类:短周期和长周期;1短周期:含元素种类少于10种的周期,包括1、2、3周期;2长周期:含元素种类多余10种的周期,包括4、5、6、7周期;12、族的定义:将化学性质相似的元素依照核电荷数由小到大的顺序排成一列形成一族注意:VIII族是3列;1主族的定义:由短周期元素和长周期元素构成的族稀有气体除外另有名称;2副族的定义:完全由长周期元素构成的族第8、9、10列元素除外另有名称;3VIII族的定义:第8、9、10列元素构成的族;40族的定义:稀有气体构成的元素族;13、族的分类:主族、副族、0族、VIII族;14、主族的分类:依照最外层电子数由少到多的顺序分为7个主族;1主族序数的规定:主族序数=最外层电子数=最高正价数氧、氟例外;2主族序数的表示方法:罗马数字后加A;15、罗马数字的辨析:“四六不分”说的就是罗马字母IV和VI容易混淆;I是1,V是5,X是10,I在V或X左时,用减法,5-1=4IV,10-1=9IX;I在V或X右时,用加法,5+1=6VI,5+2=7VII,5+3=7VIII,10+1=11XI,10+2=12XII;16、副族的表示方法和分类:罗马数字后加B表示副族,共有7个副族,从左到右的顺序是IIIB、IVB、VB、VIB、VIIB、VIIIIB、IIB;17、各族元素的位置关系长式周期表18列和短式周期表各族从左到右对应的关系IA→IIA→IIIB→IVB→VB→VIB→VIIB→VIII﹡﹡﹡→IB→IIB→IIIA→IVA→VA→VIA→VIIA→018、元素的性质:是指元素的核外电子排布、原子半径、主要化合价、金属性和非金属性;19、碱金属元素性质比较1相同点:内层电子呈充满状态,最外层电子数相同都是1,发生化学反应时都失去一个电子呈+1价;2不同点:电子层数越来越多,原子半径越来越大,核对最外层电子的引力越来越弱,最外层电子越来越容易失去,金属性越来越强;20、碱金属单质的相似性1物理性质上的相似性:大多数是银白色金属铯略带金属光泽,硬度小,质软;2化学性质的相似性:都可以与氧气反应,生成含氧化合物;都可以与水反应生成碱并放出氢气,无论与哪种物质反应产物中碱金属元素的化合价都是+1价;21、碱金属单质的递变性1物理性质上的递变性:从锂到铯,密度逐渐增大钾反常,熔沸点逐渐降低;2化学性质的递变性:①与氧气反应产物的种类越来越多,含氧化合物中氧元素的价态越来越高;锂元素只有一种含氧化合物:Li2O,钠元素有两种含氧化合物:Na2O和Na2O2;钾元素有三种含氧化合物:K2O、K2O2、KO2;②与水反应的激烈程度不一样;22、卤族元素性质比较1相同点:内层充满,最外层电子数都是7,最低负价都是-1;2不同点:从氟到碘,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的引力逐渐减小,非金属性逐渐减弱、;23、卤素单质的相似性1物理性质的相似性:都有颜色都是双原子分子;2化学性质的相似性:都可以和氢气反应生成卤化氢HX,都可以和水反应;24、卤素单质F2→I2的递变性1物理性质颜色逐渐变深,密度逐渐增大,熔沸点逐渐升高,聚集状态变化:气态→液态→固态; 2化学性质①与氢气反应:反应条件不同、激烈程度不同;②与水反应:激烈程度逐渐变弱,氟气与水发生置换反应,其余卤素单质与水发生歧化反应;2 F2+2H2O=4HF+O2↑;X2+H2O=HX+HXO , X∈{ Cl 、Br、 I }③与强碱溶液反应▲常温下与强碱的稀溶液反应:X 2 +2NaOH=NaX+NaXO+H 2O , X∈{ Cl 、Br 、 I } ▲加热条件下与强碱的浓溶液反应:3X 2+6KOH 浓5KX+KXO 3+3H 2O , X∈{ Cl 、Br 、I }④与亚硫酸溶液反应:X 2 +SO 2+2H 2O=2HX+H 2SO 4 ,X∈{ Cl 、Br 、 I }▲该反应可以用来鉴别CO 2和SO 2 ,SO 2的还原性可以使氯水、溴水、碘水褪色,CO 2没有还原性,不可以使氯水、溴水、碘水褪色;▲该反应表明:氯气和二氧化硫如果以体积比1:1通入品红溶液中,品红溶液将不褪色;⑤与无氧酸盐盐溶液反应Cl 2+2Br - =2Cl - +Br 2 ,Cl 2 +2I -=2Cl - +I 2 ,Br 2 +2I -=2Br - +I 2 ,I 2 +S 2- =2I -+S ↓ 结论:氧化性:Cl 2>Br 2>I 2> S,还原性: Cl -<Br - <I -< S 2-⑥与亚硫酸盐溶液反应:X 2 +Na 2SO 3+H 2O=2HX+ Na 2SO 4 ,X∈{ Cl 、Br 、 I } 工业上用Na 2SO 3aq 除去氯碱厂的氯水,然后再用强碱溶液中和,然后排放; 知识点拓展1:HX 的稳定性、还原性和水溶液的酸性的递变规律; ▲稳定性:HF>HCl>HBr>HI ▲还原性:HF<HCl<HBr<HI ▲水溶液酸性:HF<HCl<HBr<HI ;▲氢氟酸可以腐蚀玻璃,其它的酸不可以:SiO2+4HF=SiF4↑+2H2O知识点拓展2:AgX和CaX2的个性和共性▲AgX感光性:AgF没有感光性,AgCl、AgBr、AgI都有感光性;▲AgX溶解性:AgF溶于水,AgCl、AgBr、AgI都不溶于水,并且溶解度依次减小;▲CaX2溶解性:CaF2不溶于水,CaCl2、CaBr2、CaI2都溶于水;25、原子结构结构与对应单质或化合物性质的关系在元素周期表中,同主族元素随着核电荷数增大,电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的引力越来越弱,最外层电子越来越易失去,表现为元素的金属性逐渐增强,非金属性逐渐减弱,金属元素的最高价氧化物对应水化物的碱性越来越强,非金属元素的最高价氧化物对应的水化物的酸性越来越弱;碱性:LiOH < NaOH <KOH <RbOH <CsOH ;酸性:HIO4 < HBrO4< HClO426、核素:把具有一定数目质子和一定数目中子的一种原子叫做核素,例如:氕、H11H,氘、D21H,氚T31H;27、同位素:质子数相同中子数不同的同一元素的不同原子互称同位素,即同一元素的不同核素之间互称同位素;28、同位素形成的分子种类1由H、D、T能组成氢分子种类共6种:H2、D2、T2、HD、 HT 、DT;2由168O、188O能组成氧分子种类数共3种:168O2、188O2、168O188O3由H、D、T和168O、188O能组成的水分子种类数12种,62=12 ;29、同位素应用1考古利用146C测定一些文物的年代;2利用示踪原子188O研究酯化反应的机理和氧化还原反应中电子转移的关系;3D、T用于制造氢弹;4利用放射性同位素释放的射线育种、治疗癌症和肿瘤等;30、1~20号元素的原子序数与元素所在周期、族的关系根据原子序数写出原子结构示意图,根据原子结构示意图的电子层数可以知道元素所在的周期序数,根据原子结构示意图的最外层电子数可以知道元素所在的主族序数;31、根据主族元素的最外层电子数推导元素的主要化合价1最高正价数=最外层电子数O、F例外, 2最低负价数=最外层电子数—8H、B例外32、设主族元素的最外层电子数为X时, 其最高价氧化物的化学式X为奇数时为R2OX ; X为偶数时为R2O2x33、设主族元素的最外层电子数为X时, 其最高价氧化物对应的水化物的化学式X=1~3 时为 ROHX ;X=4~7时为H8-XRO4 34、设主族元素的最外层电子数为X时,其最低价氢化物的化学式X=4~5时为RH8-X ;X=6~7时为H8-XR35、同主族相邻周期元素的原子序数的关系y大-x小=NX, x,Y∈﹛IA,IIA﹜;y大-x小= NY, x,Y∈﹛IIIA~VIIA﹜NX 表示X元素所在周期元素的种类数,NY表示Y元素所在周期元素的种类数36、同周期两个主族元素的原子序数的关系y大-x小=∣主族序数差∣+N;在1~ 3周期时,N=0;在4~ 5周期时,N=10;在6~7周期时,N=24;N表示各周期中过渡元素的种类数,x∈{ IA,IIA }, y∈{ IIIA~VIIA } 37、从微粒符号中的数字位置推测各种量微粒符号:AZX±n;质子数z在微粒符号的左下角,质量数A在微粒符号的左上角,电荷数“n±”在微粒的右上角,中子数N用左上角A与左下角z求差,电子数用左下角z与右上角“n±”求差;38、同主族元素的原子序数间的可能差值是:2、8、18、32四个数值的加、减组合;。
元素周期表知识点总结

考纲要求:①理解元素、核素和同位素的含义。
②理解原子的构成。
理解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的互相关系。
③理解原子核外电子排布规律。
④掌握元素周期律的本质。
理解元素周期表(长式)的构造(周期、族)及其应用。
⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子构造的关系。
⑥以ⅠA 和ⅦA 族为例,掌握同一主族内元素性质递变规律与原子构造的关系。
⑦理解金属、非金属元素在周期表中的位置及其性质递变规律。
⑧理解化学键的定义。
理解离子键、共价键的形成。
知识点总结:中子N〔核素〕原子核质子Z → 元素符号原子构造 : 决定原子呈电中性 电子数〔Z 个〕:化学性质及最高正价和族序数核外电子 运动特征:体积小,运动速率高〔近光速〕排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子〔离子〕的电子式、原子构造示意图1.原子构造[核电荷数、核内质子数及核外电子数的关系]核电荷数=核内质子数=原子核外电子数注意: (1) 阴离子:核外电子数=质子数+所带的电荷数阳离子:核外电子数=质子数-所带的电荷数(2)“核电荷数〞与“电荷数〞是不同的,Cl -的核电荷数为17,电荷数为1.[质量数] 用符号A 表示.将某元素原子核内的所有质子和中子的相对质量取近似整数决定X)(A Z值相加所得的整数值,叫做该原子的质量数.说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A=Z + N.(2)符号A Z X的意义:表示元素符号为X,质量数为A,核电荷数(质子数)为Z的一个原子.例如,2311Na中,Na原子的质量数为23、质子数为11、中子数为12.[原子核外电子运动的特征](1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描绘出它的运动轨迹.在描绘核外电子的运动时,只能指出它在原子核外空间某处出现时机的多少.(2)描绘电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现的几率.电子云密度的大小,说明了电子在核外空间单位体积内出现几率的多少.(3)在通常状况下,氢原子的电子云呈球形对称。
元素周期表知识点

智能点一元素周期表2.元素的位置关系和原子序数关系的应用(1)同一周期中相邻元素的原子序数一般比左边元素原子序数大1,比右边元素的原子序数小1。
子序数之和是A 元素原子序数的4倍,则A 、B 、C 分别为O 、P —、Q —示例2:X 、Y 、Z 、W 均为短周期元素,它们在元素周期表中位置如图所示,已知W 原子XYZW 的最外层电子数比内层电子数少3个,一则X 、Y 、Z 、W 分别为N 、O 、S 、Cl智能点二四大高频规律1.常考元素在周期表中的分企觇出金耐J提边牲昨金属小/](1元枇种类 IIMWN1用VK 「•CI N«O«F*_._IIL_1l>加上常考元素的位置 (2)同主族相邻周期元素的原子序数关系的应同书族f 下周期所含元素加数一」一周期所含元宓种教,•城.四.产值是H 同族棚都差是J I 川”•,谢营*1月[Ai 旄J^IlA^示例1:A 、B 、C 均为短周期元素,它们在周期表中的位置如图所示。
已知8、C 元素的111.元素推断中常用的10个反应:(1)NH3+HNO产=NH4NO3(2)SiO2+4HF===S可f+2H2O(3)Na2SiO3+2HCl==2NaCl+H2SiO3I(4)Cl2+H2S===S;+2HCl(5)Al2O3+2NaOH===2NaAlQ+H2O(6)Al(OH)3+NaOH===NaAlO2+2H2O(7)2Al(OH)3+3H2sO4==A!(SO4)3+6H2O(8)Al(OH)3+3HClO4===Al(ClQ)3+3H2O(9)Na2s2O3+2HCl===2NaCl+S;+SO2f+H2O(10)CaC2+2H2O===Ca(OH)2+C2H2f2.常见转化关系战金属一^金属包化物一♦碱一点(1),满足此关系的有Na、K、Ca。
(2)谭或某坐翼睁..心金展工作金限气化物丝酸凡热.满足此关系的有※电也一商肝」|!龛局利化物(3)化合物A―—」B―—」C―—2酸满足此条件的有CHgNH3、H2S O(4)X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,列举出符合此转化关系X、Y、Z、W的三组物质化学式@A1C13.,…Al(QH)3A.NaAlO^x.NaOH。
(完整版)元素周期律知识点总结
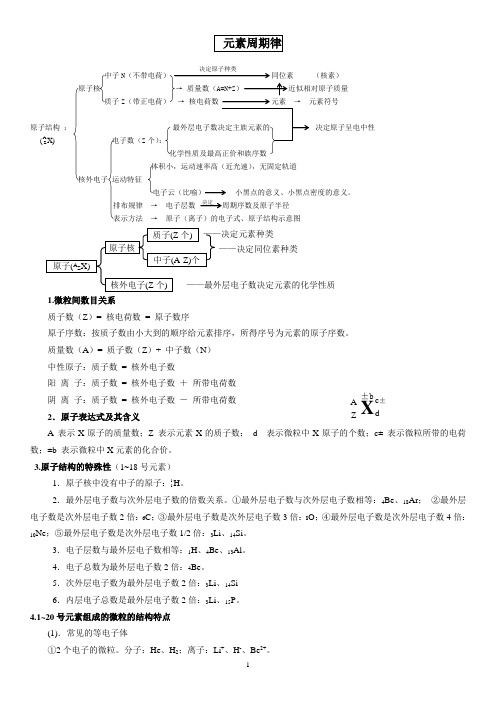
中子N(核素) 原子核质子Z → 元素符号原子结构 : 决定原子呈电中性电子数(Z 个):化学性质及最高正价和族序数 体积小,运动速率高(近光速),无固定轨道核外电子 运动特征电子云(比喻) 小黑点的意义、小黑点密度的意义。
排布规律 → 电子层数 周期序数及原子半径表示方法 → 原子(离子)的电子式、原子结构示意图1.微粒间数目关系质子数(Z )= 核电荷数 = 原子数序原子序数:按质子数由小大到的顺序给元素排序,所得序号为元素的原子序数。
质量数(A )= 质子数(Z )+ 中子数(N )中性原子:质子数 = 核外电子数阳 离 子:质子数 = 核外电子数 + 所带电荷数阴 离 子:质子数 = 核外电子数 - 所带电荷数2.原子表达式及其含义 A 表示X 原子的质量数;Z 表示元素X 的质子数; d 表示微粒中X 原子的个数;c± 表示微粒所带的电荷数;±b 表示微粒中X 元素的化合价。
3.原子结构的特殊性(1~18号元素)1.原子核中没有中子的原子:11H 。
2.最外层电子数与次外层电子数的倍数关系。
①最外层电子数与次外层电子数相等:4Be 、18Ar ; ②最外层电子数是次外层电子数2倍:6C ;③最外层电子数是次外层电子数3倍:8O ;④最外层电子数是次外层电子数4倍:10Ne ;⑤最外层电子数是次外层电子数1/2倍:3Li 、14Si 。
3.电子层数与最外层电子数相等:1H 、4Be 、13Al 。
4.电子总数为最外层电子数2倍:4Be 。
5.次外层电子数为最外层电子数2倍:3Li 、14Si6.内层电子总数是最外层电子数2倍:3Li 、15P 。
4.1~20号元素组成的微粒的结构特点(1).常见的等电子体①2个电子的微粒。
分子:He 、H 2;离子:Li +、H -、Be 2+。
决定 X)(A Z 原子(A Z X) 原子核核外电子(Z 个) 质子(Z 个) 中子(A-Z)个 ——决定元素种类 ——决定同位素种类 ——最外层电子数决定元素的化学性质X A Z c ± d±b②10个电子的微粒。
高中化学元素周期律知识点总结

高中化学元素周期律知识点总结-CAL-FENGHAI.-(YICAI)-Company One1第一节课时1元素周期表的结构一、元素周期表的发展历程二、现行元素周期表的编排与结构1.原子序数(1)含义:按照元素在元素周期表中的顺序给元素编号,得到原子序数。
(2)原子序数与原子结构的关系原子序数=核电荷数=质子数=核外电子数。
2.元素周期表的编排原则(1)原子核外电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行,称为周期。
(2)原子核外最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行,称为族。
3.元素周期表的结构(1)周期(横行)①个数:元素周期表中有7个周期。
②特点:每一周期中元素的电子层数相同。
③分类(3短4长)短周期:包括第一、二、三周期(3短)。
长周期:包括第四、五、六、七周期(4长)。
(2)族(纵行)①个数:元素周期表中有18个纵行,但只有16个族。
②特点:元素周期表中主族元素的族序数等于其最外层电子数。
③分类④常见族的特别名称 第ⅠA 族(除H):碱金属元素;第ⅦA 族:卤族元素;0族:稀有气体元素;ⅣA 族:碳族元素;ⅥA 族:氧族元素。
课时2 元素的性质与原子结构一、碱金属元素——锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr) 1.原子结构(1)相似性:最外层电子数都是__1__。
(2)递变性:Li ―→Cs ,核电荷数增加,电子层数增多,原子半径增大。
2.碱金属单质的物理性质3.碱金属元素单质化学性质的相似性和递变性 (1)相似性(用R 表示碱金属元素)单质R —⎩⎪⎨⎪⎧与非金属单质反应:如Cl 2+2R===2RCl 与水反应:如2R +2H 2O===2ROH +H 2↑与酸溶液反应:如2R +2H +===2R ++H 2↑化合物:最高价氧化物对应水化物的化学式为ROH ,且均呈碱性。
(2)递变性具体表现如下(按从Li→Cs 的顺序)①与O 2的反应越来越剧烈,产物越来越复杂,如Li 与O 2反应只能生成Li 2O ,Na 与O 2反应还可以生成Na 2O 2,而K 与O 2反应能够生成KO 2等。
(完整版)高一化学元素周期表知识点总结,推荐文档

这五种元素的核电荷数之和可能是( C )
A 5Z+2
B 5Z+8 C 5Z+10 D 5Z+18
二、碱金属元素
⑴碱金属元素包括
;
⑵碱金属的化学性质:(由钠钾分别与氧气与水反应得出)
①相似性:碱金属元素原子的最外层都有
个电子,它们的化学性质相似,化合价都是
。
②递变性:随着核电荷数的增加,碱金属元素原子的电子层数逐渐
元素周期表结构
主族(1、2、13、14、15、16、17 列),族的序号一般用罗马数字+A 表示。
副族(3、4、5、6、7、11、12 列), 族的序号一般用罗马数字+B 表示。 族 零族(18 列)
第 VIII 族(8、9、10 列) 注意:①0 族不是主族,第 VIII 族不是副族
②主族:由短周期元素和长周期元素共同构成的族 副族:完全由长周期元素构成的族
四、元素、核素、同位素
(1)质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。
(1)颜色、状态:F2
Cl 2
Br 2
状态由气到固)
(2)熔沸点:逐渐
(3)密度:逐渐
3.卤素单质与氢气反应
名称
反应条件
(4)溶解性: 方程式
F2
H2+F2 2HF
Cl2
光照或点燃
H2+Cl2
1
C.钾与水反应比钠与水反应更剧烈
D.加热时,钾比钠更易汽化
四、卤族元素
1.卤素原子结构示意图:F
Cl
Br
I
最外层电子数均为
个,但电子层数逐渐增大,得电子能力
,非金属性
2.卤族元素单质的物理性质的变化规律。
元素周期表和元素周期律知识点归纳(精华版)-共7页

——元素的非金属性
——阴离子的还
原性
——单质与氢气化和的能力
——生成的气态氢化物越
——最高价氧化
物对应水化物的酸性
。
⑵、另外可以通过单质间的置换反应判断得电子能力的强弱
如 Cl 2+Na 2S=2NaCl+S 得电子能力 Cl S
10、原子失电子能力强弱判断的方法
⑴、原子失电子能力越强——单质的还原性
行)。包括哪些族
。过度元素共包括
个纵行(第
纵行到第
纵
。过渡元素全为
元素。 又称为
。
3、写出七个主族和 ⅠA 族 ⅡA 族 ⅢA 族
0 族元素的名称和元素符号
ⅣA 族 ⅤA 族 ⅥA 族
ⅦA 族
0族 4.同一周期第Ⅱ A 族和第Ⅲ A 族原子序数之间的关系 若元素位于第二、三周期,第Ⅱ A 族的原子序数为 a,则第Ⅲ A 族的原子序数为 若元素位于第四、五周期,第Ⅱ A 族的原子序数为 a,则第Ⅲ A 族的原子序数为 若元素位于第六周期,第Ⅱ A 族的原子序数为 a,则第Ⅲ A 族的原子序数为
元素周期表与元素周期律知识点归纳
1、元素周期表共有
横行,
个周期。其中短周期为
、、
类为
、、
。长周期包括 、 、
。所含元素种类为
第七周期为不完全周期,如果排满的话有
种元素。
。所含元素种
、、
。
2 元素周期表有
个纵行
个族。包括
个主族,
族(包括
个纵行)按从左到右的顺序把 16 个族排列
个副族,一个 族,一个第Ⅷ
5、同一主族上下相邻两个周期原子序数之间的关系
若 A 在 B 的上一周期,设 A 的原子序数为 a
高中化学知识点总结元素

高中化学知识点总结元素一、元素周期表1. 元素周期表的结构- 周期表由7个周期和18个族组成。
- 每个周期代表电子能级,从上到下电子能级递增。
- 每个族代表元素的最外层电子数,从左到右递增。
2. 元素的分类- 主族元素:1-2族和13-18族,它们的最外层电子数与族数相同。
- 过渡金属:3-12族,具有不完全的d轨道。
- 镧系和锕系元素:位于周期表的底部,具有特殊的电子排布。
二、元素的基本性质1. 原子结构- 原子由原子核和电子云组成。
- 原子核包含质子和中子,质子带正电,中子不带电。
- 电子云由围绕核的电子组成,电子带负电。
2. 原子量和相对原子质量- 原子量是原子质量的度量,单位为原子质量单位(u)。
- 相对原子质量是元素的平均原子质量与1/12个碳-12原子质量的比值。
3. 元素的化学性质- 元素的化学性质主要由最外层电子数决定。
- 元素的化合价等于其最外层电子数。
- 元素的氧化还原性质与其电子排布有关。
三、元素的化学变化1. 化学反应- 化学反应是原子间重新排列形成新化合物的过程。
- 反应过程中,原子的核不变,只有电子的重新分布。
2. 氧化还原反应- 氧化还原反应涉及电子的转移。
- 氧化指失去电子,还原指获得电子。
- 氧化剂获得电子,还原剂失去电子。
3. 酸碱反应- 酸碱反应是氢离子(H+)转移的反应。
- 酸是能够提供H+的物质,碱是能够提供OH-的物质。
- 中和反应是酸与碱反应生成水和盐的过程。
四、元素的化合物1. 无机化合物- 无机化合物通常不含有碳。
- 包括氧化物、酸、碱、盐等。
- 例如:水(H2O)、硫酸(H2SO4)、氯化钠(NaCl)。
2. 有机化合物- 有机化合物含有碳。
- 包括烃、醇、酮、酸、酯等。
- 例如:甲烷(CH4)、乙醇(C2H5OH)、丙酮(CH3COCH3)。
五、元素的提取与应用1. 金属提取- 金属提取通常通过矿石的冶炼过程。
- 包括热分解法、湿法冶炼、电解法等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章物质结构元素周期律
第一节元素周期表
知识回顾:
1、原子的结构:
肿f时示F
原子是由原子核和电子组成;原子核由质子和中子组成
原子的质量集中在原子核上,电子的质量很小,几乎可以忽略不计
一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,中子不带电,所以原子对外显中性
2、元素的定义:具有相同核电荷数(质子数)的一类原子的总称
一、元素周期表的结构
1、原子序数
原子序数=核电荷数=质子数=核外电子数
2、周期
按原子序数递增的顺序,把电子层数相同的元素自左向右排成横行,每行叫做一个周期。
元素周期表共有七个周期,从上到下依次命名为第一周期、第二周期等
各周期内的信息表
3、族
按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行,每一个纵行称为一个族•共18行
元素周期表共有十八个纵行,除& 9、10三个纵行叫第毗族外,其余每个纵行各为一个族,它们又被划分为十六个族。
族分为主族和副族,主族用罗马数字加“ A”表示,如I A族;副族用罗马数字
加” B”来表示,如U B。
0族和毗族则不加“ A”或“ B”
注意:① 1,2行对应为I A,n A;13---17行对应为川A---A
②3---7行对应为川B --- W B; 11,12行对应为I B,n B o
③8,9,10对应为忸
④18行对应0族
二、元素的性质与原子结构
1、碱金属元素
知识回顾:Na的物理性质和化学性质
从上到下原子的电子层数在增加,原子半径逐渐增大,所以失电子的能力逐渐增强从上到下金属性逐渐增强(金属性包括
碱金属元素的化学性质
R+2H2O====2ROH+H
4Li+Q====2L2O
4Na+Q====2Na;O(缓慢氧化)
Na+Q==A ===Na s O2
2
卤族元素的主要物理性质
从上到下电子层数依次增加,原子半径依次增加,所以得电子的能力也依次减弱,即非金属性依次减弱(非金属性包括
单质溴是唯一在常温常压下呈液态的非金属单质
卤素的化学性质
X-+Ag+======Ag刈(AgCI为白色沉淀,AgBr为淡黄色沉淀,Agl为黄色沉淀)
X2+H2O=====HX+HXO
F2+H2O=====HF+O
Fe+C2=====2FeQ
Fe+2=====Fe2
、核素
1质量数
将原子核内所有质子和中子的相对质量取近似整数值相加,所得到的数值
叫质量数
质量数(A)=质子数(Z)+中子数(N)
2、核素
具有一定数目质子和一定数目中子的一种原子叫做核素
质子数相同而中子数不同的同一元素的不同原子互为同位素
当某种元素具有两种或两种以上天然、稳定的同位素时,无论是在单质还是在化合物里,任意一种同位素在该元素内所占的原子数目百分比都不变
4、同素异形体
指同种元素形成的不同单质,它们之间互称为同素异性体。
第二节元素周期律。
