测定方法-游离脂肪酸
游离脂肪酸测试标准分析

游离脂肪酸测试标准分析作者:伦玮峰来源:《中国纤检》2011年第18期摘要:根据操作经验,对GB/T 22933—2008与ISO 4048—2008游离脂肪酸检验标准之间的差异及检验过程中需要注意的细节进行分析,提出GB/T 22933—2008中结果计算可能存在的问题。
关键词:游离脂肪酸;GB/T 22933—2008;ISO 4048—2008;滴定法皮革加脂是皮革生产过程中一个重要的工序,决定着成革的物理机械性能、卫生性能、柔软度、丰满性及手感等。
皮革经过加脂处理,表面包裹上了一层具有润滑作用的油脂,从而提高了纤维之间的相对滑动性能,降低了皮革纤维之间的摩擦,从而使皮革变得柔软、耐折、丰满、富有弹性[1],但油脂在一定条件下会分解,形成游离脂肪酸。
通过测定皮革中的游离脂肪酸含量可在一定程度上反映油脂与皮革的结合牢度。
检测皮革中游离脂肪酸含量的标准有GB/T 22933—2008《皮革和毛皮化学试验游离脂肪酸的测定》及ISO 4048—2008《皮革化学试验二氯甲烷中可溶物质和游离脂肪酸含量的测定》。
它们的原理均是用二氯甲烷对样品进行萃取,将溶剂蒸发后用乙醚—乙醇混合溶剂溶解萃取物,用氢氧化钠溶液滴定萃取物中的游离脂肪酸含量。
本文对GB/T 22933—2008与ISO 4048—2008的异同点进行分析和比较。
1预调GB/T 22933—2008要求称量样品之前,试样需按照QB/T 2707的规定进行调节,即在温度(20±2)℃,湿度(65±5)%的标准空气环境下进行48 h的预处理;而ISO 4048—2008则没有要求对样品进行温湿度调节。
2样品萃取GB/T 22933—2008的引用标准QB/T 2718及ISO 4048—2008中均有对使用的萃取溶剂二氯甲烷进行有无形成盐酸存在的试验要求。
两个标准在这里的要求是一致的,这是因为二氯甲烷长期与水接触会缓慢分解,生成甲醇、甲酸和氯化氢(2CH2Cl2+3H2O→CH3OH+HCOOH+4HCl),而这两个标准均以氢氧化钠溶液滴定测定样品中的游离脂肪酸,若萃取过程中混入氯化氢,滴定时氢氧化钠溶液除了与游离脂肪酸产生中和反应外,亦会与氯化氢产生中和反应,最终计算时会将混入的氯化氢当作等物质的量游离脂肪酸,使最终结果偏高。
血清游离脂肪酸含量测定铜试剂比色法
血清游离脂肪酸含量测定(铜试剂比色法)
标准曲线:
2000umol/L、1500umol/L、1000umol/L、500umol/L 棕榈酸溶液(FFA提取液配)空白管:100uL生理盐水+900uL生理盐水
标准管:标准品100uL+900uL生理盐水
测定管:待测血清100uL+900uL生理盐水
各管加入FFA提取液5毫升,剧烈震摇约20秒,3000rpm离心5min,取下清液4ml,加入铜试剂1.6mL,剧烈震摇约20秒,3000rpm离心5min,取上清液2毫升,加入0.4毫升显色剂,显色15min后,在30min内,550nm测OD值。
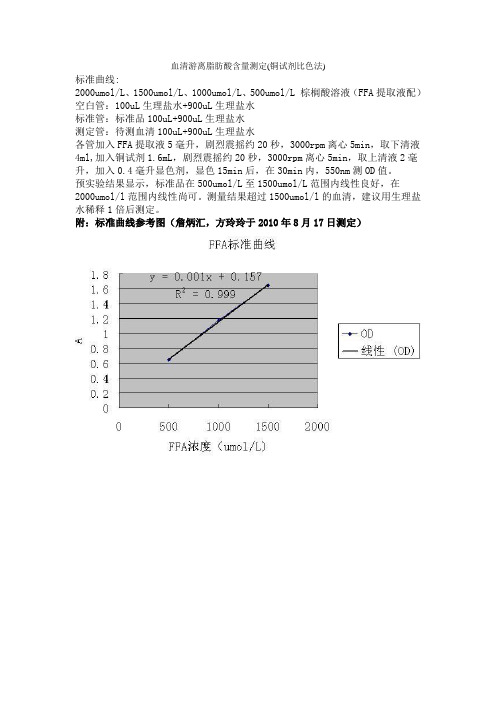
预实验结果显示,标准品在500umol/L至1500umol/L范围内线性良好,在2000umol/l范围内线性尚可。
测量结果超过1500umol/l的血清,建议用生理盐水稀释1倍后测定。
附:标准曲线参考图(詹炳汇,方玲玲于2010年8月17日测定)
附:参考文献。
测定方法-游离脂肪酸

2.1.4 游离脂肪酸测定方法2.1.4.1 试剂乙醇-乙醚混合溶液:无水乙醚与95%乙醚1:1(V )混合,每100mL 溶剂加入0.3mL 酚酞指示剂0.1M KOH 标准溶液:称取5.8gKOH 溶于1000mL 新沸冷却蒸馏水中,摇匀,按下法标定其摩尔浓度。
称取在125℃烘至恒重的基准邻苯二甲酸氢钾0.8608g ,精确至0.0002g ,置于250mL 锥形瓶中,以50mL 蒸馏水溶解,加入2-3滴酚酞指示剂,用上述KOH 溶液滴定至粉红色,同时做空白试验,KOH 标准溶液摩尔浓度2042.0)(0⨯-=V V G M 式中:G —邻苯二甲酸氢钾质量,gV —KOH 溶液用量,mLV 0—空白试验KOH 溶液的用量,mL0.2042—每mol 邻苯二甲酸氢钾的质量,g计算结果:KOH M =0942.02042.0)10.085.44(8608.0=⨯- 1%酚酞指示剂:1g 酚酞溶于100mL95%乙醇中2.1.4.2 仪器250mL 锥形瓶,25mL 滴定管 分析天平2.2.5 游离脂肪酸(FFA )含量的测定[1]:精确称取样品5.0g ,置于锥形瓶中,用水浴微热熔融,加入预先中和的乙醚、乙醇混合液50mL ,使之溶解,加入1%酚酞5滴,然后用氢氧化钾标准溶液滴至呈粉红色,10s 内不退色为终点,记录消耗氢氧化钾标准液的毫升数。
游离脂肪酸质量分数 (以油酸计)为1001000282⨯⨯⨯=m C V FFA式中 FFA -游离脂肪酸的质量分数V -消耗氢氧化钾标准溶液的体积(mL )C -氢氧化钾标准溶液的浓度(mol/L )282-油酸的摩尔质量(g/mol ) m -样品质量(g )2.1.5 游离氨基酸测定方法2.1.5.1 试剂40%中性甲醛:40mL 甲醛溶于60mL 蒸馏水中,用1mol/L NaOH 调pH 为8.10.1%百里酚酞:0.1g 百里酚酞溶于90mL 乙醇,加水至100mL0.1M NaOH 标准溶液:称取110gNaOH ,溶于100mL 无CO 2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
酸价测定的实验原理

酸价测定的实验原理
酸价测定是一种测定油脂中游离脂肪酸含量的方法,其原理基于游离脂肪酸与碱溶液中的氢离子(H+)反应式:
RCOOH+NaOH→RCOONa+H2O。
其中,RCOOH代表游离脂肪酸,NaOH代表碱溶液。
实验中,将待测油脂按一定比例溶解在异丙醇中,再将溶解后的油脂溶液滴入已知浓度的氢氧化钾溶液中,用苯酚酚酞作为指示剂,滴加至出现颜色变化,记录滴加过程中的用量,根据计算公式计算油脂中游离脂肪酸的含量,即为酸价值。
计算公式为:
酸价值(mg KOH/g)=V×N×56.1/m。
其中,V为氢氧化钾溶液的滴定体积(mL),N为氢氧化钾溶液的正常浓度(mol/L),m为待测油脂的质量(g),56.1为1mol KOH相当于56.1g KOH。
椰子汁游离脂肪酸含量的测定方法

椰子汁游离脂肪酸含量的测定方法
1.酶解法:
这种方法将椰子汁中的游离脂肪酸进行酶解,生成相应的酯类化合物,然后采用色谱分析技术来测定酯类化合物的含量。
首先,将椰子汁样品中
的脂肪酸通过酶解反应转化为甲酯化合物。
然后,将甲酯化合物进行色谱
分析,通过对比标准品的峰面积或峰高来计算游离脂肪酸的含量。
2.重铬酸钾滴定法:
这种方法是通过游离脂肪酸和重铬酸钾的化学反应进行测定。
首先,
将椰子汁样品中的游离脂肪酸提取出来,然后加入重铬酸钾溶液,并在温
水浴中加热,游离脂肪酸会被氧化成相应的醛或酮。
当重铬酸钾完全被游
离脂肪酸氧化时,溶液的颜色由橙色变为绿色。
通过加入亚硫酸钠溶液去
除余下的重铬酸钾,然后用氨烷溶液进行滴定,最后通过计算滴定液的用
量来确定游离脂肪酸含量。
3.气相色谱法:
这种方法是通过气相色谱仪测定椰子汁样品中游离脂肪酸的含量。
首先,将样品通过氯仿或其他有机溶剂提取出游离脂肪酸,然后通过蒸发浓
缩或萃取浓缩使溶剂挥发。
将样品溶解于氯仿或其他适宜的溶剂中,然后
通过气相色谱仪进行分析。
根据标准品的峰面积或峰高来计算游离脂肪酸
的含量。
这些方法都可以对椰子汁中的游离脂肪酸含量进行准确测定。
选择合
适的方法取决于实验室的设备和技术以及实验目的。
游离脂肪酸测定方法

游离脂肪酸检测(Fatty Acids Content)
游离脂肪酸检测试剂盒(FFA Assay Kit.Kit content Cu Reagent,Color reagent and standard)
实验准备
1.抽提剂配制:自备氯仿、正庚烷、甲醇,按照体积(氯仿:正庚烷:甲醇=28:21:1)配制抽提剂200ml,
4℃储存。
2.标准品配制:精确称取82.06mg标准品(Palmitic acid,分子量=256.44),溶于抽提剂中,终体积50ml,
终浓度64mM,密封4℃保存。
测定方案
1.用抽提剂将64mM标准品新鲜稀释为6.4、3.2、1.6、0.8、0.4、0.2、0.1mM。
现用现配。
2.取1.5mlAxygen进口离心管,加入50µl样品、标准品、空白对照。
3.向管中加1.2ml抽提剂,盖紧盖子,悬涡混合器振荡30秒。
4.加0.2ml铜试剂Cu Reagent,振荡30秒,各管混匀强度时间保持一致。
5.室温放置20min。
6.室温2000g离心5min。
7.取1ml上层相转移到新离心管。
8.向新管内加0.5ml显色试剂Color Reagent。
混匀,室温孵育5min。
9.用1-cm光径玻璃比色杯读取550nmOD值。
10.做标准曲线,计算FFA浓度。
游离脂肪酸检测方法

游离脂肪酸检测方法
游离脂肪酸(FFA)是指不与任何脂肪酸结合而游离状态存在的脂肪酸。
游离脂肪酸在人体内发挥着重要的生理作用,包括脂肪供能、调节胰岛素分泌、维持血管内皮细胞的功能等。
因此,对游离脂肪酸的检测对于了解机体脂类代谢的状况和环境污染物对脂类健康的影响极为重要。
目前,用于检测游离脂肪酸的方法主要有以下几种:
1.高效液相色谱法(HPLC)
高效液相色谱法是当前较为常用的游离脂肪酸检测方法之一。
此方法可检测多种脂肪酸,且检测精度高、准确性好。
但需要较为专业的仪器设备和操作技能。
2.毛细管电泳法(CE)
毛细管电泳法是利用毛细管管道对化学物质进行分离的方法,其分离效率、准确性与HPLC相当。
但毛细管电泳法检测速度较慢,对样品和仪器设备的要求也较高。
3.气相色谱法(GC)
气相色谱法是一种通过化学反应使被分析的物质变为易挥发性化
合物,再利用气相色谱进行分离和检测。
该方法具有灵敏度高、分离
度好、分析速度快的优点,但需要复杂的前处理步骤,且对仪器设备
和操作技能的要求也较高。
4.红外光谱法(IR)
红外光谱法是通过检测样品中化学键振动的方式,较为准确地测
量样品中的化学成分,因此也可以用于测量游离脂肪酸。
该方法及其
设备较为成熟,测定精度高,但检测速度较慢。
总体而言,各种游离脂肪酸检测方法各自具有自己的优点和缺点。
在选择适合的检测方法时,需要根据实验目的、所需测量的脂肪酸种类、检测设备和实验经费等各方面综合考虑。
血清中游离脂肪酸检测方法的研究进展

血清中游离脂肪酸检测方法的研究进展摘要】游离脂肪酸,简称FFA,其组成成分为亚油酸、油酸以及软脂酸等,属于甘油三酯的水解产物。
游离脂肪酸存在于血液中,且与血清白蛋白结合。
对人体血清中游离脂肪酸含量进行检测,能够尽早发现患者血清中游离脂肪酸的异常情况,最终起到预防及尽早对相关疾病进行治疗的目的。
临床中对人体血清游离脂肪酸的检测方法主要有气相色谱法、液相色谱法以及酶法等。
临床最常用也最简单的血清游离脂肪酸检测方法为气相色谱法,而使用酶法进行血清游离脂肪酸检测是最准确的检测方法,临床进行血清游离脂肪酸检测时,应根据患者实际情况以及临床需要选择合适的检测方法。
【关键词】血清游离脂肪酸检测方法研究进展【中图分类号】R446.1 【文献标识码】A 【文章编号】2095-1752(2013)03-0035-02本文将探讨血清中游离脂肪酸检测方法,从而提高临床检测血清中游离脂肪酸正确率,现结果如下。
1 血清中游离脂肪酸概述游离脂肪酸,简称FFA,其组成成分为亚油酸、油酸以及软脂酸等,属于甘油三酯的水解产物。
游离脂肪酸存在于血液中,且与血清白蛋白结合。
脂肪酸是生物体中重要的组成部分,对生物体的某些生命活动提供能量,参与前列腺素或类固醇的合成过程,对某些蛋白质起到一定的修饰作用[2]。
是生物体脂类代谢情况出现异常的重要标识无,能够影响基因表达,导致生物体内细胞生长、分化、代谢等发生变化。
脂肪酸可分为饱和脂肪酸与不饱和脂肪酸,不饱和脂肪酸又分为单不饱和脂肪酸与多不饱和脂肪酸。
各种脂肪酸对人体中脂代谢以及糖代谢具有不同影响。
近年研究发现,人体血清中的游离脂肪酸浓度易受多种因素影响,如脂类代谢、内分泌功能以及糖代谢等,血清中游离脂肪酸浓度升高可导致人体中胰岛素抵抗情况增加,且大部分肥胖且伴有2型糖尿病患者体内都存在胰岛素抵抗现象;反之,人体中游离脂肪酸浓度升高,发生胰岛素抵抗,则患有2型糖尿病以及心血管疾病的风险将增加。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.1.4游离脂肪酸测定方法2.141 试剂
乙醇-乙醚混合溶液:无水乙醚与95沱醚1:1(V)混合,每100mL溶剂加入0.3mL酚酞指示剂
0.1M KOH标准溶液:称取5.8gKOH溶于1000mL新沸冷却蒸馏水中,摇匀,按下
法标定其摩尔浓度。
称取在125 C烘至恒重的基准邻苯二甲酸氢钾
0.8608g ,精确至0.0002g ,置于250mL锥形瓶中,以50mL蒸馏水溶解,
加入2-3滴酚酞指示剂,用上述KOH容液滴定至粉红色,同时做空白试
验,KOH标准溶液摩尔浓度M G—
(V V。
)0.2042
式中:G—邻苯二甲酸氢钾质量,g
V —KOH容液用量,mL
V 。
一空白试验KOH溶液的用量,mL
0.2042 —每mol邻苯二甲酸氢钾的质量,g
计算结果:M KOH二0.86080.0942
(44.85 0.10) 0.2042
1獅酞指示剂:1g酚酞溶于100mL95乙醇中
2.1.4.2 仪器
250mL锥形瓶,25mL滴定管分析天平
2.2.5游离脂肪酸(FFA)含量的测定⑴:
精确称取样品5.0g,置于锥形瓶中,用水浴微热熔融,加入预先中和的乙醚、乙醇混合液50mL使之溶解,加入1%酚酞5滴,然后用氢氧化钾标准溶液滴至呈粉红色,10s 内不退色为终点,记录消耗氢氧化钾标准液的毫升数。
游离脂肪酸质量分数(以油酸计)为
m
式中FFA 游离脂肪酸的质量分数
V-消耗氢氧化钾标准溶液的体积(mL C-氢氧化钾标准溶液的浓度(mol/L ) 282-油酸的摩尔质量(g/mol )
m 样品质量(g )
2.1.5游离氨基酸测定方法 2.1.5.1 试齐I 」
40%中性甲醛:40mL 甲醛溶于60mL 蒸馏水中,用1mol/L NaOH 调pH 为8.1 0.1%百里酚酞:0.1g 百里酚酞溶于90mL 乙醇,加水至100mL
0.1M NaOH B 准溶液:称取110gNaOH 溶于100mL 无CO 的水中,摇匀,注入聚乙烯容器
中,密闭放置至溶液清亮。
用塑料管量取5.1m 上层清液,用无CO 的水稀释至1000mL 摇匀。
称取0.75g 于105-110 C 烘至恒重的邻苯二甲酸氢钾,加入无 CO 水溶解,加2滴酚酞指示液,用配好的NaOH 底至溶液呈粉红色, 并保持30s ,同时做空白实验。
NaOH 标准溶液的摩尔浓度
M NaOH
m 1000 (V 1 V 2)M
式中:m —邻苯二甲酸氢钾
质量,
g
V 1
—NaOH 体积,mL
V
2
—空白试验消耗NaO 啲体积, mL
M
—邻苯二甲酸氢钾的摩尔质量, 204.22g/mol
计算结果: M NaOH =——
0.7512
1000
—
=0.11026
(33.41 0.05) 204.22
FFA
V C 282 1000
100
2.2.6游离氨基酸(FAA含量的测定:甲醛滴定法[8]
吸取相同的2份样品溶液10.0mL,置于2只三角瓶中,各加50mL蒸馏水,50C水浴萃取0.5 h。
其中1份加入中性红指示剂3滴,用标准氢氧化钠溶液(0.1mol/L)滴定至琥珀色为终点,此时可用pH计测定其pH值为8.2。
另一份加入百里酚酞指示剂3滴和中性甲醛20ml,静置1分钟后,用0.1mol/L氢氧化钠溶液滴定至淡蓝色,此时用PH计测定其pH值为9.2。
游离氨基酸含量计算公式:
FAA% N M V i)O.°14 !oo
w
式中FAA%游离氨基酸的百分0.014- 氮的毫克当量
N-标准氢氧化钠的摩尔浓度/mol/L
V1-中性红做指示剂时消耗氢氧化钠的体积/mL
V百里酚酞做指示剂时消耗氢氧化钠的体积/mL
2.8 SDS凝胶电泳的测定
样品的处理:样品处理液0.5mL (含浓缩胶缓冲液56%甘油42% SDS2%与(3 -巯基乙醇2-ME 20山,溴酚蓝20山混合,加蒸馏水定容至1mL混合均匀,将混合溶液倒入2mL的带盖的试样管中。
将试样管放入沸水中加热5min (加强SDS与蛋白的结合),冷却到室温,于-20C冷藏。
SDS-PAGE电泳采用5%的浓缩胶和12%的分离胶,分别用0.125mol/L Tris-Hcl (pH6.8)和0.38mol/LTris-HCI (pH8.8)进行配制,两者均含有0.1%SDS电泳缓冲溶液含有0.025mol/LTris , 0.192mol/L 甘氨酸(Glycine ) , 0.1%SDS 上样量为10 卩L。
浓缩胶部分的电流为100V,进入分离胶后,电流为150V。
电泳结束后,将胶片固定4h (固定液含有33%甲醇和12%E氯乙酸)。
然后染色3h (染色液含有0.9g,考马斯亮蓝
G-250, 1mol/L硫酸,10mol/LNaOH 12%TCA。
染色结束后,用水对胶片进行洗脱何。
3.2.4测定方法
3.241 pH
4.6 SN 测定网:
准确称取0.75 g干酪,加入25mL pH4.6的醋酸盐缓冲液,将干酪充分磨碎,再用25mL的缓冲液充分冲洗,悬
浮液在4000rpm的离心机中离心20min,取上清液定量地移入凯氏消化瓶,进行微量凯氏定氮,并以占干酪总氮量的百分数(%表示。
3.2.
4.2 12% TCA SN 测定[253]:
准确称取1.5g干酪,加入25mL12%勺TCA溶液,将干酪充分磨碎,再用20mL的缓冲液充分冲洗,悬浮液在4000rpm 的离心机中离心20min,取上清液定量地移入凯氏消化瓶,进行微量凯氏定氮,并以占干酪总氮量的百分数(%表示。
3.2.
4.3干酪的融化性[39]:
用改良的Schreiber试验法测定干酪的融化性,方法为:用特制打孔器取17.6mm直径x 7mm厚的干酪样品,其
纤维方向垂直于干酪的直径;将样品放置于预先铺有滤纸的9cm的培养皿内,在室温下回复温度30 min,然后,将其放
入预热至100 C的烘箱内,加热1小时,取出,在室温下回复30min ,测定融化干酪的直径,测四个值,精确到0.01cm ,
计算出平均数,表示干酪的融化性。
3.2.
4. 4 干酪的油脂析出性[39]:
通过传统的脂肪渗漏法经改良用于油脂析出性的测定,方法为:取17.6mm直径x 7mm厚的干酪样品,其纤维方向垂
直于干酪的直径;将样品放置于预先铺有滤纸的9cm的培养皿内,在室温下回复温度30 min,然后,将其放入预热至100C
的烘箱内,加热1小时,取出,在室温下回复30min ,油圈形成,测定油圈的直径,测四个值,精确到0.01cm,计算出
平均数,表示干酪的油脂析出性。
3.2.
4.5 干酪的拉丝性[44]:
将15g粉碎的干酪放入25x 150mm的试管内,用水浴加热到60C,并保温10min ,然后用T型金属棒搅动,缓慢提升,测量拉丝的长度。
3.2.
4.6 干酪加热色泽试验[263]:
粉碎的干酪放入25x 150mm的试管内,在沸水中水浴60min,使用色差计以L、a、b为测色模型,试管的底部被夹
紧与测光头密合。
每个试管有8个数据被读取,每旋转45。
读取一个数据,取其平均值。
3.2.
4.7感官评定方法[264]:
由于目前我国还没有对软质干酪统一的感官评分标准,所以我们制定了Mozzarella干酪质量的评分标准,采用15分制的评定方法,评定项目为:未融化干酪的特性:滋味与气味、组织结构、弹性、切条性;权重分别为2、1、1.5和0.8 ;融化干酪的特性:拉丝性、褐变性、熔化性、油脂析出,权重分别为2、1.5、0.5和0.7,其中除滋味与气味、组
织结构和切条性凭主观评判外,其余均以客观测定值为指标,选取9名经过训练的人员进行感官评定。
干酪分为天然和再制两大类。
简单地说,天然干酪是从乳制成的,而再制干酪是从天然干酪制成的。
这一点可以从配料表里看出。
如果某产品的配料表里第一个是乳、牛乳,则该产品是天然干酪。
如果某产品的配料表里第一个是干酪、奶酪、乳酪类,则该产品是再制干酪。
按照这个原则,你可以去超市的奶酪冷柜看看哪些产品是天然干酪,哪些是再制干酪。
天然干酪是一种“活的食品”,含有活性菌群和活性酶,在冷藏条件下也在生长代谢,从而使干酪的感官特性不断变化。
因此,天然干酪需要冷藏,而且即使在冷藏条件下保质期也有一定期限。
把干酪岀口到热带气候的国家因而成为一件非常困难的事,贸易的发展需要一种容易保存和运输的干酪。
再制干酪就这样应运而生了。
再制干酪的最大优点是经过热处理,因而延长了保质期,而且在保质期内对贮藏条件的要求不象天然干酪那么严格。
除此之外,再制干酪可以利用天然干酪的边脚料生产,减少了工厂的损失。
更重要的是,再制奶酪中可以添加各种风味料,产品口味丰富,状态和包装形式方便食用,因而在日本、韩国、中国等没有干酪消费传统的国家首先被接受。
