乙酸丁酯的制备
乙酸丁酯的制备实验报告

乙酸丁酯的制备实验报告乙酸丁酯的制备实验报告引言:乙酸丁酯是一种常用的有机溶剂,广泛应用于化学、医药和食品工业等领域。
本实验旨在通过酯化反应制备乙酸丁酯,并通过实验结果分析反应条件对产率的影响。
实验原理:酯化反应是一种酸催化反应,通过酸催化剂将醇和酸酐反应生成酯。
乙酸丁酯的制备实验中,我们使用了乙酸和丁醇作为反应物,硫酸作为酸催化剂。
实验步骤:1. 实验前准备:准备好所需的试剂和仪器设备,确保实验环境的安全和整洁。
2. 反应体系的准备:将一定量的乙酸和丁醇按照一定的摩尔比例加入反应瓶中。
3. 加入催化剂:向反应瓶中加入适量的硫酸作为酸催化剂。
4. 反应过程控制:将反应瓶密封并放置在恒温槽中,控制反应温度在适宜的范围内。
5. 反应结束:反应一定时间后,将反应瓶取出,停止反应。
6. 产物分离:将反应液倾倒入分液漏斗中,与适量的水进行萃取。
7. 乙酸丁酯的提纯:将乙酸丁酯溶液经过蒸馏或其他提纯方法,得到纯净的乙酸丁酯。
实验结果与讨论:在实验中,我们通过改变反应物的摩尔比例、酸催化剂的用量和反应温度等条件,进行了多组实验。
根据实验结果,我们发现这些条件对乙酸丁酯的产率有着不同程度的影响。
首先,我们改变了反应物的摩尔比例。
在一组实验中,我们保持乙酸的用量不变,逐渐增加丁醇的用量。
结果显示,随着丁醇用量的增加,乙酸丁酯的产率呈现上升的趋势。
这是因为酯化反应是一个平衡反应,反应物中醇的增加可以推动反应向生成酯的方向进行。
其次,我们改变了酸催化剂的用量。
在一组实验中,我们保持反应物的摩尔比例不变,逐渐增加硫酸的用量。
结果显示,随着硫酸用量的增加,乙酸丁酯的产率先升高后下降。
这是因为酸催化剂的作用是加速反应速率,但过量的酸会导致副反应的发生,降低产率。
最后,我们改变了反应温度。
在一组实验中,我们保持反应物的摩尔比例和酸催化剂的用量不变,逐渐改变反应温度。
结果显示,反应温度对乙酸丁酯的产率有着显著的影响。
在适宜的温度范围内,反应速率较快,产率较高;而在温度过高或过低时,反应速率会受到限制,产率下降。
乙酸丁酯生产工艺

乙酸丁酯生产工艺
乙酸丁酯是一种有机化合物,具有广泛的应用领域。
它可以作为溶剂、涂料、香料等方面使用。
本文将介绍乙酸丁酯的生产工艺。
一、原材料准备
乙酸丁酯的生产需要以下原材料:丁醇、乙酸、硫酸和水。
这些原材
料需要经过净化和检验,确保其纯度符合生产要求。
二、反应过程
1.预处理阶段
在反应开始前,需要对反应器进行清洗和消毒。
然后将所需量的丁醇
加入反应器中,并加入催化剂硫酸。
搅拌均匀后,开始加入乙酸。
2.反应阶段
在加入乙酸后,反应温度会逐渐升高,达到80-90℃左右。
此时需要
控制温度不要过高,否则会影响产物质量。
同时也需要控制反应时间,在1-2小时左右即可完成反应。
3.分离阶段
完成反应后,需要进行分离操作。
首先将反应混合物冷却至室温,并加入适量的水进行中和处理。
然后加入碳酸钠,使反应混合物中的硫酸中和。
最后将产物乙酸丁酯和水分离出来,通过蒸馏等方法进行纯化。
三、产品质量控制
在乙酸丁酯生产过程中,需要对产品质量进行严格控制。
主要包括以下方面:
1.原材料纯度:确保原材料的纯度符合生产要求。
2.反应温度和时间:控制反应温度和时间,以确保产物质量稳定。
3.分离操作:通过中和处理和分离操作,保证产物的纯度。
4.产品检测:对产品进行检测,确保其符合国家标准和客户要求。
以上是乙酸丁酯生产工艺的主要内容。
通过科学的生产工艺和质量控制体系,可以生产出高品质的乙酸丁酯产品。
实验室制取乙酸丁酯
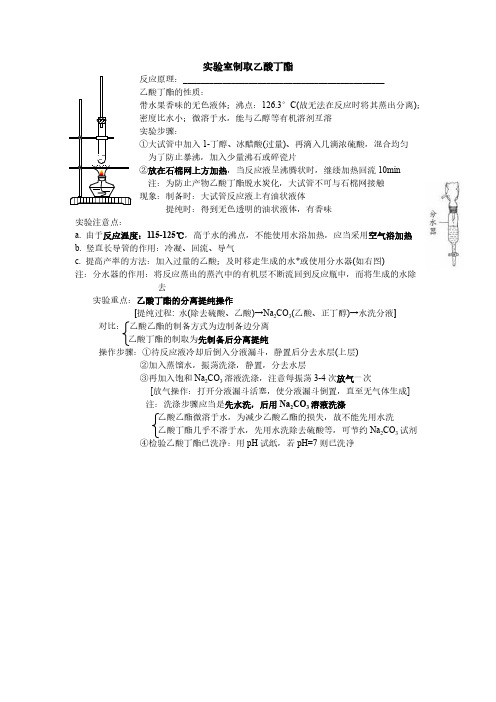
126.3°C(故无法在反应时将其蒸出分离);
(过量)、再滴入几滴浓硫酸,混合均匀
10min
a. 由于反应温度:115-125℃,高于水的沸点,不能使用水浴加热,应当采用空气浴加热
b. 竖直长导管的作用:冷凝、回流、导气
c. 提高产率的方法:加入过量的乙酸;及时移走生成的水*或使用分水器(如右图)
注:分水器的作用:将反应蒸出的蒸汽中的有机层不断流回到反应瓶中,而将生成的水除
去
实验重点:乙酸丁酯的分离提纯操作
[提纯过程: 水(除去硫酸、乙酸)→Na2CO3(乙酸、正丁醇)→水洗分液]对比:
乙酸丁酯的制取为先制备后分离提纯
操作步骤:①待反应液冷却后倒入分液漏斗,静置后分去水层(上层)
②加入蒸馏水,振荡洗涤,静置,分去水层
③再加入饱和Na2CO3溶液洗涤,注意每振荡3-4次放气一次
[放气操作:打开分液漏斗活塞,使分液漏斗倒置,直至无气体生成]
注:洗涤步骤应当是先水洗,后用Na2CO3溶液洗涤
乙酸乙酯微溶于水,为减少乙酸乙酯的损失,故不能先用水洗
乙酸丁酯几乎不溶于水,先用水洗除去硫酸等,可节约Na2CO3试剂
④检验乙酸丁酯已洗净:用pH试纸,若pH=7则已洗净。
香料乙酸丁酯的制备

三、实验装置与试剂
1、实验药品 丁醇(10ml)、浓硫酸(2 ml) 、冰醋酸(20 ml) 、 10%碳酸钠溶液,盐水,无水MgSO4。 2、实验装置
加热回流装置,普通验步骤
1、在50ml圆底烧瓶中加入1-丁醇(10 ml)、乙酸(20 ml) 、 浓硫酸(2 ml) ,加热回流2h。 2、冷却,将反应混合液转入分液漏斗,分别用盐水(20ml)、 碳酸钠(10%)(15ml)、盐水(20ml)洗涤。 3、有机层干燥(无水MgSO4 )后,蒸馏(所用仪器需干燥), 收集122-126°C的馏分,得乙酸丁酯,称重,计算产率。。
五、实验中的注意事项
1、加药品的先后顺序:丁醇、冰醋酸、浓硫酸。 2、加入硫酸后摇动,混合均匀,避免硫酸局部过浓导致炭 化,溶液变黑。 3、浓硫酸的作用:催化剂(加快反应速率)、吸水剂(使 可逆反应向生成乙酸丁酯的方向移动)。 4、盐水洗涤:减少酯在水中的溶解度,防止乳化,利于分 层。
5、碳酸钠溶液的作用:吸收未反应的乙酸和硫酸。
6、不能用NaOH溶液代替碳酸钠溶液:因为 NaOH溶液碱性强促进乙酸丁酯的水解。
7、提高乙酸丁酯的产率的方法:加入浓硫酸、加 入过量的乙酸或丁醇、延长反应时间。
一、实验目的
1.通过乙酸丁酯的制备,加深对酯化反应的理解;
2.了解乙酸丁酯的分离提纯方法。
二、实验原理
酸和醇起作用,生成酯和水的反应叫做酯化反应。在 浓硫酸催化下,乙酸和丁醇生成乙酸丁酯:
CH3COOH + HO(CH2) 3CH3浓硫酸 CH3COO(CH2)3CH3 + H2O
△
该反应经历了加成-消去的过程。质子活化的羰基被 亲核的醇进攻发生加成,在酸作用下脱水成酯。酯化反应 是可逆反应,为了提高酯的产量,为使平衡向生成酯的方 向移动,常常使反应物之一过量,或将生成物从反应体系 中及时分离出去(将乙酸乙酯及时蒸出或将水吸收)。
乙酸丁酯的制备的化学方程式

乙酸丁酯的制备的化学方程式乙酸丁酯(也称为丁酸乙酯)是一种常见的酯化合物,化学式为C6H12O2。
它是由乙酸和丁醇反应生成的。
乙酸丁酯具有水果香味,常用作溶剂和合成香料的原料。
乙酸丁酯的制备可以通过酯化反应来实现。
酯化反应是一种酸催化反应,将醇与酸酐(酸的酯)反应生成酯。
在乙酸丁酯的制备中,乙酸充当酸酐,而丁醇充当醇。
具体的化学方程式如下:CH3COOH + C4H9OH → CH3COOC4H9 + H2O乙酸和丁醇在酸催化下反应生成乙酸丁酯和水。
反应中酸催化剂可以选择无水硫酸或磷酸等。
这些酸催化剂能够加速酯化反应的进行,并且在反应结束后可以被蒸馏去除。
乙酸丁酯的制备过程可以分为以下几个步骤:1. 准备原料:将乙酸和丁醇准备好,确保它们的纯度和质量符合要求。
2. 反应体系的配置:将乙酸和丁醇按照一定的摩尔比例加入反应容器中。
一般情况下,乙酸和丁醇的摩尔比例为1:1。
3. 添加酸催化剂:向反应容器中添加酸催化剂,常用的酸催化剂有无水硫酸和磷酸。
4. 加热反应混合物:将反应容器中的混合物加热至适当的温度。
酯化反应一般需要在较高的温度下进行,通常为100-130摄氏度。
5. 反应时间控制:根据具体的反应条件,控制反应时间,使反应达到理想的程度。
一般来说,反应时间在数小时至一天之间。
6. 分离产物:反应结束后,将反应混合物进行分离。
由于乙酸丁酯的沸点较低,可以通过蒸馏的方式将其分离出来。
以上就是乙酸丁酯的制备过程及化学方程式的详细描述。
乙酸丁酯作为一种重要的化学品,在化工、制药和香料等领域有广泛的应用。
了解其制备过程有助于我们更好地理解和应用该化合物。
乙酸和丁醇为原料制备乙酸丁酯的工艺流程

乙酸和丁醇为原料制备乙酸丁酯的工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!乙酸与丁醇合成乙酸丁酯的工业生产工艺流程乙酸丁酯是一种重要的有机溶剂,广泛应用于涂料、香料和印刷油墨等行业。
乙酸丁酯反应原理

乙酸丁酯反应原理乙酸丁酯(Butyl acetate)是一种常用的有机溶剂,其化学式为C6H12O2,由乙酸和丁醇反应制得。
乙酸丁酯具有较低的沸点、较好的溶解性和挥发性,广泛应用于涂料、油墨、胶黏剂和清漆等行业。
乙酸丁酯的制备反应是一种酯化反应,即酸与醇反应生成酯的过程。
具体而言,乙酸丁酯由乙酸和丁醇在酸催化剂的存在下发生酯化反应,生成乙酸丁酯和水。
酸催化剂通常采用无机酸如硫酸、磷酸或有机酸如甲苯磺酸。
酸的存在可以加速反应速度,促使酯化反应进行。
酯化反应的原理是羧酸和醇发生酯键形成,同时伴随着水分子的释放。
先由酸催化剂将一分子乙酸质子化,形成乙酸根离子,然后乙酸根离子与丁醇发生亲核取代反应,醇的氧原子攻击碳原子,断裂碳氧单键形成中间物质,最后经过质子转移、断裂醇的σ键和羧酸的π键,形成酯的酯化产物。
乙酸丁酯反应的化学方程式如下:CH3COOH + C4H9OH → CH3COOC4H9 + H2O乙酸丁酯的制备条件和反应速率主要受到以下几个因素的影响:1. 反应物浓度:当乙酸和丁醇的浓度较高时,反应速率较快,但是过高的浓度也会导致产物的回流沉淀,降低反应效率。
2. 反应温度:一般情况下,反应温度越高,反应速率越快,但也要考虑到副反应的发生和安全性。
3. 催化剂选择:选择适当的催化剂对反应速率有重要影响。
硫酸等强酸催化剂能够促进酯化反应,但也容易引起副反应和热分解。
因此,需要选择适当浓度和适宜温度下的催化剂。
4. 反应时间:反应时间越长,反应程度越大,但是过长的反应时间也会导致产物的分解、副反应的增加。
乙酸丁酯的制备反应需要进行适当的控制,以保证产率和纯度。
在实际应用中,还可以通过逆流酯化反应和连续流动酯化反应等工艺来提高乙酸丁酯的制备效果。
总体而言,乙酸丁酯的制备反应是一种经过酸催化剂作用的酯化反应。
通过适当选择反应条件和催化剂,可以得到高产率和高纯度的乙酸丁酯。
乙酸丁酯在涂料和化工等领域具有广泛应用,其制备原理的了解和掌握对于相关行业的发展具有重要意义。
化工专业实验乙酸丁酯的合成与精制

乙酸丁酯的合成与精制一、乙酸丁酯简介1、乙酸丁酯1.1、物化性质:无色有果香气味的液体。
沸点(101.3kPa)126.114℃,熔点-73.5℃,相对密度(20℃/4℃)0.8807,燃点为421℃。
闪点(闭口)27℃;爆炸极限(下限)1.4%(vol),(上限)8.0%(vol)。
乙酸丁酯微溶于水,能与醇、醚等一般有机溶剂混溶。
乙酸丁酯与低级同系物相比,乙酸丁酯难溶于水,也较难水解。
但在酸或碱的作用下,水解生成乙酸和丁醇。
1.2、性质:分子式:C6H12O2 。
分子量:116.16 。
FEMA:2174 。
密度:0.8764熔点(℃):-77.9沸点(℃):126.1闪点(℃):22(闭杯)折射率:1.3907(19℃)色状:无色液体。
溶解情况:溶于醇、醚、醛等有机溶剂,溶于180份水。
稳定性:在弱酸性介质中较稳定。
1.3、用途:乙酸正丁酯是一种重要的化工产品,也是重要的有机合成中间体,广泛用于有机合成、塑料、涂料等工业。
它是化工、军工、医药等行业的主要溶剂,特别是清漆、人造革、塑料等物质的良好溶剂。
此外,它还是制造油漆、飞机漆的主要原料[1],可用于香料、化妆品、食品添加剂、防腐防霉剂和药物的合成工业中。
乙酸正丁酯具有广泛的应用价值和巨大的发展前景。
二、乙酸丁酯的合成2.1、乙酸丁酯的合成乙酸丁酸合成实验是我们有机化学实验教材中一个典型的酯化反应,现行实验教材的合成方法是以液体浓硫酸作催化剂由乙酸和丁醇加热回流而制得,浓硫酸易导致较多的副反应,使得原料消耗量大,选择性差,产率低,实验后处理过程复杂,废水排放量大,这些弊端与日益兴起的绿色化学背道而驰.如何充分利用原材料,减少或消除化工过程对环境的污染,获得对环境友好的新工艺,是每个化学工作者亟待解决的问题,是每个从事化学工作行业无法推却的责任。
近年国内科研单位高等院校和化工企业继续保持对乙酸丁酯合成技术的科研攻关活跃发展的势头,为克服传统浓硫酸催化剂工艺方法的诸多缺点,研究者皆在致力于新型催化剂的筛选和实用工艺的开发,力求达到催化活性高、使用寿命长、可回收重复使用、产(收)率高、产品质量好、设备维护耗费低、节约能源、三废尽量少、投资费用小的目标。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Other methods are available for the synthesis of esters, most of them more expensive but readily carried out on a small scale. For example, alcohols react with acid anhydrides to form esters:
Ketene
Benzyl Acetate
O CH3C O- Ag+ Silver acetate
+
CH3 BrCH2CH2CH CH3 1-Bromo-3-methylbutane
O CH3 CH3C O CH2CH2CH CH3 Isoamyl acetate
As noted above, Fischer esterification is an equilibrium process. Consider the reaction of acetic acid with 1-butanol to give n-butyl acetate:
O H3C C O O H3C C OH CH2 CH2CH2 CH3 [H2O]
Keq=
[HOCH2CH2CH2CH3]
For primary alcohols reacting with unhindered carboxylic acids, Keq ~ 4. If equal quantities of 1butanol and acetic acid are allowed to react, the theoretical yield of ester is only 67% at equilibrium. To upset the equilibrium we can, by Le Chatelier's principle, increase the concentration of either the alcohol or acid, as noted above. If either one is doubled, the theoretical yield increases to 85%. When one is tripled, it goes to 90%. But note that in the example cited the boiling point of the relatively nonpolar ester is only about 8°C higher than the boiling points of the polar acetic acid and 1-butanol, so a difficult separation problem exists if either starting material is increased in concentration and the product is isolated by distillation. Another way to upset the equilibrium is to remove water. This can be done by adding to the reaction mixture molecular sieves, an artificial zeolite, which preferentially adsorb water. Most other drying agents, such as anhydrous sodium sulfate or calcium chloride, will not remove water at the temperatures used to make esters. A third way to upset the equilibrium is to preferentially remove the water as an azeotrope. The information in the table below can be found in any chemistry handbook table of ternary (threecomponent) azeotropes.
Esters can be prepared by the reaction of a carboxylic acid with an alcohol in the presence of a catalyst such as concentrated sulfuric acid, hydrogen chloride, p -toluenesulfonic acid, or the acid form of an ion exchange resin:
O H3C C OH Acetic acid + HOCH2CH2CH2CH3 n-Butanol
H+
O CH2CH2CH2CH3 C + H2O O H3C n-Butylacetate
The equilibrium expression for this reaction is shown below.
O C H3C + CH OH 3 OH
H+ H3C
O O CH3 + H O 2
This Fischer esterification reaction reaches equilibrium after a few hours of refluxing. The position of the equilibrium can be shifted by adding more of the acid or of the alcohol, depending on cost or availability. The mechanism of the reaction involves initial protonation of the carboxyl group, attack by the nucleophilic hydroxyl, a proton transfer, and loss of water followed by loss of the catalyzing proton to give the ester. Because each of these steps is completely reversible, this process is also, in reverse, the mechanism for the hydrolysis of an ester:
O CH3CH2OH Ethanol + O H3C O O CH2CH3 + CH3COOH Acetic acid C C H3C CH3 O Acetic anhydride
Ethyl acetate
Acid chlorides form esters by reactioe Give the detailed mechanism for the synthesis of isobutyl formate by Fischer esterification. Introduction The ester group is an important functional group that can be synthesized in a number of different ways. The low-molecular-weight esters have very pleasant odors and indeed are the major components of the flavor and odor aspects of a number of fruits. Although the natural flavor may contain nearly a hundred different compounds, single esters approximate the natural odors and are often used in the food industry for artificial flavors and fragrances.
O CH3CH2CH2OH 1-Propanol + H3C Cl Acetyl chloride C H3C O C O
CH2CH2CH3 + HCl
n-Propyl acetate
In the latter reaction, an organic base such as pyridine is usually added to react with the hydrogen chloride. A number of other methods can be used to synthesize the ester group. Among these are the addition of 2-methylpropene to an acid to form t-butyl esters, the addition of ketene to make acetates, and the reaction of a silver salt with an alkyl halide.
O CH3CH2C OH Propionic Acid + CH2 CH3 C CH3 H+ O CH3 CH3 t-Butyl propionate O CH2 C O + HOCH2 Benzyl alcohol CH3 C OCH2 CH3CH2C O C CH3
2-Methylpropene (isobutylene)
The Ternary Azeotrope of Boiling Point 90.7 °C Percentage Composition of Azeotrope Boiling Point of Vapor Compound Upper Lower Pure Compound Phase Layer Layer (°C) l-Butanol 117.7 8.0 11.0 2.0 n-Butyl 126.7 63.0 86.0 1.0 acetate Water 100.0 29.0 3.0 97.0 These data tell us that the vapor that distills from a mixture of 1-butanol, n-butyl acetate, and water will boil at 90.7° C and the vapor contains 8% alcohol, 63% ester, and 29% water. The vapor is homogeneous, but when it condenses, it separates into two layers. The upper layer is composed of 11% alcohol, 86% ester, and 3% water, but the lower layer consists of 97% water with only traces of alcohol and ester. If some ingenious way to remove the lower layer from the condensate and still return the upper layer to the reaction mixture can be devised, then the equilibrium can be upset and nearly 100% of the ester can be produced in the reaction flask.
