关于酸碱溶液稀释后pH的计算方法和规律范文文稿
酸碱溶液的pH值计算与调节

酸碱溶液的pH值计算与调节酸碱溶液的pH值是表示溶液酸碱性强弱的重要指标,对于许多化学和生物过程的控制具有至关重要的作用。
了解如何计算和调节酸碱溶液的pH值,有助于我们更好地理解和应用这一概念。
本文将介绍酸碱溶液pH值的计算原理,以及常见的pH调节方法。
一、酸碱溶液pH值的计算原理pH值是用来表示溶液酸碱程度的指标,其取值范围从0到14。
pH值小于7表示酸性溶液,pH值大于7表示碱性溶液,pH值等于7表示中性溶液。
pH值的计算公式如下:pH = -log[H+]其中[H+]代表溶液中的氢离子浓度。
氢离子浓度越高,溶液越酸;氢离子浓度越低,溶液越碱。
在实际应用中,我们往往需要根据溶液中已知的物质的浓度或其他性质,计算得出酸碱溶液的pH值。
不同酸碱物质的计算方法略有差异,但总体思路相似。
二、酸碱溶液pH值的计算方法1. 酸溶液的pH值计算:对于强酸溶液,其pH值可以直接通过以下公式计算:pH = -log[H+]其中[H+]为酸溶液的氢离子浓度,可由溶液的浓度和酸的解离度确定。
对于弱酸溶液,其pH值的计算较为复杂,需考虑酸的解离平衡反应。
一般来说,我们需要根据酸的解离常数(Ka)和溶液中的酸浓度,结合酸的解离平衡反应式,计算得出酸溶液的pH值。
2. 碱溶液的pH值计算:与酸溶液相似,强碱溶液的pH值计算较为简单,可以直接通过以下公式得出:pOH = -log[OH-]pH = 14 - pOH其中[OH-]为碱溶液中的氢氧根离子浓度。
对于弱碱溶液,其pH值计算也需要考虑碱的解离平衡反应和碱的解离常数(Kb)。
通过计算溶液中水的离子积与酸解离常数的比值,再求对数,即可得到碱溶液的pH值。
三、酸碱溶液pH值的调节方法1. 添加酸碱试剂:可以通过添加酸碱试剂来调节溶液的pH值。
例如,如果需要降低溶液的pH值,可以添加酸性试剂,如盐酸或硫酸等。
相反,若需要提高溶液的pH值,则可添加碱性试剂,如氢氧化钠或碳酸氢钠等。
溶液PH值的计算总结

溶液PH值的计算总结溶液pH值的计算与规律的探讨溶液pH值问题涉及⾯⼴,与⽣活实际关系密切,内容多⽽繁杂,是⾼中阶段学习的重点和难点,尤其是pH值计算更是考试的热点。
因此,探讨pH值的计算⽅法和技巧,寻找解决问题的关键与规律,对于解决溶液pH问题具有重要意义。
⼀、单⼀溶液的pH的计算若是酸性溶液,应先确定c(H+),再进⾏pH的计算。
若是碱性溶液,应先确定c(OH-),再根据c(H+)·c(OH-)=Kw换算成c(H+),求pH⼆、溶液稀释后的pH的计算1、强酸或强碱的稀释在稀释强酸或强碱时,当浓度⼤于10-5mol/L时,不考虑⽔的电离如pH=6的盐酸,稀释100倍后,p H≈7(不能⼤于7);pH=8的NaOH溶液,稀释100倍后,p H≈7(不能⼩于7);pH=3的盐酸,稀释100倍后,pH=5;pH=10的NaOH溶液,稀释100后,pH=82、弱酸或弱碱的稀释(1) 强酸或强碱的稀释在稀释强酸或强碱时,当它们的浓度⼤于10-5mol/L时,不考虑⽔的电离;当它们的浓度⼩于10-5mol/L时,应考虑⽔的电离。
如pH=6的盐酸,稀释100倍,稀释后pH≈7(不能⼤于7);pH=8的氢氧化钠溶液,稀释100倍,稀释后pH≈7(不能⼩于7);pH=3的盐酸,稀释100倍,稀释后pH=5;pH=10的氢氧化钠溶液,稀释100倍,稀释后pH=8。
(2) 弱酸或弱碱的稀释在稀释弱酸或弱碱过程中既有浓度的变化,⼜有电离平衡的移动,不能求得具体数值,只能确定其PH范围。
如pH=3的醋酸溶液,稀释100倍,稀释后3<pH<5;pH=10的氨⽔,稀释100倍,稀释后8<pH<10;pH=3的酸溶液,稀释100倍,稀释后3<pH≤5;pH=10的碱溶液,稀释100倍,稀释后8≤pH<10。
(3) 总结pH=a的强酸与弱酸和pH=b的强碱与弱碱溶液,稀释10-n倍(相同倍数),溶液的PH及其变化情况如何如下表物质pH 稀释后溶液的pH强酸 a pH=a+n弱酸 a a<pH<a+n强碱 b pH=b-n弱碱 b b-n<pH<b如:PH=3的醋酸溶液,稀释100倍,稀释后3<pH<5;PH=10的氨⽔,稀释100倍,稀释后8<pH<10;(4)溶液稀释后pH变化曲线pH分别相同的强酸与弱酸或强碱与弱碱溶液稀释相同的倍数(10n),对应溶液pH变化曲线如下图所⽰。
酸碱稀释后的ph变化规律

酸碱稀释后的ph变化规律酸碱稀释后的 pH 变化规律:在酸碱溶液稀释过程中,强酸或强碱溶液稀释时,溶液的 pH 值会向 7 靠近,但酸溶液的 pH 始终小于 7,碱溶液的 pH 始终大于 7。
并且稀释倍数越大,pH 值的变化越接近 7。
说起这酸碱稀释后的 pH 变化规律,咱们可以把酸和碱想象成两个性格迥异的小伙伴。
酸呢,就像是个总是板着脸、比较严肃的家伙,它的 pH 值小于 7。
而碱呢,则像是个特别活泼、爱热闹的孩子,pH 值大于 7。
当我们开始给酸溶液加水稀释的时候,就好像是在劝这个严肃的小伙伴变得温和一些。
一开始,它可能还有些固执,pH 值变化不是特别大,但随着加的水越来越多,它也慢慢妥协了,pH 值逐渐增大,向 7 靠近。
不过,它再怎么改变,也还是保留着那份严肃,pH 值始终小于7。
碱溶液呢,当我们给它加水稀释,就像是让这个活泼过头的孩子安静一点。
一开始,它可不愿意,pH 值变化不大。
但水加得多了,它也不得不收敛一些,pH 值逐渐减小,朝着 7 靠拢。
可就算是收敛了,它还是那么活泼,pH 值始终大于 7。
比如说,咱们常见的盐酸溶液,它原本的 pH 值可能是 2。
当我们把它稀释 10 倍,pH 值可能会变成 3 左右;要是再稀释 100 倍,pH 值就更接近 7 啦。
再比如氢氧化钠溶液,原本 pH 值是 12,稀释 10 倍后,pH 值可能变成 11 左右。
在实际生活中,这一规律也有很多应用呢。
比如在农业生产中,农民伯伯调节土壤的酸碱度,就需要了解酸碱稀释的规律,才能让庄稼在合适的土壤环境中茁壮成长。
在化工生产中,控制溶液的 pH 值对于反应的进行和产品的质量都至关重要。
总之,了解酸碱稀释后的 pH 变化规律,对我们的生产和生活都有着重要的意义。
它就像是一把神奇的钥匙,能帮助我们打开化学世界的大门,解决许多实际问题。
如果您对这方面的知识感兴趣,想要更深入地了解,不妨读一读《化学的奥秘》这本书,或者登录科普中国网,那里有丰富的化学知识等着您去探索。
溶液稀释时pH的计算
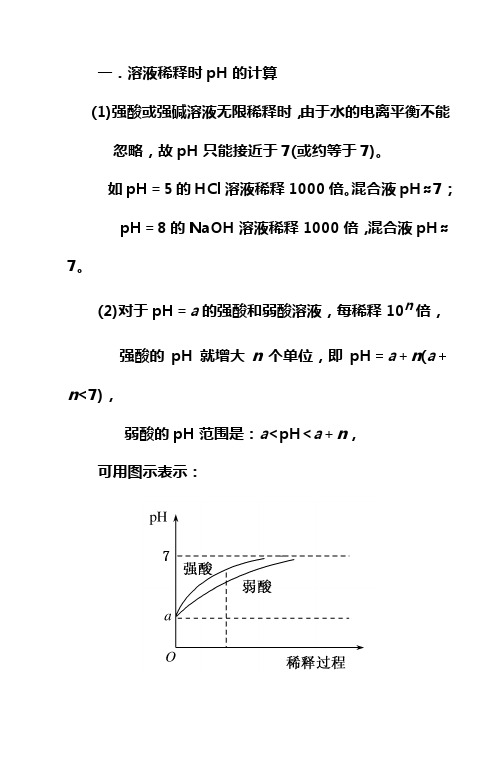
一.溶液稀释时pH的计算
(1)强酸或强碱溶液无限稀释时,由于水的电离平衡不
能忽略,故pH只能接近于7(或约等于7)。
如pH=5的HCl溶液稀释1000倍。
混合液pH≈7;
pH=8的NaOH溶液稀释1000倍,混合液pH≈7。
(2)对于pH=a的强酸和弱酸溶液,每稀释10n倍,
强酸的pH就增大n个单位,即pH=a+n(a+n<7),弱酸的pH范围是:a<pH<a+n,
可用图示表示:
从图像可以看出:
①强酸比弱酸pH改变快;
②当稀释同样倍数时,强酸pH变化大于弱酸;
③当稀释至pH相同时,弱酸稀释的倍数大。
3)对于pH =b 的强碱和弱碱溶液, 每稀释10n
倍, 强碱的pH 减小n 个单位,即pH =b -n (b -n >7), 弱碱的pH 的范围是:b -n <pH<b ,
可用图示表示。
从图像可以看出:
①强碱比弱碱pH 改变快;
②当稀释同样倍数时,强碱pH 变化大于弱碱; ③当稀释至pH 相同时,弱碱稀释的倍数大。
pH 计算记忆方法:
碱按碱,酸按酸,同强混合在中间, 异强混合看过量,无限稀释7
为限。
酸碱溶液的pH值及其计算

酸碱溶液的pH值及其计算酸碱溶液的pH值是描述其酸碱性质的一个重要指标。
pH值的计算可以通过测定溶液中氢离子(H+)的浓度来进行。
本文将详细介绍酸碱溶液的pH值的定义、计算方法和相关知识。
一、pH值的定义pH值是用来衡量溶液酸碱性质的指标,其定义为溶液中氢离子浓度的负对数。
pH值的范围是0到14,其中7为中性。
低于7的pH值表示溶液为酸性,高于7的pH值表示溶液为碱性。
二、pH值的计算计算pH值需要知道溶液中氢离子的浓度。
在水中,pH值可以通过以下公式计算:pH = -log[H+]根据这个公式,如果知道氢离子浓度为1.0×10^-3 mol/L,可以计算得到pH值为3。
需要注意的是,这里的[H+]是指溶液中氢离子的浓度,单位为mol/L。
三、pH值计算的常用方法1. 酸碱指示剂法酸碱指示剂法是通过使用某种酸碱指示剂,根据溶液的颜色变化来判断其pH值的大致范围。
常用的酸碱指示剂有酚酞、溴腈酚等。
2. pH试纸法pH试纸法是一种简单直观的测定pH值的方法,使用酸碱指示纸可以根据纸上显示的颜色和颜色变化来判断溶液的pH值。
3. 电位计法电位计法是一种较为准确测定溶液pH值的方法。
通过使用一个玻璃电极,浸入溶液中,测量溶液和参比电极之间的电位差来计算pH值。
四、常见酸碱溶液的pH值1. 盐酸(HCl):pH≈0盐酸是一种强酸,其pH值非常低,接近于0,表明溶液非常酸性。
2. 苏打水(NaHCO3):pH≈8.4苏打水是一种碱性溶液,其pH值约为8.4,接近于中性。
3. 醋(CH3COOH):pH≈2.4醋是一种弱酸,其pH值约为2.4,表明溶液酸性较弱。
五、影响酸碱溶液pH值的因素1. 酸碱离子浓度溶液中酸碱离子的浓度越高,pH值越低(酸性增强),反之亦然。
2. 弱酸弱碱的离解程度弱酸和弱碱的离解程度较低,因此其pH值通常较高。
3. 温度温度的变化会影响溶液中酸碱离子的浓度,进而影响pH值。
溶液PH值的计算

溶液PH值的计算第一:PH计算的基本规律:注温度抓量多按强算定范围第二:溶液的稀释规律:酸加碱减强快弱慢无限稀释7为限第三:溶液稀释后的PH求法(1)一般来说,强酸(强碱)溶液,每稀释为10倍体积,PH增大(减小)1个单位;对于弱酸(弱碱)溶液,每稀释为10倍体积,PH增大(减小)不足1个单位。
无论稀释多少倍,酸(碱)溶液的PH不能等于或大于(减小)7,只能趋近于7(考虑水的电离)。
(2)对于PH相同的强酸和弱酸(或强碱和弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的PH变化幅度大。
这是因为强酸(或强碱)已完全电离,随着加水稀释,溶液中H+(或OH-)数(除水电离的以外)不会增多,而弱酸(或弱碱)随加水稀释。
H+(或OH-)数还会增多。
(3)对于相同物质的量浓度的强酸和弱酸(强碱或弱碱),稀释相同的倍数,PH的变化幅度不同,强酸(强碱)的PH变化大。
第四:已知酸和碱的PH之和,判断等体积混合后溶液的PH(25℃):(1)若强酸与强碱溶液的PH之和等于14,则混合后溶液显中性,PH=7。
(2)若强酸与强碱溶液的PH之和大于14,则混合后溶液显碱性,PH>7。
(3)若强酸与强碱溶液的PH之的小于14,则混合后溶液显酸性,PH<7。
(4)若酸碱溶液的PH之和为14,酸碱中有一强、一弱,则酸、碱溶液混合后,谁弱显谁的性质。
1. 求0.1 mo1/L盐酸溶液的pH?2.在25℃时,0.1 mo1/L的盐酸溶液50mL和0.05 mo1/L硫酸溶液50mL混合pH值等于多少?3.在25℃时,pH等于5和pH等于3的两种盐酸溶液等体积混合pH等于多少?4. 在25℃时,pH等于1的盐酸溶液1L和pH等于4的硫酸溶液1000L混合pH值等于多少?5. 求0.1 mo1/L氢氧化钠溶液的pH?6.在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合pH等于多少?7. 在25℃时,pH等于13的NaOH溶液1L和pH等于10的Ba(OH)2溶液1000L混合pH 值等于多少?8.在25℃时,0.1 mo1/L的NaOH溶液50mL和0.05 mo1/LBa(OH)2溶液50mL混合pH 值等于多少?9.在25℃时,PH等于11 氢氧化钠溶液与pH值等于3的盐酸溶液等体积混合。
酸溶液稀释后的ph变化规律
酸溶液稀释后的ph变化规律酸溶液稀释后的pH变化规律可真是个有趣的课题!想象一下,生活中遇到酸的时候,大家是不是常常皱着眉头,心里想着“这东西可不能多碰”?确实,酸性溶液一旦跟水混在一起,简直就像在和一个朋友聚会,气氛一下子变得轻松起来。
稀释酸,就像把浓浓的咖啡加了点牛奶,口感温和了许多。
这里的酸,最常见的要数盐酸、硫酸、醋酸这些家伙了,真是给我们上了不少化学课的好材料。
先说说pH值,这个小家伙就像是化学界的天气预报,告诉我们酸碱的情况。
0到6.9的pH,酸酸的,6.9到7.1的地方是中性,7.1到14的pH就意味着你要小心了,碱性开始大肆扩张了。
现在想象一下,你把浓盐酸往水里倒,pH值从极低的数值开始爬升,逐渐走向中性。
这个变化就像是在喝饮料,开始时超甜,慢慢地你感受到那种淡淡的回甘。
水的加入真是个神奇的过程,把浓浓的酸稀释得柔和无比。
不过,稀释的时候别急,慢慢来哦。
想象一下你在调酒,少量的酸和大量的水调和在一起,最后出来的饮品可是让人回味无穷。
再说了,稀释酸也有技巧,加入水时最好是慢慢倒入酸里,避免那种强烈反应就像是打翻了五味瓶,味道变得五味杂陈。
加水时,眼睛别离开,防止浓酸飞溅,安全第一,生活中总得有点小心翼翼。
为什么稀释会让pH值变化呢?这就涉及到离子的浓度。
酸溶液里的氢离子(H+)一旦被水稀释,就像舞会上的人一下子变多了,大家都有空间跳舞,互相碰撞的机会少了。
于是,氢离子的浓度降低,pH值自然就上升了。
就好比一个热闹的聚会,大家都找到自己的位置,气氛变得轻松愉快。
咱们不光是在实验室能看到这些变化,生活中随处可见哦。
比如,给你的花浇点稀释的醋水,它们简直会感激涕零,吸收了适量的酸性营养后,长得更加茂盛。
要是直接用浓醋,花花草草可能就受不了,反而打道回府。
有趣的是,酸稀释的过程也跟我们的日常生活有关。
想想看,我们在生活中常常也需要学会“稀释”,比如遇到压力的时候,不妨想办法让自己放松点,找点乐子,酸甜苦辣都调和一下,生活就会变得更美好。
酸碱溶液的pH计算
酸碱溶液的pH计算酸碱溶液的pH是衡量溶液酸碱程度的指标之一,通过计算pH值我们可以了解溶液的酸碱性质。
本文将介绍如何计算酸碱溶液的pH值,并提供一些实例供参考。
一、什么是pH值?pH是对溶液酸碱程度的数值描述,用来表示溶液中氢离子(H+)的浓度。
pH值的范围从0到14,其中7表示中性溶液,小于7表示酸性溶液,大于7表示碱性溶液。
pH值的计算公式如下:pH = -log[H+]其中[H+]表示氢离子的浓度,以摩尔/升(mol/L)为单位。
二、如何计算酸碱溶液的pH值?1. 酸性溶液的pH计算对于已知酸性溶液,可以通过测量其酸度度量值(如HCl的浓度)来计算其pH值。
例如,如果已知一溶液中HCl的浓度为0.1mol/L,我们可以将其代入pH计算公式中:pH = -log[H+]= -log[0.1]≈ 1所以该溶液的pH值约为1,属于酸性溶液。
2. 碱性溶液的pH计算对于碱性溶液,我们可以通过测量氢氧根离子(OH^-)的浓度来计算其pH值。
同样,我们以氢氧化钠(NaOH)溶液为例,假设其浓度为0.01mol/L,氢氧根离子(OH^-)的浓度即为0.01mol/L。
根据pOH 的计算公式:pOH = -log[OH^-]= -log[0.01]≈ 2我们知道,pH + pOH = 14,因此该溶液的pH值约为14-2=12,属于碱性溶液。
3. 中性溶液的pH计算对于中性溶液,其氢离子(H+)和氢氧根离子(OH^-)的浓度相等,都为10^-7mol/L。
因此,根据pH + pOH = 14,中性溶液的pH值约为7。
三、实例分析现在我们通过两个实例来进一步说明酸碱溶液的pH计算。
1. 实例一:硫酸的pH计算假设已知一溶液中硫酸(H2SO4)的浓度为0.001mol/L,我们可以计算其pH值:pH = -log[H+]= -log[0.001]≈ 3因此,该溶液的pH值约为3,为酸性溶液。
2. 实例二:氨水的pH计算假设已知一溶液中氨水(NH3)的浓度为0.01mol/L,我们可以计算其pOH值:pOH = -log[OH^-]= -log[0.01]≈ 2根据pH + pOH = 14,该溶液的pH值约为14-2=12,为碱性溶液。
酸碱溶液的pH值与酸碱中和滴定计算
酸碱溶液的pH值与酸碱中和滴定计算酸碱溶液的pH值与酸碱中和滴定计算是化学分析中的重要内容,它们可以帮助我们准确测定溶液的酸碱性质以及浓度。
本文将深入探讨酸碱溶液的pH值计算方法和酸碱中和滴定计算原理,帮助读者更好地理解和应用相关知识。
一、酸碱溶液的pH值计算方法1. pH值的定义pH值是衡量溶液酸碱性的指标,它表示溶液中氢离子(H+)浓度的负对数。
pH值的计算公式为:pH = -log10[H+]其中[H+]代表溶液中的氢离子浓度。
2. 酸碱溶液的pH值计算对于弱酸和弱碱溶液,我们可以通过酸碱离解常数(Ka或Kb)和溶液浓度来计算pH值。
以弱酸溶液为例,pH值的计算步骤如下:步骤一:写出酸性离解方程式例如,对于弱酸HA,其离解方程式可以表示为:HA ⇌ H+ + A-步骤二:列出酸性离解平衡常数表达式根据离解方程式,我们可以写出酸性离解平衡常数表达式:Ka = [H+]⋅[A-]/[HA]步骤三:计算酸溶液中H+离子浓度根据酸性离解平衡常数和溶液浓度,可以将[H+]表示为:[H+] = √(Ka⋅[HA])步骤四:计算pH值利用pH = -log10[H+]公式,可以计算得到溶液的pH值。
相似地,对于弱碱溶液可通过酸碱离解常数和浓度计算pOH值,再转换为pH值。
二、酸碱中和滴定计算原理1. 酸碱滴定的基本原理酸碱中和滴定是一种准确测定酸碱溶液浓度的方法。
它基于酸碱滴定反应的化学反应方程,通过滴加已知浓度的酸碱溶液来使反应体系到达中和点,并利用滴定过程中酸碱物质的摩尔比例关系计算未知浓度溶液的浓度。
2. 酸碱中和滴定的计算步骤(以下以酸滴定碱为例)步骤一:准备准备待测溶液,标定好滴定管和滴定针,并将滴定针放入滴定管中。
步骤二:滴定将已知浓度的酸溶液逐滴加入待测碱溶液中,直至溶液颜色发生明显变化(通常使用指示剂来辅助判断)。
步骤三:计算根据滴定过程中酸溶液与碱溶液的反应方程,可以确定二者之间的摩尔比例。
化学实验中的酸碱溶液的浓度计算与稀释方法
化学实验中的酸碱溶液的浓度计算与稀释方法酸碱溶液的浓度计算与稀释方法化学实验中,酸碱溶液的浓度计算与稀释方法是非常重要的内容。
通过准确计算溶液的浓度,并且根据实验要求调整溶液的浓度,可以确保实验的准确性和可靠性。
本文将介绍酸碱溶液浓度的计算方法与稀释原理,并提供一些应用示例。
一、浓度计算方法1.1 原理概述酸碱溶液的浓度可以通过溶质在溶剂中的摩尔浓度来表示。
其计算公式为:浓度(mol/L)= 溶质的摩尔数 / 溶液的体积(L)1.2 实验示例为了更好地说明浓度计算方法,我们以盐酸(HCl)为例。
假设加入0.5 mol的HCl到100 mL的溶剂中,计算盐酸的浓度。
浓度(mol/L)= 0.5 mol / 0.1 L = 5 mol/L二、稀释方法2.1 稀释比例计算稀释是指在浓度过高的酸碱溶液中加入适量的溶剂,使溶液达到预期浓度的过程。
稀释液的浓度与体积可以通过以下公式计算:C1V1 = C2V2其中,C1为初始浓度,V1为初始体积,C2为目标浓度,V2为目标体积。
2.2 实验示例假设我们的目标是制备100 mL浓度为0.1 mol/L的盐酸溶液,而现有的盐酸浓度为5 mol/L。
我们可以通过稀释方法实现:C1V1 = C2V25 mol/L × V1 = 0.1 mol/L × 100 mLV1 = (0.1 mol/L × 100 mL) / 5 mol/LV1 = 2 mL因此,我们需要取2 mL的5 mol/L盐酸,并加入适量的溶剂使总体积达到100 mL。
三、pH计测酸碱溶液浓度除了上述的浓度计算与稀释方法,我们还可以使用pH计来测量酸碱溶液的浓度。
pH计通过测量溶液的酸碱度来推断溶液的浓度。
根据浓度与pH的关系,酸碱溶液的浓度越高,其pH值越低。
通过与标准溶液的比对,我们可以大致确定溶液的浓度范围。
综上所述,化学实验中酸碱溶液的浓度计算与稀释方法是实验过程中必不可少的一部分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
关于酸碱溶液稀释后pH的计算方法和规律
稀释实质:稀释前后酸或碱的物质的量不变。
一般计算公式:C1V1=C2V2,据此求出稀释后酸或碱的物质的量的浓度。
一、pH=a酸溶液的稀释常用规律:
(1)强酸溶液稀释时将水看作c(H+)=10-7mol/L的酸,其计算表达式可以表示为:
c(H+)稀释=。
于是则有:对于pH=a强酸溶液将体积稀释原来的10n倍时,则所得溶液的pH增大n个单位,即pH=a+n;(注意pH一定小于7)。
(2)对于pH=a弱酸溶液将体积稀释原来的10n倍时,则所得溶液的pH则满足如下不等式关系:a (3)无限稀释,不论酸的强弱,因水的电离已是影响pH的主要因素,pH均趋向于7(当pH接近6的时候,再加水稀释,由水电离提供的
不能再忽略,即强酸的浓度接近于10-7mol/L时,无论稀释多少倍,其pH只能是接近于7,仍要小于7而显酸性。
)。
(4)同体积同pH的强酸和弱酸,同倍稀释,强酸的pH变化大化学论文化学论文,弱酸的pH变化小。
例1、稀释下列溶液时,pH值怎样变化?
(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=
(2)pH=6的稀盐酸稀释至1000倍,pH=
解析:(1)pH=4,即[H+]=1×10-4mol/L,稀释10倍,即
c(H+)=1×10-5mol/L,
所以pH=5。
(2)当强酸、强碱溶液的H+离子浓度接近水电离出的H+离子浓度(1×10-7mol/L)时,水电离出的H+离子浓度就不能忽略不计中国论文下载中心论文的格式。
所以pH=6的稀盐酸,稀释1000倍
时:c(H+)=(1×10-6+999×10-7)/1000=1.009×10-7 mol/L, pH=6.99,由此可知溶液接近中性而不会是pH=9。
例2、常温下pH=1的两种一元酸溶液A和B,分别加水1000倍稀释,其pH与所加水的体积变化如下图所示,则下列结论中正确的是( )
(A)A酸比B酸的电离程度小 (B)B酸比A酸容易电离
(C)B是弱酸,A是强酸 (D)pH=1时,B酸的物质的量浓度比A 酸大
解析:如果一元酸是强酸,pH=1时,c(H+)=1×10-1mol/L,加
水稀释103倍后,此时,c(H+)=1×10-4mol/L,pH=4。
如果是一元弱酸,则1
二、pH=a碱溶液的稀释常用规律:
(1)强碱溶液稀释时将水看作c(H+)=10-7mol/L的碱,其计算表达式可以表示为:
c(OH-)稀释=。
于是则有:对于pH=a强碱溶液将体积稀释到原来的10n倍时,则溶液的pH减小n个单位(最后结果不得
小于或等于7)。
(2)对于pH=a弱碱,溶液将体积稀释到原来的10n倍时,a-n
(3)无限稀释,不论碱的强弱,因水的电离已是影响pH的主要因素,pH均趋向于7(当pH接近8的时候,再加水稀释,由水电离提供的
不能再忽略,即强碱溶液中的[OH-]≤10-8mol/L时化学论文化学论文,则无论稀释多少倍,其pH只能接近于7,仍大于7而显碱性)。
(4)同体积同pH的强碱和弱碱,同倍稀释,强碱的pH变化大,弱碱的pH变化小。
例3、稀释下列溶液时,pH值怎样变化?
(1)pH=11的NaOH溶液稀释100倍,所得溶液的pH=
(2)pH=11的NH3·H2O溶液稀释100倍,所得溶液的pH=
(3)pH=9的NaOH溶液稀释1000倍,所得溶液的pH= 解
析:(1)pH=11的NaOH溶液稀释100倍,稀释后所得溶液中
c(OH-)仍以NaOH
溶液中c(OH-)占主导,所以可直接利于规律(1)求得所得溶液的pH为9。
(2)因为NH3·H2O溶液为弱电解质,存在电离平衡,可直接利于规律(2)求得所得溶液的pH为:9
(3)pH=9的NaOH溶液稀释1000倍时,由水电离提供的OH- 不能忽略,其pH只能接近于7
例4、把1mL0.2mol/L的NaOH加水稀释成2L溶液,在此溶液中由水电离产生的
OH-,其浓度接近于
(A) 1×10-4 mol/L (B) 1×10-8 mol/L
(C) 1×10-11 mol/L (D) 1×10-10mol/L
解析:温度不变时,水溶液中氢离子的浓度和氢氧根离子的
浓度乘积是一个常数。
在酸溶液中氢氧根离子完全由水电离产生,而氢离子则由酸和水共同电离产生。
当碱的浓度不是极小的情况下,由碱电离产生的氢氧离子总是远大于由水电离产生的(常常忽略水电离的部分),而水电离产生的氢离子和氢氧根离子始终一样多。
所以,碱溶液中的水电离的氢离子的求算通常采用求算氢氧根离子。
稀释后C(OH-) =(1×10-3L×0.2mol/L)/2L = 1×10-4mol/L, C(H+) = 1×10-14/1×10-4 = 1×10-10 mol/L,所以答案可选(D)。
三、同体积同pH的一强和一弱,稀释到同pH时,体积大小关系
(1)体积相同,pH相同的强酸溶液与弱酸溶液,分别加水稀释m倍和n倍,稀释后溶液的pH仍相同,则m与n的关系为m (2)体积相同,物质的量浓度相等浓度的强酸溶液与弱酸溶液,分别加水稀释m倍和n倍,稀释后溶液的pH仍相同,则m 与n的关系为mn,即强酸溶液稀释的倍数大。
同理:强碱溶液与弱碱溶液化学论文化学论文,上述(1)(2)
结论仍成立中国论文下载中心论文的格式。
例5、体积相同,浓度为0.1mol/L的NaOH溶液、氨水,分别加水稀释m倍和n倍,溶液的pH都变为9,则m与n的关系为( )
(A)4m=n (B)m=n(C)mn
解析:若稀释相同倍数,则稀释后NaOH溶液和氨水的物质的量浓度相等,但是NaOH溶液的pH大,要使pH相同,则NaOH
溶液稀释的倍数大些,所以mn选(D)。
例6、体积相同,pH相同的NaOH溶液、氨水,分别加水稀释m 倍和n倍,稀释后溶液的pH仍相同,则m与n的关系为( ) (A)4m=n(B)m=n (C)mn
解析:体积相同,pH相同的NaOH溶液、氨水若稀释相同倍数,则稀释后NaOH
溶液的pH变化大(即减小程度大),而氨水的pH变化小(即减小程度小),因为稀释过程中氨水的电离程度增大,要使pH相同,则氨水溶液稀释的倍数大些,所以m
巩固练习
1 、有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸。
现只有石蕊试液、酚酞试液、pH试纸和蒸馏水,而没有其它试剂。
简述如何用最简便的实验方法来判别哪瓶是强酸。
2、pH=2的A、B两种酸溶液各1mL,分别加水稀释
到1000mL,其溶液的pH与溶液体积(V)的关系如右图
所示,则下列说法正确的是( )
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液酸性比B酸溶液强
C.a=5时,A是弱酸,B是强酸
D.若A、B都是弱酸,则52
3、常温下,从pH=3的弱酸溶液中取出1mL的溶液,加水稀释到100mL,溶液的pH为_________。
4、相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同化学论文化学论文,则所得溶液的体积 ( )
(A)仍相同(B)醋酸大 (C)盐酸大 (D)无法判断
参考答案及提示
1、答案:各取等体积酸溶液用蒸留水稀释相同倍数(如100倍),然后用pH试纸
分别测其pH,pH变化大的那瓶是强酸。
(提示:本题可利用同体积同pH的强酸和
弱酸,同倍稀释,强酸的pH变化大,弱酸的pH变化小这一规律)
2、答案:(D) (提示:由图可以看出,A酸稀释时pH的变化较B酸稀释时pH的变化明显,且稀释后pHApHB,表明A酸的电离程度要比B酸的大,酸性A强于B,故A、B都错误。
稀释
1000倍后,若A酸溶液的pH从2增大至5,则表示c(H+)减小到原来的1/1000,证明A酸原来就完全电离,所以A是强酸;B 酸溶液稀释后的pH5,则表示B未完全电离,所以B是弱酸,故C错误)。
3、答案3~5(提示:本题可利用:对于pH=a弱酸溶液将体积稀释原来的10n倍时,
则所得溶液的pH则满足如下不等式关系:a
4、答案:(B)(提示:由于醋酸是弱酸,当稀释相同倍数时,pH 的变化小;若要到相同pH时,必然要体积更大)。
