SDS-PAGE电泳操作流程—含考染 银染 碘染
电泳操作方法

XXX有限公司SDS-PAGE 电泳的测定方法文件编号XXXX-02制定部门研发部版本A/0页码1/3生效日期2014/4/9一、目的建立SDS-PAGE电泳的测定方法,确保电泳检测的准确性,保证电泳的安全性、有效性。
二、范围与权责适用于本公司的所有成品以及中间体的分析,由化验员负责采样检测。
品控主管负责审核。
三、原理SDS-PAGE电泳,是在聚丙烯酰胺凝胶系统中引进SDS,SDS会与变性的多肽结合,并使蛋白带负电荷,由于多肽结合SDS的量总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙烯酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:lgMw=k-bX。
式中:Mw为分子量;X为迁移率;k、b均为常数,若将已知分子量的标准蛋白质的迁移率对数分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
四、实验仪器及试剂1.DYCZ-24DN 双垂直电泳仪2.DYY-8C 电泳仪电源3.STS-2A 脱色摇床(水平)4.标准蛋白Marker5.平皿:直径150mm6.TEMED:四甲基乙二胺7.DTT:二硫苏糖醇8.储存液①2M Tris-HCl缓冲液:称取24.2g Tris,用50ml蒸馏水溶解后,滴加HCl调节pH至8.8,待室温,加蒸馏水至100ml。
②1 M Tris-HCl缓冲液:称取12.1g Tris,用50ml蒸馏水溶解后,滴加HCl调节pH至6.8,待室温,加蒸馏水至100ml。
③10%SDS溶液:称取10g SDS ,加蒸馏水溶解至100ml。
④50%甘油:50ml甘油加50ml蒸馏水,混合均匀。
⑤1%溴酚蓝:100mg溴酚蓝,加蒸馏水至10ml,搅拌至完全溶解,水相针式过滤器过滤除去聚合的染料。
SDS-PAGE蛋白电泳标准操作规程

SDS-PAGE蛋白电泳标准操作----(纯度检测)一.目的:检测蛋白质的纯度是否达到生产抗体的要求。
二.依据:《分子克隆手册》,Ab-mart公司内部标准。
三. 职责:质量控制部。
四.试剂与水:所有试剂为分析纯(AR);水为蒸馏水或超纯水。
五. 器皿与耗品:所有玻璃器皿使用前用玻璃清洁剂清洗, 80℃烤干。
tube、tip一次性使用。
六. 仪器设备:电泳仪(电源1--300V)电泳槽灌胶模具染色具凝胶扫描仪七. 环境要求:相对洁净环境,室温。
八. 溶液的配置:1.A液:1.5MTris·HCl pH8.8称取18.15gTris碱(分析纯)加适量的超纯水溶解,用浓盐酸(分析纯)调pH值至8.8,加超纯水定容至100 ml。
贴上标贴,4℃保存。
此溶液有效使用期限为三个月。
(溶液配置台帐见附件)2.B液: 1MTris·HCl pH6.8称取12.1gTris碱(分析纯)加适量的超纯水溶解,用浓盐酸(分析纯)调pH值至6.8,加超纯水定容至100 ml。
贴上标贴,4℃保存。
此溶液有效使用期限为三个月。
(溶液配置台帐见附件)3.C液: 30%丙烯酰胺称取29.2g丙烯酰胺(分析纯),0.8gN,N’-甲叉双丙烯酰胺(分析纯), 加适量的超纯水溶解,再定容至100 ml,用滤纸过滤,。
贴上标贴,避光4℃保存。
此溶液有效使用期限为三个月。
(溶液配置台帐见附件)4.D液:10%SDS称取10gSDS(分析纯),用超纯水溶解至100 ml.贴上标贴,室温储存。
此溶液有效使用期限为三个月。
(溶液配置台帐见附件)5.E液:10%过硫酸胺称取10g过硫酸胺(分析纯), 用超纯水溶解至100 ml。
贴上标贴,-20℃保存。
此溶液有效使用期限为三个月。
(溶液配置台帐见附件)6.F液:TEMED(amersco)7.电泳缓冲液(10X)称取60.57g Tris碱(分析纯),288.268g甘氨酸(分析纯),20gSDS(分析纯),加超纯水定容至2000ml,临用前加超纯水稀释10倍,贴上标贴,室温储存。
蛋白质sds-page凝胶电泳实验步骤

蛋白质sds-page凝胶电泳实验步骤嘿,朋友们!今天咱就来讲讲蛋白质 SDS-PAGE 凝胶电泳实验那些事儿。
首先呢,得准备好各种材料和试剂,这就好比要出门得先把鞋穿好一样重要。
什么电泳槽啦、玻璃板啦、丙烯酰胺溶液啦等等,一个都不能少。
然后就是配胶啦!这就像做菜,得把各种材料按照一定的比例调好。
先配分离胶,小心翼翼地把各种溶液倒在一起,搅拌均匀,可别搅出气泡来哟,不然就像蛋糕里有了疙瘩,可不好看啦。
接着让它静置一会儿,等它凝固得差不多了,再倒上浓缩胶,这浓缩胶就像是给蛋糕加上一层漂亮的奶油。
胶配好啦,接下来就是上样啦!把处理好的蛋白质样品加到孔里,就好像是给小格子里放上宝贝。
这时候可得细心点,别把样品洒出来啦。
接着就是电泳啦!通上电,让蛋白质在电场里欢快地奔跑起来。
它们就像一群小朋友在赛跑,跑得快慢不一样,最后就分开啦。
在这个过程中,可别闲着呀,要时刻盯着,就像看着自己的宝贝在比赛一样。
看看电泳液有没有变少呀,电泳的情况怎么样呀。
等电泳结束啦,就可以染色啦!把胶放到染色液里泡一泡,就像给它洗个彩色的澡。
等染上颜色了,就能清楚地看到蛋白质的条带啦。
哎呀,你说这蛋白质 SDS-PAGE 凝胶电泳实验是不是很有趣呀?就像一场小小的冒险,每一步都充满了惊喜和挑战。
虽然过程可能有点繁琐,但当你看到那清晰的条带时,就会觉得一切都值得啦!就好像辛苦种的花儿终于开了一样开心。
所以呀,别害怕,大胆地去尝试吧!只要按照步骤一步一步来,肯定能做出漂亮的结果。
就像学走路一样,一开始可能会跌跌撞撞,但只要坚持,总会走得稳稳当当的。
加油哦,朋友们!相信你们一定能在蛋白质 SDS-PAGE 凝胶电泳实验中找到属于自己的乐趣和成就感!。
SOP-CSDS-PAGE凝胶电泳标准操作规程
文件编号文件名称SDS-PAGE!胶电泳标准操作规程生效日期有效期至审批及颁发:部门签名日期起草质量部审核质量部批准质量受权人颁发质量部会审: 部门签名日期部门签名日期Copy-1Copy-2Copy-3Copy-4Copy-5Copy-6Copy-7Copy-8Copy-9Copy-10Copy-11Copy-12Copy-13Copy-14Copy-15文件编号文件名称SDS-PAGIE!胶电泳标准操作规程生效日期有效期至、目的建立重组人生长激素电泳检查标准操作规程,使中间产品检验有据可依、范围适用丁本公司中间产品“重组人生长激素”的电泳检查。
二、职责1质量部负责制定本规程。
2 QC人员负责按照本操作规程的规定操作,并做好记录。
3 QC室主任负责监督QC人员按照本规程的规定操作实施四、术语无五、内容1仪器、设备包压电源、垂直板泳槽和制胶模具。
2试剂2.1检查所需试剂是否在有效期内,未准备好的及时配制,缺少的试剂及时申购。
2.2所需试剂有:2.2.1 水:电阻率应不低丁18.2MQ .cm。
2.2.2 A 液:(1.5mol/L三羟基氨基甲烷-盐酸缓冲液)称取18.15g三羟基氨基甲烷,加适量水溶解,用盐酸调pH值至8.8,加水稀释至100ml。
2.2.3 B 液:30初烯酰胺-0.8%N, N'-业甲基双丙烯酰胺溶液(避光保存)。
2.2.4 C 液:1咐二烷基磺酸钠溶液。
2.2.5 D 液:10%3甲基乙二胺溶液。
2.2.6 E 液:10%±硫酸铉,临用前配置。
2.2.7 F 液:(0.5mol/L三羟基氨基甲烷-盐酸缓冲液)称取6.05g三羟基氨基甲烷加适量水溶解,用盐酸调pH值至6.8,加水稀释至100ml。
文件名称SDS-PAGE!胶电泳标准操作规程文件编号生效日期有效期至水溶解,用盐酸调PH值至8.3,加水稀释至1000ml。
2.2.9 供试品缓冲液:称取0.303g三羟基氨基甲烷,0.189ml盐酸,4ml甘油,2mg漠酚蓝, 0.8g十二烷基磺酸钠,加水溶解并稀释至10ml,此溶液用丁非还原SDS-PAGE如用丁还原SDS-PAGE则再加2m l6-筑基乙醇。
SDS-PAGE蛋白电泳检测标准操作规程(非还原还原)

SDS-PAGE蛋白电泳检测标准操作规程(非还原还原)GOOD RESEARCH & DEVELOPMENT PRACTICESDS-PAGE蛋白电泳检测标准操作规程(还原&非还原)编号:SDS-PAGE蛋白电泳检测起草人:部门审核:QA审核:替代:□新订:□日期:日期:日期:修订号:0批准:年月日生效日期:年月日文件分发部门:GOOD RESEARCH & DEVELOPMENT PRACTICESDS-PAGE蛋白电泳检测编号:SDS-PAGE蛋白电泳检测一目的保证产品电泳电泳分子量和纯度检测按规范进行和检定结果的准确可靠。
二范围用于规范电泳电泳分子量和纯度的测定。
三责任质量控制部人员。
四内容1试剂与水:所有试剂为分析纯(AR);水为蒸馏水或超纯水。
2 溶液的配制2.1A液:1.5MTris·HCl pH8.8称取90.75gTris碱(分析纯)加适量的超纯水(约400ml)溶解,用6M盐酸调pH值至8.8,加超纯水定容至500 ml。
贴上标贴,室温储存。
此溶液有效使用期限为三个月。
6M盐酸(调pH用):浓盐酸50ml,加50ml纯化水,混匀。
2.2、B液: 0.5MTris·HCl pH6.8称取60.5gTris碱(分析纯)加适量的超纯水(约400ml)溶解,用6M盐酸调pH值至6.8,加超纯水定容至1000 ml。
贴上标贴,室温储存。
2.3C液: 30%丙烯酰胺-0.8%N,N-亚甲基双丙烯酰胺溶液称取300g丙烯酰胺(分析纯),8gN,N’-甲叉双丙烯酰胺(分析纯), 加适量的超纯水溶解(一般500ml,因为丙烯酰胺具有溶胀性的特点),再定容至1000 ml,用滤纸过滤。
贴上标贴,避光4℃保存。
2.4D液:1%SDS称取2gSDS(分析纯),用超纯水溶解至200 ml.贴上标贴,4℃保存。
2.5E液:10%过硫酸铵GOOD RESEARCH & DEVELOPMENT PRACTICESDS-PAGE蛋白电泳检测编号:称取10g过硫酸铵(分析纯),用超纯水溶解至100 ml,以1ml/支分装,贴上标贴,-20℃保存。
SDS-PAGE电泳的标准操作规程
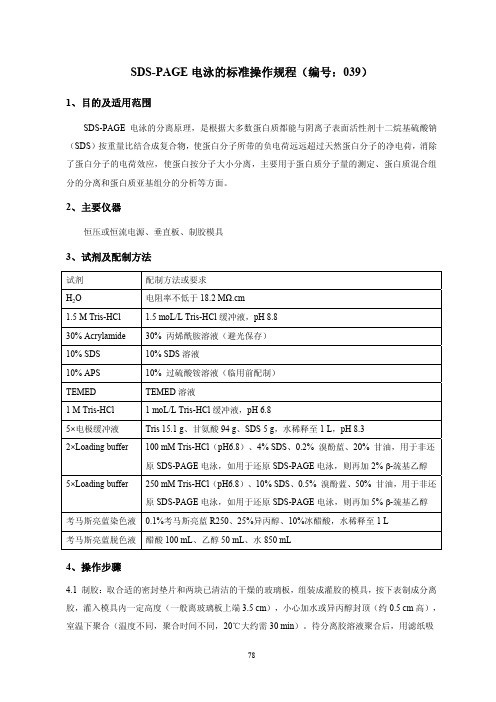
SDS-PAGE电泳的标准操作规程(编号:039)1、目的及适用范围SDS-PAGE电泳的分离原理,是根据大多数蛋白质都能与阴离子表面活性剂十二烷基硫酸钠(SDS)按重量比结合成复合物,使蛋白分子所带的负电荷远远超过天然蛋白分子的净电荷,消除了蛋白分子的电荷效应,使蛋白按分子大小分离,主要用于蛋白质分子量的测定、蛋白质混合组分的分离和蛋白质亚基组分的分析等方面。
2、主要仪器恒压或恒流电源、垂直板、制胶模具3、试剂及配制方法试剂配制方法或要求H2O 电阻率不低于18.2 MΩ.cm1.5 M Tris-HCl 1.5 moL/L Tris-HCl缓冲液,pH 8.830% Acrylamide 30% 丙烯酰胺溶液(避光保存)10% SDS 10% SDS溶液10% APS 10% 过硫酸铵溶液(临用前配制)TEMED TEMED溶液1 M Tris-HCl 1 moL/L Tris-HCl缓冲液,pH 6.815.1g、甘氨酸94 g、SDS 5 g,水稀释至1 L,pH 8.35×电极缓冲液 Tris2×Loading buffer 100 mM Tris-HCl(pH6.8)、4% SDS、0.2% 溴酚蓝、20% 甘油,用于非还原SDS-PAGE电泳,如用于还原SDS-PAGE电泳,则再加2% β-巯基乙醇5×Loading buffer 250 mM Tris-HCl(pH6.8)、10% SDS、0.5% 溴酚蓝、50% 甘油,用于非还原SDS-PAGE电泳,如用于还原SDS-PAGE电泳,则再加5% β-巯基乙醇考马斯亮蓝染色液 0.1%考马斯亮蓝R250、25%异丙醇、10%冰醋酸,水稀释至1 L考马斯亮蓝脱色液醋酸100 mL、乙醇50 mL、水850 mL4、操作步骤4.1 制胶:取合适的密封垫片和两块已清洁的干燥的玻璃板,组装成灌胶的模具,按下表制成分离胶,灌入模具内一定高度(一般离玻璃板上端3.5 cm),小心加水或异丙醇封顶(约0.5 cm高),室温下聚合(温度不同,聚合时间不同,20℃大约需30 min)。
SDS-PAGE电泳实验步骤

垂直板聚丙烯酰胺凝胶电泳分离蛋白质一、实验目的学习SDS-聚丙烯酰胺凝胶电泳法(SDS—PAGE)测定蛋白质的分子量的原理和基本操作技术。
二、实验原理蛋白质是两性电解质,在一定的pH条件下解离而带电荷。
当溶液的pH大于蛋白质的等电点(pI)时,蛋白质本身带负电,在电场中将向正极移动;当溶液的pH小于蛋白质的等电点时,蛋白质带正电,在电场中将向负极移动;蛋白质在特定电场中移动的速度取决于其本身所带的净电荷的多少、蛋白质颗粒的大小和分子形状、电场强度等。
聚丙烯酰胺凝胶是由一定量的丙烯酰胺和双丙烯酰胺聚合而成的三维网状孔结构。
本实验采用不连续凝胶系统,调整双丙烯酰胺用量的多少,可制成不同孔径的两层凝胶;这样,当含有不同分子量的蛋白质溶液通过这两层凝胶时,受阻滞的程度不同而表现出不同的迁移率。
由于上层胶的孔径较大,不同大小的蛋白质分子在通过大孔胶时,受到的阻滞基本相同,因此以相同的速率移动;当进入小孔胶时,分子量大的蛋白质移动速度减慢,因而在两层凝胶的界面处,样品被压缩成很窄的区带。
这就是常说的浓缩效应和分子筛效应。
同时,在制备上层胶(浓缩胶)和下层胶(分离胶)时,采用两种缓冲体系;上层胶pH=6.7—6.8,下层胶pH=8.9;Tris —HCI缓冲液中的Tris用于维持溶液的电中性及pH,是缓冲配对离子;CI-是前导离子。
在pH6.8时,缓冲液中的Gly-为尾随离子,而在pH=8.9时,Gly的解离度增加;这样浓缩胶和分离胶之间pH的不连续性,控制了慢离子的解离度,进而达到控制其有效迁移率之目的。
不同蛋白质具有不同的等电点,在进入分离胶后,各种蛋白质由于所带的静电荷不同,而有不同的迁移率。
由于在聚丙烯酰胺凝胶电泳中存在的浓缩效应,分子筛效应及电荷效应,使不同的蛋白质在同一电场中达到有效的分离。
如果在聚丙烯酰胺凝胶中加入一定浓度的十二烷基硫酸钠(SDS),由于SDS带有大量的负电荷,且这种阴离子表面活性剂能使蛋白质变性,特别是在强还原剂如巯基乙醇存在下,蛋白质分子内的二硫键被还原,肽链完全伸展,使蛋白质分子与SDS充分结合,形成带负电性的蛋白质—SDS复合物;此时,蛋白质分子上所带的负电荷量远远超过蛋白质分子原有的电荷量,掩盖了不同蛋白质间所带电荷上的差异。
SDS-PAGE电泳操作流程—含考染 银染 碘染
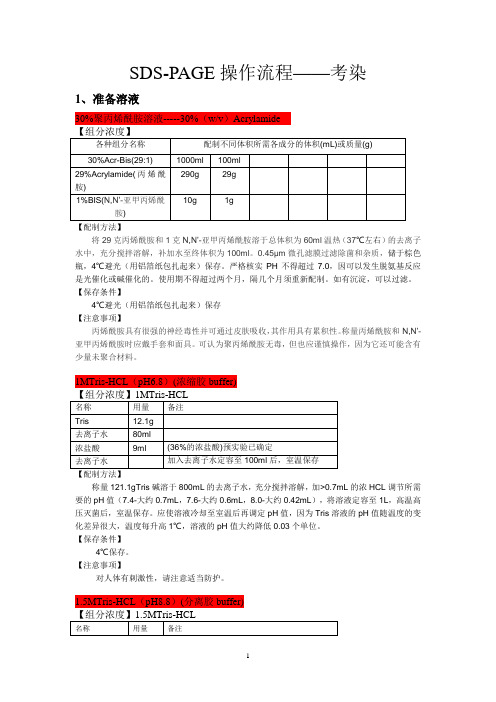
SDS-PAGE操作流程——考染1、准备溶液30%聚丙烯酰胺溶液-----30%(w/v)Acrylamide【配制方法】将29克丙烯酰胺和1克N,N’-亚甲丙烯酰胺溶于总体积为60ml温热(37℃左右)的去离子水中,充分搅拌溶解,补加水至终体积为100ml。
0.45µm微孔滤膜过滤除菌和杂质,储于棕色瓶,4℃避光(用铝箔纸包扎起来)保存。
严格核实PH不得超过7.0,因可以发生脱氨基反应是光催化或碱催化的。
使用期不得超过两个月,隔几个月须重新配制。
如有沉淀,可以过滤。
【保存条件】4℃避光(用铝箔纸包扎起来)保存【注意事项】丙烯酰胺具有很强的神经毒性并可通过皮肤吸收,其作用具有累积性。
称量丙烯酰胺和N,N’-亚甲丙烯酰胺时应戴手套和面具。
可认为聚丙烯酰胺无毒,但也应谨慎操作,因为它还可能含有少量未聚合材料。
1MTris-HCL(pH6.8)(浓缩胶buffer)【配制方法】称量121.1gTris碱溶于800mL的去离子水,充分搅拌溶解,加>0.7mL的浓HCL调节所需要的pH值(7.4-大约0.7mL,7.6-大约0.6mL,8.0-大约0.42mL),将溶液定容至1L,高温高压灭菌后,室温保存。
应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
【保存条件】4℃保存。
【注意事项】对人体有刺激性,请注意适当防护。
1.5MTris-HCL(pH8.8)(分离胶buffer)称量181.7gTris碱溶于800mL的去离子水,充分搅拌溶解,加浓HCL调节所需要的pH值=8.8,将溶液定容至1L,高温高压灭菌后,室温保存。
(1.5mmol/LTris-HCL(pH8.8):18.15gTris和48ml1mol/LHCL混合,加水稀释到100ml终体积。
过滤后40C保存。
)【保存条件】4℃保存【注意事项】应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SDS-PAGE操作流程——考染
1、准备溶液
30%聚丙烯酰胺溶液-----30%(w/v)Acrylamide
【配制方法】
将29克丙烯酰胺和1克N,N’-亚甲丙烯酰胺溶于总体积为60ml温热(37℃左右)的去离子水中,充分搅拌溶解,补加水至终体积为100ml。
0.45µm微孔滤膜过滤除菌和杂质,储于棕色瓶,4℃避光(用铝箔纸包扎起来)保存。
严格核实PH不得超过7.0,因可以发生脱氨基反应是光催化或碱催化的。
使用期不得超过两个月,隔几个月须重新配制。
如有沉淀,可以过滤。
【保存条件】
4℃避光(用铝箔纸包扎起来)保存
【注意事项】
丙烯酰胺具有很强的神经毒性并可通过皮肤吸收,其作用具有累积性。
称量丙烯酰胺和N,N’-亚甲丙烯酰胺时应戴手套和面具。
可认为聚丙烯酰胺无毒,但也应谨慎操作,因为它还可能含有少量未聚合材料。
1MTris-HCL(pH6.8)(浓缩胶buffer)
【配制方法】
称量121.1gTris碱溶于800mL的去离子水,充分搅拌溶解,加>0.7mL的浓HCL调节所需要的pH值(7.4-大约0.7mL,7.6-大约0.6mL,8.0-大约0.42mL),将溶液定容至1L,高温高压灭菌后,室温保存。
应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
【保存条件】
4℃保存。
【注意事项】
对人体有刺激性,请注意适当防护。
1.5MTris-HCL(pH8.8)(分离胶buffer)
称量181.7gTris碱溶于800mL的去离子水,充分搅拌溶解,加浓HCL调节所需要的pH值=8.8,将溶液定容至1L,高温高压灭菌后,室温保存。
(1.5mmol/LTris-HCL(pH8.8):18.15gTris和48ml1mol/LHCL混合,加水稀释到100ml终体积。
过滤后40C保存。
)
【保存条件】
4℃保存
【注意事项】
应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
10%十二烷基硫酸钠SDS溶液-----10%(w/v)SDS
称取2g高纯度的SDS置于100~200ml烧杯中,加入约16ml的去离子水,68℃加热溶解,滴加浓盐酸调节PH至7.2,定容至20ml后,室温保存
【保存条件】
室温保存
【注意事项】
对人体有害,请注意防护。
10%过硫酸铵溶液-----10%(w/v)AP
称取0.1g过硫酸铵置于1.5ml离心管,加1mL去离子水吹打溶解,4℃保存
【保存条件】
4℃保存
【注意事项】
10%过硫酸铵溶液在4℃保存时,可使用1周左右,超过期限会失去催化作用
5×Tris-甘氨酸电泳缓冲液----- 5×Tris-Glycine buffer (SDS-PAGE电泳缓冲液)
称取15.1gTris,94.0g甘氨酸(glycine),5.0gSDS,用800ml蒸馏水或去离子水溶解,充分搅拌溶解,定容至1000ml,室温保存。
得0.125mol/L Tris-1.25mol/L甘氨酸电极缓冲液。
临用前稀释5倍。
【保存条件】
室温保存
【注意事项】
配制好的电泳液使用时间不宜超过两周。
电泳缓冲液可以回收,回收后可再使用1-2次,但为了取得最佳的电泳效果,应使用新电泳液。
5×SDS-PAGE加样缓冲液----- 5×SDS-PAGE Loading Buffer
【组分浓度】0.25MTris-HCL(pH6.8);
10%(W/V)SDS;
0.5%(W/V) BPB(溴酚蓝);
50%(V/V) 甘油;
量取1.25mL 1MTris-HCL(pH6.8),0.5g SDS,25mg BPB,2.5mL甘油,置于10mL 塑料离心管中,加去离子水溶解后,定容至5mL,小份(0.5mL/份)分装,于室温保存。
使用前将25μL的2-ME加入到每小份中。
加入2-ME的Loading Buffer可在室温下保存一个月左右。
【保存条件】
-20℃保存,至少一年有效。
【注意事项】
SDS-PAGE蛋白上样缓冲液(5X)中含少量DTT和巯基乙醇,有轻微刺激性气味,必须完全溶解后再使用。
摘自Takara 商品目录--实验室常规试剂配制方法
TEMED原液直接使用
考马斯亮蓝R-250染色液
考马斯亮蓝染色脱色液
2、实验步骤
2.1. 制胶
2.1.1组装胶架
将洁净、无水的玻片对齐,形成空腔,插入塑料框的凹槽中,注意箭头向上,并
确保下端平齐。
放于制胶架上夹紧,下端紧贴密封条。
2.1.2 分离胶的配置
混匀后用移液枪将凝胶溶液沿玻棒小心注入到长、短玻璃板间的狭缝内(胶高度距样品模板
梳齿下缘约1cm)。
2.1.2.3 液封
在凝胶表面沿短玻板边缘轻轻加一层水(或者75%乙醇)以隔绝空气,使胶面平整。
静置
约30min观察胶面变化,当看到水与凝固的胶面有折射率不同的界限时,表明胶已完全凝
固,倒掉上层水,并用滤纸吸干残留的水液。
2.1.3 浓缩胶的配置
混匀后用移液枪将凝胶溶液注入到长、短玻璃板间的狭缝内(分离胶上方),轻轻加入样品模
板梳,小心避免气泡的出现。
约30分钟,聚合完全。
2.2 电泳
2.2.1 安装电泳槽
将制备好的凝胶板取下,小心拔下梳子。
两块10%的凝胶板分别插到U形橡胶框的两边凹
形槽中,可往上提起使凝胶板紧贴橡胶。
将装好玻璃板的胶模框平放在仰放的贮槽框上,
其下缘与贮槽框下缘对齐,放入电泳槽内。
倒入1×tris-gly电泳缓冲液。
2.2.2 样品处理
对于蛋白样品直接取80µl的样品,依次加上20µl 5×buffer (加了B-巯基乙醇),混匀。
对于菌体或组织等固体样品,取少量样品加100ul 2×buffer (加了B-巯基乙醇)煮沸10分
钟。
2.2.3 加样
用移液枪取处理过的样品溶液10μl,小心地依次加入到各凝胶凹形样品槽内,marker 加入到其中一个槽内,为区别两块板,marker可加在不同的孔槽中。
2.2.4 电泳
将电泳槽放置电泳仪上,接通电源,正负极对好。
电压调至约150v保持恒压。
待溴酚蓝标记移动到凝胶底部时,关电源,把电泳缓冲液倒回瓶中。
2.2.5 剥离胶
把电泳槽取出,两块板拿下来,用刮片从长短玻片中间翘起,取下。
2.3 染色
放于加有R250染色液的染色皿中,染液漫过胶即可,置于摇床上,转速约为45r/min,时间约1小时,完成后染液倒掉并用水洗掉染液。
2.4 .脱色
取出染色过的胶放于加有脱色液的染缸里,脱色液漫过胶即可,置于摇床上,转速约为45r/min,时间约1小时,本底色脱净,条带清晰可见即可,完成后倒掉脱色液。
2.5 拍照
将脱色后的胶置于透明文件夹中,把胶上面的气泡赶出(用前也可用酒精棉球擦干净文件夹),放到胶片观察灯上,拍照。
SDS-PAGE操作流程——银染
1、固定:25mL醋酸,100mL甲醇,加入125mL超纯水,对凝胶中蛋白质进行固定60min
(固定时间可延长,加一步水洗)。
2、浸泡:75mL甲醇,0.5g无水硫代硫酸钠(强还原性),17g醋酸钠(28.18g三水合醋酸
钠),加入165mL超纯水,(每10mL溶液中加入100uL稀释十倍的甲醛),30min。
3、水洗:用超纯水洗三次,每次10min。
4、银染:0.625g AgNO3溶于250mL超纯水中,20min。
5、水洗:水洗两次,每次1min。
6、显色:6.25g无水NaCO3溶于250mL超纯水中(每25mL溶液加入150uL稀释十倍的甲
醛,边观察边显色,至条带清晰可见)
7、停止:3.65g EDTA溶于250mL超纯水中,10min。
8、水洗:用超纯水洗3次,每次5min。
注:含甲醛的溶液要现配现用,因甲醛在空气中容易挥发而使浓度不足,使用时可按比例扩大,AgNO3溶液可重复使用,甲醛为还原剂,还原银离子为单质银。
SDS-PAGE操作流程——碘染
1、5%(W/V)BaCl2染胶板15min或更长时间。
2、水洗三次,每次1min
3、2.0g KI+1.3g I2+50mL H2O混匀,染胶15min。
(先让KI溶于水,待完全溶解后加入I2)
4、自来水洗至背景色消失,不要长时间水洗。
