练案5第2章第5讲氧化还原反应
高中化学氧化还原反应教案

高中化学氧化还原反应教案教学内容:氧化还原反应的基本概念和应用教学目标:1. 理解氧化还原反应的基本概念和特征;2. 掌握氧化还原反应的基本原理和化学方程式的写法;3. 熟悉氧化还原反应在日常生活和工业生产中的应用。
教学重点和难点:重点:氧化还原反应的基本概念和特征;难点:氧化还原反应的化学方程式的写法。
教学准备:1. 教师准备:教案、教学课件、实验器材、教学实验、教学资源等;2. 学生准备:预习相关知识,带有习题和问题。
教学步骤:一、导入(5分钟)教师引入氧化还原反应的概念,通过实例和图表培养学生对氧化还原反应的兴趣和好奇心。
二、理论讲解(15分钟)1. 讲解氧化还原反应的定义和特点;2. 分析氧化还原反应的过程和特征;3. 解释氧化和还原反应的化学方程式写法。
三、示范实验(20分钟)1. 教师进行氧化还原反应的实验演示;2. 学生观察实验现象,记录数据和观察结果;3. 学生独立设计并完成一个氧化还原反应的实验。
四、练习和讨论(15分钟)1. 学生根据示范实验和讲解内容,完成相关习题;2. 学生之间相互讨论和交流,澄清疑问。
五、总结(5分钟)教师总结本节课的重点内容,强调氧化还原反应的重要性和应用。
六、作业布置(5分钟)布置相关作业,巩固学习内容。
教学反思:本节课的教学内容涵盖了氧化还原反应的基本概念和应用,通过理论讲解和实验示范,帮助学生掌握了氧化还原反应的基本原理和化学方程式写法。
在今后的教学中,需要更加注重学生的实践能力和创新思维,在实验中提升学生的动手能力和实验设计能力。
化学高考总复习专题2 第5讲 氧化还原反应方程式的配平及计算

考点1 微专题5 考点2 做真题•对接高考 课时作业
首页 上页 下页 尾页
微专题 5 四步模型法书写信息型氧化还原方程式
“四步法”突破新情景下氧化还原反应方程式的书写
考点1 微专题5 考点2 做真题•对接高考 课时作业
首页 上页 下页 尾页
微专题 5 四步模型法书写信息型氧化还原方程式
[例 1] 写出 MnO2 在酸性条件下与 NaHSO3 溶液反应的离子方程式。 [分析] 第 1 步:MnO2+HSO- 3 ―→Mn2++SO24- 第 2 步:Mn 降低 2 价,S 升高 2 价,故在 MnO2、HSO- 3 前的系数均为 1: MnO2+HSO- 3 ―→Mn2++SO24- 第 3 步:方程式左边带 1 个负电荷,右边不带电荷,溶液显酸性,故在方程式左边 添加 1 个 H+使电荷守恒:MnO2+HSO- 3 +H+―→Mn2++SO24- 第 4 步:根据原子守恒在方程式右边加 1 个 H2O:MnO2+HSO3-+H+===Mn2++SO42- +H2O
(7)向含碘废液中加入稍过量的 Na2SO3 溶液,将废液中的 I2 还原为 I-,其离子方程 式:___________________________________________________________________
________________________________________________________________________。
考点1 微专题5 考点2 做真题•对接高考1 氧化还原反应方程式的配平
[示例] 配平化学方程式:
H2S+HNO3―→S↓+NO↑+H2O
第一步:标变价,H2-S2+H+N5O3―→S0 ↓++N2O↑+H2O
高中化学中的氧化还原教案

高中化学中的氧化还原教案
目标:
1. 理解氧化还原反应的基本概念;
2. 能够根据物质的氧化态变化判断其是否参与氧化还原反应;
3. 能够编写和平衡氧化还原反应方程式。
教学过程:
一、导入
1. 引入氧化还原反应的概念,解释其在化学中的重要性;
2. 通过简单的例子介绍氧化还原反应中的氧化和还原过程。
二、讲解
1. 讲解氧化和还原的定义和特征;
2. 介绍氧化态的概念和计算方法;
3. 解释氧化还原反应的基本过程;
4. 举例说明氧化还原反应在日常生活和工业生产中的应用。
三、实验
1. 进行一些简单的氧化还原反应实验,观察氧化还原反应的现象;
2. 让学生根据实验结果判断反应中的氧化和还原物质;
3. 引导学生编写和平衡氧化还原反应方程式。
四、练习
1. 分发练习题,让学生在课堂上进行练习;
2. 查漏补缺,帮助学生解决遇到的问题。
五、总结
1. 回顾本堂课的重点内容,强调氧化还原反应的重要性;
2. 引导学生思考氧化还原反应在生活中的应用;
3. 鼓励学生继续学习,深入了解氧化还原反应的更多知识。
六、作业
1. 布置作业,要求学生总结本课内容,写一份氧化还原反应的实验报告;
2. 提醒学生加强对氧化还原反应的理解和掌握。
教案2氧化还原反应
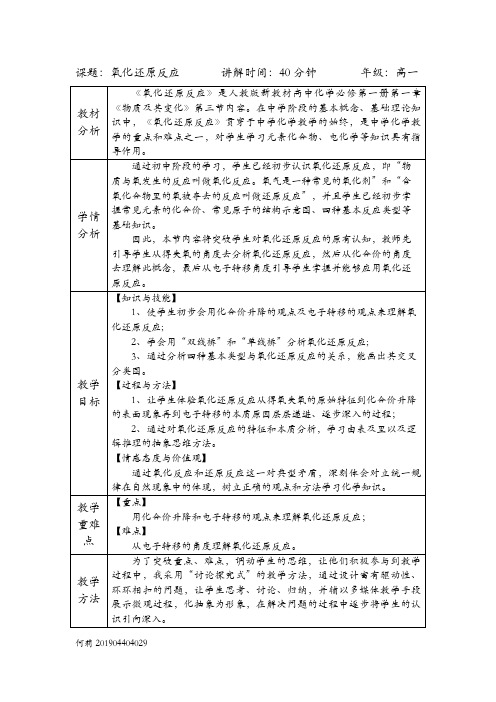
课题:氧化还原反应讲解时间:40分钟年级:高一【提问】下列9个化学反应分别属于什么类型?哪些反应是氧化还原反应?(1)CaO+H2O=Ca(OH)2(2)HCl+NaOH=NaCl+H₂O(3)2Na+Cl2=2NaCl(点燃)(4)Na₂CO₃+CaCl₂=CaCO₃↓+2NaCl(5)Fe+CuSO4=FeSO4+Cu(6)2Cu+O2=2CuO(加热)(7)CaCO3=CaO+CO2↑(高温)(8)H2+CuO=Cu+H2O(加热)(9)Fe2O3+3CO=2Fe+3CO2(高温)(36min)【总结】并非只有得氧、失氧的反应才是氧化还原反应。
有元素化合价变化的反应是氧化还原反应,没有元素化合价变化的反应叫作非氧化还原反应。
(37min)点评并展示学生的归纳结果①化合反应:有单质参加的反应是氧化还原反应。
②分解反应:有单质生成的是氧化还原反应。
③置换反应:全部是氧化还原反应。
④复分解反应:都是非氧化还原反应。
完成相关练习,归纳、总结四种基本反应类型和氧化还原反应的交叉关系。
通过氧化还原反应与初中已学习的四种基本反应类型之间的关系的对比,让学生体会交叉分类法在化学中的应用,培养逻辑思维能力。
课堂小结(40min)请同学起来梳理本堂课的知识点,老师提出要求学生重点掌握的知识点。
积极回忆,归纳整理梳理课堂重难点,帮助学生记忆板书设计第一课时氧化还原反应1、定义:凡是有元素化合价升降的反应都是氧化还原反应。
2、实质:电子的转移(得失或偏移)3、电子转移的表示方法:双线桥法、单线桥法4、氧化还原反应与四种基本反应类型的关系:副板书得氧—氧化反应—化合价升高—失电子;失氧—还原反应—化合价降低—得电子。
“有升必有降”教学反思。
练案[3] 第一章 第3讲 氧化还原反应
![练案[3] 第一章 第3讲 氧化还原反应](https://img.taocdn.com/s3/m/e56f3569ef06eff9aef8941ea76e58fafbb04556.png)
练案[3]第3讲 氧化还原反应A 组 基础必做题1.(2022·福建福州罗源第一中学月考)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag +2H 2S +O 2===2X +2H 2O ,下列说法错误的是( A )A .反应中Ag 和H 2S 均是还原剂B .银针验毒时,空气中氧气得电子C .X 的化学式为Ag 2SD .当有1 mol H 2S 参加反应时,转移2 mol e -[解析] A 项,反应中S 元素的化合价没有变化,H 2S 不是还原剂,错误;B 项,反应中O 元素化合价降低,氧气得电子,正确;C 项,由质量守恒定律可知X 的化学式为Ag 2S ,正确;D 项,当有1 mol H 2S 参加反应时,消耗0.5 mol 氧气,反应转移2 mol e -,正确。
2.(2022·福建厦门湖滨中学期中)工业上用铋酸钠(NaBiO 3)检验溶液中的Mn 2+,该反应的化学方程式为4MnSO 4+10NaBiO 3+14H 2SO 4===4NaMnO 4+5Bi 2(SO 4)3+3Na 2SO 4+,下列说法不正确的是( C )A .“”内的物质为水,配平时系数为14B .若生成1 mol NaMnO 4,则转移5 mol e -C .反应方程式中的硫酸可换为盐酸D .检验溶液中有Mn 2+的现象是溶液变为紫红色[解析] 根据质量守恒判断内的物质为水,配平时H 2O 的系数为14,故A 正确;根据配平后的化学方程式可得,若生成1 mol NaMnO 4,则转移5 mol e -,故B 正确;盐酸可被NaBiO 3氧化,故C 不正确;该反应中Mn 2+转化为MnO -4,则检验溶液中有Mn 2+的现象是溶液变为紫红色,故D 正确。
3.(2021·山东师范大学附属中学第二次考试)某同学用KSCN 溶液和FeCl 2溶液探究Fe 2+的还原性时出现异常现象,实验如下:①②③溶液变红,大约10 s 红色褪去,有气体生成(经检验为O 2)取褪色后溶液,滴加盐酸和溶液变红且不褪色,有气体生成(经检验为O 2),经检验有丁达尔效应溶液变红且不褪色,滴加盐酸和BaCl 2溶液,无白色沉淀,经检验无丁达尔效应BaCl 2溶液,产生白色沉淀下列说法不正确的是( B )A .对比①③,可以判定酸性条件下H 2O 2可以氧化SCN -B .实验②中发生的氧化还原反应有两种C .②中红色溶液中含有Fe(OH)3胶体D .③中发生的氧化还原反应为4Fe 2++O 2+4H +===4Fe 3++2H 2O[解析] ①盐酸酸化的氯化亚铁溶液中滴入KSCN 溶液,pH<1,滴入过氧化氢溶液发生氧化还原反应,生成铁离子,形成红色溶液,大约10 s 红色褪去,铁离子做催化剂,过氧化氢分解有气体生成(经检验为O 2),取褪色后溶液,滴加盐酸和BaCl 2溶液,产生的白色沉淀为硫酸钡,证明SCN -被氧化为硫酸根离子;②盐酸酸化的氯化亚铁溶液中滴入KSCN 溶液,pH =5,滴入过氧化氢溶液,溶液变红且不褪色,说明亚铁离子被氧化为铁离子,铁离子对过氧化氢起到催化作用,有气体生成(经检验为O 2),经检验有丁达尔效应,说明生成了氢氧化铁胶体;③向盐酸酸化的氯化亚铁溶液中滴入KSCN 溶液,pH<1,通入足量氧气,溶液变红且不褪色,说明氧气氧化亚铁离子生成铁离子,滴加盐酸和BaCl 2溶液,无白色沉淀,无硫酸钡生成,经检验无丁达尔效应,无氢氧化铁胶体形成,排除了氧气氧化SCN -的可能。
氧化还原反应完全讲义配习题及答案

氧化还原反应一、氧化还原反应的概念1.氧化还原反应的定义、特征及本质根据反应中物质是否得到氧或失去氧把化学反应分为氧化反应和还原反应。
这一类反应叫氧化还原反应。
特征:反应前后化合价的升降。
(判断依据)实质:发生了电子的得失和偏移2.区分氧化剂,还原剂;氧化反应,还原反应;氧化性,还原性;氧化产物,还原产物等四对基本概念。
总诀:得电价降氧化剂(被还原),失电价升还原剂(被氧化)。
氧化反应和还原反应氧化反应:失电子,化合价升高还原反应:得电子化合价降低氧化剂和还原剂氧化剂:得电子,化合价降低的物质还原剂:失电子,化合价升高的物质氧化产物与还原产物氧化产物:还原剂失电子被氧化形成的产物还原产物:氧化剂得电子被还原形成的产物氧化剂和还原剂氧化剂:能得电子具有氧化性的物质还原剂:能失电子具有还原性的物质例题:1找出下列方程式的氧化剂,还原剂。
( 失高氧得低还 )Al+FeCl3=AlCl3+FeC+HNO3(浓)=CO2+4NO2+2H2OCu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2OKClO3+6HCl=KCl+3Cl2+3H2ONa2O2+2H2O=4NaOH+O22.某元素在化学反应中由化合态变为游离态,则该元素( )A.一定被氧化B.一定被还原C.既可能被氧化,也可能被还原D.以上都不是.3.氧化还原反应的表示方法(1) 双线桥法---表示电子得失结果(2) 单线桥——表示电子转移情况二、氧化还原反应中的规律及应用1.三大守恒关系(物质守恒,电子守恒,化合价守恒)2.价态规律(高价氧低价还,中间价态都可以,同种元素靠拢不交叉)3.反应先后(一种氧化剂和多种还原剂反应时,氧化性强的优先反应。
还原剂也有相同的性质)例题:1.下列变化需要加入氧化剂的是( )A S2-→HS- B.HCO3-→CO2 C.2 Cl-→Cl2 D. Cu2+→Cu2.下列物质不能做还原剂的是( )A. H2SB. Fe2+ C .Fe3+ D. SO23.离子M2O7X-与S2-能在酸性溶液中发生如下反应:aM2O7X-+3S2-+cH+==2M3++eS +fH2O,则M2O7X-中M的化合价为()A、+4B、+5C、+6D、+7三、氧化性,还原性强弱判断的方法判断氧化性强弱的本质是反应物的是电子的难易程度,与电子的多少无关。
新课标氧化还原反应教案

新课标氧化还原反应教案一、教学内容本节课选自《普通高中化学课程标准实验教科书》第四章第四节“氧化还原反应”。
具体内容包括:氧化还原反应的定义,氧化剂与还原剂的概念,电子的转移与化合价变化,以及常见氧化还原反应的实例分析。
二、教学目标1. 理解氧化还原反应的概念,掌握氧化剂与还原剂的定义及判断方法。
2. 学会通过化合价变化分析氧化还原反应,并能正确表示电子的转移过程。
3. 能运用所学知识解释日常生活中的氧化还原现象,提高学生的科学素养。
三、教学难点与重点重点:氧化还原反应的概念、氧化剂与还原剂的判断、化合价变化与电子转移。
难点:化合价变化与电子转移的关系,以及在实际反应中的应用。
四、教具与学具准备教具:PPT、黑板、粉笔、实验器材。
学具:课本、练习本、实验报告单。
五、教学过程1. 实践情景引入(5分钟):通过展示金属腐蚀、燃烧等现象,引导学生思考这些现象背后的共同规律,引出氧化还原反应的概念。
2. 理论讲解(15分钟):详细讲解氧化还原反应的定义、氧化剂与还原剂的概念,以及化合价变化与电子转移的关系。
3. 例题讲解(10分钟):通过典型例题,指导学生如何判断氧化剂与还原剂,以及如何表示电子转移过程。
4. 随堂练习(10分钟):让学生独立完成练习题,巩固所学知识,教师巡回指导。
5. 实验演示(10分钟):进行氧化还原反应的实验,让学生观察实验现象,进一步理解氧化还原反应的本质。
六、板书设计1. 氧化还原反应的定义2. 氧化剂与还原剂的概念及判断方法3. 化合价变化与电子转移4. 氧化还原反应的实例分析七、作业设计1. 作业题目:完成课本第98页第5、6题。
2. 答案:参照课本附录。
八、课后反思及拓展延伸1. 反思:本节课学生对氧化还原反应的概念和氧化剂、还原剂的判断掌握情况较好,但在化合价变化与电子转移的应用方面还有待提高。
2. 拓展延伸:引导学生了解氧化还原反应在生活、生产中的应用,如电池、电镀、燃烧等,提高学生的科学素养。
高中化学氧化还原备课教案

高中化学氧化还原备课教案教学内容:氧化还原反应教学目标:1. 了解氧化还原反应的含义及基本特征;2. 掌握氧化和还原的定义;3. 能够正确写出氧化还原反应的化学方程式;4. 能够运用氧化还原反应解决实际问题。
教学重点:1. 氧化还原反应的概念和基本特征;2. 氧化和还原的定义;3. 氧化还原反应的化学方程式及其平衡;4. 氧化还原反应的应用。
教学难点:1. 氧化还原反应的化学方程式的平衡;2. 氧化还原反应的应用解题。
教学准备:1. 实验器材:试管、试管夹、试剂瓶等;2. 教学资料:化学教材、化学实验手册等;3. 多媒体设备:投影仪、计算机等。
教学过程:一、导入(5分钟)1. 引导学生回顾化学反应的基本概念,引出氧化还原反应的概念;2. 提出问题:什么是氧化还原反应?氧化和还原在反应中如何体现?二、讲解(15分钟)1. 介绍氧化还原反应的定义:氧化是指物质失去电子,还原是指物质获得电子;2. 表示氧化还原反应的化学方程式:氧化剂+还原剂→氧化产物+还原产物;3. 指导学生如何判断氧化还原反应发生;三、实验操作(20分钟)1. 进行实验观察氧化还原反应,学生观察实验现象并记录;2. 学生根据实验结果写出化学方程式,进行讨论和解析;3. 教师指导学生掌握氧化还原反应的化学方程式写法。
四、巩固(10分钟)1. 带领学生回顾学过的知识点,强化理解;2. 学生进行练习,加深对氧化还原反应的理解。
五、作业布置(5分钟)1. 布置作业:完成相关习题,复习氧化还原反应的基本概念;2. 提醒学生预习下节课内容。
教学反思:通过本堂课的教学,学生对氧化还原反应的概念和特点有了初步了解,能够正确写出氧化还原反应的化学方程式,并能够运用所学知识解决实际问题。
下节课将继续深入讲解氧化还原反应的平衡及应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
练案[5]第二章 化学物质及其变化第5讲 氧化还原反应A 组 基础必做题1.(2018·安徽宣城模拟)有人说“五颜六色”形象地说出了化学实验中的颜色变化。
下列颜色变化中是由于发生氧化还原反应导致的是导学号 50812961( A ) ①在氯水中加入NaOH 溶液 ②在FeCl 3溶液中加入铁粉③在品红溶液中通入二氧化硫气体 ④在Na 2CO 3溶液中滴入酚酞 ⑤在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热A .①②⑤B .①②④C .①②③D .①②③④⑤[解析] ①在氯水中加入NaOH 溶液,氯水颜色消失,生成NaCl 、NaClO ,氯元素的化合价变化,发生氧化还原反应;②在FeCl 3溶液中加入铁粉,生成氯化亚铁,颜色由棕黄色变为浅绿色,铁元素的化合价变化,发生氧化还原反应;③在品红溶液中通入二氧化硫气体,品红溶液褪色,发生化合反应,没有元素化合价的变化;④在Na 2CO 3溶液中滴入酚酞,没有元素化合价的变化;⑤在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热,生成砖红色沉淀,铜、碳元素的化合价变化,发生氧化还原反应。
2.(2017·福建南安一中月考)如图为二氧化锰的有关转化关系图,有关说法中不正确的是导学号 50812962( B )A .反应①~⑥均属于氧化还原反应B .反应①中氧化剂与还原剂的物质的量之比为1∶4C .相同条件下生成等量的O 2,反应③和④转移的电子数之比为1∶2D .反应②中Cl 2既是氧化剂又是还原剂[解析] 反应①~⑥中都有元素化合价发生变化,均属于氧化还原反应,故A 正确;反应①:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O ,氧化剂与还原剂的物质的量之比为1∶2,故B 错误;每生成1 mol O 2,反应③中转移2 mol 电子,反应④中转移4 mol 电子,则相同条件下生成等量的O 2,反应③和④转移的电子数之比为1∶2,故C 正确;反应②2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O ,Cl 2既是氧化剂又是还原剂,故D 正确。
3.(2017·安徽一模)乙醇与酸性K 2Cr 2O 7溶液混合可发生反应:Cr 2O 2-7+C 2H 5OH +H +―→Cr 3++CH 3COOH +H 2O(未配平)。
下列叙述不正确的是导学号 50812963( D ) A .Cr 2O 2-7中Cr 元素的化合价为+6 B .氧化产物为CH 3COOHC .K 2Cr 2O 7溶液常用硫酸酸化D .1 mol C 2H 5OH 发生上述反应转移2 mol e -[解析] 本题考查氧化还原反应知识。
Cr 2O 2-7中Cr 元素的化合价为+6,A 项正确;该反应中C 2H 5OH 作还原剂,发生氧化反应,得到氧化产物CH 3COOH ,B 项正确;Cr 2O 2-7具有氧化性,可与HCl 发生氧化还原反应,HNO 3本身具有强氧化性,会干扰Cr 2O 2-7的反应,故常用硫酸酸化,C 项正确;1 mol C 2H 5OH 发生该反应,转移4 mol e -,D 项错误。
4.(2017·江西南昌调研)下列化学反应属于区域3的是导学号 50812964( C )A .4Fe(OH)2+O 2+2H 2O===4Fe(OH)3B .2NaHCO 3=====△Na 2CO 3+H 2O +CO 2↑C .4NH 3+5O 2=====催化剂△4NO +6H 2O D .Zn +H 2SO 4===ZnSO 4+H 2↑[解析] A 项中的反应是化合反应,且有元素化合价的变化,属于区域1;B 项中的反应是分解反应,但元素化合价没有变化,属于除区域2外的分解反应;C 项中的反应是不属于4种基本反应类型的氧化还原反应,属于区域3;D 项中的反应是置换反应,属于区域4。
5.(2018·湖北八校联考)白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:(1)P 4+10CuSO 4+16H 2O===10Cu +4H 3PO 4+10H 2SO 4(2)11P 4+60CuSO 4+96H 20===20Cu 3P +24H 3PO 4+60H 2SO 4下列有关说法中错误的是导学号50812965(D)A.在上述两个反应中,水既不是氧化剂也不是还原剂B.在上述两个反应中,氧化产物都是H3PO4C.在反应(2)中,当有5 mol CuSO4发生反应时,共转移10 mol电子D.在上述两个反应中,氧化剂都只有硫酸铜[解析]两个反应中,反应物水中H、O元素的化合价均没有变化,故水既不是氧化剂也不是还原剂,A项说法正确;两个反应中,H3PO4中的磷元素均来自单质磷,且两个反应中化合价升高的元素均只有磷元素,B项说法正确;反应(2)中部分磷元素的化合价升高,部分磷元素的化合价降低,铜元素的化合价降低,故氧化剂不只有硫酸铜,还有P4,反应(2)中当有60 mol CuSO4参加反应时,转移120 mol电子,C项说法正确,D项说法错误。
6.(2018·湖南衡阳期中)用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮肤上的高锰酸钾,其离子方程式为(未配平):MnO-4+C2O2-4+H+―→CO2↑+Mn2++□。
关于此反应的叙述中正确的是导学号50812966(C)A.该反应右边方框内的产物是OH-B.配平该反应后,H+的化学计量数是8C.该反应中氧化产物是CO2D.该反应电子转移总数是5e-[解析]A项,酸性条件下,不可能生成OH-,应生成HO,故A错误;B项,反应2中MnO-4→Mn2+,锰元素化合价由+7价降低为+2价。
H2C2O4→CO2,碳元素化合价由+3价升高为+4价,结合电荷守恒、原子守恒配平离子方程式为:2MnO-4+5C2O2-4+16H+===10CO2↑+2Mn2++8H2O,H+的化学计量数是16,故B错误;C项,反应中H2C2O4→CO2,CO2是氧化产物,故C正确;D项错误。
7.(2017·福建漳州八校联考)三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。
下列有关该反应的说法正确的是导学号50812967(D)A.NF3是氧化剂,H2O是还原剂B.还原剂与氧化剂的物质的量之比为2 : 1C.若生成0.2 mol HNO3,则转移0.2 mol电子D.NF3在潮湿的空气中泄漏会产生红棕色气体[解析]A.只有N元素的化合价发生变化,NF既是氧化剂又是还原剂,故A错误;3B.NF3生成NO,被还原,NF3生成HNO3,被氧化,还原剂与氧化剂的物质的量之比为1∶2,故B错误;C.生成0.2 mol HNO3,转移的电子的物质的量为0.2mol×(5-3)=0.4 mol,故C错误;D.生成的NO易与空气中氧气反应生成红棕色气体二氧化氮,D正确;故选D。
8.(2018·吉林长春模拟)以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜晶体,其过程如图所示。
导学号50812968回答下列问题:(1)配平在滤液(Ⅲ)中发生反应的化学方程式:__4__NO x+__2__H2O+__(5-2x)__O2===__4__HNO3(2)写出制取硫酸铜的总反应方程式:__2Cu+O2+2H2SO4===2CuSO4+2H2O__。
(3)在上述生产过程中,可循环使用的物质是__HNO3__。
[解析]NO中氮元素的化合价可以看成+2x,利用化合价升降相等即可配平滤液(Ⅲ)x中发生反应的化学方程式:4NO x+2H2O+(5-2x)O2===4HNO3;从流程图结合反应方程式可以看出,在反应中HNO3是循环利用的物质,因此总的反应实质上是Cu和O2、H2SO4反应生成CuSO4,据此写出化学方程式。
B组能力提升题9.(2017·黑龙江、吉林两省六校期中)已知在相同条件下进行下列反应:①Cl2+2KBr===2KCl+Br2;②KClO3+6HCl===3Cl2↑+KCl+3H2O;③2KBrO3+Cl2===Br2+2KClO3。
下列说法正确的是导学号50812969(D)A.上述三个反应都有单质生成,所以都是置换反应B.反应①和反应③中均生成Br2,溴元素发生的变化相同C.反应②中被氧化与被还原物质的物质的量之比为6∶1D.③中1 mol还原剂反应,则氧化剂得到电子的物质的量为10 mol[解析]反应②中生成物有单质,但反应物没有单质,所以不是置换反应,故A错误;反应①Cl2+2KBr===2KCl+Br2中溴元素的化合价由-1价升高为0价,被氧化,反应③2KBrO 3+Cl 2===Br 2+2KClO 3中溴元素的化合价由+5价降低为0价,被还原,故B 错误;反应②KClO 3+6HCl===3Cl 2↑+KCl +3H 2O 中,氧化剂是KClO 3,还原剂是HCl ,但只有56的HCl 被氧化,所以还原剂和氧化剂的物质的量之比是5∶1,故C 错误;反应③中还原剂是Cl 2,氧化剂是KBrO 3,该反应中1 mol 还原剂反应,则氧化剂得到电子的物质的量为2×(5-0)mol =10 mol ,故D 正确。
10.(2018·福建诏安一模)Cu 2S 与一定浓度的HNO 3反应,生成Cu(NO 3)2、CuSO 4、NO 2、NO 和H 2O ,当NO 2和NO 的物质的量之比为2∶1时,实际参加反应的Cu 2S 与HNO 3的物质的量之比为导学号 50812970( B )A .1∶10B .1∶8C .1∶6D .1∶5[解析] 由题给反应物和生成物的情况看出,1 mol Cu 2S 共失去电子10 mol ,而生成2 mol NO 2和1 mol NO 共得到5 mol 电子,由得失电子守恒及原子守恒即可配平该反应的化学方程式:Cu 2S +8HNO 3===Cu(NO 3)2+CuSO 4+4NO 2↑+2NO ↑+4H 2O ,所以n (Cu 2S)∶n (HNO 3)=1∶8。
11.(2017·河北冀州中学模拟)聚合硫酸铁可用于水的净化,其化学式可表示为[Fe a (OH)b (SO 4)c ]m 。
取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。
向一份溶液中加入足量的BaCl 2溶液,得到白色沉淀1.747 5 g 。
取另一份溶液,先将Fe 3+还原为Fe 2+(还原剂不是Fe ,且加入的还原剂恰好将Fe 3+还原为Fe 2+),再用0.020 00 mol /LK 2Cr 2O 7标准溶液滴定至终点,消耗K 2Cr 2O 7标准溶液50.00 mL 。
