广东省国家食品药品监督管理局认定药物临床试验机构汇总表(至2017年12月)
国家食品药品监管总局通告2016年第112号——关于发布临床试验数据

国家食品药品监管总局通告2016年第112号——关于发布临床试验数据管理工作技术指南的通告【法规类别】药品管理【发文字号】国家食品药品监管总局通告2016年第112号【发布部门】国家食品药品监督管理总局【发布日期】2016.07.27【实施日期】2016.07.27【时效性】现行有效【效力级别】部门规范性文件国家食品药品监管总局通告(2016年第112号)关于发布临床试验数据管理工作技术指南的通告为确保临床试验数据的真实、准确、完整和可靠,强化药物临床研究的自律性和规范性,从源头上保证药品技术审评的质量,国家食品药品监督管理总局组织制定了《临床试验数据管理工作技术指南》,现予发布,自本通告发布之日起执行。
特此通告。
附件:临床试验数据管理工作技术指南国家食品药品监管总局2016年7月27日附件临床试验数据管理工作技术指南一、概述临床试验数据质量是评价临床试验结果的基础。
为了确保临床试验结果的准确可靠、科学可信,国际社会和世界各国都纷纷出台了一系列的法规、规定和指导原则,用以规范临床试验数据管理的整个流程。
同时,现代新药临床试验的发展和科学技术的不断进步,特别是计算机、网络的发展又为临床试验及其数据管理的规范化提供了新的技术支持,也推动了各国政府和国际社会积极探索临床试验及数据管理新的规范化模式。
(一)国内临床试验数据管理现状我国的《药物临床试验质量管理规范》(Good Clinical Practice,GCP)对临床试验数据管理提出了一些原则要求,但关于具体的数据管理操作的法规和技术规定目前还处于空白。
由于缺乏配套的技术指导原则,我国在药物临床试验数据管理方面的规范化程度不高,临床试验数据管理质量良莠不齐,进而影响到新药有效性和安全性的客观科学评价。
此外,国内临床试验中电子化数据管理系统的开发和应用尚处于起步阶段,临床试验的数据管理模式大多基于纸质病例报告表(Case Report Form,CRF)的数据采集阶段,电子化数据采集与数据管理系统应用有待推广和普及。
2017年CFDA政策汇总

2017.02.23 2017.03.09 2017.03.16 2017.03.17 2017.03.29 2017.04.05
2017.04.06
2017.04.07
ห้องสมุดไป่ตู้
总局办公厅关于落实《国务院第三批取消中央指定地方实 施行政许可事项的决定》有关工作的通知
总局办公厅再次公开征求《关于药物临床试验数据核查有 关问题处理意见的公告(修改稿)》意见 《医疗器械标准管理办法》(国家食品药品监督管理总局 2017.04.26 令第33号) 《医疗器械标准管理办法》解读 总局办公厅关于实施《医疗器械召回管理办法》有关事项 2017.04.28 的通知 总局关于征求《关于鼓励药品医疗器械创新实施药品医疗 2017.05.11 器械全生命周期管理的相关政策》(征求意见稿)意见的 公告(2017年第54号) 总局关于征求《关于鼓励药品医疗器械创新改革临床试验 2017.05.11 管理的相关政策》(征求意见稿)意见的公告(2017年 总局关于征求《关于鼓励药品医疗器械创新加快新药医疗 2017.05.11 器械上市审评审批的相关政策》(征求意见稿)意见的公 告(2017年第52号) 总局关于征求《关于鼓励药品医疗器械创新保护创新者权 2017.05.12 益的相关政策(征求意见稿)》意见的公告(2017年第 总局关于发布成人用药数据外推至儿科人群的技术指导原 2017.05.18 则的通告(2017年第79号) 关于征求《免于进行临床试验的第二类体外诊断试剂目录 2017.05.24 (第二批)》和《免于进行临床试验的体外诊断试剂临床 评价资料基本要求》意见的函 总局关于药物临床试验数据核查有关问题处理意见的公告 2017.05.24 (2017年第63号) 2017.05.31 《化学药品注册分类改革工作方案》政策解读(三) 2017.04.10 2017.06.02 2017.06.21 总局关于发布第二批过度重复药品提示信息的公告 (2017年第70号)
药物临床试验机构资格认定办法

《药物临床试验机构资格认定办法》是一份2004年颁布的法律法规。
中文名药物临床试验机构资格认定办法根据中华人民共和国药品管理法申请标准已取得医疗机构执业许可效力级别法律施行时间2004年3月1日负责单位由国家食品药品监督管理局办法全文第一章总则第一条为加强药物临床试验的监督管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本办法。
第二条药物临床试验机构资格认定(以下简称“资格认定”)是指资格认定管理部门依照法定要求对申请承担药物临床试验的医疗机构所具备的药物临床试验条件,药物临床试验机构的组织管理、研究人员、设备设施、管理制度、标准操作规程等进行系统评价,作出其是否具有承担药物临床试验资格决定的过程。
第三条国家食品药品监督管理局与卫生部共同制定和修订《药物临床试验机构资格认定办法》。
第四条国家食品药品监督管理局主管全国资格认定管理工作。
卫生部在其职责范围内负责资格认定管理的有关工作。
第五条省、自治区、直辖市食品药品监督管理局(药品监督管理局)和卫生厅(局)负责本行政区域内资格认定的初审和形式审查及日常监督管理工作。
第二章资格认定的申请第六条申请资格认定的医疗机构应具备以下条件:(一)已取得医疗机构执业许可;(二)申请资格认定的专业应与医疗机构执业许可诊疗科目一致;(三)具有与药物临床试验相适应的设备设施;(四)具有与承担药物临床试验相适应的诊疗技术能力;(五)具有与承担药物临床试验相适应的床位数和受试者人数;(六)具有承担药物临床试验的组织管理机构和人员;(七)具有能够承担药物临床试验的研究人员并经过药物临床试验技术与法规的培训;(八)具有药物临床试验管理制度和标准操作规程;(九)具有防范和处理药物临床试验中突发事件的管理机制和措施。
第七条申请资格认定的医疗机构应根据所具备的药物临床试验的技术要求及设施条件和专业特长,申请相应的药物临床试验专业资格认定。
第八条申请资格认定的医疗机构,应填写《药物临床试验机构资格认定申请表》(附件1),并向所在地省级卫生厅(局)报送资格认定申请的书面资料及电子软盘。
国家食品药品监督管理局药物临床试验机构资格认定公告清单
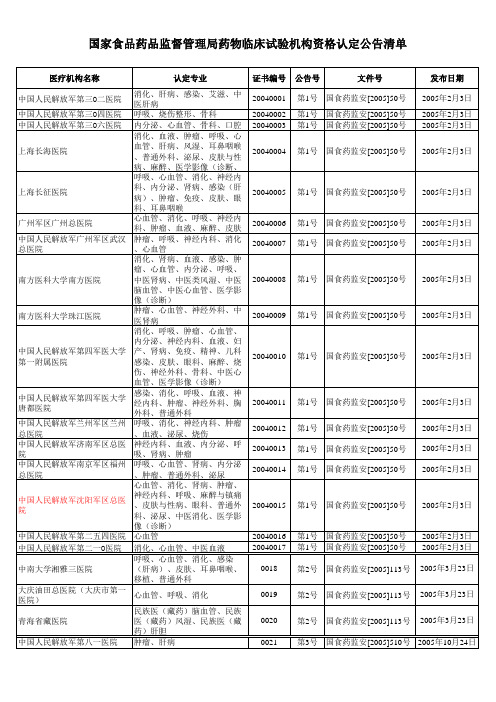
0048 0049 0050 0051 0052
第3号 国食药监安[2005]510号 2005年10月24日 第3号 国食药监安[2005]510号 2005年10月24日 第3号 国食药监安[2005]510号 2005年10月24日 第3号 国食药监安[2005]510号 2005年10月24日 第3号 国食药监安[2005]510号 2005年10月24日
消化、内分泌、肾病、呼吸、 中国人民解放军成都军区总医 血液、肿瘤、心血管、泌尿、 院 神经外科、普通外科 戒毒、心血管、消化、呼吸、 成都军区昆明总医院 肾病、肿瘤、神经内科、骨科 、中医骨科 呼吸、心血管、肿瘤、消化、 中国人民解放军第三军医大学 肾病、神经内科、血液、麻醉 第二附属医院 、皮肤、泌尿 耳鼻咽喉、创伤、呼吸、妇产 中国人民解放军第三军医大学 、心血管、眼科、神经内科、 第三附属医院 肿瘤、消化 首都医科大学附属北京佑安医 肝病、感染、艾滋、中医肝病 院 中医呼吸、中医心血管、中医 江苏省中西医结合医院 肿瘤、中医妇产、中医脑病、 中医骨伤、中医泌尿 中国人民解放军白求恩国际和 心血管、消化、肾病、内分泌 平医院 、神经内科、肿瘤 心血管、神经内科、感染(肝 病)、肿瘤、妇产、血液、消 化、呼吸、风湿、麻醉、神经 苏州大学附属第一医院 外科、皮肤、眼科、泌尿、骨 科、普通外科、医学影像(诊 断、治疗、核医学) 中国人民解放军北京军区总医 消化、神经内科、肝病、内分 院 泌、肿瘤、心血管、呼吸、骨 中国人民解放军济南军区第四 创伤 O一医院 山东省皮肤病医院 皮肤 河北省精神卫生中心(河北省 精神 第六人民医院) 杭州市第六人民医院 肝病、感染 中国人民解放军第八十五医院 肝病 中山大学附属第五医院 肾病、肿瘤 浙江大学医学院附属邵逸夫医 心血管、呼吸、消化、肿瘤、 院 神经内科、医学影像(诊断) 广州市第八人民医院 艾滋、肝病 神经内科、心血管、呼吸、消 包头市中心医院 化、普通外科 心血管、血液、呼吸、神经内 山东大学第二医院 科、神经外科、骨科、泌尿、 精神、心血管、神经内科、消 同济大学附属同济医院 化、内分泌、骨科、耳鼻咽喉 心血管、消化、呼吸、神经内 科、内分泌、感染、妇产、肿 南京市第一医院 瘤、泌尿、骨科、普通外科、 耳鼻咽喉、眼科、麻醉、医学 影像(诊断、核医学) 浙江省肿瘤医院 肿瘤 广西壮族自治区肿瘤医院 肿瘤 精神、神经内科、肝病、消化 昆明医学院第一附属医院 、心血管、呼吸、骨科、皮肤 、中医风湿 神经内科、消化、内分泌、心 昆明医学院第二附属医院 血管、呼吸、血液、妇产、儿 科呼吸、烧伤、皮肤 心血管、肿瘤、消化、神经内 浙江医院 科、内分泌
国家食品药品监督管理局关于印发药物临床试验伦理审查工作指导原则的通知

国家食品药品监督管理局关于印发药物临床试验伦理审查工作指导原则的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2010.11.02•【文号】国食药监注[2010]436号•【施行日期】2010.11.02•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于印发药物临床试验伦理审查工作指导原则的通知(国食药监注[2010]436号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),总后卫生部药品监督管理局:为加强药物临床试验的质量管理和受试者的保护,规范和指导伦理委员会的药物临床试验伦理审查工作,提高药物临床试验伦理审查工作质量,根据《药品注册管理办法》和《药物临床试验质量管理规范》的有关规定,国家局组织制定了《药物临床试验伦理审查工作指导原则》,现予印发。
请你局指导本辖区内药物临床试验机构学习,参照执行。
附件:药物临床试验伦理审查工作指导原则起草说明国家食品药品监督管理局二○一○年十一月二日附件:《药物临床试验伦理审查工作指导原则》起草说明为了加强对伦理委员会药物临床试验伦理审查工作的指导,规范伦理委员会的药物临床试验伦理审查工作,切实保护受试者的安全和权益。
国家局组织制定了《药物临床试验伦理审查工作指导原则》(以下简称《指导原则》),旨在促进国内药物临床试验伦理审查能力的提高,充分发挥伦理委员会在保护受试者安全和权益中的作用,进一步规范药物临床试验的研究行为。
一、背景和必要性药物临床试验应遵循两大基本原则--研究的科学性和伦理的合理性。
伦理委员会审查是保护受试者的安全与权益、保证药物临床试验伦理合理性的重要措施之一,在药物临床研究中发挥重要作用。
针对涉及人体的生物医学研究和临床试验,世界各国发布了伦理指南与法规性文件。
美国专门针对生物医学研究受试者保护颁布了联邦法规文件,其中21CFR56阐述伦理委员会审查,并在美国健康与人类事业部专门成立了人体受试者保护办公室;欧洲2005年新颁布的临床研究指令相对以往法规重要的变更之一,是临床研究需要同时获得药政管理部门和伦理委员会的批准方可进行研究;新加坡1997年出台涉及人体受试者研究的伦理指南。
药物临床试验工作程序

药物临床试验工作程序1.资料备案:申办方提供下列资料到我院临床试验机构办公室备案,由机构办公室对试验资料进行形式审查:1.1国家食品药品监督管理局药物临床试验批件。
1.2 试验初步方案。
1.3 研究者手册及临床前研究资料。
1.4 知情同意书样本。
1.5 试验用药物的药检报告。
疫苗类制品、血液制品、国家食品药品监督管理局规定的其他生物制品以及境外生产的临床试验药物必须有由国家食品药品监督管理局指定的药品检验所出具的药检报告复印件。
1.6 病例报告表样本。
1.7 如为多中心试验的参加单位,需有各参加研究单位及主要研究者名单,组长单位伦理委员会批件。
1.8 申办方的经营许可证、生产许可证、工商营业执照。
1.9 所提交材料真实性的自我保证声明。
包括所提交材料的清单、生产企业承担法律责任的承诺。
1.10 其他相关资料。
2.受理立项:2.1机构办对通过形式审查的试验予以登记立项,并根据药物的临床作用确定专业科室承接。
2.2 机构办向专业科室发出“药物临床试验审批受理通知”。
2.3 科室根据具体情况考虑是否承接。
2.4 由科主任指定主要研究者,并将“承担药物临床试验回执”以及主要研究者简历和GCP培训合格证书复印件交机构办。
2.5 机构办审定主要研究者资格后,向伦理委员会发出“药物临床试验审批受理通知”。
3.伦理审批3.1主要研究者与申办方共同修订临床试验方案和知情同意书,并讨论试验协议。
已定稿的试验方案需由双方共同签名。
3.2 主要研究者认可试验资料后,将以下资料提交医院的医学伦理委员会审批:3.2.1主要研究者及科主任签名的“开展本临床试验的申请”。
3.2.2机构办发给伦理委员会的“药物临床试验审批受理通知”。
3.2.3上述“1.资料备案”的全套资料。
3.2.4本研究授权职责表和研究组成员简历(含职称、专业、试验分工、是否经过GCP培训等),获得GCP培训证书的研究者需提供证书复印件。
4.签订协议4.1 经医学伦理委员会批准后(必须将“伦理委员会接受临床试验回执”和伦理委员会批件原件交回机构办公室),申办方将主要研究者与申办方签字认可的试验方案,研究者简历及分工(“3.2.4”的内容)及其他已修订的试验资料到机构办公室备案,同时将临床试验协议样本交机构办公室审核。
药物临床试验机构资格认定申请流程

药物临床试验机构资格认定国家食品药品监督管理局 2008年05月05日发布一、项目名称:药物临床试验机构资格认定二、许可内容:药物临床试验机构资格认定(药物临床试验机构资格认定、军队所属医疗机构资格认定)三、设定的实施许可的法律依据:《药品管理法》四、收费:不收费五、许可数量:本许可事项无数量限制六、申请人提交资料目录:1、《药物临床试验机构资格认定申请表》;2、省级卫生行政部门审核意见;3、省级食品药品监督管理部门审核意见;4、医疗机构执业许可证复印件;5、医疗机构概况;6、防范和处理医疗中受试者损害及突发事件的预案;7、药物临床试验机构组织管理机构与负责人情况;8、药物临床试验管理制度和标准操作规程情况;9、申请资格认定的专业科室及人员情况;10、申请资格认定的专业科室年均门诊诊疗及入出院人次;11、参加药物临床试验技术要求和相关法规的培训情况;12、机构主要仪器设备情况;13、实施药物临床试验工作情况(近3年完成药物临床试验情况);14、其他有关资料。
七、对申报资料的要求:(一)对申报资料的一般要求:1、申报资料应使用A4规格纸打印或复印,内容完整、规范、清楚,不得涂改;2、资料份数:书面资料和电子软盘各两份。
(二)对申报资料的具体要求:1、《药物临床试验机构资格认定申请表》的封面应加盖医疗机构公章;2、医疗机构执业许可证应在有效期内;3、相关省级卫生行政部门和省级食品药品监督管理部门应签署意见和加盖公章;4、若申请单位为原国家临床试验基地,申报资料中应有省级食品药品监督管理部门对其老专业进行复核检查的书面报告;5、Ⅰ期临床试验研究室按照新专业受理;6、申请的专业名称应根据卫生部治疗目录要求相对规范(1)中医、儿科专业应进一步细分,如(中医呼吸、小儿呼吸等)。
(2)急诊、老年病等专业较特殊,应具体限定到具体研究方向,如急诊中毒专业,老年性痴呆专业等)。
(3)医学影像专业分为诊断、治疗、核医学三个方向,受理时应明确。
药物临床试验 药物管理·广东共识(2020年版)

药物临床试验药物管理•广东共识(2020年版)广东省药学会(2020年8月1日发布)关键词:药物临床试验;药物管理;共识中图分类号:R95 文献标志码:A文章编号:1674-229X(2020) 12-0822-04Doi :10.12048/j.issn.1674-229X.2020.12.006Consensus of Expert on Drug Management of Drug Clinical Trial in Guangdong (Version 2020) GuangDong Pharmaceutical AssociationKEY W ORDS :drug clinical trial;drug management;consensus更新说明试验用药品作为整个药物临床试验的核心,其管理贯穿于临床试验全过程,加强试验用药品的管理对保 护受试者安全和确保试验结果科学可靠起着至关重要的作用。
为规范药物临床试验中试验用药品的管理,广东省药学会药物临床试验专业委员会分别于2016年1月和2020年4月印发了《药物临床试验药物管理•广东共识》供同行参考。
随着2019年新版《药品管理法》的执行,2020年《药品注册管理办法》及《药物临床试验质量管理规范》的颁布,共识的相关内容亟待更新一 致。
本次更新主要遵循新法规,进一步明确各方职责,力求继续系统、完整和保持共识的生命力,使其成为一 份与时俱进的行业共识。
希望各机构在实践中不断探索和总结,对本共识存在的不足之处持续完善。
本次修订得到专委会各位专家的指导以及各位同行在共识征求意见期间提供宝贵意见,在此谨向大家 致以诚挚谢意!共识撰写小组2020年7月7日试验用药品指由申办者负责提供用于临床试验 的试验药物、对照药品。
临床试验中涉及的标准品、免费用于临床试验的应急处理药品和基础治疗药品 管理也可以参考本共识。
1目的试验用药品管理是临床试验管理中的关键环节 之一,对试验的质量和受试者的安全有举足轻重的 作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗机构所在
地医疗机构名称广东
爱尔眼科医院广东
东莞市人民医院广东
东莞市人民医院广东
佛山市第一人民医院(中山大学附属佛山医院)广东
佛山市顺德区第一人民医院广东
佛山市中医院广东
广东省第二人民医院广东
广东省第二中医院广东
广东省第二中医院广东
广东省妇幼保健院(广东省妇产医院、广东省儿童医院)广东
广东省人民医院广东
广东省人民医院广东
广东省中医院(广州中医药大学第二附属医院)广东
广东药科大学附属第一医院(广东药学院附属第一医院)广东
广东医学院附属医院广东
广西医科大学第一附属医院广东
广州军区广州总医院广东
广州市第八人民医院广东
广州市第一人民医院广东
广州市第一人民医院广东
广州市番禺区中心医院(广州市番禺区人民医院)广东
广州市番禺区中心医院(广州市番禺区人民医院)广东
广州市妇女儿童医疗中心广东
广州市红十字会医院广东
广州市精神病医院(广州市脑科医院)广东
广州市中医医院广东
广州医科大学附属第五医院广东
广州医科大学附属第五医院广东广州医学院第二附属医院
广东省国家食品药品监督管理
根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试
临床试验机构资格并颁发证书,现予以公告。
至2017年12月
广东广州医学院第二附属医院
广东广州医学院第三附属医院
广东广州医学院第一附属医院
广东广州医学院第一附属医院
广东广州中医药大学第一附属医院
广东广州中医药大学第一附属医院
广东广州中医药大学附属骨伤科医院
广东暨南大学附属第一医院
广东江门市五邑中医院
广东南方医科大学第三附属医院
广东南方医科大学南方医院
广东南方医科大学南方医院
广东南方医科大学珠江医院
广东汕头大学-香港中文大学联合汕头国际眼科中
心
广东汕头大学医学院第二附属医院
广东汕头大学医学院第二附属医院
广东汕头大学医学院第一附属医院
广东汕头大学医学院附属肿瘤医院
广东汕头市中心医院
广东深圳市第三人民医院
广东深圳市东湖医院
广东深圳市儿童医院
广东深圳市康宁医院
广东深圳市人民医院(暨南大学第二临床医学院)广东深圳市中医院
广东香港大学深圳医院
广东中山大学附属第二医院
广东中山大学附属第六医院
广东中山大学附属第三医院
广东中山大学附属第三医院
广东中山大学附属第五医院
广东中山大学附属第五医院
广东中山大学附属第一医院
广东中山大学附属第一医院
广东中山大学附属第一医院广东中山大学孙逸仙纪念医院
广东中山大学中山眼科中心(中山大学附属眼科医
院)
广东中山大学肿瘤防治中心
广东中山大学肿瘤防治中心
广东中山市博爱医院(中山市妇幼保健院)广东中山市人民医院(中山大学附属中山医院)广东中山市中医院
广东省广州医学院附属肿瘤医院
广东省深圳市第二人民医院
督管理局认定药物临床试验机构汇总表(至2017年12月)临床试验机构资格认定办法(试行)》,经资料审查和现场检查,具备承担药物
月
认定专业
眼科
心血管、神经内科
肿瘤、内分泌、呼吸内科、医学影像(诊断)、肾病、消化内
科、放射治疗
感染、肾病、神经内科、呼吸、肿瘤、心血管、消化
心血管内科、肾病、内分泌、呼吸内科、肿瘤、血液内科、感
染性疾病、普通外科
中医神经内科、中医肿瘤、中医内分泌、中医骨伤
血液病、风湿与临床免疫、肿瘤内科、神经内科、心血管内科
、器官移植
中医心血管、中医神经内科、中医消化、中医骨伤
中医呼吸、中医内分泌、中医肿瘤、中医妇科
妇科、产科、小儿呼吸、中医儿科、普通外科、麻醉、生殖健
康与不孕症
心血管、肿瘤、皮肤、风湿免疫、呼吸、内分泌、血液、烧伤
、肾病、医学影像(诊断)专业
神经内科、消化、麻醉、耳鼻喉科、小儿呼吸、感染、精神、
普通外科
中医眼科、中医消化、中医外科、中医骨科、中医妇科、中医
肛肠、中医皮肤、中医心血管、中医神经内科、中医呼吸、中
医肾病、中医内分泌、中医肿瘤、中医耳鼻咽喉、中医儿科、
心血管内科、消化内科、神经内科、免疫、老年病、肾病、口
腔、肿瘤、康复医学、中医老年病
肾病、心血管、肿瘤、消化、神经内科、普通外科、呼吸、皮
肤、麻醉
心血管、内分泌、消化、血液、皮肤、耳鼻咽喉、感染、神经
内科、肾病、烧伤、呼吸、骨科、泌尿、眼科专业
心血管、消化、呼吸、神经内科、肿瘤、血液、麻醉、皮肤
艾滋、肝病
消化、呼吸、心血管、肾病、血液、神经内科、妇产、麻醉、
皮肤、烧伤、骨科、泌尿
普外科、神经外科、耳鼻喉、风湿免疫、内分泌、老年心血管
、重症医学、肿瘤、精神心理、疼痛、中医脑血管
妇科、呼吸、消化、心血管、血液、肿瘤
内分泌
妇科、小儿呼吸、小儿消化、小儿普通外科、小儿胸心外科、
小儿血液、小儿神经病学
心血管、内分泌、消化、呼吸、烧伤
精神、戒毒
中医肿瘤、中医心血管、中医神经内科、中医消化、中医骨科
肿瘤、康复医学、神经内科、呼吸内科、肾内科
泌尿外科
神经内科、心血管、风湿免疫、麻醉、医学影像(诊断)
血液、呼吸、普通外科、神经外科、泌尿、皮肤、变态反应妇产、骨科、心血管、肿瘤、神经内科、呼吸、内分泌、肾病
呼吸
心血管、神经内科、妇产、胸外科、普通外科、肿瘤、泌尿、
中医呼吸
中医骨科、中医消化、中医外科、中医肛肠、中医妇科、中医眼科、中医肿瘤、中医心血管、中医呼吸、中医肾病、中医耳
鼻咽喉、中医神经内科
中医内分泌、中医风湿病、中医血液、中医儿科
中医骨伤
心血管、神经内科、皮肤、精神、麻醉、眼科、呼吸、肾病、
普通外科、骨科、妇科、产科
中医心血管、中医神经内科、中医肾病、中医消化、中医妇科骨科、妇科、内分泌、神经内科、心血管内科、肾病、免疫、呼吸内科、血液内科、泌尿外科、医学影像(诊断)、普通外麻醉、重症医学、神经内科、普通外科、神经外科、骨科、妇
科、产科、小儿血液
消化、肾病、血液、感染、肿瘤、心血管、内分泌、呼吸、中医肾病、中医类风湿、中医脑血管、中医心血管、医学影像肿瘤、心血管、神经外科、中医肾病
眼科
骨科、内分泌、妇产、泌尿
儿科(小儿血液病、小儿肾病、小儿消化、小儿呼吸、小儿神经病、小儿心脏病)、小儿外科(小儿普通外科、小儿泌尿外科)、心血管内科、消化内科、肝病、肾病、神经外科、血液内科、普通外科、急诊医学(中毒和创伤急救)、胸外、烧伤
肿瘤、呼吸、风湿、普通外科
肿瘤
心血管、肿瘤
肝病
肝病、结核、艾滋
小儿血液、小儿呼吸、小儿神经病学、中医儿科、医学影像
(超声诊断)
精神卫生
呼吸、心血管、肿瘤、感染(肝炎)、神经内科、肾病
中医肝病、中医肾病、中医心血管、中医内分泌、中医骨伤、中医消化、中医神经内科、中医妇科
呼吸内科、肾病、肿瘤、生殖健康与不孕症、骨科、消化内科
、皮肤
心血管、内分泌、消化、皮肤、妇产、骨科、呼吸、神经内科
、医学影像(诊断)
普通外科(胃肠、结直肠)、肿瘤、中西医结合(肛肠)、消
化、生殖健康与不孕症
感染、风湿免疫、呼吸、妇产、神经内科、内分泌、精神、皮
肤专业
麻醉
肾病、肿瘤
心血管、内分泌、呼吸、血液、消化、传染
心血管、血液、消化、烧伤、心血管外科、移植(肾移植)、麻醉、骨科、内分泌、肾病、神经内科、呼吸
普通外科
耳鼻咽喉、泌尿外科、皮肤、肿瘤、超声波(超声诊断、超声介入)、急诊医学(急性感染、创伤、休克复苏)、妇产、小儿血液与肿瘤、小儿内分泌、重症医学、风湿、核医学、医学影像(介入)、肝移植、神经外科
普通外科(乳腺、肝胆)、泌尿、血液、耳鼻喉、眼科、麻醉
、肾病、风湿
眼科
肿瘤
医学影像(CT诊断、核医学、超声诊断)、麻醉
妇科、生殖健康与不孕症、计划生育、肿瘤、小儿肾病、小儿
神经病、小儿呼吸、小儿消化
心血管、肿瘤、神经内科、血液、内分泌、妇科、骨科、普通
外科
中医心血管内科、中医消化内科、中医呼吸内科、中医肾病、中医肿瘤、中医骨伤、中医耳鼻咽喉、中医肛肠、中医泌尿外科、中医神经内科、中医眼科、中医急诊
肿瘤
血液、内分泌、肾病学、呼吸、骨科、神经外科、泌尿、普通外科(甲乳、肝胆)、烧伤科、胸外科、中西医结合、重症医
2017年12月)
担药物临床试验的条件,同意认定其具有药物
证书
697
0380
793
0270
689
831
696
0063
0276
691
0174
0338
0134
695
0352
0163
20040006
0038
0052
796
687
833
390
0248
0281
0136
692
832
0067
517 0344 0094
0277 0137
794 0065
446
686
693
525 20040008
20040009 0056 0092
792 0054 0051 0083
798 0105
556
564 0291 0314
694 0223
406 0181
497 0036
536 0215
434
797 562
0082 0188 795 690 0327
688 424 431。
