同位素地球化学和分馏效应(氢氧同位素)
03 第三章(氢氧同位素)

---------------------------------------------------------------最新资料推荐------------------------------------------------------03 第三章(氢氧同位素)Theory, Technique and Application of Environmental Isotopes第三章氢氧稳定同位素Theory, Technique and Application of Environmental Isotopes1/ 49轻元素稳定同位素的基本特点1.原子量低,一般小于36。
2.同位素相对质量差大。
3.形成共价键,键性与同位素分馏有很大关系。
4.化学价可变,在化合价变化过程中会发生大的同位素分馏5.小丰度同位素的相对丰度为千分之几到百分之几,便于精确测定。
研究稳定同位素的组成特征、变化机理、分馏原理并应用它们作为地球化学示踪剂研究各种地质过程Theory, Technique and Application of Environmental Isotopes---------------------------------------------------------------最新资料推荐------------------------------------------------------ Outline1.氢氧同位素概述 2.天然水的氢氧同位素组成及分布特征3.氢氧稳定同位素的应用Theory, Technique and Application of Environmental Isotopes3/ 491 概述氢氧同位素的主要地球化学性质氢和氧是自然界中的两种主要元素,它们以单质和化合物的形式遍布全球。
水是一种极为重要的氢氧化合物。
氢和氧是生物圈的最基本的物质组成,是各种生物赖以生存的基础。
氢氧同位素分馏机理及其在地学中的应用

氢氧同位素分馏机理及其在地学中的应用
氢氧同位素,即水分子中的一部分原子核,因为其由氢原子和氧原子组成,通
常被称为氢氧。
氢氧同位素具有由氢原子和氧原子组成的两种稳定同位素,分别为氘(D)和氚(T)。
T和D的物理性质和化学性质几乎完全一致,但是它们具有偏
振性,氢氧同位素基本上具有可从水中分离的特性。
氢氧同位素分馏是通过将氢氧同位素与沉淀或离子固形物中的氢氧同位素不同
之处,使其于趋势和反应强度的不同,实现氢氧同位素的分馏。
氢氧同位素分馏受气体净化设备(如填料,柱式储存系统或反渗透模块)影响,该设备可以释放油气,并将氢氧同位素从气体中分离出来。
这种分离技术可以使氢氧同位素从接近自然的状态中进行选择性的提取。
在地学研究中,水的氢氧同位素分馏是研究流域源,特别是流域和质量循环过
程中重要作用的重要研究手段。
氢氧同位素被广泛用于地学研究,从流域水循环研究中推断水源,估算污染物迁移的距离以及研究特定区域的潮汐循环等。
氢氧同位素的分馏还可以为古气候研究提供参考,所以它还被广泛用于古气候研究。
因此,氢氧同位素的分馏在地学研究中发挥着重要的作用,有助于我们更好地
了解地壳结构、古气候变化以及物质迁移路径。
未来,氢氧同位素分馏将继续被广泛应用于地学研究领域,为地学研究和教育提供重要技术支持。
考点预测--同位素地球化学

《同位素地球化学》考点预测一名词解释1-同位素地球化学是研究自然体系(地球和宇宙体)中同位素的形成、丰度以及在自然作用过程中分馏和衰变规律的科学。
它是地球化学的一个重要分支学科。
2-同位素是指具有相同质子数和不同中子数的一组核素,它们在元素周期表中占据同一个位置。
3-核素是由一定数量的质子和中子构成的原子核,具有质量、电荷、能量、放射性和丰度五种主要性质。
4-放射性衰变不稳定核素自发地发射出粒子和能量而转变为另一种核素的过程。
5--同位素稀释法在已知量的“稀释剂”和未知量的元素样品的混合物中确定样品中某元素的同位素含量的方法。
6--同位素分馏由于同位素质量不同,在各种地球化学过程中会引起同位素在不同化合物和物相中的丰度变异,该现象称~ 7--分馏系数表示同位素分馏作用的大小:α= 某元素同位素在A物质中的比值/某元素同位素在B物质中的比值。
(其中A、B可以是相同的化合物,亦可以是不同化合物)二填空题1--同位素地球化学在研究地球或宇宙体的成因与演化(主要包括地质时钟、地球热源、壳幔相互作用及壳幔演化、成岩成矿作用、构造作用及古气候和古环境记录等)方面提供了重要有价值的信息,为地球科学从定性观察到定量的发展作出了重要贡献。
2--同位素地球化学研究领域(分支科学):放射性、稳定、天体同位素地球化学。
3--引起同位素成分变化的主要过程放射性同位素衰变、同位素分馏。
4--同位素地球化学研究思路和方法(思维方式):理解基本原理、熟悉研究步骤、了解仪器设备、实现主动思维。
5--放射性衰变的结果是原子核的质子数和/或中子数发生变化,从某一元素的同位素转变为另一元素的同位素,直至最终转变成为稳定的同位素。
6--同位素地质年代学定年的基本公式:D=D0+N(eλt-1) ;为满足高精度的同位素质谱分析的要求,以同一子体元素的稳定同位素作为参照(记为Ds),可得:D/Ds=D0/Ds+N(eλt-1)/Ds 。
同位素分析是将样品元素的各同位素丰度以比值形式进行测量。
第五章4同位素地球化学基础
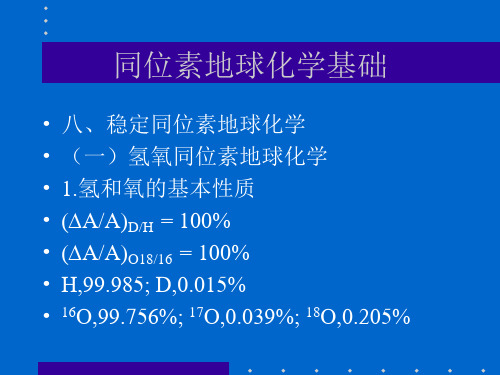
• • • • • • • 八、稳定同位素地球化学 (一)氢氧同位素地球化学 1.氢和氧的基本性质 (A/A)D/H = 100% (A/A)O18/16 = 100% H,99.985; D,0.015% 16O,99.756%; 17O,0.039%; 18O,0.205%
同位素地球化学基础
(2)岩浆岩 (3)沉积岩:最高的18O和变化范围 (4)变质岩:
同位素地球化学基础
4.研究意义 (1)矿物和矿床的成因 根据矿物及其中的流体包裹体研究
同位素地球化学基础
(2)花岗岩成因 • S型花岗岩:18O %o = 10-12.5 • (Sediment type) • I型花岗岩:18O %o = 7.5-9.5 • (Igneous type) (3)古环境(纬度)的确定
同位素地球化学基础
• • • • • • 2.自然界中氢和氧的分馏作用 (1)蒸发-凝聚分馏 H216Ol + H218OV <=> H218Ol + H216OV 25oC下 a(18O) = (18O/16O) l / (18O/16O)V =1.0029
同位素地球化学基础
• H216Ol + D216OV <=> D216Ol + H216OV • a( D) = (D/H)l /(D/H)V = 1.071 • D 与 18O之间有如下关系: • D = 8 18O + 10
同位素地球化学基础
4.研究意义 (1)矿床物质来源(沉积岩,岩浆岩?) (2)硫同位素地碳同位素地球化学 • 自然界中的碳同位素 • 12C = 98.89% • 13C = 1.11% 1. 碳同位素的分馏反应:
地球化学中的同位素地球化学研究

地球化学中的同位素地球化学研究同位素地球化学研究作为地球化学的一个重要分支,已经成为了地球科学领域的一个重要组成部分。
同位素地球化学研究的历史可以追溯到上世纪四十年代,当时科学家在分析地球中的不同元素时发现了这些元素存在着同位素的现象。
这些同位素具有与其它元素不同的质量,因而可以用来对自然界和人造体系中不同的地理化学过程进行精确的追踪、探究和解释。
同位素地球化学研究的应用范围非常广泛,包括了地质学、气象学、海洋学、生物学、环境科学和矿物学等多个领域,并且已经被证明是一种非常有力的工具。
而可以被用来研究的同位素也非常的丰富,可以包括氢、碳、氮、氧、硫、铅、锶等几乎所有的元素。
同位素地球化学研究的主要优势在于其可以检测地球环境中非常低的含量元素,这些元素往往难以用其它手段进行检测,但是却是准确推断地球化学过程的关键。
此外,同位素地球化学研究可以提供非常准确的时间信息,这对于研究地球历史上的重大事件,如气候变化、环境演变和地球内部动力学的活动,都是非常重要的。
同位素地球化学研究的一个重要方面是利用同位素比例来研究元素的循环、转换和分配。
在地球化学的过程中,元素的比例和同位素的分布往往扮演着非常重要的角色。
相反,另外一个常用的方法是以研究大气中的同位素比例为基础来研究地球历史上的气候变化和环境演变。
以氢、碳、氧同位素为例,我们可以利用它们之间的比例来进行一系列的研究。
氢同位素的变化可以反映出水的来源和循环,如研究降水中氢同位素的变化可以推断季风气候的演变。
碳同位素的变化可以反映出生物和地球化学条件的变化,如气候条件、极端环境的来源、生物地位变化等,我们可以利用其在环境恶化过程 ("酸雨"和温室气体排放)中的反应和修复过程 ("碳汇"和吸收)中的变化来分析全球碳循环的变化趋势。
氧同位素可以反映出水的循环和气候变化趋势,我们可以在深海沉积中通过氧同位素来进行气候的变化。
第一部分 同位素地球化学原理解析

2. 同位素分馏效应
由质子数目相同,中子数目不同的同位素原子或化合物之间物 理化学性质上的差异(热力学性质,运动及反应速度上的差异等), 使得它们在自然界的各种地球化学作用过程中产生了同位素分馏。 根据分馏的性质和原因分为两大类型:热力学同位素分馏和动力学 同位素分馏。产生同位素分馏的各种作用统称为同位素分馏效应 (isotope fractionation efect)。
同位素分馏(isotope fractionation):是指一系统中,某元素的各 种同位素原子或分子以不同的比值分配到各种物质或物相中的作用。
同位素分馏系数(α)(isotope fractionation coefficient):某一组分 中两种同位素丰度之比与另一组分的相应比值之商。
AB
自然界物质的同位素交换,可以通过扩散、溶解-重新沉淀和微区化 学置换等方式来实现。交换可以在均质体系中进行,也可以在非均质体系 中进行。在均质体系中同位素交换速度快且容易接近或达到同位素平衡。
同位素交换及热力学同位素分馏特点
(1)同位素交换反应(isotope exchange reaction) :
(3)Slap(Standard light Antarctic Precipitation)南极原始的粒雪样品。 δD SMOW = -55.50‰,δ18O SMOW = -428.5±1‰; D/H=(89.02±0.05)×10-6, 18O/16O=1882.766×10-6。
(4) PDB(Pee Dee Belemnite)美国卡罗莱纳州白垩系Pee Dee组中拟箭 石制成的CO2,作为碳氧同位素标准。 PDB的 δ13CPDB=0‰,δ18OPDB=0‰;13C/12C=1123.72 ×10-6, 18O/16O=415.80 ×10-5。
地球化学-复习总结3

(3)沉积岩 • 87Sr来源: • 陆源碎屑物 • 自生矿物(海绿石等)
• 5.锶同位素地球化学演化
三、U-Th-Pb法定年和铅同位素地球化学 四、钾-氩法定年 五、钐-钕法年龄测定 六、14C法 重点:原理
八、稳定同位素地球化学 (一)氢氧同位素地球化学 (二)硫同位素地球化学 (三)碳同位素地球化学 重点:1.原理;2.不同环境的稳定同位素特 征(如轻、重同位素各趋向于分布在何 环境或地质体中,为什么?)
(2)衰变定律 母体和子体概念: • 母体:放射性核素 • 子体:衰变产物
• 衰变定律表达式: -dN/dt = N (原子数目与时间的关系) dN / N = - dt, 左边由No积分到N, 右边由0 积分到 t, 得: ln N - ln No = - t N/No = e - t 或 N = No e - t
(4)同位素组成和分馏的表示方法 • 绝对比值 如大气中18O与国际通用标准样品之间的偏 差 • 绝对比值差: • R(样品) - R(标准样品) • 相对比值差: • (%o)= [(R样品- R标准)/ R标准]1000
如:
当t=0时,D* =0, 经过t时间后有: D* = No - N • 代入上式得: • D* = N( e t - 1)
(3)同位素年代学的技术和条件 • 准确测定衰变常数 • 高精度、高灵敏度的测定技术 • 样品的封闭性:例如,对于岩浆作用可 选择耐高温的岩石或矿物,如锆石等, 含水矿物中,角闪石的封闭性好于云母
第五章 同位素地球化学基础
一、同位素分馏和衰变反应 1.同位素的定义和分类 定义:质量数不同,质子数相同的核素为 同位素。
2.同位素分馏作用 A/A >=10% • 物理分馏(质量分馏): 同位素质量差异引起的分馏称为物理分馏。 例如:蒸发-凝聚:蒸汽富H2O,水体富D2O 扩散:高层富14N,低层富15N 等
3-同位素地球化学和分馏效应(氢氧同位素)

T=300-600º C T>700º C
阿尔伯达
b)平衡条件下定量水/岩比值
W/Rclosed= (δ18Orockfinal - δ18Orockinitial )/ (δ18Ofluidinitial- δ18Ofluidfinal )
Gregory et al. (1986 )和 Criss et al. ( 1987 )基于 δ -δ 图 解原理,给出了开放体系中同位素交换反映的表达式。它们的结 果可以直接转化为δ -△表达式。下面简要讨论的多相封闭体系中 的同位素交换特征,根据质量守衡定律,有: δ x=x1δ 1+x2δ 2+x3δ 3+x4δ 4+xiδ i 式中的x1+x2+x3+x4+xi+=1,若x1 和x3相与x2 和 x4、xi更富重同 位素,且δ 1>x2≥δ 3>δ 4>xiδ i, 则条斜率符号相反的相关直线 仍可以表达为: δ 1=α 2•△12+b δ 2= -α •△12+b 在平衡条件下,△ij只是温度的函数。在封闭体系下,两组共 生矿物的彝族同位素数据在δ -△图解上呈两个斜率相反的线性展 布。对应的同位素分馏即为平衡条件下的分馏值。因此得到有用 的同位素温度,斜率的大小指示了体系中两种矿物的相对比值, 高温端的最大最小δ 指指示两种流体的同位素组成,因此可以用 来推断热液的源区。一般是从高到低温的演化过程。不遵从同位 素平衡和质量守恒的岩石、矿床形成体系肯定是同位素非平衡或 开放体系(混合体系),在非平衡条件下,△ij受动力学同位素效 应的制约,在δ -△图解上直线的截距和斜率之取决于质量守恒。
2)δ -△图解 在δ -△图解中,以每种矿物的δ 值为y轴,以矿物对的△值为x 轴,两条直线斜率的夹角为ɑ(图1-1);一般地对于两项(1相、 2相)封闭体系而言,其总的同位素组成为: δ s=x1•δ 1+ x2•δ 2(s代表体系;xi 代表摩尔数,且x1+x2=1) 在δ -△空间中,根据质量守恒定律,上是可以变成: δ 1= x2•△12+δ s δ 2= -x2•△12+δ s(△12=δ 1+δ 2) 上式满足条件是:①体系中相1与相2之比保持平衡;②δs保持常 数;③相1 与相 2 之间的同位素交换是引起体系内各相 δi 变化的唯 一原因。当体系中只有两种物质时,即x1+x2=1,则以上条件均能 满足。然而,在自然界的大多数体系中,一般至少两相以上的物 相;显然,上述给出的两相的封闭体系或开放体系都不适合。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2 稳定同位素的标准值、实测值和成矿过程的
同位素效应
(1)氢-氧同位素 1)标准值(SMOW) The the Hydrogen isotope on Natural abundance: 2D: 1H=0.0156:99.9844; δDi(Pre mil)=[( D/H)i- (D/H )Standard]/ (D/H)Standard]×1000 Standard: Standard Mean ocean Water(SMOW) (D/H)SMOW=1.050(D/H)NBS-1 NBS-1:National Bureau of Sandards(USA)
一、稳定同位素
1. 轻元素的稳定同位素表示方法和分馏
(1)表示方法 目前,以发现稳定同位素数目大约300多种,而
目前应用在 矿床研究领域的稳定同位素主要有S、 H-O、C-O、N、Si、Li、B等。通常用轻稳定同位素 的组成来表示(δ),这是因为: ①原子量小,同位素组成变化大; ②同一元素的轻同位素与重同位素的质量差大,如⊿21H/1H=100%、⊿13-12C/12C=8.3%、⊿18-16O/16O=12.5%、 ⊿34-32S/32S=6.3%; ③它们形成的化学键以强共价键为特征; ④碳、硫、氮具有可变的电价; ⑤同一元素的轻同位素比重同位素具有更高的丰度。
Gregory et al.(1986)和Criss et al.(1987)基于δ-δ图 解原理,给出了开放体系中同位素交换反映的表达式。它们的结 果可以直接转化为δ-△表达式。下面简要讨论的多相封闭体系中 的同位素交换特征,根据质量守衡定律,有:
δx=x1δ1+x2δ2+x3δ3+x4δ4+xiδi
离图中的直线,说明体系为非平衡分馏(图1-1)。
δA-δB 图解判断平衡分馏(实心园)和非平衡分馏(空心圆);四相
封闭体系中共存相1和2的和δ-△理论图解(Zheng1992)
δGrA-eδgoBr空y等间(非1平98衡6)同对位δ素A交-δ换B图的解数的学理模论型基,础将进同行位了素充交分换研速究率,以建准一立阶了 微分方程表示,并将此方程应用于封闭的无水体系、水-岩作用体系用体 系和流体流动的开放体系。给出的动力学分馏关系式:
reference water(Standards Mean Ocean Water)
And oxygen isotope on Natural abundance(in air oxygen):
18O: 17O: 16O=0.1995:0.0375:99.763
δ18Oi(Pre
mil)=[(18O/16O)i-
1)δ-δ图解
热力学平衡条件下,两种矿物A、B之间的同位素分 馏系数ɑA-B可由下式定义:
103lnɑA-B≈δA-δB(两种物质的同位素比值‰) 或 δA=δB+103lnɑA-B
当K≈1时,直线(等温线)上的成分点(两矿物) 基本达到平衡,因此能够从截距103lnɑA-B计算出平衡
温度,而103lnɑA-B可以 通过理论计算、实验测定或经验估计获得;若数据点偏
(4) 矿物之间的同位素平衡
共生的热液矿物之间是否达到并保留了他们 形成史的同位素平衡,是应用矿物队的前提和 基础。这里一方面根据同位素平衡温度与地质 产状之间的吻合性来验证同位素的平衡;另一 方面也可以应用δ-Δ和δ-δ图解,依据同位 素数据本身判断同位素平衡δ-Δ和δ-δ图解 是稳定同位素数据解释上最常用的两种图解, δ-δ图解用于开放体系,δ-Δ图解用于封闭 体系;他们的共同优点是在于可以考虑温度和 质量守恒。
δA=mδB-b 式中的截距b为两种物相A、B在一定条件下(给定交换介质的相对速率常数
KA/KB、同位素交换分数F和温度t)同位素交换速率常数比值函数的。斜 率m的定义为:
m=[1-(1-F)Ka/Kx]/F
式中F为同位素交换分数,定义为:
F=(ɑ0-ɑAC)/(ɑ0-ɑBC) ɑ0代表A、B之间的初始分馏系数,ɑC代表平衡分馏系数。由于0≤F≤1, 在为常数的矿物对图解中直线的斜率m恒为正数。显然,当F=1,说明体 系为平衡分馏,因此在δ-δ 得到斜率为1的等温线。
3)同位素分馏系数与温度关系 a)Equilibrium
氧同位素
氢同位素
石
英
与
矿
磁铁矿
金红石
物
镁橄榄石
之
石榴石
间
透辉石 钙长石
的
白云母
氧
钠长石
同
方解石
位
素
大气水线 Epstein,1970
低纬度水
Taylor,1974 Sheppard,1977
高纬度水
阿尔伯达
密歇根州
T=300-600ºC T>700ºC
因此,我们能够应用这个图解中斜率为1的线性关系检验同位素交换 的平衡状态。与此同时,还表明如果物相之间的同位素交换要达到平衡,
需要的是开放体系,或是准开放体系。
2)δ-△图解
在δ-△图解中,以每种矿物的δ值为y轴,以矿物对的△值为x 轴,两条直线斜率的夹角为ɑ(图1-1);一般地对于两项(1相、 2相)封闭体系而言,其总的同位素组成为:
根据S.Epstein (1976)H.P.Taylor (1976)的研究, 矿物中的18O(重同位素)的递减序列为:石英、白云母 (硬石膏)→碱性长石、方解石、文石→白榴石→白 云母、霞石→钙长石(蓝晶石)→蓝闪石(十字市) →硬柱石→石榴石、普通辉石、闪石→黑云母→橄榄 石(榍石)→绿泥石→钛铁矿(金红石)→磁铁矿 (赤铁矿)→烧绿石。
(3) 同位素交换反应
从同位素角度来讲,可分三种类型: 1)岐化反应:同一元素在同种化学分子之间;
如:H2O+D2O=2HDO 2)简单同位素交换反应:含有同一元素的不同分子之
间进行的同位素交换; H2O(液)+D2O(气)= HDO(液)+H2(气) 3)复杂同位素交换反应:不同的分子之间进行的同位
式中的x1+x2+x3+x4+xi+=1,若x1和x3相与x2和 x4、xi更富重同 位素,且δ1>x2≥δ3>δ4>xiδi,则条斜率符号相反的相关直线 仍可以表达为:
δ1=α2•△12+b δ2= -α•△12+b 生矿在物平的衡彝条族件同下位,素△数ij只据是在温δ度-△的图函解数上。呈在两封个闭斜体率系相下反,的两线组性共展 布。对应的同位素分馏即为平衡条件下的分馏值。因此得到有用 的同位素温度,斜率的大小指示了体系中两种矿物的相对比值, 高温端的最大最小δ指指示两种流体的同位素组成,因此可以用 来推断热液的源区。一般是从高到低温的演化过程。不遵从同位 素平衡和质量守恒的岩石、矿床形成体系肯定是同位素非平衡或 开应放的体制系约(,混在合δ体-△系图)解,上在直非线平的衡截条距件和下斜,率△之ij取受决动于力质学量同守位恒素。效
引言
自从T.J.Thmoson(1913)发现氢的氖元素、 F.W.Aston利用他制造的第一台质谱计先后测定氖、氩、 氪等71种元素中共发现202种同位素后;同位素地球化学 被广泛应用于各科学领域的研究。首先用于地质方面研究 是A.Holmes(1932,1937,1938),他运用钙、铅同位素 进行了矿石的成因探讨;在H.C.Urey(1947)论述了同位 素物质热力学性质基础上,S. Epstein(1953)、H.P. Taylor(1967,1968)、R.N. Clayton(1961,1963)、 H. Ohmoto(1972)及J.R.O‘Neil(1968,1977)等进行 了广泛地质应用研究,逐渐使得同位素地球化学在地质上 的应用趋于成熟。目前,在地学领域已被广泛地探讨各种 地质体成因和形成环境,当前广泛用于矿床研究领域的同 位素有S、H-O、C-O、N、Si、Li、B、Sr-Nd、Re-Os、普 通Pb及Ar、He等同位素比值和同位素体系。可分为:稳定 同位素、稳定同位素和稀有气体同位素。
素交换。 NH3+HDO= NH2D+ H2O; NH3+ D2O= NH2D+ HDO; 地质上主要应用简单的同位素交换反应,并符合: 1)同位素交换是可逆的;2)反映前后分子数和化学组
分不变;3)主要是分子键的断开和重新组合; 4)恒温状态下进行;5)没有热熵的变化。 但是,设是理想状态。
b)平衡条件下定量水/岩比值 W/Rclosed= (δ18Orockfinal - δ18Orockinitial )/ (δ18Ofluidinitial- δ18Ofluidfinal )
开放体系
封闭体系
Groud water,400-450ºC,
δ18Owaterfinal =-12 δDwaterfinal =-120
ɑA,B=RA/RB, R表示两种物质的同位素比值,当ɑA,B>1表示物质A 比物质B富集重同位素,相反表示物质A比物质B富 集氢同位素。
ɑA-B=(1+δA/1000)/(/1(010+0δ+δB/B1)000)= (1000+δA) 由此可见,只要测定一个体系内两种物质的δ
值,便可以根据上是求得两种物质间的同位素分馏
花岗闪长岩
δ18Ofeldsfinal =8-9; δDBiotitefinal =-65
weight
Volume ir and H.Taubald.Hytrogen and oxygen isotope evidence for fluid-rock interactions in the menderes massif, western turkey. Int J Earth Science 2001,89:812-821
(18O/16O)Standard]×1000
