2008年全国化学竞赛初赛模拟试题及答案1
2008年全国高中化学竞赛初赛备用试题答案
第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
在343K 时能将一氧化碳定量地转变为CO 2,这一性质被用于合成氨厂中测定合成气中CO 的含量。
1—1写出X 的化学式及其热分解反应方程式1—2写出X 与CO 反应的化学方程式,并简述X 能用于测定合成气中CO 含量的理由。
1—3画出X 的分子结构示意图1—4 X 的水溶液中添加盐酸并将逸出的气体通入氯仿中得化合物Y ,Y 是制造一种灭火器的原料,写出上述两步反应的化学方程式。
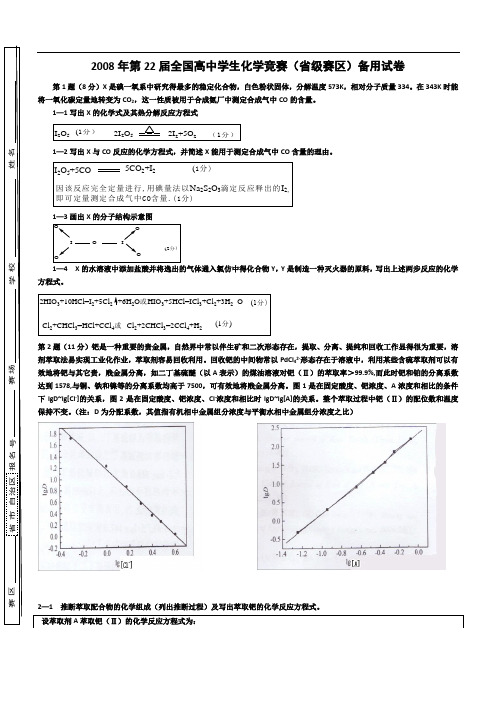
第2题(11分)钯是一种重要的贵金属,自然界中常以伴生矿和二次形态存在,提取、分离、提纯和回收工作显得很为重要,溶剂萃取法易实现工业化作业,萃取剂容易回收利用。
回收钯的中间物常以PdCl 42-形态存在于溶液中,利用某些含硫萃取剂可以有效地将钯与其它贵,贱金属分离,如二丁基硫醚(以A表示)的煤油溶液对钯(Ⅱ)的萃取率>99.9%,而此时钯和铂的分离系数达到1578,与铜、铁和镍等的分离系数均高于7500,可有效地将贱金属分离。
图1是在固定酸度、钯浓度、A 浓度和相比的条件下lgD~lg[Cl -]的关系,图2是在固定酸度、钯浓度、Cl -浓度和相比时lgD~lg[A]的关系。
整个萃取过程中钯(Ⅱ)的配位数和温度保持不变。
(注:D 为分配系数,其值指有机相中金属组分浓度与平衡水相中金属组分浓度之比)姓名学校赛场报名号赛区省市自治区第3题(11分)3—1 PCl 3和NH 3在CHCl 3中于195K 时生成A 物质,A 不稳定在稍高温度下即分解为一种不溶于液氨、氯仿等溶剂中的黄色无定形物质B ,B 中含磷68.89%。
写出生成A 的化学反应方程式和A 分解为B 的反应方程式,画出B 的路易斯结构式。
3—2 POCl 3和NH 3作用生成一种易溶于水的晶体C ,它在NaOH 溶液中水解浓缩得化合物D ,D 于483K 时置于真空条件下发生缩合反应生成E ,数天后将E 在水中重结晶得到含十个结晶水的盐类F ,F 和十水焦磷酸钠是等电子体。
2008年全国高中学生化学竞赛试题及参考答案

中国化学会第22届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则题号 1 2 3 4 5 6 7 8 9 10 11 总分满分14 5 4 10 5 11 14 9 7 11 10 100第1题(14分)1-1EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA二钠盐水溶液中浓度最高的阴离子的结构简式。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb2+ 表示铅)。
(3)能否用EDTA二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?1-2氨和三氧化硫反应得到一种晶体,熔点205o C,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
1-3 Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na2[Fe(CN)5(NO)]是鉴定S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
1-4 CaSO4• 2H2O微溶于水,但在HNO3 ( 1 mol L-1)、HClO4 ( 1 mol L-1)中可溶。
写出能够解释CaSO4在酸中溶解的反应方程式。
1-5取质量相等的2份PbSO4 (难溶物)粉末,分别加入HNO3 ( 3 mol L-1) 和HClO4 ( 3 mol L-1),充分混合,PbSO4在HNO3 能全溶,而在HClO4中不能全溶。
简要解释PbSO4在HNO3中溶解的原因。
1-6X和Y在周期表中相邻。
CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。
确定B、C、D、E、X和Y。
第2题 (5分) 化合物X 是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300万吨的氯酸钠是生产X 的原料,92%用于生产X —在酸性水溶液中用盐酸、二氧化硫或草酸还原。
2008年全国化学竞赛初赛模拟试题及答案1

2008年全国化学竞赛初赛(国初)模拟试题(时间:3小时 满分:100分)第一题(8分)BeCl 2是正交晶型,1250℃,纯的BeCl 2可在氮气中升华,形成细长柔软的白色石棉状针形物。
BeCl 2有着异乎寻常的解离性,受压后易沿一个方向裂成纤维。
已知BeCl 2中Be 的杂化方式与SiO 2无异。
1.画出BeCl 2的结构示意图;2.BeCl 2结构的化学键基础是什么。
第二题(6分) 阅读下表:2r m 解的全过程来看,MgCl 2的熵变因素对溶解过程不利,而NaCl 的熵变因素对溶解过程有利。
解释原因。
第三题(8分)相对论效应与电子钻穿效应使得第六周期的元素有这一定的特殊性质,如:Au的氧化态可为-1。
化学家合成了一种“合金”,最简式为LaFe4Au12,晶胞由八个小立方体构成,每个小立方体中有一个由Au构成的八面体,Au位于小立方体的面心,Fe位于小立方体中心,La的堆积方式为bcp(体心立方堆积)。
1.画出该“合金”的晶胞;2.该物质是否为合金,解释原因。
第四题(12分)一定条件下乙炔、EtOH、过氧乙酸混合后生成一中间产物A,随后又得一多元醚B,已知A中各元素化学环境相同,A也属于醚类,含一六元环。
1.画出A、B的结构;2.写出A分解的反应;3.预测A的用途,解释原因第五题(12分)将某溶液A分为等量两份,一份以10A的电流电解完全,用去六小时整,阴极析出26.79g,向另一份中加入M-COOH生成难溶物S,已知M为一五元芳香杂环,S中含N:8.34%,S:28.58%,求:1.写出S的化学式;2.画出M的可能结构,并指出最稳定的一种。
第六题(8分)Ti(IV)在水中的形式为[Ti(OH)2(H2O)4]2+,在TiOSO4·H2O晶体中不存在简单的TiO2+,是以―Ti―O―Ti―长链存在。
在Ti(IV)中加入H2O2,pH<1时,为[Ti(O2)(OH)(H2O)4]+单核配离子,呈红色;pH=1~3时,为Ti2O52+,为双核配离子,呈橙黄色。
2008年全国化学竞赛初赛国初模拟试题

2008年全国化学竞赛初赛(国初)模拟试题(时间:3小时满分:100分)第i题(8分)近年来对于三价铜的研究日益深入,特别随着是钇钡铜氧化物的研究的深入,三价铜化合物越来越受到化学家的重视。
起初发现的三价铜化合物为离子化合物,三价铜存在于阴离子[Cu2O6]6-中,目前所发现的三价铜配合物都是四配位的。
1.画出[Cu2O6]6-的结构;2.一种三价铜的稀土化合物LaCuO3的晶格属立方晶系,氧离子位于棱心,阳离子各占据氧离子所构成的空隙中,其中三价铜离子的配位数是La(Ⅲ)的一半,试画出LaCuO3的晶胞。
第ii题(4分)物理中的安培右手螺旋定则可以用以快捷的判断电流方向,然而判断手性碳原子R、S构型也有一个右手螺旋定则,分析其判断方法,并用一段不超过100字的文字表述出来。
第iii题(8分)今年是关于钠-硫电池研究工作40周年,1966年美国福特汽车公司的J.T.Kummer和N.Weber 首先发表了有关报导,随后包括我国的和其他一些国家的科学家也积极进行了研制并纳入我国863计划。
常用的电池是由一个液体电解质将两个固体电极隔开,而钠-硫电池正好相反,它是由固体电解质将两个液体电极隔开:一个由钠-氧化铝固体电解质做成的中心管,将内室的熔融钠和外室的熔融硫隔开,并允许钠离子通过。
1.写出电池反应方程式;2.钠-硫电池与传统电池相比有何优点。
第iv题(9分)在有机化合物的处理过程中,氧化还原反应是非常重要的反应。
尤其是在设计特定目标产物的有机合成中,化学选择性、位置选择性或者空间选择性的还原-氧化反应都是极其重要的。
自然界是通过特定酶的活性中心来获得选择,化学反应往往是取决于试剂种类在反应中的微小差别来实现的。
下面的流程图是从氰基乙酸酯出发的具有化学选择性的氧化还原反应:1.在FeCl3存在的条件下,用还原剂硼氢化钠与氰基乙酸乙酯相互作用,官能团将发生选择性还原。
如果产物A与苯甲酰氯反应,1当量的苯甲酰氯将会转化成产物B,写出A和B的结构式。
2008年全国化学竞赛(初赛)试题与答案

2008年全国化学竞赛(初赛)试题第1题(14分)1-1EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA二钠盐水溶液中浓度最高的阴离子的结构简式。
(2)Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb2+ 表示铅)。
(3)能否用EDTA二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?1-2氨和三氧化硫反应得到一种晶体,熔点205o C,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
1-3Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na2[Fe(CN)5(NO)]是鉴定S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
1-4CaSO4• 2H2O微溶于水,但在HNO3 ( 1 mol L-1)、HClO4 ( 1 mol L-1)中可溶。
写出能够解释CaSO4在酸中溶解的反应方程式。
1-5取质量相等的2份PbSO4 (难溶物)粉末,分别加入HNO3 ( 3 mol L-1) 和HClO4 ( 3 mol L-1),充分混合,PbSO4在HNO3 能全溶,而在HClO4中不能全溶。
简要解释PbSO4在HNO3中溶解的原因。
1-6 X和Y在周期表中相邻。
CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。
确定B、C、D、E、X和Y。
第2题(5分) 化合物X是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300万吨的氯酸钠是生产X的原料,92%用于生产X—在酸性水溶液中用盐酸、二氧化硫或草酸还原。
此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产X。
X有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应。
π)。
2-1写出X的分子式和共轭π键(m n2-2分别写出上述用草酸还原和用氯气氧化生产X的反应方程式。
08年全国高中化学竞赛初赛试卷-免费

2008高中化学竞赛初赛模拟试卷一.(9分)A是一种四面体型的分子, A与NaOH溶液共热反应产物中B与C的物质的量之比为1︰3,其它相关物质的转化见下图:(2)试写出E与F分子的结构式:(3)实际在A和NaOH制C时,加入少量H可使产物更纯,这是因为:二(17分).铁是自然界分布最广的金属元素之一,在地壳中的质量约占5%左右。
1.钢铁是最重要的金属材料。
我国年产钢铁产量已超过1亿吨,居世界第一位。
工业上用铁矿石和焦炭来炼铁。
(1)铁矿石的种类很多,写出以下铁矿石主要成分的化学式:磁铁矿________________、赤铁矿________________、菱铁矿________________、黄铁矿________________。
(2)请写出用菱铁矿和焦炭为原料来炼铁的化学方程式:(3)从高炉冶炼得到的生铁,含铁约95%左右,要得到纯铁(含铁99.9%以上)可采用电解的方法。
电解槽的阳极材料应选用____________,阴极材料应选用____________,电解质溶液应采用________溶液。
要获取1.0kg纯铁,电极上通过的电量理论值为_________.2.在常温下,铁跟水不起反应。
但是,在水和空气里的氧气及二氧化碳等的共同作用下,铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)刷油漆是重要的防腐蚀措施之一,油漆防腐蚀的主要原理是:(2)土壤中严重缺氧,又无其它杂散电流时,按理说金属较难电化腐蚀,但事实上埋在地下的钢铁构件仍遭严重腐蚀。
有人取下腐蚀造成的锈瘤,呈黑色并有难闻气味,每克腐蚀产物中约有一千条硫酸盐还原菌。
多数土壤中都有SO42-,硫酸盐还原菌的存在对钢铁构件的电化腐蚀起了催化作用。
试写出反应式:3. 1183k以下纯铁晶体的基本结构单元与CsCl相同,1183k以上转变为与干冰相似(如图示)两种晶体中最邻近的铁原子间距离相同。
求转变温度时两者的密度比(取两位有效数字)。
2008年全国初中学生化学素质和实验能力竞赛湖北省赛区初赛试题
2008年全国初中学生化学素质和实验能力竞赛湖北省赛区初赛试题试卷说明:1.本试卷包括第Ⅰ卷和第Ⅱ卷。
第Ⅰ卷为选择题,共40分;第Ⅱ卷为非选择题,共60分。
全卷满分100分。
答题时间为120分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Mn-55 Cu-64 Fe-56全卷计分表第Ⅰ卷(选择题,共40分)一、选择题(本题包括20小题,每小题2分,共40分。
每小题有1个或2个选项符合题意。
请将所选答案的序号填写则下表相应的空格内,只写在试题旁无效)第Ⅰ卷(选择题)答题表1.下列物质按单质、氧化物、化合物、混合物的顺序排列的是A.金刚石、生石灰、粗食盐、冰水B.水银、干冰、熟石灰、天然气C.苛性钠、铁锈、纯碱、石油D.硫磺、液态氧、粗食盐、胆矾2.类推的思维方法在化学学习与研究中是一种常用的推理方法,如乙酸(CH3COOH)→过氧乙酸(CH3COOOH),氧化钠(Na2O)→过氧化钠(Na2O2);由此类推,过氧化钙的化学式为A.Ca2OB. CaOC. CaO2D. CaO33.如果按某种标准能将Cu2O、Na2SO3、NO划为同一类物质,则下列物质中能划分为此类物质的是A.K2SO4B.K2MnO4C.NaH2PO4D.HNO34.碳在氧气中燃烧,下列说法中符合质量守恒定律的是A.8 g碳和3 g氧气完全化合可生成11 g二氧化碳B. 6 g碳和16 g氧气完全化合可生成22 g二氧化碳C. 6 g碳和20 g氧气完全化合可生成26 g二氧化碳D.32 g碳和12 g氧气完全化合可生成44 g二氧化碳5.氯气和氧气都是活泼的非金属单质,在一定条件下它们都能跟甲烷起反应。
已知O2与CH4充分反应后的生成物是CO2和H2O,据此推知,Cl2与CH4充分反应后的生成物是l4和HCll4和Cl2C.CH2Cl2和H2D.C和HCl6.锆(Zr)的一种氧化物是耐高温的新型陶瓷材料,经测定,锆原子核内有51个中子,核外有40个电子,其氯化物的相对分子质量为233,若锆钻氯化物和这种氧化物中的化合价相同。
2008年全国初中化学竞赛初赛试题(广东)含答案

选项 A B
操作或现象 25m3 的石油气在加压装入容积为 0.024m3 的钢瓶中 经过加油站常闻到汽油的气味
)
C. O
B.石墨 熟石灰 生石灰
D.冰 干冰 冰醋酸
2.社会主义本质理论对探索怎样建设3.社19会57主年义2月具,有毛重在要《的关实于践正意确义处。理社人会民主内义2.社部本科会矛质学主盾理的义的论1本本问的.邓质质题提小是的》出平创科讲,提新学话为出,内中我“创涵提们社邓新。出寻始会小的邓(找终主平关小1一代义)坚键平种表的我2持在对能.1中本国把科人社9够国质社5发学才会从4先,会展社年,主更进是主作会,人义深生解义为主毛才本层产放制执义在的质次1力生度政理《成所.认社1的产还兴论论长作.识会 发发力刚国和十靠的社主 展展,刚的实大教概会义 才要发建第践关坚育括主本 是求展立一的系2持。,义质 硬、,生,要基》以人一,理 道发大产还务本重发才方从论 理展力力没是成要展资面而把 ,才促,有由果讲社的源强为我 把是进消完中,话会办是调中四们 发(硬先灭全国抓中主法第必国、对 展2道进剥建共住提三义解一)须的科社 生理生削立产“出、经决资采解社学会 产,产,党什(代济前源取放会技主 力是力消还的么1表基进。从和主术义 作)对的除不执是中础科低发义是1的 为吧社3发两完政社9国基的学级展.建第发认 社二国5会展极全地会先本问技到6生设一展识 会、内主,年分巩位主进建题术高产在生才提 主发外义是底化固所义生立,实级力改产是高 义1展一时中我,的决邓产的是力9,革力硬到 建是切间5国最思定怎小力同实和国另3开道了 设党积经共对终想年的样平的时行国家一放理一 的执极验产农达。1,建一发,改民资方中2,个 根政因教党业到(是设月再展我革教本面探是新 本兴素训站、共2对社,强要国开育主指索)适的 任国都的在手一同执会毛调求的放水义出出第创
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2008年全国化学竞赛初赛(国初)模拟试题
(时间:3小时 满分:100分)
第一题(8分)
BeCl 2是正交晶型,1250℃,纯的BeCl 2可在氮气中升华,形成细长柔软的白色石棉状针形物。
BeCl 2有着异乎寻常的解离性,受压后易沿一个方向裂成纤维。
已知BeCl 2中Be 的杂化方式与SiO 2无异。
1.画出BeCl 2的结构示意图;
2.BeCl 2结构的化学键基础是什么。
第二题(6分) 阅读下表:
2r m 解的全过程来看,MgCl 2的熵变因素对溶解过程不利,而NaCl 的熵变因素对溶解过程有利。
解释原因。
第三题(8分)
相对论效应与电子钻穿效应使得第六周期的元素有这一定的特殊性质,如:Au的氧化态可为-1。
化学家合成了一种“合金”,最简式为LaFe4Au12,晶胞由八个小立方体构成,每个小立方体中有一个由Au构成的八面体,Au位于小立方体的面心,Fe位于小立方体中心,La的堆积方式为bcp(体心立方堆积)。
1.画出该“合金”的晶胞;
2.该物质是否为合金,解释原因。
第四题(12分)
一定条件下乙炔、EtOH、过氧乙酸混合后生成一中间产物A,随后又得一多元醚B,已知A中各元素化学环境相同,A也属于醚类,含一六元环。
1.画出A、B的结构;
2.写出A分解的反应;
3.预测A的用途,解释原因
第五题(12分)
将某溶液A分为等量两份,一份以10A的电流电解完全,用去六小时整,阴极析出26.79g,向另一份中加入M-COOH生成难溶物S,已知M为一五元芳香杂环,S中含N:8.34%,S:28.58%,求:
1.写出S的化学式;
2.画出M的可能结构,并指出最稳定的一种。
第六题(8分)
Ti(IV)在水中的形式为[Ti(OH)2(H2O)4]2+,在TiOSO4·H2O晶体中不存在简单的TiO2+,是以―Ti―O―Ti―长链存在。
在Ti(IV)中加入H2O2,pH<1时,为[Ti(O2)(OH)(H2O)4]+单核配离子,呈红色;pH=1~3时,为Ti2O52+,为双核配离子,呈橙黄色。
1.画出Ti2O52+的可能结构;
2.解释颜色;
3.[Cr2Cl9]3-的结构中存在一C3轴,画出[Cr2Cl9]3-的结构。
第 3 页 共 6 页
第七题(8分)
测定铅锡合金中Sn 、Pb 的含量进行下列操作: ①称取试样0.2000g ,用过量的HCl 溶解;
②取0.1259mol/L 、10mL 的AgNO 3标准溶液,加入过量Ni(CN)42
-,用未知浓度的EDTA 溶液滴定置换出的Ni 2
+,用去20.98mL ;
③准确加入50.00mL 上述EDTA 溶液、50mL 水,加热2min ,用0.03000mol/LPb 2
+滴定,
用去3.000mL ,然后加入足量NH 4F ,加热,再用上述Pb 2+
标准溶液滴定,用去35.00mL 。
试计算试样中Sn 、Pb 的质量分数。
第八题(10分)
氮化铝是有机中的重要脱水试剂,其晶胞与六方ZnS 有相似之处却不同。
右边两图中前者是六方ZnS 按一定取向截得的部分,后者是AlN 按一定取向截得的部分。
已知两种阳离子皆占据阴离子围成的四面体空隙。
分别画出六方ZnS 和AlN 的晶胞。
第九题(10分)
臭氧既可以帮助保护生命的形式,也可以对生命造成伤害。
20亿年前地球大气层中氧气浓度开始显著增加,与此同时,高层大气中的臭氧浓度也逐渐增大。
臭氧层能有效阻止紫外线辐射,使地球上形成生命成为可能。
如今,臭氧层出现了大的空洞,臭氧似乎要被耗尽了,因此臭氧层的命运引起了人们极大的关注。
另一方面,地表环境中的臭氧是光化学烟雾的主要组分,对于健康是有危害的。
以下介绍测量地表大气中臭氧浓度的一个简单方法。
向含有碘化物的酸性溶液中鼓泡通入空气,空气中的臭氧可以将碘化物氧化为三碘化物,如下面未配平的方程式所示:
O 3(g)+I -(aq)→I 3-(aq)+O 2-
1.配平该方程式;
2.在一定条件下,Cu 、HCl 和空气反应生成一种酸A ,A 含单电子,是自由基,有极高的活性,曾认为A 为B ,可后来发现B 不存在,试求B 的化学式。
3.解释B 不存在的原因。
第十题(8分)
通过自组装可以得到一系列有用而且重要的结构。
实际上,40亿年以前,生命形式最早就是通过细胞膜的自组装实现的。
自组装是从分子到星系的所有尺度范围内进行结构组建的一个最基本原则。
自组装定义为已经存在的部分或已经存在在系统中的无序部分,形成具有规则图案的稳定结构的可逆过程。
1.分析上反应还有何物质生成;
2.解释该反应能进行的原因;
3.判断该物质是否具有顺磁性;
4.根据结构推测其物理性质。
第十一题(10分)
某人在一次试验中不小心将一催化剂放在混有CO和甲烷的潮湿空气之中意外发现有氢气生成,反应机理为:CO和空气、水份生成一极活泼中间体M,M与甲烷反应生成M -CH3和氢气等,M为一元酸,M中各原子可在一个平面上,与一常见气体N互为等电子体。
1.写出M、N的化学式;
2.画出M的结构。
第 5 页 共 6 页
参考答案
第一题(8分)
1
.
2.配位键
第二题(6分)
当-+≈X M r r 时,对U 有利,即正负离子大小相近时,有利于U 增大。
当M X r r +-<<时,对Δ h H m 有利,即正负离子差别较大时,有利于Δ h H m 增大。
如
果正负离子差别较大时,以水合能大小来判断溶解性大小。
例如M +
与-4ClO 组成的盐,由于ClO 4-离子半径大,从Li +→Cs +
离子的水合能减小,所以LiClO 4溶解度较大,NaClO 4在水中的溶解度比LiClO 4约小3~12倍,而KClO 4,RbClO 4和CsClO 4的溶解度仅是LiClO 4
的10-3
倍。
如果正负离子差别不大时,以晶格能大小来判断溶解性大小。
例如:M +与F -
离子组成的盐,由于离子半径相近,而LiF 的晶格能最大,所以LiF 是碱金属氟化物溶解度最小的。
一般来说大的阳离子需要大的阴离子作为沉淀剂,因为大的阳离与大的阴离子形成的离
子型的盐溶解度小。
例如Na[Sb(OH)6]、NaZn(UO 2)3(CH 3COO)9·
6H 2O 、K 3[Co(No 2)6]、K 2[PtCl 6]、K[B(C 6H 5)4]等都是难溶的钠盐、钾盐。
铷、铯比相应的钾盐还要难溶。
第三题(8分)
1.
2.元素组成比为定值,故不是合金。
第四题(12分)
1.A :
B :
E t
E t E t
2.
→
+3/2O 2
3.炸弹。
放热,熵增。
第五题(12分) 1.TiS 3N 2C 8H 4O 4
2.
N
S
、
N
S
,后者更稳定。
第六题(8分)
1.
2.这些配离子之所以有颜色是由于 2
2
O离子变形性较强,发生O22-向Ti(IV)上电荷跃迁。
3.
第七题(8分)
Pb:37.30%;Sn:62.25%
第八题(10分)
第九题(10分)
1.O3(g)+9I-(aq)→3I3-(aq)+3O2-
2.HO3
3.受H的极化很不稳定。
第十题(8分)
1.水;
2.鳌环效应和模板合成;
3.无;
4.有疏水基团故具有疏水性。
第十一题(10分)
1.M:HCO2;N:NO2
2.
C O
O
H。
