精馏1传质过程概述1传质过程的定义传质过程的定义
传质过程(化工基础,化学)汇总

②填料塔内的流体力学状况
在设计填料塔时,首先要考虑填料塔的流 体力学性能:包括气体通过填料层的压降、 液泛气速、持液量(单位体积填料所持有的 液体体积)、气液分布等。
例如,确定动力消耗需知压降;确定塔径 以液泛速度为依据;持液量关系着填料支承 装置的强度;气液分布情况影响着传质效率 等。
L =0(当没有液体喷淋 时),即气体通过干填料 层时,Δp/H~u呈直线关 系,直线的斜率为1.8~ 2.O,表明H与u的1.8~2 次方成比例,气流状态为 湍流。
• ③若物质在A相实际浓度等于B相实际浓度 所要求的平衡浓度,则无传质过程发生,体系 处于平衡状态。
对于空气中的氨向水中传 递的过程,若以氨的分压p表 示气相中氨的实际浓度,p* 表示液相实际浓度所要求的 气相平衡分压,则:
p>p*时,氨从气相向液相传递; p<p*时,氨由液相向气相转移; p= p*时,体系达到平衡状态。
无论哪种类型的均相混合物,要将 其分离成纯净或几乎为纯态物质,必 须造成一个两相物系,利用原物系中 各组分间某种特性的差异,使其中某 个组分在两相间进行传质。
物质在两相中的传质历程
物质首先从一相主体扩散到两 相界面的该相一侧,然后通过相 界面进入另一相,最后从此相的 界面向主体扩散。
例如气体吸收,气相主体中溶 质扩散经过气相到达气液相界面, 溶解进入液相,然后扩散进入液 相主体。
以混合物中吸收质摩尔数与惰性物质摩尔数的比 来表示气相中吸收质的含量,称为气相摩尔比,用Y 表示;
以液相中吸收质摩尔数与纯吸收剂摩尔数的比来 表示液相中吸收质的含量,称为液相摩尔比,用X表 示。
摩尔比与摩尔分数的关系是: Y=y/(1-y) X=x/(1-x)
• 吸收计算中,有时需要在亨利定律 各系数之间进行变换。
化工原理

(适用于有机化工、环境工程、 应用化学、精细化工专业)
2020年6月23日
第八章 传质过程概论
第一节 概述 传质定义 分类 四个工具(传质速率方程)
第二节 扩散与单相传质 分子扩散与fick定律 等分子反向扩散、单向扩散 扩散系数 涡流扩散与对流传质
第三节 质量、热量和动量传递的类比
(双膜理论 传质系数) 第四节 吸收设计计算
(操作线方程、最小吸收剂用量、 低浓度气体吸收填料层高度计算) 第五节 传质系数和传质理论 第六节 其他条件下的吸收(非等温、多组分、化学)
第一节 概述
1.1 处理对象 1.2 定义 1.3 吸收剂的选择 1.4 吸收的类型与例子 1.5 吸收与精馏的比较
1.5 吸收与精馏的比较
区别: 精馏操作用加入能量分离剂的方法产生第二相(塔顶冷凝,塔底
再沸加热);吸收操作是用加入质量分离剂的方法直接得到第二相( 吸收剂)。
精馏操作可以直接获得较纯净的轻、重组分;吸收操作得到的是含 有溶质的吸收液,要想得到较纯净的溶质,还需要经过第二个分离操 作(如脱吸)。
精馏操作中,液相部分汽化与汽相部分冷凝同时发生,每层板上的 汽、液相都处于接近饱和的温度下,在相界面两侧轻重组分同时地向 着彼此相反的方向传递,二元精馏接近等分子反向扩散过程。而吸收 操作中,液相温度远远低于沸点,溶剂没有显著的汽化现象,只有溶 质分子由汽相进入液相的单向传递,而汽相中的惰性组分和液相中的 溶剂组分处于“停滞”状态,吸收接近单向扩散过程。
H——溶解度系数,受物系和温度影响,kmol/(kPa·m3)
亨利定律的表达形式:
③ 摩尔分率: y*=mx
式中:y*——每千摩尔气体中所含A组分的摩尔分率; m——相平衡常数,受物系、温度和压力影响,无因次
传质过程基础----蒸馏(修改版)

传质过程基础---蒸馏
汽相和液相在塔板上或 填料表面上进行着质量 传递过程。 易挥发组分从液相转移 至汽相,难挥发组分从 汽相转移至液相。
传质过程基础---蒸馏
二、拉乌尔定律(各组分为什么会分离)
在一定温度下,溶液上方某组分的平衡分压等于此组分在该 温度下的饱和蒸汽压乘以其在溶液中的摩尔分率。
pA pB 对于非理想溶液:v A , vB xA xB
2、相对挥发度
溶液中易挥发组分的挥发度与难挥发组分的挥发度之比, 用α表示。
vA vB
pA p A xB xA pB pB x A xB
传质过程基础---蒸馏
若操作压强不高,气相遵循道尔顿分压定律
pA yA pB yB
来决定。
故 R↑→V↑, V'↑→加热介质↑,冷却介 质↑→操作费用↑
R=(1.1~2.0)Rmin
1、挥发度
•对纯液体,挥发度指该液体在一定温度下的饱和蒸汽压
o v A p o , vB pB A
• 对混合液,挥发度为组分在蒸气中分压和与之平衡的液 相中的摩尔分率之比
pi vi xi
传质过程基础---蒸馏
对于理想溶液:
pA po xA o o A vA p A vB pB xA xA
Vyn1 Lxn Dx D
L D yn 1 xn xD LD LD
R 1 xn x D ——精馏段操作线方程 R 1 R 1
L R D
——回流比
传质过程基础---蒸馏
3)提馏段操作线方程
对总物料:
L V W
对易挥发组分:
xm V ym1 Wxw L
化工基础 第四章 传质过程.

注意!传质速率方程式有多种形式(浓度的表示方法有多 种 传质推动力和相应的传质系数)。传质比传热更复杂。
• 作业 • 1.2.3.4
kL
DL
L
c csm
N A p A1 p A 2
1
推动力 阻力
kG
N A cA1 cA 2
1
推动力 阻力
kL
过 程 进 行 的 速 率
推动力 阻力
显然,若流体气体中的湍流愈激烈Re,则δ ,传质阻力也 愈小,即1/k。
传质速率方程式能否用于计算? (cA1-cA2)可求,但k=?(同传热的,k取决于流体物性、流动 状况等因素)实验测定经验公式(下一章)。
RT p p dl A
利用边界条件积分后
因整体流动而产生的传递速率分别为 :
N
D
ln
p p Ai
Dp ln Bi
N
N cA 和N
N
c B
A,M
Mc
B,M
Mc
A RTl p p RTl p
A1
B1
由于 p pA1 pB1 pA2 pB2 pA1 pA2 pB2 pB1
对流扩散
N D D dcA
AB
E dz
层流:D占主要地位; 湍流:DE占主要地位。
DE——涡流扩散系数。非物性常数,与湍动程度有关,且与流体 质点所处位置有关,很难测定。 D——扩散系数。在温度压力不变时为Const.
对流传质
膜模型
c cA1 F
层流底层 (DE ≈ 0,分子扩散)
作用物
流体分子
流体质点
作用方式
精馏1传质过程概述1传质过程的定义传质过程的定义
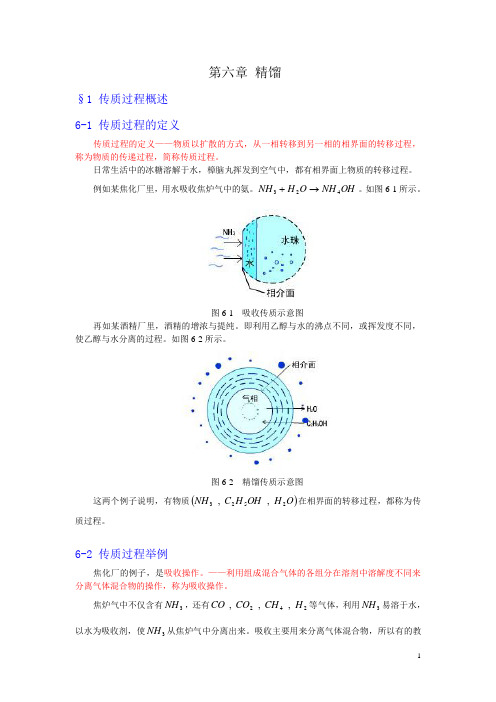
第六章 精馏§1 传质过程概述 6-1 传质过程的定义传质过程的定义——物质以扩散的方式,从一相转移到另一相的相界面的转移过程,称为物质的传递过程,简称传质过程。
日常生活中的冰糖溶解于水,樟脑丸挥发到空气中,都有相界面上物质的转移过程。
例如某焦化厂里,用水吸收焦炉气中的氨。
OH NH O H NH 423→+。
如图6-1所示。
图6-1 吸收传质示意图再如某酒精厂里,酒精的增浓与提纯。
即利用乙醇与水的沸点不同,或挥发度不同,使乙醇与水分离的过程。
如图6-2所示。
图6-2 精馏传质示意图这两个例子说明,有物质()O H OH H C NH 2523 , , 在相界面的转移过程,都称为传质过程。
6-2 传质过程举例焦化厂的例子,是吸收操作。
——利用组成混合气体的各组分在溶剂中溶解度不同来分离气体混合物的操作,称为吸收操作。
焦炉气中不仅含有3NH ,还有242 , , , H CH CO CO 等气体,利用3NH 易溶于水,以水为吸收剂,使3NH 从焦炉气中分离出来。
吸收主要用来分离气体混合物,所以有的教材称吸收为气体吸收。
如图6-3所示。
图6-3 吸收局部示意图水称为溶剂,3NH 称为溶质,炉气中其他气体称为惰性组分。
用水吸收氯化氢气体)(HCl ,制备盐酸,也是一种吸收操作。
酒精厂的例子,是精馏操作。
——利用液体混合物各组分沸点(或挥发度)的不同,将物质多次部分汽化与部分冷凝,从而使液体混合物分离与提纯的过程,称为精馏操作。
精馏主要用来分离液体混合物,所以有的教材称精馏为液体精馏。
传质过程还有,萃取——利用混合物各组分对某溶剂具有不同的溶解度,从而使混合物各组分得到分离与提纯的操作过程。
例如用醋酸乙酯萃取醋酸水溶液中的醋酸。
如图6-4所示。
图6-4 萃取示意图此例中醋酸乙酯称为萃取剂)(S ,醋酸称为溶质)(A ,水称为稀释剂)(B 。
萃取操作能够进行的必要条件是:溶质在萃取剂中有较大的溶解度,萃取剂与稀释剂要有密度差。
化学工程中的传质过程

化学工程中的传质过程传质是化学工程中的重要过程之一,它涉及物质在不同相之间传递的过程。
在化学工程中,传质过程是实现各种反应以及分离纯化的关键步骤之一。
本文将介绍传质的基本原理、传质过程的分类以及传质操作在化学工程中的应用。
一、传质的基本原理传质是指物质在空间中由高浓度区域向低浓度区域的传递。
在化学工程中,传质可以通过扩散、对流和反应来实现。
扩散是指物质由浓度较高的区域向浓度较低的区域通过分子运动的方式传递。
对流是指物质在流体中由于流体的运动而传递,可以通过外加压力差或者液体搅拌等方式实现。
反应传质是指在化学反应过程中,反应物和产物通过扩散和对流的方式进行传递。
二、传质过程的分类根据传质方法的不同,传质过程可以分为气体传质、液体传质和固体传质三种。
1. 气体传质气体传质是指气体在不同相之间的传递过程。
在化学工程中,气体传质通常通过气体的扩散来实现。
扩散系数是气体传质研究中的重要参数,它与物质本身的性质、传质介质的性质以及温度等因素有关。
气体传质在化学工程中的应用广泛,例如在气体吸附、蒸馏和气体分离等领域都有重要的应用。
2. 液体传质液体传质是指液体在不同相之间的传递过程。
在化学工程中,液体传质通常通过扩散和对流的方式来实现。
液体传质过程中的重要参数是质量传递系数,它与溶质的性质、传质介质的性质以及温度等因素有关。
液体传质在化学工程中的应用广泛,例如在溶剂萃取、萃取精馏和浸出等工艺中都有重要的应用。
3. 固体传质固体传质是指固体在不同相之间的传递过程。
在化学工程中,固体传质通常通过扩散和渗透的方式来实现。
固体传质过程中的重要参数是固体的扩散系数和扩散路径的长度。
固体传质在化学工程中的应用广泛,例如在膜分离、吸附和离子交换等工艺中都有重要的应用。
三、传质操作在化学工程中的应用传质操作在化学工程中广泛应用于反应器设计、分离纯化以及废水处理等领域。
下面将以蒸馏过程为例介绍传质操作在化学工程中的应用。
蒸馏是一种常用的分离纯化方法,它通过液体的汽化和凝结来实现混合物组分之间的分离。
化工原理精馏-PPT

提馏段 V1 ' V2 ' V3 ' ... V ' constant 2.恒摩尔液流
精馏段 L1 L2 L3 ... L constant 提馏段 L1 ' L2 ' L3 ' ... L ' constant
某组分在气相中的平衡分压与该组分在液相中
的摩尔分率之比
挥发度意义
vi
pi xi
某组分由液相挥发到气相中的趋势,是该组分 挥发性大小的标志
双组分理想溶液
vA
pA xA
pAo xA xA
pAo
vB
pB xB
pBo xB xB
pBo
☆相对挥发度定义
溶液中易挥发组分挥发度与难挥发组分挥发度之比
vA pA / xA
气液平衡关系的表示法 1)用饱和蒸气压表示
拉乌尔定律:理想溶液气相中组分的分压等于纯组分 在该温度下的饱和蒸气压与其在溶液中摩尔分数乘积
pA pAo xA pB pBo xB pBo (1 xA )
A:易挥发组分,沸点低组分 B:难挥发组分,沸点高组分
x: 液相中易挥发组分的摩尔分数; 1-x:难挥发组分的摩尔分数
在精馏塔的塔板上气液两相接触时,若有n kmol/h的蒸气冷凝,相应有n kmol/h液体气 化。
1.5.2 物料衡算与操作线方程 1.全塔物料衡算 总物料:
F D W
F , D , W--- 原 料 液 、 馏 出 液 、 釜残液摩尔流量,kmol/s
易挥发组分:
FxF DxD WxW
xF,xD,xW---易挥发组分的 摩尔分数
L qF L qF W
精馏工艺操作

影响精馏操作的主要因素
五、操作压力的影响
塔的压力是精馏塔主要的控制指标之一。在精馏操作中,常常规定了操作压力的 调节范围。塔压波动过大,就会破坏全塔的气液平衡和物料平衡,使产品达不到所要 求的质量。
提高操作压力,可以相应地提高塔的生产能力,操作稳定。但在塔釜难挥发产品 中,易挥发组分含量增加。如果从塔顶得到产品,则可提高产品的质量和易挥发组分 的浓度。影响塔压变化的因素:塔顶温度,塔釜温度、进料组成、进料流量、回流量、 冷剂量、冷剂压力等的变化以及仪表故障、设备和管道的冻堵等。
1)减少塔顶采出量以增大回流比。
2)塔顶冷凝器为分凝器时,可增加塔顶冷剂的用量,以提高凝液量,增大回流比。
3)有回流液中间贮槽的强制回流,可暂时加大回流量,以提高回流比,但不得将 回流贮槽抽空。必须注意,在馏出液采出率D/F规定的条件下,借增加回流比R以提高 塔釜残液量的的方法并非总是有效。加大操作回流比意味着加大蒸发量与冷凝量,这 些数值还将受到塔釜及冷凝器的传热面的限制
精馏工艺流程
常压塔底液含有微量的甲醇和高沸点杂质,经回收塔进料泵加压, 由调节阀控制,由甲醇回收塔第24、26、30任一塔板进料至甲醇回收 塔。回收塔再沸器热源为低压蒸汽,塔釜温度由调节阀控制。回收塔塔 顶气体~81℃,经回收塔冷凝器降温至~40℃,液体进入回收塔回流槽, 再由回收塔回流泵抽出,部分由调节阀控制,送回至回收塔塔顶回流, 部分作为产品杂醇油,由调节阀控制,送至杂醇贮槽。回收塔侧线由塔 盘18、20、32、38任意采出的杂醇至冷却器冷却到~40℃后靠静压送 到杂醇贮槽。回收塔底的废水,经废水冷却器冷却后由废水泵送至事故 水池。
TWO
精馏工艺流程图
THREE
精馏工艺流程
从甲醇合成工段来的粗甲醇和稀醇水,(温度40℃,压力0.5MPa, 流量约40t/h)或由粗甲醇贮槽来粗甲醇,经粗甲醇预热器预热后,进 入(共3路进料,视情况选择进料板。进料板分别为14、20、24塔板) 预精馏塔。为中和预精馏塔底的少量酸及促进胺类和羰基物的分解,在 配碱槽配置5%-10%含量的NaOH碱液后放入碱液槽,经往复式计量泵 送入ME-40501管线,向预塔加入碱液约67.5㎏/h。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章 精馏§1 传质过程概述 6-1 传质过程的定义传质过程的定义——物质以扩散的方式,从一相转移到另一相的相界面的转移过程,称为物质的传递过程,简称传质过程。
日常生活中的冰糖溶解于水,樟脑丸挥发到空气中,都有相界面上物质的转移过程。
例如某焦化厂里,用水吸收焦炉气中的氨。
OH NH O H NH 423→+。
如图6-1所示。
图6-1 吸收传质示意图再如某酒精厂里,酒精的增浓与提纯。
即利用乙醇与水的沸点不同,或挥发度不同,使乙醇与水分离的过程。
如图6-2所示。
图6-2 精馏传质示意图这两个例子说明,有物质()O H OH H C NH 2523 , , 在相界面的转移过程,都称为传质过程。
6-2 传质过程举例焦化厂的例子,是吸收操作。
——利用组成混合气体的各组分在溶剂中溶解度不同来分离气体混合物的操作,称为吸收操作。
焦炉气中不仅含有3NH ,还有242 , , , H CH CO CO 等气体,利用3NH 易溶于水,以水为吸收剂,使3NH 从焦炉气中分离出来。
吸收主要用来分离气体混合物,所以有的教材称吸收为气体吸收。
如图6-3所示。
图6-3 吸收局部示意图水称为溶剂,3NH 称为溶质,炉气中其他气体称为惰性组分。
用水吸收氯化氢气体)(HCl ,制备盐酸,也是一种吸收操作。
酒精厂的例子,是精馏操作。
——利用液体混合物各组分沸点(或挥发度)的不同,将物质多次部分汽化与部分冷凝,从而使液体混合物分离与提纯的过程,称为精馏操作。
精馏主要用来分离液体混合物,所以有的教材称精馏为液体精馏。
传质过程还有,萃取——利用混合物各组分对某溶剂具有不同的溶解度,从而使混合物各组分得到分离与提纯的操作过程。
例如用醋酸乙酯萃取醋酸水溶液中的醋酸。
如图6-4所示。
图6-4 萃取示意图此例中醋酸乙酯称为萃取剂)(S ,醋酸称为溶质)(A ,水称为稀释剂)(B 。
萃取操作能够进行的必要条件是:溶质在萃取剂中有较大的溶解度,萃取剂与稀释剂要有密度差。
干燥操作——利用热能使湿物料的湿分汽化,水汽或蒸汽经气流带走,从而获得固体产品的操作。
如图6-5所示。
图6-5 干燥传质示意图还有固—液萃取,结晶,吸附等操作。
要研究传质过程,主要从三个方面进行研究。
相平衡关系(气-液溶解度,液-液溶解度,干燥中的水蒸气分压),物料衡算关系和传质速率关系。
浓度表示法及其换算:重量百分率(质量分率)的摩尔数的摩尔数摩尔比分率的摩尔数的摩尔数的摩尔数摩尔分率)质量百分率(质量分率B A X B A A x kgm m kg m W A A B A A A =+=+=()()AA A AA A BA A AAA AB A A A AA A X X x x x X M W M W M W x M x M x M x W +=-=-+=-+=1111§2 理想溶液的汽-液平衡 6-3 由制酒作坊引出相平衡大庆油田开采出来的是原油,如何将原油加工成汽油、煤油、柴油、重油呢?酿酒厂酿制出了原酒,如何将粗酒加工成︒60的白酒呢?先介绍以下古老的烧酒作坊吧!目前江浙一带仍有这种家庭小作坊,主要分三步: (1) 粬的制作——发酵过程(获得菌种)(2) 粗酒的制作——将酒粬与蒸熟的米饭,按一定比例混合发酵,制成酒、水、酒糟的糊状混和物(生物降解)。
(3) 酒的提纯——蒸馏操作过程。
图6-6 制酒作坊装置图锅为汽化器,顶盖为冷凝器。
如图6-6所示。
这就是一种简单蒸馏的操作过程。
我还不知道“对酒当歌”源于哪个朝代的帝王将相,但可以肯定,从“对酒当歌”那个时候起,劳动人民已经掌握了简单精馏这种操作过程。
为什么能使乙醇增浓呢?主要因为乙醇比水的沸点低(或说乙醇比水的挥发度高)。
这样蒸汽中乙醇的含量()A y 高于粗酒中乙醇的含量()A x ,即A A x y >。
蒸汽冷凝之后,就得到乙醇含量高的酒。
()A y ——蒸汽中乙醇所占的摩尔分率=A y 水的摩尔数乙醇的摩尔数乙醇的摩尔数+()A x ——液相中乙醇所占的摩尔分率本章中,y 均代表蒸汽的组成(摩尔分率),x 均代表液体的组成(摩尔分率)我们要问,()A y 与()A x 服从什么规律呢?即()A x f y =的函数关系如何呢?本节就要回答这个问题。
6-4 理想溶液及拉乌尔定律图6-7 拉乌尔定律示意图()A BB BB AA A x p x p p x p p -===100如图6-7所示,在一定的温度下,溶液上方任意组分的蒸汽分压,等于该纯组分在同温度下的蒸汽压与该组分在溶液中的摩尔分率之乘积。
——拉乌尔定律。
()oBo A p p 的意思是()11==B A x x 时的蒸汽分压。
道尔顿分压定律的表达式为:P y p P y p B B A A ⋅=⋅= ,6-5 y x t --图在一定外压条件下()P ,沸点t 与汽液相组成),(y x 的关系,绘在图上即是y x t --图。
图6-8 温度-组成图如图6-8所示,对于一定组成的溶液)(1x 加热到与x t -相交的点,即出现第一个气泡,所以x t -线亦称泡点线。
对于组成为1y 的蒸汽,冷却至与y t -线相交,出现第一个露珠,所以称y t -线为露点线。
若x t -线与y t -线重合,则表示该溶液不能分离。
若两线相距愈远,则表示愈易分离。
y x t --图可通过实验测定。
若为二元理想溶液,t-x-y 图可利用计算方法求得:A o A A x p p = ()A oB B o B B x p x p p -==1 ()A oB A o A B A x p x p P p p -+==+1 ⎪⎪⎭⎪⎪⎬⎫==--=∴P x p P p y p p p P x A oA A A oBoA oBA …………)(I 式)(I 说明,只要知道某温度下的oB o A p p 和(饱和蒸汽压数据),就可以计算得到x 与y ,就可以作出在指定外压()P 下的y x t --图。
式)(I 还说明,总压P 对y x t --图是有影响的。
6-6 x-y 图取y x t --图中的y x ,数据,以x 为横坐标,y 为纵坐标,绘成的图为y x -图。
如图6-9所示,用一条曲线表达汽-液相平衡,图面清晰,数据易查。
图6-9 x-y 图对于易挥发组分,因为A A x y >,所以y x -线均在对角线上方。
y x -线与对角线偏离越远,表示越易分离。
若y x -线与对角线重合,则不能用精馏方法分离。
对于二元理想溶液,y x -图可由式)(I 计算得到。
6-7 汽-液平衡解析表达式用图表达汽-液相平衡关系,利用计算机计算就十分不便,能不能用一解析式来表达呢? 挥发度——达到相平衡时,某组分在蒸汽中的分压()A p 和它在平衡液相中的摩尔分率()A x 之比,叫做该组分的“挥发度”。
BBB AAA x p v x p v ==,相对挥发度——各组分的挥发度之比,称为组分间的“相对挥发度”。
oBo AB B o B A A o A B B A A AB B A ABp p x x p x x p x p x p v v =⋅⋅===αα , 在本课程中,通常定义易挥发组分挥发度与难挥发组分挥发度之比为相对挥发度。
这样定义的α,则1>α。
对于二元理想溶液()()A A o BoAA o Bo AA oB A o A AoA B A A A x x p p x p p x p x p x p p p p y -+=-+=+=11 ()A A Ax x x -+=1αα∴() 11AAA x x y -+=αα ……………)(II式)(II 为汽-液平衡的解析表达式。
由式)(II 得知,当1=α时,A A x y =,则表示该二元溶液不能用精馏的方法分离。
注意:以后所见的y x ,均为易挥发组分浓度,就是表示A A y x , 的意思。
6-8 相平衡计算举例【例6-1】正庚烷和正辛烷的饱和蒸汽压和温度的关系数据如下表所示。
试求出该体系157.26949.126===∑α§3 简单蒸馏及其计算6-9 简单蒸馏的装置在家庭制酒业中,即是一个简单蒸馏装置,只是冷凝装置较简单,是一个空气自然对流冷却装置。
在实验室或工业生产中,采用如图6-10所示的装置,实质也是一个汽化器,一个冷凝器。
图6-10 简单精馏装置图6-10 简单蒸馏的原理在简单精馏的过程中:液相组成由n x x x x →→→→ 321汽相组成(馏出液组成)由n y y y y →→→→ 321釜液量由W dn F F →→-→若全部汽化,又全部冷凝,即最终釜液量0=W ,则达不到分离的目的。
只有部分汽化,部分冷凝,才可得到易挥发组分较高的馏出液。
由图6-11看出,当料液组成为1x 时,所得馏出液最高组成为1y 。
所以用简单蒸馏的方法,得不到纯度高的产品。
图6-11 蒸馏原理示意图6-11 简单蒸馏的计算公式设W ——任一瞬间蒸馏釜中的釜液量,kmol ; x ——任一瞬间釜液组成,摩尔分率; y ——任一瞬间蒸汽组成,摩尔分率;经τd 时间后,溶液汽化量为dW , 釜液组成变化为dx ,如图6-12所示,在τττd +→的时间间隔,对易挥发组份作衡算得:()() ydW dx x dW W W x +-⋅-= ……………)(a易挥发组分量τ挥发组分量时刻易ττd易挥发组分量蒸出的ττd图6-12 蒸馏计算原理推导图 整理式(a )得:ydW dx dW xdW Wdx Wx Wx +⋅+--=忽略高阶无穷小,即0→⋅dx dW ,即得:xy dxW dW -= 若最初釜液量为F ,此时釜液组成为F x ,最终釜液量为W ,此时釜液组成为W x ,积分上式:⎰⎰-=F W FWx x x x xy dxW dW ⎰-=F W x x xy dx W F ln………………)(b 式)(b 可用图解积分求解。
若()xxy 11-+=αα,代入上式积分得:11ln ln 11ln⎥⎦⎤⎢⎣⎡--+-=FW W Fx x x x W F αα ………………)(c若对最初与最终易挥发组分作衡算,则得:() W F x W x F x D W F -+⋅= ………………)(d其中,D x 为馏出液的平均组成,摩尔分率;式)(b 、)(d 是简单蒸馏的计算公式。
共有六个物理量()α , , , , , 21D x x x W F 两个方程[式)(b 、)(d ],必须直接或间接的已知四个量,才可计算其他两个量。
6-12 简单蒸馏计算举例【例6-2】在常压下用简单蒸馏方法处理含苯为5.0的苯与甲苯混合液。
当釜液中苯的浓度降至37.0(以上均为摩尔分率)时,操作停止。
