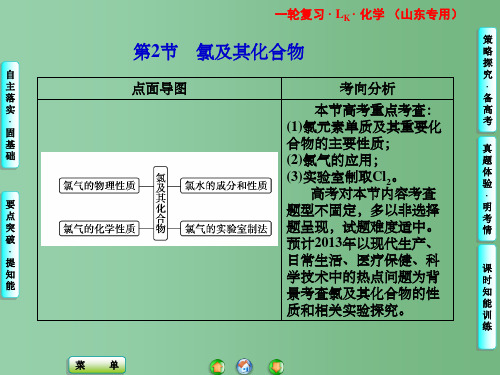
2018-2019届鲁教版高中化学一轮复习课件:第1章第2节 氯及其化合物
合集下载
高考化学一轮复习 第一章 第2讲 氯及其重要化合物 鲁科版

闻集气瓶中氯气气味的方法:用手在瓶口轻轻 扇动 ,使极少量的氯气
飘进鼻孔。
2.化学性质
(1)与金属反应:与变价金属反应生成高价金属氯化物
①与铁反应: 2Fe+3Cl2 2FeCl3 ②与铜反应: Cu+Cl2 CuCl2
(2)与非金属(H2、磷等)反应
与 H2 反应: H2+Cl2
2HCl
点燃时 平静燃烧,发出苍白色火焰,瓶口形成白雾
23
等)
反应,应考虑 Cl2 的作用。
跟踪训练
(2015·东北三校联考)下列有关氯水的表述不正确的是( A ) A.氯水可以导电,说明氯气是电解质 B.氯水中含有7种微粒,其可以与AgNO3、FeBr2等多种物质反应 C.蓝色石蕊试纸放入氯水中先变红后退色 D.向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度
Cl-+ClO-+H2O
【断一断】 (1)H2、Cu、Fe在Cl2中均可以发生燃烧反应。( ) (2)Cl2可用于消灭田鼠,为此可将Cl2用软管通入田鼠洞中,这是利用了Cl2的毒 性和密度比空气的大。( ) (3)Cl2与过量的铁反应生成FeCl2。( ) (4)Cl2有很强的氧化性,在反应中只做氧化剂。( ) (5)1 mol Cl2与足量Fe反应转移3 mol电子。( ) (6)Cl2 与少量 FeI2 溶液反应的离子方程式为:Cl2+2Fe2+ 2Fe3++2Cl-。( )
考点二 氯气的实验室制法 考点剖析
1.装置及过程
2.注意事项
(1)为了减少制得的Cl2中HCl的含量,加热温度不宜过高,以减少HCl的挥发。 (2)制备Cl2时必须用浓盐酸,稀盐酸与MnO2不反应。 (3)实验结束时,先使反应结束并排出残留Cl2,再拆卸装置,以免污染空气。 (4)不可用澄清石灰水进行尾气吸收,因澄清石灰水中Ca(OH)2浓度低,吸收慢 且吸收不完全。
高考化学一轮复习 第1单元 认识化学科学课件 鲁科版

返回目录
使用建议
3.阿伏加德罗常数正误判断是物质的量的一个难点。 这类题目是高考的热点,涉及氧化还原反应中的电子转移 知识、电化学知识等。知识的综合性强,思考容量大。教 学时要注意以物质的量为核心,一切知识都是从物质的量 入手的。在教学过程中要善于运用归纳、小结的方法,引 导学生从物质的量入手,明确阿伏加德罗常数的误区。阿 伏加德罗常数渗透到整个高中化学知识中,综合性强,对 思维的严密性和准确性要求比较高,是历年高考的必考内 容之一。
2011年
北京11(选择); 全国7(选择)、
12(选择); 重庆7(选择)、
9(选择)
江苏3(选择)、 11(选择)、 25(解答);
海南15(解答)
2012年
北京7(选择); 四川9、10(选择); 广东10(选择); 浙江28(解答)
江苏8(选择); 山东8(选择); 北京26(解答); 福建25(解答)
江苏8(选择)
江苏8(选择)
物质的 量浓度
全国Ⅰ12(选择);
上海31(解答);
上海22(选择); 四川12(选择);
福建23(解答); 江苏18(解答)
天津4(选择); 海南(选择)6; 江苏18(解答)
上海30(解答)
一定物质的 山东14(选择); 量浓度溶液 安徽8(选择); 的配制及误 天津9(解答);
差分析 上海26(解答)
广东33(解答); 福建6(选择); 四川27(解答) 安徽10(选择)
返回目录
使用建议
【教学建议】 本单元以钠、氯为例,学习了研究物质的基本方法和 基本程序。重点介绍了钠、氯及其化合物的基本性质及其 应用。物质的量的内容比较抽象,概念性和综合性强,易 混淆知识点较多,物质的量、气体摩尔体积、物质的量浓 度等是高考常考的知识点,通常以选择题、填空题或计算 的形式出现,是历年高考命题的重点和热点。 1.钠及其化合物主要考查其性质、相互转化以及在日 常生活、生产中的应用。通常以选择题、综合推断题、实 验题为主,特别注意在实际生活、生产中的应用为载体的 综合实验题。教学中应注重以下两点:(1)Na2O2与CO2或 H2O的反应及其计算;(2)Na2O2性质的探究实验。
使用建议
3.阿伏加德罗常数正误判断是物质的量的一个难点。 这类题目是高考的热点,涉及氧化还原反应中的电子转移 知识、电化学知识等。知识的综合性强,思考容量大。教 学时要注意以物质的量为核心,一切知识都是从物质的量 入手的。在教学过程中要善于运用归纳、小结的方法,引 导学生从物质的量入手,明确阿伏加德罗常数的误区。阿 伏加德罗常数渗透到整个高中化学知识中,综合性强,对 思维的严密性和准确性要求比较高,是历年高考的必考内 容之一。
2011年
北京11(选择); 全国7(选择)、
12(选择); 重庆7(选择)、
9(选择)
江苏3(选择)、 11(选择)、 25(解答);
海南15(解答)
2012年
北京7(选择); 四川9、10(选择); 广东10(选择); 浙江28(解答)
江苏8(选择); 山东8(选择); 北京26(解答); 福建25(解答)
江苏8(选择)
江苏8(选择)
物质的 量浓度
全国Ⅰ12(选择);
上海31(解答);
上海22(选择); 四川12(选择);
福建23(解答); 江苏18(解答)
天津4(选择); 海南(选择)6; 江苏18(解答)
上海30(解答)
一定物质的 山东14(选择); 量浓度溶液 安徽8(选择); 的配制及误 天津9(解答);
差分析 上海26(解答)
广东33(解答); 福建6(选择); 四川27(解答) 安徽10(选择)
返回目录
使用建议
【教学建议】 本单元以钠、氯为例,学习了研究物质的基本方法和 基本程序。重点介绍了钠、氯及其化合物的基本性质及其 应用。物质的量的内容比较抽象,概念性和综合性强,易 混淆知识点较多,物质的量、气体摩尔体积、物质的量浓 度等是高考常考的知识点,通常以选择题、填空题或计算 的形式出现,是历年高考命题的重点和热点。 1.钠及其化合物主要考查其性质、相互转化以及在日 常生活、生产中的应用。通常以选择题、综合推断题、实 验题为主,特别注意在实际生活、生产中的应用为载体的 综合实验题。教学中应注重以下两点:(1)Na2O2与CO2或 H2O的反应及其计算;(2)Na2O2性质的探究实验。
高考化学一轮复习 1.2 氯及其重要化合物课件 鲁科版

考点1 考点2 考点3 触摸高考
4.(2012·江苏卷)标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为 0.1NA。( )
提示:Cl2 与水的反应为可逆反应,不能反应完全。 答案:× 5.(2012·广东卷)将混有 HCl 的 Cl2 通入饱和 NaHCO3 溶液中除去 HCl。 () 提示:HCl 与 NaHCO3 溶液反应生成 CO2,使 Cl2 中又混有 CO2,故不能用 饱和 NaHCO3 溶液除去 Cl2 中混有的 HCl。 答案:×
考点1 考点2 考点3 触摸高考
3.漂粉精、“84 消毒液” 漂粉精的主要成分为 NaClO,“84 消毒液”的主要成分为 NaClO 和 NaCl, 有效成分为 NaClO。
4.能否用 pH 试纸测新制氯水的 pH? 提示:不能。因新制氯水中含有次氯酸,具有强氧化性,能将 pH 试纸漂 白。
考点1 考点2 考点3 触摸高考
c(H+)减小
c(HClO) 减小
右移 右移
重点1 重点2
应用
①用饱和食盐水除 Cl2 中 的 HCl ②用排饱和食盐水法收 集 Cl2 次氯酸盐与浓盐酸反应 制 Cl2 用 NaOH 溶液吸收多余 的 Cl2 制高浓度的 HClO 溶液 氯水应避光保存或现用 现配
重点1 氯水的成分和性质
例1
变式训练1
Cl-+Ag+ AgCl↓
重点1 重点2
重点1 氯水的成分和性质
例1
变式训练1
3.Cl2+H2O H++Cl-+HClO 平衡移动的应用
向氯水中加入 的物质
浓度变化
平衡移动 的方向
可溶性 氯化物
c(Cl-)增大 左移
4.(2012·江苏卷)标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为 0.1NA。( )
提示:Cl2 与水的反应为可逆反应,不能反应完全。 答案:× 5.(2012·广东卷)将混有 HCl 的 Cl2 通入饱和 NaHCO3 溶液中除去 HCl。 () 提示:HCl 与 NaHCO3 溶液反应生成 CO2,使 Cl2 中又混有 CO2,故不能用 饱和 NaHCO3 溶液除去 Cl2 中混有的 HCl。 答案:×
考点1 考点2 考点3 触摸高考
3.漂粉精、“84 消毒液” 漂粉精的主要成分为 NaClO,“84 消毒液”的主要成分为 NaClO 和 NaCl, 有效成分为 NaClO。
4.能否用 pH 试纸测新制氯水的 pH? 提示:不能。因新制氯水中含有次氯酸,具有强氧化性,能将 pH 试纸漂 白。
考点1 考点2 考点3 触摸高考
c(H+)减小
c(HClO) 减小
右移 右移
重点1 重点2
应用
①用饱和食盐水除 Cl2 中 的 HCl ②用排饱和食盐水法收 集 Cl2 次氯酸盐与浓盐酸反应 制 Cl2 用 NaOH 溶液吸收多余 的 Cl2 制高浓度的 HClO 溶液 氯水应避光保存或现用 现配
重点1 氯水的成分和性质
例1
变式训练1
Cl-+Ag+ AgCl↓
重点1 重点2
重点1 氯水的成分和性质
例1
变式训练1
3.Cl2+H2O H++Cl-+HClO 平衡移动的应用
向氯水中加入 的物质
浓度变化
平衡移动 的方向
可溶性 氯化物
c(Cl-)增大 左移
高考化学大一轮复习第1单元第2节氯及其重要化合物课件鲁科鲁科高三全册化学课件

碱
氧化
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
12/11/220H21 ClO
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
2HCl+O2↑,必须密封保存
第六页,共三十三页。
考点(kǎo diǎn)一
考点(kǎo diǎn)二
考情概览
-7-
必备(bìbèi)知识·自主预诊 关键能力·考向突破
必备(bìbèi)知识·自主预诊 关键能力·考向突破 关闭
在酸性条件下发生反应:ClO-+2H++2I- Cl-+I2+H2O,淀粉溶液遇 I2
变为蓝色,证明氧化性 ClO->I2;在溶液中加入足量的亚硫酸钠溶液, 蓝 证即色 明变对在蓝逐 氧淀点,粉演渐 化在K练上消 性I溶述失I2溶液>,是液S中O中因加42加-为,入所入又少以足发量量微的生次粒亚了氯的硫酸反氧酸钠应钠化溶:溶性 I2液液+:HC,,蓝并l2OO加色-+>入逐SI2O>少渐32S-量消O42的失-,2A稀。I-+项硫下2酸正H列+,确溶+判S液;断O漂立42不白-, 粉正的确有的效是成( 分是) Ca(ClO)2,电离产生 ClO-,由于氧化性 ClO->I2,所以 漂 所白 以AB..粉 当漂氧溶 次白化粉性液 氯溶:可 酸Cl液O使 钠->可淀 与I2>使粉亚淀硫KS粉OI酸试42K-钠I纸试溶纸变液变蓝混蓝,B合项时正,会确发;由生于反氧应化:H性C:lCOl+OS-O>S32-O42-,
HCl>H2CO3>HClO,所以向溶液中加入碳酸钙粉末,会发生反 应:2HCl+CaCO3==CaCl2+H2O+CO2↑,使化学平衡正向移动,导致c(HClO)增大, 则溶液的漂白性会增强,B项正确;加入氯化钙溶液,增大Cl-浓度,化学平衡逆向 移动且溶液对氯水起稀释作用,使溶液的漂白性减弱,C项错误;加入二氧化硫的 水溶液,与次氯酸发生氧化还原反应,溶液中c(HClO)减小,溶液的漂白性减
高考化学一轮复习第1章2氯及其化合物课件鲁科版

原因是酸性:H2CO3>HClO>H 。
C
O
3
和CHCOl3O。
(2)次氯酸盐 ①“84”消毒液
②漂白粉
【基础小题诊断】
判断正误(正确的打“√”,错误的打“×”)
(1)过量的铁粉在少量氯气中加热,充分反应后产物为FeCl2。
()
提示:×。铁粉与氯气充分反应后产物为FeCl3。
(2)氯气溶于水溶液呈酸性且可以导电,所以氯气是电解质 ( )
提示:×。氯气是单质,既不是电解质也不是非电解质。
(3)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5NA。 提示:×。该反应为可逆反应,Cl2不能完全反应。
()
(4)1 mol氯气分别与铁和铝完全反应时转移的电子数均为3NA。
()
提示:×。1 mol Cl2分别与铁和铝完全反应时,氯元素化合价由0变为-1,所以
复习课件
高考化学一轮复习第1章2氯及其化合物课件鲁科版
2021/4/17
高考化学一轮复习第1章2氯及其化合物课件鲁科版
内容索引
考点1:氯及其化合物的性质及应用 考点2:氯气的制法与性质探究 高考新风向·命题新情境 课时精归纳·素养速提升 核心素养测评
考点1:氯及其化合物的性质及应用 【核心知识自查】 1.氯气的性质 (1)氯气的物理性质
颜色 _黄__绿__色
气味 _刺__激__性__气味
毒性 密度 _有__毒 比空气_重__
特性 _易__液化
【微点拨】实验室里闻有毒气体及未知气体气味的方法是用手在瓶口轻轻扇动,仅使 极少量气体飘进鼻孔。
(2)从氯的原子结构认识氯气的化学性质——氧化性
依据氯气的氧化性完成下列方程式:
高考化学一轮复习 第1章第2节 氯及其化合物课件
策
略
探
自
究
主 1.(判一判)某城市以“液氯泄漏”作为应急预警演习的项目,判
·
落 实
断下列防护措施是否正确(正确打“√”,错误打“×”)
备 高
· 固
(1)及时向上风口和地势较高处转移疏散人群( )
考
基
础
(2)及时戴上用烧碱溶液湿润过的口罩( )
真 题
(3)用高压水枪向泄漏口附近喷洒稀碱液并设法控制氯气泄漏
知 能
(2)B (3)①③④
课 时 知
能
训
练
菜单
一轮复习 ·LK ·化学 (山东专用)
策
略
探
自
究
主
·
落
化学性质
实
应用
备
高
·
考
固
常温下,干燥的氯气或液氯不能与 工业上常用钢瓶贮存干燥的
基 础
铁发生反应
液氯
真 题
体
验
要
常用于工业制取盐酸
·
明
点
考
突 破
①氯水应保存在棕色试剂瓶
情
·
中,置于阴凉避光处
提 知 能
·
落
备
实 ·
B.氯气的水溶液呈酸性
高 考
固 基
C.过量的铁在氯气中燃烧可生成氯化亚铁
真
础
D.闻其气味时要小心地将集气瓶放在鼻孔下直接闻
题 体
【答案】 B
验 ·
要
明
点
考
突
情
破
·
提 知 能
课 时 知
能
训
练
菜单
二、氯元素的重要化合物
自
高中化学一轮复习第1章认识化学科学第2节氯及其化合物课件鲁教版

——歧化反应
氯气与水或碱反应,氯元素的化合价既有升高又有降低,因
而氯气既表现氧化性又表现还原性。
(1)与水反应 氯气与水反应的化学方程式: Cl2+H2O
HCl+HClO 。
(2)与碱(NaOH)反应 反应的化学方程式:Cl2+2NaOH===NaCl+NaClO+H2O 。
第八页,共40页。
4.次氯酸
Cl-
离子方程式或解释 Cl-+Ag+===AgCl↓
第十八页,共40页。
所加试剂
Na2CO3 固体
有色布条
SO2 石蕊溶液
实验现象
参与反应 的微粒
离子方程式或解释
有气泡产生
H+
布条颜色褪去 HClO
2H++CO32-=== O2↑+H2O
发生氧化还原反应
黄绿色褪去
SO2+Cl2+2H2O===
Cl2
△ (5)MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O
第四页,共40页。
考点一 氯单质及其化合物的性质
[基础自主落实]
1.氯气的物理性质
颜色
气味
毒性
密度
特性
_黄__绿__色 _强__烈__(q_i_á_n_ɡ_l_iè气)刺味激性_有__毒 比空气_大__ _易__液化
[注意] 闻氯气气味的方法是用手在瓶口轻轻扇动,使极 少量的 Cl2 飘进鼻孔。
(3)与还原性无机化合物反应 ①与碘化钾溶液反应: Cl2+2KI===2KCl+I2 。 ②与 SO2 水溶液反应:Cl2+SO2+2H2O===H2SO4+2HCl 。 ③与 FeCl2 溶液反应: 2FeCl2+Cl2===2FeCl3 。
第七页,共40页。
高三化学一轮复习 第一章 第2节氯元素单质及其化合物知识综合验收课件 鲁科版必修1

[Cl-]增大
左移
盐酸
[H+]和[Cl
-]增大
左移
NaOH溶液
[H+]减小
右移
•名 4.新制氯水、久置氯水、液氯的比较 新制氯水 久置氯水 液氯
称
物 质 类 别
混合物
混合物
纯净物
Cl2、HClO、 微 H2O、H+ 粒 、Cl-、 种 ClO-、OH 类 -
H2O、H+、 Cl-、OH-
Cl2
• 特别提醒 • 在氯水中加入CaCO3,过滤可制得一定浓度 的次氯酸,因为CaCO3只与HCl反应,促使 平衡Cl2+H2O HCl+HClO正向移动, 使Cl2几乎完全与H2O反应生成HClO。
• (4)通过实验②的“实验现象”,同学们得 出两个不同的结论。这两个结论可能是: a.________,b.________。 • 请设计简单的实验证明上述a、b结论 _____________________________________ ___________________________________ • _____________________________________ ___________________________________。
(2)工业制法:电解食盐水。
电解 2NaCl+2H2O===== 2NaOH+Cl2↑+H2↑。
• 氯气的制取实验几点问题 • (1)足量MnO2和含4 mol HCl的浓盐酸加热制 得Cl2物质的量________1 mol(填小于或等于 或大于),为什么? • (2)该反应必须加热到90 ℃左右,为什么温 度不能再高? • (3)若实验室没有浓盐酸,可用什么代替? 写出化学方程式。
1.成分 由Cl2+H2OH++Cl-+HClO可知: (1)三种分子:Cl2、HClO、H2O; (2)四种离子:ClO-、Cl-、H+、OH-。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯气的性质及应用
1.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化 性,下列叙述中不正确的是 A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 B.通常状况下,干燥的氯气能和 Fe 反应 C.纯净的 H2 在 Cl2 中安静地燃烧,发出苍白色火焰,集气瓶 瓶口呈现雾状;光照 H2 和 Cl2 的混合气体时,因迅速化合 而爆炸 D.氯气能与水反应生成 HClO 和 HCl,久置氯水最终变为稀 盐酸 ( B )
HCl+HClO 。 氯气与水反应的化学方程式: Cl2+H2O
(2)与碱(NaOH)反应 反应的化学方程式:Cl2+2NaOH===NaCl+NaClO+H2O 。
导航页 结束放映
4.次氯酸
(1)不稳定性:次氯酸分解反应的化学方程式为 2HClO 光照 =====2HCl+O2↑ 。氯水须现用现配,保存在棕色瓶 ,置于 冷暗处。 (2)强氧化性 ①能将有色物质氧化为无色物质,作漂白剂。 ②杀菌、消毒。
第2节
考点一
氯及其化合物
氯单质及其化合物的性质
考点二
氯气的制备、性质综合实验探究
以“KClO的制备”为载体串联氯元素单质及 其化合物的相关知识
课堂小结 一题串知
课后检测 演练提能
课时跟踪检测(二)
导航页 结束放映
1.了解氯元素单质及其重要化合物的主要性质及应用。 2.了解氯元素单质及其重要化合物对环境质量的影响。
导航页
(× )
(× ) (8)漂白粉和明矾都常用于自来水的处理, 二者的作用原理是
结束放映
(× )
2.漂白粉和明矾都用于自来水的处理,二者有何不同?
提示:漂白粉是利用其氧化性杀菌消毒,明矾净水是 利用 Al3 水解产生的 Al(OH)3 胶体吸附水中的固体悬
+
浮物。
导航页
结束放映
[考向合作探究]
解析:Cl2 与 Fe 反应需要点燃或加热。
导航页 结束放映
2.向下列溶液中通入氯气,现象和结论描述正确的是 ( B ) C 项,氯气和 NaOH 溶液反应生成氯化钠、次氯酸钠和水, A.品红溶液:红色褪去,加热该褪色溶液,仍无色;氯气具
其中,氯气既作氧化剂,又作还原剂,次氯酸钠的漂白性和 有漂白性 溶液碱性的减弱均会使溶液的红色褪去,错误; D 项,Cl2+ B.紫色石蕊溶液:先变红,后褪色;氯气与水反应生成盐酸 Na2S===2NaCl 和次氯酸 +S↓,溶液变浑浊,氯气作氧化剂,错误。
(3)与还原性无机化合物反应 ①与碘化钾溶液反应: Cl2+2KI===2KCl+I2 。 ②与 SO2 水溶液反应:Cl2+SO2+2H2O===H2SO4+2HCl 。 ③与 FeCl2 溶液反应: 2FeCl2+Cl2===2FeCl3 。
导航页 结束放映
3.从化合价的角度认识 Cl2 的化学性质 ——歧化反应 氯气与水或碱反应,氯元素的化合价既有升高又有降低,因 而氯气既表现氧化性又表现还原性。 (1)与水反应
导航页 结束放映
考点一 氯单质及其化合物的性质
[基础自主落实]
1.氯气的物理性质
颜色 _____ 黄绿 色
[注意]
气味 ___________ 强烈刺激性 气味
毒性 ___ 有毒
密度 比空气___ 大
特性 ___ 易 液化
闻氯气气味的方法是用手在瓶口轻轻扇动,使极
少量的 Cl2 飘进鼻孔。
导航页
结束放映
2.从氯的原子结构认识氯气的化学性质 ——氧化性
(1)与金属反应:与变价金属反应生成高价金属氯化物。
点燃 ①与铁反应: 2Fe+3Cl2=====2FeCl3 。
点燃 ②与铜反应:Cu+Cl2=====CuCl2。
导航页 结束放映
(2)与非金属反应 点燃或光照 与 H2 反应:H2+Cl2 ========= 2HCl。
导航页 结束放映
(3)弱酸性 向 NaClO 溶液中通入少量 CO2,化学方程式为2NaClO+
CO2+H2O===Na2CO3+2HClO 。
5.次氯酸盐 (1)漂白液
导航页
结束放映
(2)漂白粉 ①成分:漂白粉的主要成分是 Ca(ClO)2、CaCl2 , 其中有效成分是 Ca(ClO)2 。 ②制备原理:化学方程式为 2Cl2+2Ca(OH)2===
-
(3)Cl2 通入水中的离子方程式为 Cl2+ H2O===2H + Cl + ClO- (× ) (4)用 pH 试纸测定氯水的 pH 为 4 (× ) (5)Cl2 具有很强的氧化性,在化学反应中只能作氧化剂 (× ) (6)过量的铁与氯气在一定条件下反应生成 FeCl2 (7)次氯酸是酸性比碳酸强的弱酸 相同的
CaCl2+Ca(ClO)2+2H2O 。
③漂白原理:化学方程式为 Ca(ClO)2+H2O+
CO2===CaCO3↓+2HClO 。
导航页
结束放映
小题热身 1.判断正误(正确的打“√”,错误的打“×”)。 (1)氯气的水溶液可以导电,说明氯气是电解质 (2)新制取的漂白粉是纯净物
+
(× ) (× )
导航页 结束放映
氯水的成分与性质
3.(2016· 宁德模拟)某同学在一 pH 试 纸上滴几滴新制的氯水,现象如图 所示,下列有关该实验的说法中正 确的是 ( B )
A 项,氯气与水反应生成的次氯酸具有漂白性,能使品红溶液 C.含酚酞的氢氧化钠溶液:红色褪去;氯气只作氧化剂 褪色, 且加热已褪色的溶液, 溶液不会恢复原来的颜色, 错误; D.硫化钠溶液:溶液变浑浊;氯气只作还原剂 B 项,氯气与水反应生成盐酸和次氯酸,盐酸使紫色石蕊溶液 变红,次氯酸具有漂白性,能使变红的石蕊溶液褪色,正确;
导航页
结束放映
[循 记一记]
1.特殊的颜色:Cl2——黄绿色气体 2.特殊的成分:新制氯水中含三分子(Cl2、HClO、H2O)、四 离子(Cl-、ClO-、H+、OH-) 3.Cl2 实验室制法五装置:①发生;②净化;③干燥;④收集; ⑤尾气处理 4.必记五反应: (1)Cl2+H2O HCl+HClO (2)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O (3)Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO (4)Cl2+SO2+2H2O===H2SO4+2HCl △ (5)MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O
1.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化 性,下列叙述中不正确的是 A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 B.通常状况下,干燥的氯气能和 Fe 反应 C.纯净的 H2 在 Cl2 中安静地燃烧,发出苍白色火焰,集气瓶 瓶口呈现雾状;光照 H2 和 Cl2 的混合气体时,因迅速化合 而爆炸 D.氯气能与水反应生成 HClO 和 HCl,久置氯水最终变为稀 盐酸 ( B )
HCl+HClO 。 氯气与水反应的化学方程式: Cl2+H2O
(2)与碱(NaOH)反应 反应的化学方程式:Cl2+2NaOH===NaCl+NaClO+H2O 。
导航页 结束放映
4.次氯酸
(1)不稳定性:次氯酸分解反应的化学方程式为 2HClO 光照 =====2HCl+O2↑ 。氯水须现用现配,保存在棕色瓶 ,置于 冷暗处。 (2)强氧化性 ①能将有色物质氧化为无色物质,作漂白剂。 ②杀菌、消毒。
第2节
考点一
氯及其化合物
氯单质及其化合物的性质
考点二
氯气的制备、性质综合实验探究
以“KClO的制备”为载体串联氯元素单质及 其化合物的相关知识
课堂小结 一题串知
课后检测 演练提能
课时跟踪检测(二)
导航页 结束放映
1.了解氯元素单质及其重要化合物的主要性质及应用。 2.了解氯元素单质及其重要化合物对环境质量的影响。
导航页
(× )
(× ) (8)漂白粉和明矾都常用于自来水的处理, 二者的作用原理是
结束放映
(× )
2.漂白粉和明矾都用于自来水的处理,二者有何不同?
提示:漂白粉是利用其氧化性杀菌消毒,明矾净水是 利用 Al3 水解产生的 Al(OH)3 胶体吸附水中的固体悬
+
浮物。
导航页
结束放映
[考向合作探究]
解析:Cl2 与 Fe 反应需要点燃或加热。
导航页 结束放映
2.向下列溶液中通入氯气,现象和结论描述正确的是 ( B ) C 项,氯气和 NaOH 溶液反应生成氯化钠、次氯酸钠和水, A.品红溶液:红色褪去,加热该褪色溶液,仍无色;氯气具
其中,氯气既作氧化剂,又作还原剂,次氯酸钠的漂白性和 有漂白性 溶液碱性的减弱均会使溶液的红色褪去,错误; D 项,Cl2+ B.紫色石蕊溶液:先变红,后褪色;氯气与水反应生成盐酸 Na2S===2NaCl 和次氯酸 +S↓,溶液变浑浊,氯气作氧化剂,错误。
(3)与还原性无机化合物反应 ①与碘化钾溶液反应: Cl2+2KI===2KCl+I2 。 ②与 SO2 水溶液反应:Cl2+SO2+2H2O===H2SO4+2HCl 。 ③与 FeCl2 溶液反应: 2FeCl2+Cl2===2FeCl3 。
导航页 结束放映
3.从化合价的角度认识 Cl2 的化学性质 ——歧化反应 氯气与水或碱反应,氯元素的化合价既有升高又有降低,因 而氯气既表现氧化性又表现还原性。 (1)与水反应
导航页 结束放映
考点一 氯单质及其化合物的性质
[基础自主落实]
1.氯气的物理性质
颜色 _____ 黄绿 色
[注意]
气味 ___________ 强烈刺激性 气味
毒性 ___ 有毒
密度 比空气___ 大
特性 ___ 易 液化
闻氯气气味的方法是用手在瓶口轻轻扇动,使极
少量的 Cl2 飘进鼻孔。
导航页
结束放映
2.从氯的原子结构认识氯气的化学性质 ——氧化性
(1)与金属反应:与变价金属反应生成高价金属氯化物。
点燃 ①与铁反应: 2Fe+3Cl2=====2FeCl3 。
点燃 ②与铜反应:Cu+Cl2=====CuCl2。
导航页 结束放映
(2)与非金属反应 点燃或光照 与 H2 反应:H2+Cl2 ========= 2HCl。
导航页 结束放映
(3)弱酸性 向 NaClO 溶液中通入少量 CO2,化学方程式为2NaClO+
CO2+H2O===Na2CO3+2HClO 。
5.次氯酸盐 (1)漂白液
导航页
结束放映
(2)漂白粉 ①成分:漂白粉的主要成分是 Ca(ClO)2、CaCl2 , 其中有效成分是 Ca(ClO)2 。 ②制备原理:化学方程式为 2Cl2+2Ca(OH)2===
-
(3)Cl2 通入水中的离子方程式为 Cl2+ H2O===2H + Cl + ClO- (× ) (4)用 pH 试纸测定氯水的 pH 为 4 (× ) (5)Cl2 具有很强的氧化性,在化学反应中只能作氧化剂 (× ) (6)过量的铁与氯气在一定条件下反应生成 FeCl2 (7)次氯酸是酸性比碳酸强的弱酸 相同的
CaCl2+Ca(ClO)2+2H2O 。
③漂白原理:化学方程式为 Ca(ClO)2+H2O+
CO2===CaCO3↓+2HClO 。
导航页
结束放映
小题热身 1.判断正误(正确的打“√”,错误的打“×”)。 (1)氯气的水溶液可以导电,说明氯气是电解质 (2)新制取的漂白粉是纯净物
+
(× ) (× )
导航页 结束放映
氯水的成分与性质
3.(2016· 宁德模拟)某同学在一 pH 试 纸上滴几滴新制的氯水,现象如图 所示,下列有关该实验的说法中正 确的是 ( B )
A 项,氯气与水反应生成的次氯酸具有漂白性,能使品红溶液 C.含酚酞的氢氧化钠溶液:红色褪去;氯气只作氧化剂 褪色, 且加热已褪色的溶液, 溶液不会恢复原来的颜色, 错误; D.硫化钠溶液:溶液变浑浊;氯气只作还原剂 B 项,氯气与水反应生成盐酸和次氯酸,盐酸使紫色石蕊溶液 变红,次氯酸具有漂白性,能使变红的石蕊溶液褪色,正确;
导航页
结束放映
[循 记一记]
1.特殊的颜色:Cl2——黄绿色气体 2.特殊的成分:新制氯水中含三分子(Cl2、HClO、H2O)、四 离子(Cl-、ClO-、H+、OH-) 3.Cl2 实验室制法五装置:①发生;②净化;③干燥;④收集; ⑤尾气处理 4.必记五反应: (1)Cl2+H2O HCl+HClO (2)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O (3)Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO (4)Cl2+SO2+2H2O===H2SO4+2HCl △ (5)MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O
