药物合成反应 缩合反应
药物合成反应 第五章 缩合反应

(CH3)2CHCH2 CH C COCH3 H
含α -活 泼氢的醛、 酮的交错缩合
H2O 30
(CH3)2CHCH2 CH
C COCH3 H
甲醛与含α -活泼氢 的醛、酮交错缩合
(CH3)2C CHO + H C H H
O
K2CO3 14 ~ 20
(CH3)2C
CHO (50%)
CH2OH
COOR
Na
+ X
NaX
第四节 其他缩合 达参反应
1.催化剂
2.α -卤代酸酯的结构 3.羰基化合物的结构
第四节 其他缩合 达参反应
i C4H9
CH3COCl/AlCl3 20 ,3~3.5h
CH3 i C4H9 C O
(95%)
CH3 i C4H9 C O C H COOCH(CH3)2 NaOH/H2O i C4H9
O
H + C2H5O
CH3 C
OC6H5+ H
H (2) HCl O (1)NaNH2 CH3 C C COOC2H5
(2)H
C
OC2H5 (1) EtONa, COOC2H5 回流10h 85 ~ 90 C O C6 H5CH C O H
OC2H5 C O
O C COOC2H5 + C6H5OH
C6H5
反应机 理
O H OO H H RCH2 C C COOC2H5 + C2H5O (1)C H ONa RCH2 C C COOC2H5 + C2H5OH 2 5 RCH2 C OC2H RCH2 C RC COOC2H5+C2H5OH R5 + H C COOC2H5
药物合成反应缩合反应

+ CH3COCH3
NaOH 30℃
H3C H3C
CHCH2CH
CHCOCH3
药物合成反应缩合反应
定向醇醛(酮)缩合
•醛或酮与具位阻的碱如LDA(二异丙胺 锂)作用,形成烯醇盐再与另一分子醛 或酮作用, •醛、酮转变成烯醇硅醚,在TiCl4催化 下与另一分子醛、酮分子作用, •醛、酮与胺形成亚胺,与LDA形成亚 胺锂盐,再与另一分子醛、酮作用。
Reformatsky反应
醛或酮与 -卤代酸酯在金属锌粉存在下
(9(C H 3)2N
CHO +
CHO
C N /E tO H /H 2O (C H 3)2N
OH C CH O
N C 1 2 H 2 5 .B r /磷酸盐
2 O
S
CHO
pH=8 r.t. 几分钟
O CH C O
(80%) O H O 药物合成反应缩合反应
4.有机金属化合物的-羟烷基化
Tollens缩合(羟甲基化反应)
含有-氢的醛或酮在Ca(OH)2、K2CO3、 NaHCO3等碱的存在下,用甲醛处理,在醛、 酮的-碳原子上引入羟甲基的反应称为
Tollens缩合反应。
稀 NaOH HCHO + CH3COCH3 40~42℃
COOH
COOH
CH2 OH
CH2
COCH3 H2O CH2
1) T iC l4 /C H 2 C l2 , -78℃ C H 3 C H 2 C H 2 C H C H C H 2 C 6 H 5
2) H 2 O
OH CHO
TsO H /P hH
C H 3 C H 2 C H 2 C H C C H 2 C 6 H 5 78%
药物生物合成反应类型

实 例
H 瘤胃细菌 HOOC N H O (R u m e n b a c te ria ) HOOC C H C H H C H COOH
H2N
5 -酮 基 已 内 酰 胺
谷氨酸
2. 醚的开裂
C O CH2 R COH
CH O R或 H
CH3 R或 H
CHOH
C
O
CH3
COH
实 例
HO O C H 2C O O H 分 节 孢 子 杆 菌 SP. (A rth ro b a cte riu m S P .) HO OH
生物合成反应类型:
一、氧化反应 二、还原反应 三、水解反应
五、胺化反应
六、酰基化反应
七、脱羧反应
八、脱水反应
四、缩合反应
一、氧化反应
1. 单一氧化反应
C H 2O H CHO
CHO
C H 2O H
COOH
COOH
CHOH
CO
CH3
CHO
CH3
COOH
CH2
CO
CH2
COOH
实 例
C H 2O H 1. 产 黄 青 霉 Q 176 2. 假 单 胞 菌 PI (1 . P en icilliu m ch ry so g en u m Q 176) (2 . P seu d o m o n as P I) 苄醇 苯甲醛 CHO
O C O C R COH
O C O C R COH
R
CO SR
R
COOH
实 例
H 2C C O N O COOH Cl 7 -氯 苯 乙 酰 头 孢 菌 素 C Cl 7 -氯 苯 乙 酰 -3 -脱 乙 酰 头 孢 菌 素 C C H 2O C C H 3 H N S O 大肠杆菌 (B a c te riu m c o li) O COOH H 2C C O N C H 2O H H N S
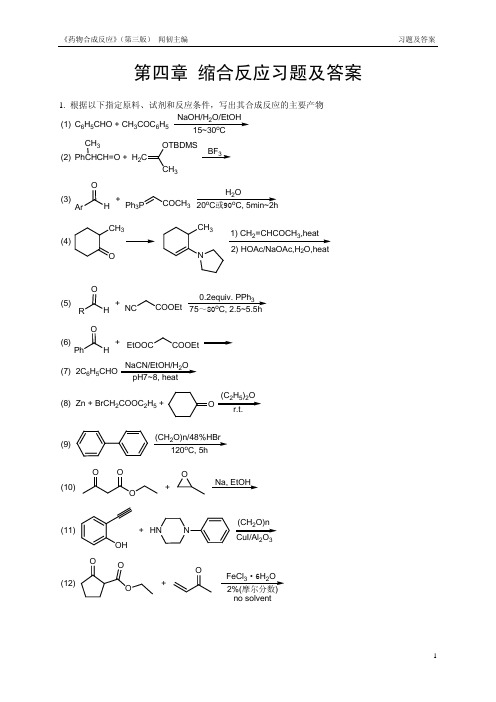
药物合成反应(第三版 闻韧)第四章课后答案
10
O
O O
Eur. J. Org. Chem., 2001, 21, 4009.
11
O N N
Tetrahedron Lett. 2001, 42: 6049.
12
O
O
CO2Et
13
O OC2H5 HO N Ph CO2Et CN
NO2
Tetrahedron Lett. 2000, 41: 8011.
J. Org. Chem., 2007, 72: 5244.
4
O
J. Am. Chem. Soc., 1963, 85: 207. 1. pyrrolidine, p-TsOH, xylene; 2.
5
R Hห้องสมุดไป่ตู้
CN CO2Et
Eur. J. Org. Chem., 2004, 3: 546.
6
PhHC
*反应机理提示:安息香缩合 (2)参考答案: 反应式:
*反应机理提示:氯甲基化反应
4
根据以下指定原料试剂和反应条件写出其合成反应的主要产物参考答案题号答案1o注释benzalacetophenone2phch3ch3ohoj
《药物合成反应》 (第三版) 闻韧主编
习题及答案
第四章 缩合反应习题及答案
1. 根据以下指定原料、试剂和反应条件,写出其合成反应的主要产物 NaOH/H2O/EtOH (1) C6H5CHO + CH3COC6H5 15~30oC CH3 OTBDMS BF3 (2) PhCHCH=O + H2C CH3
O (3) Ar H + Ph3P
o
H2O COCH3 20 C或90oC, 5min~2h
药物合成反应(第三版_闻韧)第四章 缩合反应总结

R
CH C OH
R'
R
-H
R' R R CH2 C OH
O R'
Hale Waihona Puke CH C- H2O
R'
O C C CR'
CH2R R
Organic Reactions for Drug Synthesis
1)自身缩合 (一般用碱性催化剂)
NaOH 25℃ 2CH3CH2CH2CHO NaOH 80℃ CH3CH2CH2CH OH CH3CH2CH2CH CH CHO CH2CH3 C CHO
试解释上述反应中为什么使用镁?
Organic Reactions for Drug Synthesis
1)
-卤代酸酯的活性顺序为:
R1 R1
ICH2COOC2H5>BrCH2COOC2H5 >ClCH2COOC2H5
X CCOOC2H5 > X CHCOOC H > X CH2COOC2H5 2 5 R2
2) 无水操作:Et2O、THF等。Zn需活化(用20%HCl 处理)
Organic Reactions for Drug Synthesis
Reformatsky反应的应用:
•合成-羟基羧酸酯 •合成-羟基羧酸
•醛、酮增长碳链的方法之一
Organic Reactions for Drug Synthesis
C O Y
Nu
C O Nu
+ Y
Organic Reactions for Drug Synthesis
羰基化合物的结构与反应特征
羰基化合物的结构特征之二: ——羰基C=O的吸电子作用使得a-H具有明显 的酸性,在碱性条件下可以离解,生成烯醇 负离子,从而成为亲核试剂,进攻羰基碳或 卤代烃,发生亲核加成反应、亲核取代反应。
药物合成第四章缩合反应_图文

α ,β-不饱和羰基化合物和活性亚甲基化合物在碱催化下进
行共轭加成,称为Micheal加成
电子给体:活泼亚甲基化合物、烯胺、氰乙酸酯类、酮酸酯、 硝基烷类、砜类等 碳负离子接受体:-不饱和醛、酮、酯,不饱和腈、不饱和硝 基化合物以及易于消除的曼尼希碱 催化剂:醇钠(钾)、氨基钠、吡啶、三乙胺、季铵碱
第一节 α-羟烷基、卤烷基、氨烷基化反应
三 α-氨烷基化反应(Mannich反应)
机理
第一节 α-羟烷基、卤烷基、氨烷基化反应
三 α-氨烷基化反应(Mannich反应)
影响因素:
第一节 α-羟烷基、卤烷基、氨烷基化反应
三 α-氨烷基化反应(Mannich反应)
例:
第一节 α-羟烷基、卤烷基、氨烷基化反应
第一节 α-羟烷基、卤烷基、氨烷基化反应 一、α-羟烷基化
3 芳醛的α -羟烷基化(安息香缩合)芳醛在含水乙醇中,以氰化
钠(钾)为催化剂,加热后发生双分子缩合生成α -羟基酮
机理(关键:如何来制造一个碳负离子)
第一节 α-羟烷基、卤烷基、氨烷基化反应 一、α-羟烷基化
当R为吸电子基团时有利于反应但不能生成对称的α -羟基 酮, 能与苯甲醛反应生成不对称的α -羟基酮.如:
①
酸性很强-活泼
例:
第三节 亚甲基化反应 二. 羰基α-位的亚甲基化
1 活性亚甲基化合物的亚甲基化(Knoevenagel)
② 例:
活性稍弱于①
第三节 亚甲基化反应 二. 羰基α-位的亚甲基化
1 活性亚甲基化合物的亚甲基化(Knoevenagel)
③ 例:
用醇钠强碱作催化剂
第三节 亚甲基化反应 二. 羰基α-位的亚甲基化
药物合成反应

四.缩合反应定义:两个及两个以上有机化合物通过反应形成一个新的较大分子或同一分子内部发生分子内的反应形成新分子的反应称为缩合反应。
Aldol:定义:在稀酸或稀碱催化下(通常为稀碱),一分子醛(或酮)的 氢原子加到另一分子醛(或酮)的羰基氧原子上,其余部分加到羰基碳上,生成 -羟基醛(或酮),这个增长碳链的反应称为α-羟烷基化反应。
但该类化合物不稳定,易消除脱水生成α,β-不饱和醛酮,又称Aldol缩合反应。
Aldol特点:酮:活性小于醛,反应速度慢。
1. 对称酮产物较单纯。
2. 不对称酮的自身缩合,在碱性或酸性催化下,反应都发生在取代较少的羰基碳原子上。
羟醛缩合催化剂碱:弱碱(如Na3PO4、NaOAc、Na2CO3、K2CO3、NaHCO3),强碱(如NaOH、KOH、NaOEt、NaH、NaNH2)酸:盐酸、硫酸、对甲苯磺酸、三氟化硼以及阳离子交换树脂等Cannizzaro反应(歧化反应)定义:凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇。
甲醛的羟甲基化反应和交叉Cannizzaro反应能同时发生,是制备多羟基化合物的有效方法。
定向醇醛(酮)缩合方法:A.烯醇盐法:醛或酮与具位阻的碱如LDA(二异丙胺锂)作用,形成烯醇盐再与另一分子醛或酮作用,B.烯醇硅醚法:醛、酮转变成烯醇硅醚,在TiCl4催化下与另一分子醛、酮分子作用。
C. 醛、酮与胺形成亚胺,与LDA形成亚胺锂盐,再与另一分子醛、酮作用。
Diels-Alder反应含有一个活泼的双键或叁键的烯或炔类和二烯或多烯共轭体系发生1,4-加成,形成六员环状化合物的反应称为Diels-Alder反应。
该反应易进行且反应速度快,应用范围广,是合成环状化合物的一个非常重要的方法。
《药物合成》第四章缩合反应

具有活性H的化合物与羰基化合物(醛、酮、酯等) 之间的缩合反应。主要包括: α -羟烷基、卤烷基、 氨烷基化反应;β-羟烷基, β-羰烷基化反应
第一节: α-羟烷基、卤烷基、氨烷基化反应
一、α-羟烷基化反应
主要包括 1.羰基α-位碳原子的α-羟烷基化(aldol 缩合) 2. 不饱和烃的α-羟烷基化反应(Prins 反应) 3.芳醛的α-羟烷基化反应(安息香缩合) 4.有机金属化合物的α-羟烷基化
缩合反应
Condensation Reaction
本节主要内容
α-羟烷基化反应 α-卤烷基化反应 α-氨烷基化反应 β-羟烷基化反应 β-羰烷基化反应
前言
缩合:两个或多个有机化合物分子通过反应形成一个 新的较大分子或同一分子内两个官能团重新连接 而生成新的分子的过程,即称为缩合。
反应特点: 有小分子的水或醇等脱去,从而建立新的C—C键 或 C—Y(碳—杂)键。
1、羰基α位碳原子的α羟烷基化(Aldol缩合)
定义:含有α-活性氢原子的醛或酮,在碱或 酸的催化下发生自身缩合,或与另一分子的醛或 酮发生缩合,生成β-羟基醛或酮类化合物的反应, 称α-羟烷基化反应。
但该类反应不稳定,易消除脱水生成α,β-不 饱和醛酮。故此反应又称醛醇缩合(Aldol缩合)反 应。
缩合而生成新的C—C键的一种缩合方法;主要有烯醇 盐法、烯醇硅醚法、亚胺法。
机理①烯醇盐法
②烯醇硅醚法
③亚胺法:将醛与胺类反应生成亚胺,再与LDA作用转变为亚胺锂盐,然
后与另一醛、酮分子发生醛醇缩合而得α,β-不饱和醛。机理如下:
对羰基进行加成
例 (4)甲醛与含有α-活性氢的醛酮之间的缩合(Tollens缩合)
CH3OCH2Cl /ZnCl2、CH3OCH Cl2/lewis酸
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应机理
如:
抗胆碱药阿托品的中间体 (90%)
Introduቤተ መጻሕፍቲ ባይዱtion
One-Pot
Aldehydes + Amines
+
Imines and Imine Surrogates
Preformed Imines Electrophiles
Silicon Enolates
Ketones
OH CH3CH CH2 COOC2H5
(95%)
加入(CH3O)3B/THF可提高收率(如上)
• (2)Grignard反应
机理:
乙醚(干) RX + Mg
RMgX
O
δ -δ +
H C H + RMgX
OMgX
H3O +
HC R
RCH2 OH + Mg(OH)X
H
• ③影响因素
• 1) the reagents are predominantly prepared by reacting alkyl, aryl, or vinyl halides with magnesium metal in aprotic nucleophilic solvents (e.g., ethers, tertiary amines);
• (b) 烯醇硅醚法
• (2)芳醛与a-活性氢的醛、酮的缩合
• 应用特点 • 制备反式芳丙醛
• 制备手性b-羟基醛 有机小分子脯氨酸催化 直接 Aldol 反应
O
+
RH
O R'
Catalyst
OH O
DMSO, RT R
R'
COOH N H
R = Ar, < 78% ee; R = Alkyl, 99% ee, R = 4-NO2Ph, 78% ee
• 二、 a-卤烷基化反应(Blanc反应)
3.影响因素
• 也可用ZnCl2(干)等Lewis酸。苯环上供电子基, 有利于反应进行。吸电子基不利于反应进行。
(87%)
• 引入-CH2Cl后,可进一步转化成其他官能 团并增长碳链。
三、a-氨烷基化反应
Mannich反应:有活泼氢的化合物(醛、酮等) 与甲醛、胺进行缩合,H原子被a-氨甲基 取代称为 a-氨甲基化反应(Mannich反应)
• most often ether solvents are used such
as diethyl ether,tetrahydrofuran, 1,4-
dioxane and dimethoxyethane, but
mixtures of these solvents with aromatic
O
O
R' R RCH2C C CR'
OH H O
O
B
OH R'
△
CC RCH2
CR' + BH
R
OHC
(CH2)3
CH CHO C3H7
OH 1150C
CHO C3H7
(62%)
CH2COCH3
O
KOH
O (90%)
甲醛与含有a-活泼氢的醛、酮之间的缩合
HCHO +
CH3COCH3
NaOH(稀) 40-420C
List, B. et al, J. Am. Chem. Soc. 2000, 122, 2395
• (3)分子内的羟醛缩合
• Robinson环化
• 2. 不饱和烃的a羟烷基化(Prins反应)
Mechanism
• 3. 安息香缩合
• 影响因素 • ① 芳醛结构的影响 • 强吸电子、强供电子对反应都不利; • 自身缩合、交叉缩合
- H2O
H2C CHCOCH3
K2CO3 2HCHO + CH3 CH2 CH2 CHO 14-200C, 3h
CH2 OH CH3 CH2C CHO
CH2 OH
(1) [H] (2) HCHO+NaOH
CH2 OH CH3 CH2 C CH2 OH
CH2 OH
三羟甲基丙烷
(45%)
(90%)
• 催化剂的影响 • 以碱催化剂为主,酸催化剂应用较少 • ④应用特点 • 定向醇、醛缩合 • (a) 烯醇盐法
第一节 a-羟烷基、卤烷基、氨烷基 化反应
一、a-羟烷基化反应
1.醇醛缩合反应(Aldol缩合)
(1)含有a-活泼氢的醛或酮的自身缩合
碱催化机理:
RCH2CR' + B
O
δ
δ
δ
R CH2CR' + RCH CR'
Oδ
O
RCHCR' O
RCH CR' + BH O
R' R BH
RCH2C CH CR'
• 亦可用K、Na、Li等还原无水氯化锌,此法 活性较高。
• Mg, Cd, Ba, In, Ge, Co, Ni, Ce等。
例如:
O CHO + Br Zn CH2 COOC2H5
THF 00C
CHCH2 COOC2H5 (50%) O
OH
CH3 CHO + Br CH2 COOC2H5 Zn / (CH3O)3B / THF r. t.
• ② 催化剂的影响
• NaCN剧毒,可用噻唑鎓盐、咪唑鎓盐等代 替
Example
4.有机金属化合物的a-羟烷基化 (1) Reformatsky反应:
醛或酮与a-卤代酸酯在金属锌粉存在下缩 合而得b-羟基酸酯或脱水得a、b-不饱和羧 酸酯的反应:
metal: Zn, Mg, Cd, Ba, In, Ge, Co, Ni, Ce; metal salt: SmI2, CrCl2, TiCl2, CeX3, Na2Te, R3SnLi, R3Sb/I2, Et2AlCl
hydrocarbons and more polar solvents
such as acetonitrile, dimethyl formamide,
dimethyl
sulphoxide,
and
hexamethylphosphoric triamide are also
used;
催化剂
• 锌粉必须活化,常用20%盐酸处理,再用 丙酮、乙醚洗涤,真空干燥。
• 2) the reagents are usually thermodynamically stable but air and moisture sensitive and incompatible with acidic functional groups (e.g., alcohols, thiols, phenols, carboxylic acids, 1°, 2° amines, terminal alkynes);
