医学实验手册:实验动物安死术
常用实验动物安乐死方法
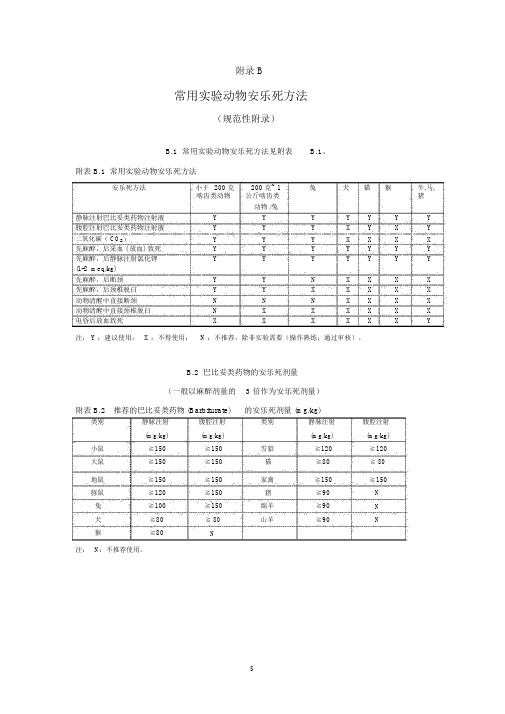
附录 B
常用实验动物安乐死方法
(规范性附录)
B.1 常用实验动物安乐死方法见附表 B.1。
附表 B.1 常用实验动物安乐死方法
安乐死方法小于200 克200 克~ 1兔犬猫猴牛,马,
啮齿类动物公斤啮齿类猪
动物 /兔
静脉注射巴比妥类药物注射液Y Y Y Y Y Y Y 腹腔注射巴比妥类药物注射液Y Y Y X Y X Y 二氧化碳( CO2)Y Y Y X X X X 先麻醉,后采血 ( 放血) 致死Y Y Y Y Y Y Y 先麻醉,后静脉注射氯化钾Y Y Y Y Y Y Y (1-2 meq/kg)
先麻醉,后断颈Y Y N X X X X 先麻醉,后颈椎脱臼Y Y X X X X X 动物清醒中直接断颈N N N X X X X 动物清醒中直接颈椎脱臼N X X X X X X 电昏后放血致死X X X X X X Y
注: Y :建议使用; X :不得使用;N :不推荐,除非实验需要(操作熟练;通过审核)。
B.2 巴比妥类药物的安乐死剂量
(一般以麻醉剂量的 3 倍作为安乐死剂量)
附表 B.2推荐的巴比妥类药物 (Barbiturate)的安乐死剂量 (mg/kg)
类别静脉注射腹腔注射类别静脉注射腹腔注射
(mg/kg)(mg/kg)(mg/kg)(mg/kg)小鼠≧150≧150雪貂≧120≧120
大鼠≧150≧150猫≧80≧ 80
地鼠≧150≧150家禽≧150≧150
豚鼠≧120≧150猪≧90N
兔≧100≧150绵羊≧90N
犬≧80≧ 80山羊≧90N
猴≧80N
注:N:不推荐使用。
5。
采血安乐死麻醉,这么全的实验动物指导方针一定要收藏!

采血安乐死麻醉,这么全的实验动物指导方针一定要收藏!导读常见实验动物指导方针:一、常见动物血液采集二、安乐死的指导方针三、常见动物麻醉的指导方针一、常见动物血液采集网站:/services-name/research-animal-resources/research-support/guidelines/blood-collection本网站收集的常见动物有以下:(点击各动物前的+号可以查看详情)1、小鼠血液采集2、大鼠血液采集3、小鼠和大鼠血液采集总结4、兔血液采集5、啮齿动物常见的采血程序介绍点击各动物前的+号,可以查看详细的采血步骤。
二、安乐死的指导方针网址:/services-name/research-animal-resources/research-support/guidelines/euthanasia本网站收集的常见动物有以下:(点击对应的物种,可以跳转到查看具体的安乐死方式)1、老鼠、老鼠、沙鼠、仓鼠或其他小啮齿动物安乐死方式① Carbon dioxide (CO2)Inhalation to effect. Flow rate must displace no more than 30% of the chamber volume/minute. Prolonged exposure may be required for neonates and fetuses.② Sodium pentobarbital(戊巴比妥钠)≥100 mg/kg intraperito neal (IP) or intravenous (IV). This is a controlled substance (DEA Schedule II). Dosing is the same for the commercial product Fatal-Plus®.③ Euthanasia solution(安乐死溶液)≥86 mg/kg IP or IV. Multiple pharmaceutical grade products available. Contains sodium pentobarbital 390 mg/ml + sodium phenytoin 50 mg/ml (dosing based on barbiturate concentration). This is a controlled substance (DEA Schedule III).④ Cervical dislocation(颈椎脱位)Use in conscious small rodents requires demonstrated technical skill (or must be performed only on unconscious/anesthetized small rodents). Use in rats >200 g to be performed under anesthesia only.⑤ Decapitation(断头)Use in conscious small rodents requires demonstrated technical skill (or must be performed only on unconscious/anesthetized small rodents). Use in rats >200 g to be performed under anesthesia only.⑥ Isoflurane overdose(异氟醚过量)Inhalation to effect. May require prolonged exposure to ensure death.⑦ Injectable anesthetic overdose(注射麻醉过量)Administration varies (IP or IV). Consult a Research Animal Resources (RAR) veterinarian regarding specific agents.⑧ Anesthesia followed by potassium chloride(麻醉后氯化钾)75-150 mg/kg KCl IV. Administer rapidly to effect.⑨ Anesthesia followed by physical method(麻醉后物理方法)Cervical dislocation, decapitation, exsanguination, bilateral pneumothorax.2、兔安乐死方式① Sodium pentobarbital(戊巴比妥钠)≥100 mg/kg IP or IV. This is a controlled substance (DEA Schedule II). Dosing is the same for the commercial product Fatal-Plus®.② Euthanasia solution(安乐死溶液)≥86 mg/kg IP or IV. Multiple pharmaceutical grade products available. Contains sodium pentobarbital 390 mg/ml + sodium phenytoin 50 mg/ml (dosing based on barbiturate concentration). This is a controlled substance (DEA Schedule III).③ Injectable anesthetic overdose(注射麻醉过量)Administration varies (IP or IV). Consult an RAR veterinarian regarding specific agents.④ Anesthesia followed by potassium chloride(麻醉后氯化钾)75-150 mg/kg KCl IV. Administered rapidly to effect.⑤ Anesthesia followed by physical method(麻醉后物理方法)Cervical dislocation, decapitation, exsanguination, bilateralpneumothorax三、常见动物麻醉的指导方针网址:/services-name/research-animal-resources/research-support/guidelines/analgesia此网站记录麻醉方式的物种有以下:1、小鼠麻醉方式小鼠麻醉指南,包括麻醉药物和程序和对新生小鼠麻醉特殊考虑。
实验动物的处死方法(一)

实验动物的处死方法(一)摘要阐述了实验动物的几种常用的处死方法,包括物理方法致死、化学药物致死、特殊实验动物的处死等,并从动物福利角度讨论了这些方法的利弊,以为实验动物的使用提供参考。
关键词实验动物;处死方法;动物福利安乐死是英文单词Euthanasia的中译,Euthanasia一词来源于古希腊语,意思是美好的死亡、快乐的死亡、无痛苦的死亡。
日本学者将Euthanasia 翻译为“安乐死”,这一译称为中国学者所接受1]。
实施安乐死一般遵循以下原则:①尽量减少动物的痛苦,尽量避免动物产生惊恐、挣扎、喊叫。
②注意实验人员安全,特别是在使用挥发性麻醉剂(乙醚、安氟醚、三氟乙烷)时,一定要远离火源。
③方法容易操作。
④不能影响动物的实验结果。
⑤尽可能缩短致死时间,即安乐死从开始到动物意识消失的时间。
⑥判定动物是否被安乐死,不仅要看动物呼吸是否停止,而且要看神经反射、肌肉松弛等状况2]。
1物理方法致死1.1急性失血法此法应用于大鼠和小鼠等小动物时,常是剪断动物的股动脉,放血致死。
可以采用摘眼球法,在鼠右侧或左侧眼球根部将眼球摘去,使其大量失血致死。
如果是犬、猫或兔等稍大型动物应先使动物麻醉、暴露股三角区或腹腔,再切断股动脉或腹主动脉,迅速放血。
动物在3~5min内即可死亡3]。
采用急性失血法动物十分安静,对动物的脏器无损害,但器官贫血比较明显,若采集组织标本制作病理切片时可用此法。
1.2断头法此法适用于鼠类等小动物,可用直剪刀,也可用断头器。
断头法处死动物时间短,并且脏器含血量少,若需采集新鲜脏器标本可采用此法。
断头法会引起血液循环的突然中断和血压的迅速下降并伴随意识的消失,只能用于恒温动物。
对于变温脊椎动物不推荐用断头法,因为它们相对能更高的抵制缺氧4]。
1.3空气栓塞法当空气注入静脉后,可阻塞其分支,进入心脏冠状动脉可造成冠状动脉阻塞,发生严重的血液循环障碍,动物很快死亡。
此法适用于较大动物的处死,家兔、猫用此法需注入20~40mL空气,犬致死的空气剂量为80~150mL。
动物实验操作要领

营养学研究
大鼠对营养缺乏比较敏感,可发 生典型的症状,是研究营养学的首 选动物。 常用于蛋白质缺乏、氨基酸、维 生素和无机离子代谢等研究; 用于营养不良和饥饿对身体发育 所产生不利影响的研究;
• 用于代谢性疾病的研究
自发高血压肥胖大鼠SHR/N-CP 用于研 究Ⅱ型糖尿病;
自发糖尿病大鼠“BB”Wistar用于研究 Ⅰ型糖尿病; 盐敏感大鼠Ds用于高盐对生理因素的 影响。
2、双色涂染法: 在每组动物不超过100只的情况下 适用。 实验动物:大鼠、小鼠。 常用染色剂: (1)3-5%苦味酸溶液,可染成黄色 ——作为“个”位数。 (2) 0.5%中性红或品红溶液,可染 成红色——作为“十”位数。
方法步骤: (1) 用两种颜色同时进行染色标记。 (2) 用苦味酸(黄色)染色标记作为个 位数,个位数的染色标记方法同单 色涂染法。 (3) 用品红(红色)染色标记作为十位 数,
小鼠的生物学特性及选择应用
一、生物学特性
• 1.对外界环境反应敏感,适应性差,强光 或噪声刺激时,可能导致哺乳母鼠神经紊 乱,发生食仔现象。温度过高或多低时, 生殖能力下降,严重时会发生死亡; • 2.对多种毒素和病原体易感,百万分之一 的破伤风毒素能使小鼠死亡;
• 3.对致癌物敏感,自发性肿瘤多。
实验动物分类
• 普通动物用于研究所获得的实验结果的反应性差,故主要 用于生物医学示教或为某项研究进行探索方法的预试验。 • 清洁动物是目前国内科研工作主要要求的标准实验动物, 适用于大多数科研实验。无特定病原体动物( SPF)是理 想的健康动物,用它来研究,可排除疾病或病原的干扰, 适用于所有科研实验、生物制品生产及检定,是国际公认 的标准实验动物。涉及具有国际交流意义的重大课题,最 好选用无特定病原体动物。 • 无菌动物是一种非常规动物,仅适用于特殊研究目的,如 微生物与宿主、微生物间的相互作用,免疫发生发展机制, 放射医学等方面的研究。由于无菌动物体内无任何可检出 的微生物,使实验简洁明确,给课题研究带来极大方便。
动物安乐死

动物安乐死发布时间:2009年12月06日20:53:48 安死术(euthanasia)是指公众认可的、以人道主义的方法处死实验动物的过程,即达到没有惊恐或焦虑而安静地、无痛苦地死亡。
安乐死方法的最重要的标准是:安乐死应具有保证实验动物中枢神经系统立即达到死去痛觉的早期抑制作用。
选择哪种安乐死术必须根据待处死动物的感觉能力而不是根据实验研究人员和操作者的主观感觉,尽管后者是不容忽视的。
因此断头术或放血致死还不失为人道主义的安乐死法。
安乐死的方法对动物的物种和年龄应是适宜的,而且应是无痛苦,不引起兴奋,能快速导致意识丧失和死亡。
此外,方法应是可靠、可重复和不可逆的。
推荐的安乐死方法见表。
建议在实施安乐死之前,对猫、犬及大型实验动物,都应使用兴奋剂。
如果可能,即将处死的动物不应该和其他实验动物在同一个房间里,特别是当用比较残忍的方法时,如断头法。
安乐死实施后,确认动物死亡十分关键。
死亡症状有心跳、呼吸停止、反射缺失。
可通过放血或取出心脏,毁损大脑、断头、切除内脏、出现尸僵来确保实验动物死亡。
施行实验动物的安死术较伴侣动物或家畜更困难。
因为它除了必须是人道的,不产生疼痛、惊恐、挣扎、叫喊以及不适的其他表现;对操作人员安全;容易操作;作用快;与动物的年龄、品系、健康状况和数量相适应;道德之能为操作人员所接受;可靠且能重复;不可逆;对环境无污染或无有害影响;对药物滥用无大的潜在危险;经济。
作为科学研究所使用的实验动物,还必须安乐死方法不引起组织的化学变化;不增加组织的化学负荷;不引起会干涉其后研究工作的组织病理学变化。
研究者通常应该知道何种研究工作应采用处死方法。
安乐死是实验动物和动物实验中处死实验动物的一种手段,这是从人道主义和动物保护角度,在不影响实验结果的同时,尽快让动物无痛苦死去的方法。
实验动物安乐死,有的是因为中断实验而淘汰动物的需要,有的是因为实验结束后做进一步检查的需要,有的是因为保护健康动物而处理患病动物的需要。
浅谈实验动物安乐死 - 中国医学伦理学(杂志)网

http :∥www.yxllx.com E-mail :zgexllx@mail.xjtu.edu.cn 中国医学伦理学Chinese Medical Ethics 2011年4月Apr.2011第24卷第2期Vol.24No.2浅谈实验动物安乐死*朱玉峰,王元占**,杨培梁,弓莉,吴湘慧,曾俊岭,刘谋荣(南方医科大学南方医院实验动物研究中心,广东广州510515)〔摘要〕在动物实验过程中或结束后,通常会为免除或减轻动物痛苦、节约动物饲养成本、获取精确的实验数据等原因,对实验动物施行安乐死。
实施实验动物安乐死,应当由经过伦理道德、技术和心理培训的人员选择适当的仁慈终点,根据动物的品种、年龄、数量、身体状况及实验目的选择最合适的安乐死方法,使动物在无痛苦的状态下迅速失去意识,直至死亡。
〔关键词〕实验动物;动物伦理;动物福利;动物安乐死;医学伦理〔中图分类号〕R -052〔文献标识码〕A〔文章编号〕1001-8565(2011)02-0260-03On the Euthanasia of Laboratory AnimalsZHU Yu -feng ,WANG Yuan -zhan ,YANG Pei -liang ,GONG Li ,WU Xiang -hui ,ZENG Jun -ling ,LIU Mou -rong(Laboratory Animal Research Center of Nanfang Hospital of Nanfang Medical University ,Guangzhou 510515,China )Abstract :During or after animal experiments ,the animals are always euthanased for various reasons including avoiding or relieving animals'pain ,saving breeding cost ,and receiving accurate data.To make the laboratory ani-mals die while in the state of grace ,the researchers who have received moral ,technological and psychological train-ing select the appropriate method of euthanasia according to the animals'species ,age ,number ,and health condi-tion.Thus the animals may be induced to death rapidly without or with a minimum of pain ,fear and anxiety.Keywords :Laboratory Animal ;Animal Ethics ;Animal Welfare ;Animal Euthanasia ;Medical Ethics1实验动物安乐死的必要性1.1对动物施行安乐死是保护动物的需要动物实验是揭示生命现象的本质和规律、发展科学技术必不可少的方法和手段。
实验四五六动物的给药、麻醉、处死术
四、涂布给药
大鼠、小鼠常采用浸尾方式经尾皮给药, 从而定性地判定药物或毒物经皮肤的吸收 作用。豚鼠、家兔涂布给药的部位通常为 脊柱两侧的背部皮肤,给药部位需脱毛后 24h方可给药。
五、直肠给药和阴道给药
不同种类实验动物不同给药方法一次给药能耐受的最大容量(ml)
动物名称 灌胃给 药
小鼠 0.9
大鼠 5.0
(3)肌肉注射给药
小鼠体积小,肌肉少,很少采 用肌肉注射。当给小鼠注射不溶 于水而混悬于油或其他溶剂中的 药物时,采用肌肉注射。用药量 不超过0.1ml/10g体重。
(4)静脉注射给药
小鼠尾静脉注射:
用75%酒精棉球反复擦拭尾部,以达到消毒和使尾 部血管扩张的目的. 以左手拇指和食指捏住鼠尾 两侧,使静脉更为充盈, 右手持4号针头注射器, 使针头与静脉平行(小于30°角),从尾巴的下1/4 处进针, 注射量为0.05-0.1ml/10g体重。
局麻常用的方法有表面麻醉、浸润麻醉和区 域阻断麻醉、脊髓麻醉等,使用最多的是浸润麻 醉。
表面麻醉:将穿透力强的局部麻醉药直接作用于 黏膜表面,使黏膜下神经末梢麻醉,可将药物配 成不同浓度的溶液、凝胶和糊剂,通过滴入、喷 雾、涂布和灌注等方法将其应用到眼、口腔、鼻 腔、喉外耳道或尿道等黏膜处,产生麻醉。多用 丁卡因和利多卡因。丁卡因常用于眼部手术,利 多卡因常用于猫气管插管前的咽喉表面麻醉。
药品:乙醚、戊巴比妥钠、咖啡因 器材:麻醉箱或其它密闭容器如烧杯、棉球
实验方法:
(一)全身麻醉法
1.吸入法:吸入麻醉是将乙醚、氯仿等挥发性麻醉 剂经呼吸道吸入体内而产生麻醉效果的方法。本法 最适合于大、小鼠的短期操作试验的麻醉。
将大鼠、小鼠或兔放入杯或缸内,将乙醚倒在 棉花上,在室温下乙醚逐渐变成气体挥发,将缸内 动物麻醉,动物倒下后立即取出,此时动物肌肉松 弛,角膜反射迟钝,皮肤痛觉消失。
标准操作规程(SOP)——实验动物的处死和处置
一、目的实验动物的处死和处置是进行动物试验的重要步骤。
在许多动物实验中,必须处死的实验动物应采用安死术,以减少动物不必要的痛苦。
二、适用范围适用于中国国家流感中心的所有技术人员对实验动物进行处死和处置。
三、程序(一)生物安全要求接种过H5、H7亚型高致病性禽流感病毒,H2N2亚型流感病毒的动物处死和处置操作需要在动物生物安全三级实验室(ABSL-3)进行。
其它动物处死和处置操作需要在动物生物安全二级实验室(ABSL-2)中进行。
(二)材料1.实验动物:中小型实验动物,如:小鼠、大鼠、豚鼠、兔等。
2.其他:注射器、手术刀、药物等。
(三)实验步骤1.大鼠和小鼠的处死(1)颈椎脱臼法1)操作者穿上工作服,戴上口罩和手套,将小鼠或大鼠放在表面粗糙的台面上,用左手拇指、食指按住鼠的头部。
2)右手将鼠尾根部用力向后上方拉,导致颈椎脱臼,动物立即死亡。
3)实验完成后将动物尸体放入生物安全袋中,集中焚烧处置。
(2)击打法1)实验者穿上工作服,戴上口罩及手套。
2)右手抓住鼠尾,提起,用力摔击其头部,鼠痉挛后立即死亡。
3)用小木锤用力击打鼠头部也可致死。
4)实验完成后将动物尸体放入生物安全袋中,集中焚烧处置。
标准操作规程(SOP )——死和处置(3)急性大量放血法1)实验者穿上工作服,戴上口罩及手套。
2)将动物麻醉后,在股动脉、股静脉处切开血管,并保持通畅,大量失血后,动物迅速死亡。
3)用于大鼠时可将颈动脉、颈静脉切开放血。
4)实验完成后将动物尸体放入生物安全袋中,集中焚烧处置。
2.豚鼠、家兔的处死(1)空气栓塞法:常用于兔的处死。
(2)实验者穿上工作服,戴上口罩及手套。
(3)左手持兔耳,用酒精棉球擦拭耳缘静脉,使血管暴露出来。
(4)右手持注射器,在兔的耳缘静脉处注射一定量空气(20-40mL)。
(5)处死大鼠时,可在尾静脉或颈静脉血管中注入一定量的空气。
(6)当空气注入静脉后,可在右心随着心脏的跳动使空气与血液相混致血液成泡沫状,随血液循环到全身。
动物安乐死
动物安乐死发布时间:2009年12月06日20:53:48 安死术(euthanasia)是指公众认可的、以人道主义的方法处死实验动物的过程,即达到没有惊恐或焦虑而安静地、无痛苦地死亡。
安乐死方法的最重要的标准是:安乐死应具有保证实验动物中枢神经系统立即达到死去痛觉的早期抑制作用。
选择哪种安乐死术必须根据待处死动物的感觉能力而不是根据实验研究人员和操作者的主观感觉,尽管后者是不容忽视的。
因此断头术或放血致死还不失为人道主义的安乐死法。
安乐死的方法对动物的物种和年龄应是适宜的,而且应是无痛苦,不引起兴奋,能快速导致意识丧失和死亡。
此外,方法应是可靠、可重复和不可逆的。
推荐的安乐死方法见表。
建议在实施安乐死之前,对猫、犬及大型实验动物,都应使用兴奋剂。
如果可能,即将处死的动物不应该和其他实验动物在同一个房间里,特别是当用比较残忍的方法时,如断头法。
安乐死实施后,确认动物死亡十分关键。
死亡症状有心跳、呼吸停止、反射缺失。
可通过放血或取出心脏,毁损大脑、断头、切除内脏、出现尸僵来确保实验动物死亡。
施行实验动物的安死术较伴侣动物或家畜更困难。
因为它除了必须是人道的,不产生疼痛、惊恐、挣扎、叫喊以及不适的其他表现;对操作人员安全;容易操作;作用快;与动物的年龄、品系、健康状况和数量相适应;道德之能为操作人员所接受;可靠且能重复;不可逆;对环境无污染或无有害影响;对药物滥用无大的潜在危险;经济。
作为科学研究所使用的实验动物,还必须安乐死方法不引起组织的化学变化;不增加组织的化学负荷;不引起会干涉其后研究工作的组织病理学变化。
研究者通常应该知道何种研究工作应采用处死方法。
安乐死是实验动物和动物实验中处死实验动物的一种手段,这是从人道主义和动物保护角度,在不影响实验结果的同时,尽快让动物无痛苦死去的方法。
实验动物安乐死,有的是因为中断实验而淘汰动物的需要,有的是因为实验结束后做进一步检查的需要,有的是因为保护健康动物而处理患病动物的需要。
动物处死法实验报告(3篇)
第1篇一、实验目的1. 掌握动物处死的基本方法,确保实验动物在处死过程中减少痛苦。
2. 熟悉不同动物处死方法的操作步骤和注意事项。
3. 了解动物处死过程中的伦理问题和法律规定。
二、实验材料1. 实验动物:小白鼠、豚鼠、兔子等。
2. 实验器材:剪刀、止血钳、手术剪、注射器、乙醚、麻醉剂、解剖台等。
三、实验方法1. 颈椎脱臼处死法(1)操作步骤:用左手抓住实验动物尾部,将其提起,放在粗糙面上。
用右手拇指和食指捏住动物头部,向下按压,使颈椎脱臼。
此时,脊髓与脑干断离,实验动物立即死亡。
(2)注意事项:操作过程中要轻柔,避免对实验动物造成二次伤害。
2. 断头处死法(1)操作步骤:用左手按住实验动物背部,拇指夹住右腋窝,食指和中指夹住左前肢。
右手用剪刀在动物颈部垂直剪断,使动物因脑脊髓断离且大量出血死亡。
(2)注意事项:操作过程中要迅速、准确,避免对实验动物造成二次伤害。
3. 击打头盖骨处死法(1)操作步骤:用左手抓住实验动物尾部,提起,用右手用木锤等硬物猛烈打击实验动物头部,使大脑中枢遭到破坏,实验动物痉挛并死亡。
(2)注意事项:操作过程中要迅速、准确,避免对实验动物造成二次伤害。
4. 放血处死法(1)操作步骤:用注射器抽取实验动物血液,使动物因失血过多而死亡。
(2)注意事项:操作过程中要迅速、准确,避免对实验动物造成二次伤害。
5. 吸入麻醉剂处死法(1)操作步骤:将实验动物放入充满乙醚的容器中,使其吸入乙醚,直至死亡。
(2)注意事项:操作过程中要控制好乙醚浓度,避免实验动物在处死过程中痛苦。
四、实验结果1. 通过本次实验,我们掌握了动物处死的基本方法,确保实验动物在处死过程中减少痛苦。
2. 熟悉了不同动物处死方法的操作步骤和注意事项。
3. 认识到动物处死过程中的伦理问题和法律规定,提高了我们的实验素养。
五、实验讨论1. 在实验过程中,我们深刻认识到动物处死的重要性,以及对实验动物福利的重视。
2. 在选择动物处死方法时,应根据实验动物种类、实验目的等因素综合考虑,确保实验动物在处死过程中减少痛苦。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医学实验手册:实验动物安死术
安死术(euthanasia)是指公众认可的、以人道主义的方法处死实验动物的过程,即达到没有惊恐及焦虑,安静地、无痛苦地死亡。
一、安死术标准
1、死亡时没有惊恐、疼痛表现。
2、使动物在最短时间内失去意识迅速死亡。
3、方法可靠且可重复。
4、保证操作人员安全。
5、采取的方法要与研究要求和目的一致。
6、对观察者和操作者的情绪影响最小。
7、对环境污染的影响最小。
8、需要的机械设备简单、价廉、易操作。
9、处死动物的地点应远离动物房并隔开。
此外还需注意通过对呼吸、心跳、瞳孔、神经反射等指征的观察,对死亡作出综合判断,确认实验动物已经死亡,同时妥善处理好尸体。
二、安死术常用方法
1、吸入麻醉法
常用的麻醉剂为乙醚,主要用于大、小鼠等小型啮齿类动物。
方法是将浸润乙醚的棉花或纱布放入密闭的容器内,将动物放入,数分钟后动物因吸入过量麻醉剂导致中枢神经过度抑制而死亡。
优点:不需要静脉注射,操作简便。
缺点:易燃易爆,具有黏膜刺激性,应配置合适的排气系统;麻醉兴奋期有时会出现动物挣扎的现象;处死豚鼠时,肺和脑会出现小出血点,在病理解剖时应注意。
2、颈椎脱位法
主要用于大、小鼠等小型啮齿类动物。
其方法是右手抓住鼠尾,将其放在实验台上,用左手拇指、食指用力向下按压鼠头及颈部,右手抓住鼠尾根部用力拉向后上方,造成颈椎脱臼,脊髓与脑干断离,动物立即死亡。
优点:脑干与脊髓分离时动物感觉不到痛的刺激,只破坏脊髓,体内脏器完整无损,适于采样时使用。
缺点:施力不当,特别是施力不够时,动物不能立即死亡,会造成动物疼痛以及肺、脾、肾等脏器充血和淤血。
3、击打头盖骨法
主要用于豚鼠、兔等啮齿类动物。
方法是用木锤等硬物重击动物头部使大脑中枢遭到破坏,动物痉挛并死亡。
优点:简单易行,操作得当能使动物痛觉立即全部消失。
缺点:操作不当仅会造成动物部分痛觉丧失;会引起脑损伤痉挛、鼻出血、颈部气管或肺内出血、个别内脏破裂等。
4、断头法
主要用于大、小鼠等小型啮齿类动物。
方法是用右手握住大鼠头部,左手握住背部,露出颈部,助手用剪刀在动物颈部垂直将头剪断,动物脑与脊髓断离且大量出血而死亡。
优点:使动物立即丧失眨眼反射,对组织和血液的生理学(酶)变化影响最小。
缺点:操作不当仅会造成动物部分痛觉丧失;血液可灌入气管及肺组织,影响肺重及组织学镜检,有时可损伤甲状腺。
5、空气栓塞法
常用于犬、猫、兔、豚鼠。
向动物静脉内注入一定量的空气,可在右心随着心脏的跳动与血液相混使血液成泡沫状,并随血液循环到全身。
进入肺动脉,可梗阻其分支,进入心脏冠状动脉,可造成冠状动脉阻塞,发生严重的血液循环障碍,动物很快死亡。
一般兔、猫等由静脉注入20~40ml,犬由前肢或后肢皮下静脉注入80~150ml。
优点:操作简便。
缺点:会造成动物抽搐、角弓反张,发出痛苦呻吟;只能用于深度麻醉的动物,不能单独使用。
6、过量注射麻醉剂法
用于各种动物。
可经静脉、腹腔、肌内、皮下和心内等途径注射大量的麻醉剂来达到迅速致死的目的,其中静脉注射最迅速有效。
最常用的麻醉药是盐酸氯胺酮和水合氯醛。
优点:价廉,作用迅速,动物无不适感。
缺点:浓度过高有局部刺激性
7、急性失血法
大鼠和小鼠可采用眼眶动脉和静脉急性大量失血方法立即死亡。
家兔可采用颈动脉急性大量失血方法立即死亡。
犬可先轻度麻醉(每千克体重静脉注射硫喷妥钠20~30mg即快速入睡),暴露股三角区,用锋利的杀犬刀在股三角区做一个约10cm的横切口,把股动、静脉全切断,立即喷出血液,用一块湿纱布不断擦去股动脉切口周围处的血液和血凝块,同时不断地用自来水冲洗流血,使切口处保持畅通,动物在3~5分钟内即可死亡。
优点:对脏器无损伤,适用于活杀采集病理切片标本。
缺点:需要受过培训、技术熟练的人员来操作,即便如此动物仍会受到很大的痛苦,仅适用于麻醉状态下的动物;易造成动物脏器贫血,影响脏器称重。
8、开放性气胸致死法
将动物开胸,使胸膜腔的压力与大气压力相等,肺脏受大气压缩发生肺萎陷,纵隔摆动,动物窒息而死。
优点:操作方便。
缺点:动物的痛觉不会立即消失;不能单独使用,要在动物麻醉状态下使用。
9、化学致死法
①将动物装笼后放入透明塑料袋内,封好后慢慢充入二氧化碳,动物很快死亡。
②静脉内注入一定量的氯化钾溶液,使动物心肌失去收缩能力,心脏急性扩张,致心脏迟缓性停跳而死亡。
家兔一般耳缘静脉注入5~10ml,犬一般前肢或后肢下静脉注入20~30ml。
③静脉注入福尔马林溶液使血液内蛋白凝固,动物由于全身血液循环严重障碍和缺氧而死,犬一般注射20mL。
优点:价廉,动物无不适感。
缺点:注射的速度要快,剂量要大到足以使动物的心博迅速停止;福尔马林毒性较大,实验人员要做好自身的防护;不能单独使用,要在动物深度麻醉后再使用。
10、脑脊髓刺毁法
主要用于蛙、蟾蜍等两栖动物和爬行动物。
具体的方法是用左手的拇指压住蛙头,右手持金属探针由头前端沿线向尾方刺触,触及凹陷处(枕骨大孔),将探针由凹陷处垂直刺入,再转向头侧,向前探入颅腔,然后向各方搅动,捣毁脑组织。
脑组织捣毁后将探针退出,再由枕骨大孔剌入,并转向尾侧,与脊柱平行刺入椎管破坏脊髓。
动物若四肢肌肉完全松弛,则脑和脊髓被完全破坏。
优点:操作得当能使动物立即丧失全部痛觉。
缺点:需要专业培训,了解蛙的骨骼结构;操作过程中要防止毒腺分泌物射入实验人员眼内,如被射入,立即用生理盐水冲洗眼睛。
