05_华理_物理化学_答案
物理化学__华东理工大学(9)--《物理化学》(上)考试试卷及答案(A)
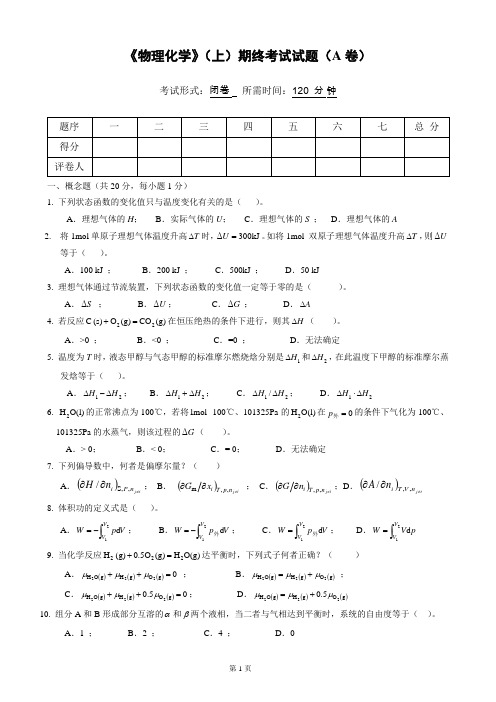
四、(14 分) 20℃时,HCl 气体溶于苯中形成理想稀溶液。
(1)当达气液平衡时,若液相中 HCl 的摩尔分数为 0.0385,气相中苯的摩尔分数为 0.095。试求气相 总压。(7 分)
(2)当达气液平衡时,若液相中 HCl 的摩尔分数为 0.0278。试求气相中 HCl 气体的分压。(7 分) 已知 20℃时纯苯的饱和蒸气压为 10010Pa。
D.
K 1
(K
2
)0.5
=1
二、(15 分) 以 25℃的 1mol CH4 (g) 和 4mol H2O(l) 为原料,在恒定压力下进行如下化学反应: CH4 (g) + H2O(g) → CO(g) + 3H2 (g)
第2页
若 CH4 的转化率为 50%,终态温度为 700℃,试求整个过程的热量。设气体服从理想气体状态方程,各物
相化合物之间彼此完全不互溶,则在 A 和 B 完整的液固平衡相图中最低共熔点有( )个。
A. 2 ; B. 3 ; C. 4;
D.5
17. 对于正偏差系统,下列正确的说法是( )。
A. pi < pi*xi ;
B.正偏差强烈时,可形成最高恒沸混合物 ;
C. pi = pi*xi ;
D.正偏差强烈时,可形成最低恒沸混合物
8. 体积功的定义式是( )。
∫ A.W
=−
V2
pdV
;
V1
∫ B.W = − V2 p外dV ; V1
∫ C.W = V2 p外dV ; V1
∫ D.W =
V2
Vd p
V1
9. 当化学反应 H2 (g) + 0.5O2 (g) = H2O(g) 达平衡时,下列式子何者正确?(
2005年华南理工大学物理化学考研试题及参考答案

8、 一般药物的有效期可通过升温时测定一定时间的分解率来确定, 例如某药物分解 30% 即无效。今在 50℃、60℃测得该药物每小时分解 0.07%、0.16%。已知浓度改变不影响每小 时该药物分解的百分数。 (1) 求此药物分解反应的活化能 Ea。 (2) 此药物在 25℃保存,试问有效期有多长? (12 分)
单分子层吸附
;
表面均匀
; 被吸
吸附与脱附同时达到平衡 。(8 分)
5 、 氧气 和 乙 炔 气 溶 于 水 中 的 亨 利 系 数 分 别 是 7.93 107 Pakgmol 1 和 2.43106 Pakgmol 1,由亨利定律系数可知,在相同条件下, 乙炔 在水中的溶解度大于 水中的溶解度。 (4 分) 氧气 在
pr=0.9929p=0.9929×101.325kPa=100.6kPa
附加压力 p= 2/r =(2×0.0589/107)Pa=1178kPa 气泡逸出的条件: pr> p 外+p=101.325kPa+1178kPa=1279kPa 所以无法逸出。
~2~
10、1.0mol 理想气体由 500K、1.0MPa ,反抗恒外压绝热膨胀到 0.1MPa 达平衡,然后 恒容升温至 500K,求整个过程的 W、Q、△U 和△H。已知 CV,m =20.786JK1mol 1。(12 分) (本题原题有错漏) 解:系统状态变化:(500K,1.0MPa,V1)→(T2,0.1MPa,V2) →(500K,p3,V2) 对恒外压绝热过程: U=W=p2(V2V1)= p2V2+0.1p1V1
=[8.315×323.15×333.15×ln(2.287)/10] Jmol1=74.05kJmol 1 (2) ln(k25/ k50)= Ea(T2T1)/RT1T2=74050×(25)/(8.315×323.15×298.15)= 2.311
05_华理_物理化学_答案

团结力量大——恩波、翔高强强联手,共同打造上海考研专业课金牌培训机构!
2、丁二稀(A)的二聚反应 2A(g) → A2 (g)为二级反应。当温度由 326℃降至 306℃时,反应速率
降低一半,试计算该反应的活化能。 [试题解析] 本题考查有关化学动力学方面的计算
1、
A(g) ⎯⎯→ B(g) + D(g)
总压
反应前:
p
A0
转化量:
−Δp
0
Δp
0
Δp
p t0 Δp
反应后: p = p − Δp
=
h
2/3
8mV
222
n +n +n
x
y
z
=
7h
2/3 ,即
4mV
222
n x
+n y
+n z
= 14 ,因此三个平动量子数只能分别等于 1,2 和 3,根据排列组合可知,该能级上可能
3
的量子态数为 P = 6 ,即 g = 6 。
3
t
12、摩尔电导率
Λ
∞ m
是电解质溶液浓度无限稀释时的摩尔电导率。(很小,无限稀释,等于零)
θ2
p /p co2
θ2
θ
p /p p /p
co
O2
θ2
100kPa / p
=
θ2
θ
1kPa / p 5kPa / p
物理化学__华东理工大学(12)--《物理化学》下册期中考试试卷及答案

A. 不变; B. 减少; C. 增加; D. 可能增加也可能减少
16. 在常温下,分子的平动、转动和振动的能级间隔由大到小的顺序是( )。
A. 平动、转动、振动; B. 转动、平动、振动;
C. 振动、转动、平动; D. 平动、振动、转动
17. 在子配分函数 q t 、 qr 、 q v 中,与系统体积无关的是( )。
C. 中间产物 B 的浓度在反应过程中出现极大值; D. 在反应过程中 B 的消耗速率不变
8. 合成氨反应为 0 N2 3H2 2NH3 ,若氮气的消耗速率用 N 2 表示,则氢气的消耗速率 H2 应为
(
)。
A. H2= N2 ;
B.
H
=
2
1 2
N2
;
C.
H
=3
2
N2
14. 关于最概然分布,下列说法中不正确的是( )。
A. 最概然分布是拥有微观状态数最多的分布;
B. 最概然分布是热力学概率最大的分布;
C. 在含有大量粒子的系统中,最概然分布代表了一切可能的分布;
D. 最概然分布的出现概率 max / Ω 随系统粒子数 N 的增大而增大
15. 在一定温度下,将 1mol 理想气体压缩,则该系统拥有的微观状态数( )。
(选填:
8. 连串反应 A k1 B k2 C 的最显著特点是
。
9. 复合反应的速率系数 k 与各基元反应速率常数间的关系为 k 2k1k2 / k3 ,则复合反应的活化
能 Ea 与各基元反应活化能 E1、E2、E3 之间的关系为
。
1
10. 由反应机理建立复合反应的速率方程常用两种近似方法,它们是
;
物理化学__华东理工大学(19)--《物理化学》(下)考试试卷及答案(A)

四、(14 分)
(1) 在 平 衡 的 独 立 子 系 统 中 , 粒 子 的 两 个 能 级 的 能 量 分 别 为 ε1 = 6.1×10−21J 和 ε 2 = 8.4 ×10−21J ,能级的简并度分别为 g1 = 3和 g2 = 5 。试求 300 K 时此两能级上分布的粒子数
第2页
之比 N2 : N1 。已知玻尔兹曼常数 k = 13.81×10−24 J ⋅ K−1 。(7 分) (2) CO 气体分子的转动惯量 I = 1.45 ×10−46 kg ⋅ m2 ,试求 100℃时 CO 分子的转动配分函数
{ } { } 1.2307V, Eo Zn2+ Zn = −0.7630 V , Eo Cl− Hg2Cl2 (s), Hg (l) = 0.2676 V , (∂E ∂T )p =
− 4.29 ×10−4 V ⋅ K−1 。 (1) 写出电极反应和电池反应;(5 分) (2) 求溶液中 ZnCl2的活度 aZnCl2 ;(5 分) (3) 当1mol Zn 发生反应时,求电池反应的 ∆rGm 、 ∆r Sm 、 ∆r H m 。(6 分)
h2 8π 2 Ik
=
(0.6626 ×10−33)2
8π
2
×
1.45
×
10−
46
×
13.81
×
10− 24
K
=
2.777 K
qr
=
T σ Θr
= 373.15 1× 2.777
= 134.4
五、解:(1) σ = σ ∗ − bc , (∂σ / ∂ c)T = −b
Γ (1) 2
⋅ dm3
⋅ s −1
华东理工物理化学书后习题解答(胡英主编_高等教育出版社)

第1章 物质的pVT 关系和热性质习 题 解 答1. 两只容积相等的烧瓶装有氮气,烧瓶之间有细管相通。
若两只烧瓶都浸在100℃的沸水中,瓶内气体的压力为0.06MPa 。
若一只烧瓶浸在0℃的冰水混合物中,另一只仍然浸在沸水中,试求瓶内气体的压力。
解: 21n n n +=2212112RT V p RT V p RT V p +=⋅2111121222112p T p T T p T T T T =+⎛⎝⎜⎞⎠⎟=+ ∴112222p T T T p ⋅+=MPa0.0507=MPa 06.02)15.273100()15.2730(15.2730⎥⎦⎤⎢⎣⎡××++++=2. 测定大气压力的气压计,其简单构造为:一根一端封闭的玻璃管插入水银槽内,玻璃管中未被水银充满的空间是真空,水银槽通大气,则水银柱的压力即等于大气压力。
有一气压计,因为空气漏入玻璃管内,所以不能正确读出大气压力:在实际压力为102.00kPa 时,读出的压力为100.66kPa ,此时气压计玻璃管中未被水银充满的部分的长度为25mm 。
如果气压计读数为99.32kPa ,则未被水银充满部分的长度为35mm ,试求此时实际压力是多少。
设两次测定时温度相同,且玻璃管截面积相同。
解:对玻璃管中的空气,p V p V 2211=kPa 0.96=kPa )66.10000.102(35251212−×==p V V p ∴ 大气压力 = kPa 28.100kPa )96.032.99(=+·28· 思考题和习题解答3. 让20℃、20 dm 3的空气在101325 Pa 下缓慢通过盛有30℃溴苯液体的饱和器,经测定从饱和器中带出0.950 g 溴苯,试计算30℃时溴苯的饱和蒸气压。
设空气通过溴苯之后即被溴苯蒸气所饱和;又设饱和器前后的压力差可以略去不计。
(溴苯Br H C 56的摩尔质量为1mol g 0.157−⋅)解:n pV RT 131013252010831452027315==×××+⎡⎣⎢⎤⎦⎥−().(.) mol =0.832 mol n m M 209501570==..mol =0.00605mol p py p n n n 22212101325732==+=×= Pa 0.006050.832+0.00605 Pa4. 试用范德华方程计算1000 g CH 4在0℃、40.5 MPa 时的体积(可用p 对V 作图求解)。
物理化学知到章节答案智慧树2023年华东理工大学
物理化学知到章节测试答案智慧树2023年最新华东理工大学绪论单元测试1.物理化学是研究速率规律和()的平衡。
参考答案:前3个选项都正确第一章测试1.下列叙述中不属于状态函数特征的是()。
参考答案:状态函数均有加和性2.在使用物质的量时,必须指明物质的基本单元,以下不正确的是()。
参考答案:1 mol铜离子3.400K、101325Pa下,1mol气体的体积为22.85 dm3,则气体的压缩因子=()。
参考答案:0.69624.下图为某物质的压缩因子图,图中标有三条等温线,则三条线上注明的温度T1、T2、T3,其大小关系是()。
参考答案:5.甲、乙、丙三种物质的临界温度分别为343.05K、373.65K和405.65K,其中最易液化的气体为()。
参考答案:丙物质6.范德华气体分子的微观模型为()。
参考答案:只具有吸引力的硬球7.在一定温度和压力下求解范德华方程,得到三个摩尔体积的值:0.0523、0.2534和2.9523 ,其中饱和液体的摩尔体积为()。
参考答案:8.物质A和B的对比温度相等、对比压力也相等,按对应状态原理,以下结论不一定正确的是()。
参考答案:它们的体积相同9.一隔板将一刚性绝热容器分为左右两侧,左室气体的压力大于右室气体的压力。
现将隔板抽去,左、右气体的压力达到平衡。
若以全部气体作为系统,则()。
参考答案:W=0、Q =0、 =010.物质的标准摩尔蒸发焓为,标准摩尔熔化焓为,标准摩尔升华焓为,三者间的关系为()。
参考答案:第二章测试1.下列叙述不正确的是()。
参考答案:凡是不违背能量守恒原理的过程都能发生2.关于可逆过程,以下叙述不正确的是()。
参考答案:无限接近平衡的条件下进行的过程3.已知低温热源T2是高温热源T1的0.6倍,则其间运转的可逆热机()。
参考答案:0.44.克劳修斯不等式表示的意义不正确的是()。
参考答案:小于零:过程逆向进行5.绝热不可逆过程中,系统(Sys)与环境(Sur)的熵变,正确的是()。
华东理工大学《物理化学》 练习题答案
第1章 物质的pVT 关系和热性质基本概念1.(1) (3)。
2. (1)分子无体积;(2)分子间无相互作用。
3.气。
4.气液共存区的边界线;不稳定区的边界线。
375.0ccc c ==RT V p Z ,得到普遍化的范德华方程以及对应状态原理。
5.a 气体;b 饱和气体;c 气液共存;d 饱和液体;e 液体。
6.不能,MPa 8.59=p7.状态一定,状态函数的量值一定;状态函数量值的变化仅与系统的初终状态有关。
对于一个均相系统,如果不考虑除压力以外的其他广义力,为了确定平衡态,除了系统中每一种物质的数量外,还需确定两个独立的状态函数。
8. (1) 外p p =,(2) =常数外p p =。
9. (1)封闭系统;(2)封闭系统,恒容过程,非体积功为零;(3)封闭系统,恒压过程,非体积功为零。
10. 压力为0.1MPa 下处于理想气体状态的气态纯物质。
压力为0.1MPa 下的液态和固态纯物质。
压力为0.1MPa 下浓度为3dm mol 1-⋅或1kg mol 1-⋅的理想稀溶液中的溶质。
11. 降低;=。
12.BB B )0(νζn n -=。
从数量上统一表达反应进行的程度。
13.<, =。
14.=, <。
15.=, >。
16. (1)×;(2)×;(3)√。
17. 实验测定;经验半经验方法;理论方法。
18. 反应前后气体的物质的量之差。
计算题1. 解:mol 1071.6mol )15.27330(3145.8101001021.169363--⨯=⎥⎥⎦⎤⎢⎢⎣⎡+⨯⨯⨯⨯==RT pV n []211122112211 )-(1 M y M y n M n y M y n M n M n m +=+=+= []2211) -( M M M y n +=836.001.4601.30101.461071.6219.0132121=-⋅⎪⎭⎫ ⎝⎛-⨯=-⋅⎪⎭⎫⎝⎛-=∴-M M M n m y 2. 解:以“1”代表空气,以“2”代表H 2O ,()mol 613.0mol 15.273253145.8100.1510325.1013311=⎥⎦⎤⎢⎣⎡+⨯⨯⨯⨯==-RT pV n3.174kPa kPa 01982.0613.001982.0325.10121222=⎪⎭⎫⎝⎛+⨯=+⋅==n n n p y p p331121dm 5.15dm 0.15613.001982.0613.0=⨯+=⋅+=V n n n V3. 解:以“1”代表NO ,以“2”代表“Br 2”,以“3”代表NOBr 开始时,p 1(0) = 23.102kPa9.76kPa Pa 10055.13003145.8)81.159/660.0()/()0(32222=⨯⨯⨯===-V RT M m V RT n p 平衡时,[]3213323132121)0()0(21)0()0(p p p p p p p p p p p p -+=+⎥⎦⎤⎢⎣⎡-+-=++=[]14.25kPa kPa )737.2576.9102.23(2)0()0(2213=-+=-+=∴p p p p 8.85kPa kPa )25.14102.23()0(311=-=-=p p p 2.64kPa kPa )25.142176.9(21)0(322=⨯-=-=p p p 4. 解:()RT b V p =-m , b pRTV +=m ,1,m 2,m kV V = 即kb p RT k b p RT k b p RT +=⎪⎪⎭⎫ ⎝⎛+=+112, ⎪⎪⎭⎫ ⎝⎛-=-=-21121)1(p p k p RT p RT p RT k k b ⎪⎪⎭⎫ ⎝⎛-⋅-=∴21111p p k p RT k b 133mol m 10132.5101.3250.01107510101.325273.15)(08.31450.01107511-⋅⎪⎭⎫ ⎝⎛-⋅⨯+⨯⋅-=135mol m 102.437--⋅⨯=A 3*m 3444N r V b ⋅⋅==π0.134nm m 100.134m 10022.61610437.2316393/12353/1A =⨯=⎪⎪⎭⎫⎝⎛⨯⨯⨯⨯=⎪⎪⎭⎫ ⎝⎛=∴--ππN b r5. 解:(1) I ,液-固;II ,气-液;III ,气-固。
2005年华南理工大学物理化学考研试题及参考答案
葛华才整理并解答.
2005 年《物理化学》(二) 参考答案
△U1=△H1△pV=△H1△nRT=44.01kJ.mol11×8.315×298 J.mol 1=41.53kJ.mol 1 4. (1)请简要回答胶体系统的主要特征是什么 ? 胶体系统能在一定程度上稳定存在的主要 原因是什么?(6 分) (2) 反应 Ba(SCN)2+K2SO4→2KSCN+BaSO4,在 K2SO4 稍过量的情况下, 生成 BaSO4 溶胶, 试写出 BaSO4 溶胶的胶团结构表示式。(4 分) 解答:(1) 主要特征:高度分散,多相,热力学上的不稳定系统。胶体系统能够稳定存在的主 要原因与胶粒带电有关。 (2) K2SO4 为稳定剂,胶团结构为 [(BaSO4)m nSO42 . (2nx)K+]x . xK+ 或 [(BaSO4)m nSO42 . 2(nx)K+]2x . 2xK+
= cBRT=(0.1976×1000×8.315×298.2)Pa=4.90×105Pa
(3) 已知水在 100℃时的蒸气压 pA=101.325Pa,求 25℃时的蒸气压 p,利用克克方程 ln(p/101.325kPa)= (40670/8.315)(1/298.151/373.15)
1 H2O(l, 1 mol, 298K, p )
ΔH
H2O(g, 1 mol, 298K, p=101325Pa) ↑△H4
↓△H2
ΔH
3 H2O(l, 1 mol, 298K, p*) H2O(g, 1 mol, 298K, p*=3168Pa )
忽略压力对液体的影响:△H2≈0,△S2≈0, 平衡相变过程:△H3 =44.01kJ.mol 1 △S3=△H3/T=44.01kJ.mol 1/298K=147.7 J. K1.mol 1 气相变压过程:△H4 =0 △S4= Rln( p/p*)=[8.315×ln(101325/3168)] J. K1.mol 1=28.81 J. K1.mol 1 因此 △H1=△H2+△H3+△H4=(0+44.01+0) kJ.mol 1= 44.01kJ .mol 1 △S1=△S2+△S3+△S4=(0+147.728.81) J. K1.mol 1= 118.9J. K1.mol 1 △G1=△H1T△S1=(44.010.298×118.9) kJ.mol 1=8.578 kJ.mol 1
华东理工大学2005年物理化学考研试题
华东理工大学2005年硕士研究生入学考试试题一、(20分)1.在绝热密闭的房间里置有一电冰箱,若将电冰箱接通电源使其运转,则房间里的温度_____(上升、下降、不变)2.孤立系统中进行的过程都是向着熵增大的方向进行。
____(对、错)3.在两个不同温度的热源T1和T2间,有一以理想气体为工作介质的可逆热机,其热机效率为30%。
若将工作介质换为实际气体,则此可逆热机的效率____30%(大于、等于、小于)4.一定量的理想气体经节流膨胀,其热力学函数的变化U___0,H___0,S__0,G__0。
(>,=,<)5.热力学基本方程dG=-SdT+Vdp的适用条件是__________。
6.若以Xi表示均相系统中任一组分i的偏摩尔量,则Xi的定义式是________。
7.混合物中组分i的逸度用fi表示,则组分i的化学势表达式为i=_____。
8.氨在炭上的吸附服从兰缪尔吸附等温式,则在低压下单位界面吸附量与平衡压力呈_____关系。
(直线、曲线)9.光化学反应的量子效率可以大于1,可以小于1,也可以等于1。
_____(对、错)10.一纯物质液体在毛细管中呈凹面,则此凹面液体的蒸气压比同温度下平面液体的蒸气压____。
(大,小,无法确定)7h211.一平动子处于能量1的能级上,则此能级的简并度gt=_____。
2/34mV12.摩尔电导率m是电解质溶液浓度______时的摩尔电导率.(很小,无限稀释,等于零)13.用对消法测定电池反应的电势,目的在于_____。
(A .保护标准电池;B.延长被测电池的寿命;C.使电池在接近可逆条件下工作)二、(21分)2mol理想气体由1013.25kPa,10dm3,609.4K的初态,在101.325kPa的恒定外压下膨胀至80 dm3,且内外压力相等。
求此过程的Q、W、U、H、S、A、G.已知该理想气体初态的熵值S1=400J K1,Cv,m=12.5 J K1mol1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
θ
∴ 燃烧反应的 Δ H < 0 rm
∴
θ
d ln K dT
θ
ΔH = rm
2
RT
<0,
θ
即反应的平衡常数 K 随反应温度 T 的升高而变小。
六、(19 分)
1、物质 A(g)在 450 K 于一恒容容器中发生气相分解反应 A(g) → B(g)+ D(g)。反应开始时
只有 A(g)存在,压力为 213 kPa 。反应进行到 100 S 时,系统总压为 233 kPa 。试求此一级反应的速率 常数、A 的半衰期以及 120 S 时 A 的转化率。
[试题解析]
根据开尔文公式 ln
p r
p
=
2σ M rρ RT
可得, p r
<
p 。(其中 r 为弯曲液面的曲率半径,凹液面的 r 取负值, 0
0
凸液面的 r 取正值)
11、一平动子处于能量 εi
=
7h2 4mV 2/3
的能级上,则此能级的简并度 gt = 6
。
[试题解析]
( ) 2
2
因为平动能 ε t
= −14.36KJ
同理可得, ΔH = −9.19KJ , ΔH = 2.52KJ , ΔH = 32.14KJ
2
3
5
θ
又因为 ΔH = Δ H (373K ) = 40.66KJ / mol
4
vap m
所以:
θ
θ
ΔH (800K ) = ΔH + ΔH + ΔH (298K ) + ΔH + ΔH + ΔH = −234.03KJ
团结力量大——恩波、翔高强强联手,共同打造上海考研专业课金牌培训机构!
μi
=
μ i
=
μθ i
+
RT
ln
f
i θ
。
p
8、氨在炭上的吸附服从兰缪尔吸附等温式,则在低压下单位界面吸附量与平衡压力呈 直线 关系。(直 线,曲线)
[试题解析]
根据兰缪尔等温吸附理论可得θ = V = bp ,在压力很低的情况下 bp << 1 ,则该等温吸附方程可 V 1+ bp
团结力量大——恩波、翔高强强联手,共同打造上海考研专业课金牌培训机构!
华东理工大学 2005 年物理化学考研试题解析
一、(24 分) 1、在绝热密闭的房间离置有一电冰箱,若将电冰箱接通电源使其运转,则 房间里的温度 上升 。 (上升,下降,不变) [试题解析] 把电冰箱和房间作为一个系统,则外界输入电冰箱的电能将最终以热能的形式散发到房间里,而房间 是绝热密闭的,故房间的温度必然会上升。
[试题解析] 本题考查摩尔无限稀释摩尔电导率的概念。
13、用对消法测定电池反应的电势,目的在于 C 。(A.保护标准电池; B 延长被测电池的寿命; C. 使电池在接近可逆条件下工作)
[试题解析] 因为电池有内阻,当有电流通过时,内阻会分配一部分电压,因此其路端电压要比电池反应的电动势 要低。采用对消法,使电流无限小,即电池在接近可逆条件下工作,这时所测得的路端电压就会无限接近 电池反应的电动势。
(2)HCl 的分压为: p = p − p = 101.3 − 9.625 = 91.7KPa
1
2
团结力量大——恩波、翔高强强联手,共同打造上海考研专业课金牌培训机构!
由亨利定律可得: p = k x 1 x1
因 为 当 HCl 的 液 相 摩 尔 分 数 为 0.0385 时 , 其 气 相 分 压 为 91.7 KPa , 所 以 :
X i
=
⎛ ⎜⎜⎝
∂X ∂n
i
⎞ ⎟⎟⎠T , p,nj≠i
。
[试题解析] 偏摩尔量定义:多组分系统中的任一广延量 X 在温度和压力及除了组分 i 外其他各组分的物质的量均 不变的条件下,由于组分 i 的微笑的变化而引起系统广延量 X 随组分 i 的物质的量的变化率。根据定义可 得上述定义式。
7、混合物中组分 i 的逸度用 fi 表示,则组分 i 的化学势表达式为
团结力量大——恩波、翔高强强联手,共同打造上海考研专业课金牌培训机构!
二、(21 分) 2 mol 理想气体由 1013.25 kPa ,10 dm3 , 609.4 K的初态,在 101.325 kPa的恒定外压下膨胀至 80 dm3 ,且内外压力相等。求此过程的Q、W 、△U 、△H 、△S 、△A、△G 。已知该理想气体初态的 熵值S1=400 J· K-1·mol-1 [试题解析] 本题考查理想气体纯 PVT 变化过程的热力学计算。
m
简化为V ≈ V bp ,此时单位界面的吸附量与平衡压力近似 呈线性关系。 m
9、光化学反应的量子效率可以大于 1,可以小于 1,也可以等于 1。对 (对,错) [试题解析] 本题考查光量子效率的概念:吸收一个光子能发生反应的分子个数。
10、一纯物质液体在毛细管中呈凹面,则此凹面液体的蒸汽压比同温度下平面液体的蒸汽压 小 。(大, 小,无法确定)
m
1
2
m
3
4
5
四、(16 分) 20℃时,HCl 气体溶于苯中形成理想稀溶液。(1)当气液平衡时,若液相中 HCl 的摩尔分数为 0.0385 , 气相中的苯的摩尔分数为 0.095 。试求气相总压;(2)当达气液平衡时,若液相中的 HCl 的摩尔分数为 0.0278。试求气相中 HCl 气体的分压。 已知 20℃时纯苯的波阿和蒸汽压为 10010 Pa 。 [试题解析] 本题考查多组分系统热力学的计算,主要是关于拉乌尔定律和亨利定律的应用。
2、丁二稀(A)的二聚反应 2A(g) → A2 (g)为二级反应。当温度由 326℃降至 306℃时,反应速率
降低一半,试计算该反应的活化能。 [试题解析] 本题考查有关化学动力学方面的计算
1、
A(g) ⎯⎯→ B(g) + D(g)
总压
反应前:
p
A0
转化量:
−Δp
0
Δp
0
Δp
p t0 Δp
反应后: p = p − Δp
=
h
2/3
8mV
222
n +n +n
x
y
z
=
7h
2/3 ,即
4mV
222
n x
+n y
+n z
= 14 ,因此三个平动量子数只能分别等于 1,2 和 3,根据排列组合可知,该能级上可能
3
的量子态数为 P = 6 ,即 g = 6 。
3
t
12、摩尔电导率
Λ
∞ m
是电解质溶液浓度无限稀释时的摩尔电导率。(很小,无限稀释,等于零)
[试题解析]
本题考查有关化学平衡的计算。
( ) θ ( ) ( ) (1)因为 K =
θ2
p /p co2
θ2
θ
p /p p /p
co
O2
θ
=K p P
7
所以
θθ
K =K /p P
= 3.23×10 3 100 ×10
−1
= 323Pa
(2)设压力商为 J ,则 p
( ) ( ) J = ( ) ( ) ( ) ( ) p
∵ pV = nRT
pV
∴
T 2
=
2 2 T = 487.5K pV 1
11
∫'
W = − p dV = p (V −V ) = −810.6J 21 2
ΔU = nC (T − T ) = −3.048KJ V ,m 2 1
ΔH = nC (T − T ) = n(C + R)(T − T ) = −5.075KJ
[试题解析] 可逆热机的效率只与高低热源的温度有关,与工作介质无关。
4、一定量的理想气体经节流膨胀,其热力学函数的变化△UU = 0 ,△H = 0 ,△S > 0 ,△G = 0 。(>、=、<) [试题解析]
节流膨胀过程的 ΔH = 0 ,压强 p 减小。对于理想气体,节流膨胀前后温度 T 不变。而理想气体的内
p,m 2 1
V ,m
21
T
V
ΔS = nC ln 2 + nR ln 2 = 29.0J / K
V ,m T
V
1
1
∴ S = S + ΔS = 429.0J / K
2
1
ΔA = A − A = (U − T S ) − (U − T S )
2
1
2 22
1 11
= ΔU − (T S − T S ) = 31.58KJ 2 2 11
CΘ p,m
(H2
,g)=(29.07-0.84×10-3 T/K)J·K-1·mol-1
,
CΘ p,m
(O2
,g)=(36.16+0.85×10-3 T/K)J·K-1·mol-1
,
CΘ p,m
(H2O
,l)=75.26 J·K-1·mol-1
,
CΘ p,m
(H2O
,g)=(30.0+10.71×10-3 T/K)J·K-1·mol-1
θ
H (g) + O (g) ⎯Δ⎯Hm⎯(298⎯K )⎯→ H O(l)
2
2
2
ΔH 3
298 K
因为:
dH = nC dT p,m
所以:
∫ ΔH =
T2 n(H
θ
)C
(H )dT
1
T1
2 p,m 2
= n(H
⎡ ) ⎢29.07(T
