亲核取代反应及其影响因素
亲核取代反应及其影响因素

亲核取代反应及其影响因素摘要:饱和碳原子上的亲核取代反应主要有两种:单分子亲核取代反应(S N1)与双分子亲核取代反应(S N2)。
大多数反应介于这两种极端情况之间。
人们提出离子对机理与邻近基团参与的理论来解释反应情况与构型变化的问题。
亲核取代反应的反应速度,与烃基的数量、离去集团的大小、亲核试剂的活性以及溶剂的极性等有关。
一般来说,烃基数量少,离去基团大,亲核试剂亲核性强,溶剂的极性弱,对S N2反应有利;烃基数量多,离去基团大,溶剂的极性强,对S N1反应有利。
另外,亲核取代反应和对应的消除反应(单分子消除反应E1、双分子消除反应E2与S N1、S N2)互为竞争性反应。
强碱和较高的温度有利于消除,弱碱和强亲核试剂有利于取代;有利于碳正离子生成的条件,有利于按单分子机理进行;不利于底物异裂的条件,有利于双分子反应。
正文:一、烷基结构的影响1.烷基的结构对S N2 反应的影响反应中,如果中心碳原子上连接的取代烷基(支链)越多,它们对亲在卤代烷的SN2核试剂从碳卤键背后进攻中心碳原子的空间位阻就越大,使得发生有效碰撞的概率大为下降;而在过渡态时众多的支链与中心碳原子要保持在同一个平面内,其张力是很大的,这就使形反应的活性下降,反应速成过渡态需要有非常高的活化能,这些都将导致卤代烷进行SN2率减小。
例如,I-与下面各溴代烷的丙酮溶液中于25℃发生S N2 反应时的相对反应速率为:反应的速率也有明显的影响,即卤如果在卤代烷的β- 碳原子上连有支链烷基时,对SN2代烷中心碳( α- 碳)原子上连接的烷基体积越大,其空间位阻越大,不利于亲核试剂的攻击。
反应时,在其它条件相同时,不同结构卤代烷的反应活性综上所述,卤代烷进行SN2次序为:2.烷基的结构对S N1 反应的影响在S N1 反应中,由于决定反应速率的步骤是碳正离子的生成。
因此,烷基子离子越稳,越易形成,生成时的活化能越低,反应速率也越快,由于烷基正离子稳定性的顺序是:(CH3)3C+>(CH3)2CH+>CH3CH2+>CH3+所以,在S反应中,卤代烷的活性顺序为:R3CX > R2CHX > RCH2X > CH3X N1(3°>2°>1°>CH3X),例如:卤代烷与AgNO溶液的反应被认为是S N1 机理。
8.3影响亲核取代反应的因素

4
08-03 影响亲核取代反应的因素
b. 对SN1的影响:烷基的供电子效应及C-H的 σ-p 超共轭效应有利于稳 定碳正离子中间体。 有利于稳定碳正离子的因素就有利于SN1反应。
SN1反应速度:叔卤代烃 > 仲卤代烃 > 伯卤代烃
CH3 CH3 CH3-C-X > CH3-CH-X > CH3CH2-X > CH3-X CH3
08-03 影响亲核取代反应的因素
主讲人:袁金伟
08-03 影响亲核取代反应的因素
影响亲核取代反应机制的因素 □ 底物卤代烃的结构 □ 亲核试剂的亲核能力 □ 离去基的离去能力 □ 溶剂效应
08-03 影响亲核取代反应的因素
□ 卤代烃结构的影响 a. 对SN2的影响:与X相连的C上连接的基团体积越小,易进行SN2反应。
08-03 影响亲核取代反应的因素
6
08-03 影响亲核取代反应的因素
□ 亲核试剂亲核能力的影响 在SN1反应中,决定反应速度的步骤是 R-X 的离解,而与亲核试剂的
亲核性和浓度的改变无关,对SN1反应影响不大。
在SN2反应中,由于亲核试剂参与过渡态的形成,因此,亲核试剂的 亲核性和浓度越大,体积越小,则SN2反应速率越快。 一些试剂的亲核能力比较: HS- > RS- > CN- > I- > NH3 > OH> Br- > OR- > Cl- > F- > H2O
反应物
极性变化不大
过渡态
极性溶剂对它的稳 定化作用比反应物 差
10
08-03 影响亲核取代反应的因素
例如, I- 与下面各溴代烷的丙酮溶液中于25℃发生 SN2 反应时的相对反 应速率为: 相对转化速率( SN2 ) CH3Br > C2H5Br > (CH3)2CHBr > (CH3)3CBr
亲核取代反应的历程及影响因素
2. 底物 + 亲核试剂
中性分子 中性分子
RX +
NH3 H2O HOR'
R+NH3X- NH3
RO+H2
RO+R' H
- H+ - H+
RNH2 + NH+4XROH ROR'
3. 底物为正离子:
RN+(CH3)3 + OH+ H2S
ROH + N(CH3)3 R+SH + N(CH3)3
Organic Chem
νC-F νC-Cl νC-Br νC-I
1000-1350 cm -1 (S) 700-750 cm-1 (m) 485-610 cm-1 (m) 485-610 cm-1 (m)
1.24-1.55
R CH2
CH2
CH2
X
1.03-1.08
2.16-4.4
例: H3C CH2 CH2 Cl
54
3
2
1
2-甲基-4-溴戊烷
H3C CH CH CH2 CH3
12
34
5
3-甲基-2-氯戊烷
(取代基离两端等距离,
优先考虑列出的基团 )
Organic Chem
H3C
4
1
CH2Cl
CH2 CH CH2 CH3
3
2
2-乙基-1-氯丁烷
Br
H3C CH CH CH CH3
54
3
2
1
4-溴-2-戊烯
优先使双键的位次最小
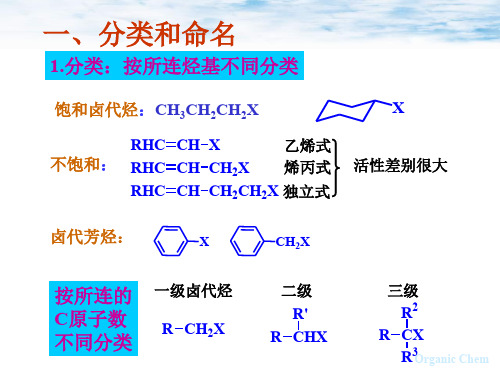
也可按所含卤原子数目分为:
一卤代物: R-X 二卤代物: CH2X2 多卤代物: CHX3,CX4 2.命名: 系统命名法
有机化学基础知识点亲核取代反应的机理

有机化学基础知识点亲核取代反应的机理在有机化学领域中,亲核取代反应是一类重要的反应类型,它涉及一个亲核试剂与有机物中电子不足的位点之间的亲核攻击和断裂反应。
亲核取代反应机理的理解对于合成新颖的有机化合物以及研究有机反应有着至关重要的意义。
本文将介绍亲核取代反应的一些基础知识点,并详细解析其机理。
一、亲核试剂的选择亲核取代反应中,亲核试剂的选择通常是根据底物的特性来确定的。
常见的亲核试剂包括氢离子(H^-)、氧化物离子(O^-)、卤素离子(Cl^-、Br^-、I^-)等。
不同的亲核试剂对应着不同的反应类型和机理。
二、亲核取代反应的机理亲核取代反应的机理大致分为两步:亲核攻击和断裂反应。
1. 亲核攻击在亲核取代反应中,亲核试剂通过自身的强电子亲合性,攻击有机底物上的电子不足的位点(如C=O双键、C-X键等)。
亲核试剂的亲核攻击会导致分子内电子重新分布,形成新的共价键。
2. 断裂反应亲核攻击后,原有的化学键会发生断裂,底物分子会发生结构改变。
通常情况下,在亲核取代反应中,断裂反应是一个带有正电荷的离去基团的离去,形成新的化学键。
三、亲核取代反应的分类和示例亲核取代反应可以根据亲核试剂的种类和底物中亲电子受体的特点进行分类。
下面将以常见的亲核试剂和底物为例,介绍几种典型的亲核取代反应:1. 氢离子(H^-)的亲核取代反应氢离子亲核取代反应是有机化学中最基础的反应类型之一,常用来合成醇、胺等化合物。
例如,酯的水解反应就是氢离子亲核取代反应的一个典型例子:[示例反应方程式]2. 水氧离子(OH^-)的亲核取代反应水氧离子亲核取代反应广泛应用于合成醇、酚等化合物。
这类反应以醇的合成反应为代表,其机理与氢离子亲核取代反应类似。
3. 卤素离子(Cl^-, Br^-, I^-)的亲核取代反应卤素离子亲核取代反应是常见的有机反应类型,用于制备卤代烃等化合物。
其中,氯离子亲核取代反应最为常见。
以氯离子的亲核取代反应为例,其机理如下:[示例反应方程式]四、亲核取代反应的影响因素亲核取代反应的速度和产率受多种因素的影响,包括溶剂、温度、底物结构等。
影响亲核取代反应的因素

影响亲核取代反应的因素2010-04-27 08:55饱和碳原子上的亲核取代反应可按SN1和SN2两种不同历程进行。
亲核取代反应的两种历程,在反应中同时存在,相互竞争。
但对一种反应物来说, 在一定条件下, 与亲核试剂作用时, 我们能否知道, 反应究竟按什么历程进行?如果对不同的反应物, 我们能否预计哪一个快, 哪一个慢?对于这样类似的一系列问题, 通过许多科学家的研究, 现在已经找到明确而肯定的答案。
研究表明, 反应历程和反应活性与反应物中的烃基结构, 离去基团性质, 亲核试剂性质以及溶剂性质等因素都有关系, 下面分别讨论。
5.5.1烃基结构的影响影响反应历程的因素很多,卤代烃本身结构是主要因素之一。
在卤代烃分子中,反应中心是a-C原子。
a-C原子上电子密度的高低,直接影响反应历程。
如果a-C原子上电子密度低,则有利于Nu-进攻,有利于反应按双分子历程进行。
反之,如果a-C原子上电子密度高,则有利于卤素夺取电子而以X-的形式离解,所以有利于按单分子历程进行反应.从反应中间体来看如果能形成稳定的正离子,则有利于反应按SN1历程进行。
反之,则有利于SN2历程。
烃基结构对亲核取代反应的影响, 可以通过分析烃基的电子效应和空间效应来确定。
先看看SN1和SN2两个决速步骤中过渡态的结构(见表5.8)。
表5.8 SN1和SN2过渡态结构反应历程SN2SN1过渡态结构电荷分散集中体积比反应物拥挤比反应物宽松在卤代烃的亲核取代反应中, 烃基的立体效应和电子效应对SN1和SN2影响程度不同。
对SN2历程,烃基的立体效应是主要的,而对SN1历程,烃基的电子效应是主要的。
5.5.1.1 烃基的立体效应由于SN2历程中形成的过渡态比较拥挤, 所以SN2历程对烃基的立体效应比较敏感。
(1)当中心碳原子上的支链增多时, 不利于SN2反应, 有利于SN1反应。
考虑立体因素时,伯卤代烃有利于SN2反应,叔卤代烃有利于SN1反应。
亲核取代反应 (SN )

RO- > HO- > PhO- > RCOO- > ROH > H2O
碱性逐渐减弱
亲核性逐渐减弱
*3 亲核试剂中取代基的空间位阻效应较大时,不利于试剂接近 底物分子。因此,取代基的空间效应大于其电子效应:
C2H5NH2 > (C2H5)2NH > (C2H5)3N
CH3O- CH3CH2O- (CH3)2CHO- (CH3)3CO-
第二十二章 亲核取代反应 (SN )
§1 亲核取代反应的机制 §2 影响亲核取代反应的因素
定义:有机化合物分子中的原子或原子团被亲核试 剂取代的反应称为亲核取代反应。
反应包括中心碳原子与离去基团相连的键断裂,进入 基团 (亲核试剂) 和中心碳原子构成新键。 中心碳原子 RCH2–A + Nu: RCH2–Nu + A: 底物 (进入基团) 产物 离去基团 亲核试剂 受进攻 的对象 一般是负离子或带孤 对电子对的中性分子
(2)试剂亲核性对亲核取代反应的影响
试剂亲核性的强弱对SN1反应不重要。 试剂亲核性越强,对SN2反应越有利。 碱 性: 试剂对质子的亲合能力。 亲核性: 一个试剂在形成过渡态时对碳原子的亲合能力。 亲核试剂的亲核性由两种因素决定 试剂的给电子能力 试剂的可极化性
给电子能力强,可极化性大,试剂亲核性强。
SN1
SN2
影响SN2和SN1机理的因素
SN2机理
烃 基
离去基 团 亲核性 溶 剂
1RX;CH2=CHCH2X, PhCH2X,体积小,利于翻转
SN1机理
3RX;CH2=CHCH2X, PhCH2X,生成稳定的正碳 离子 离去性能好对反应有利
离去性能好对反应有利 亲核性强对反应有利 弱极性溶剂有利
第三节 亲核取代反应历程

离子的碱性: X 离子的碱性:I - < Br- < Cl离子离去倾向: X 离子离去倾向:I - >Br- > Cl卤代烷反应活性顺序是:
R I > R Br > R Cl
(三)亲核试剂的影响
SN 2反应 反应 SN 1反应 反应
亲核试剂的亲核能力 , 亲核试剂的亲核能力↑, 亲核能力 浓度↑,反应υ↑。 浓度 ,反应 。
1.双分子亲核取代反应(S 2)历程 历程: 1.双分子亲核取代反应(SN2)历程 双分子亲核取代反应
HO + CH3 Br
CH3OH + Br
动力学特征: 动力学特征 υ = k [ CH3Br ] [ OH- ],二级反应 ,
OH-
CH3Br
空间位阻最小 静电斥力最小
H
H
Br
H HO C H H
(四)溶剂极性
1) SN 2反应 反应
Nu R L
-
2) SN 1反应 反应
C L]
δ Nu R L
[Nu
δ
R L
[R
δ
L]
δ 慢
R+ LNu
溶剂的极性变化所起的作用很小
O H Nu R O H R
H O
R
溶剂极性的提高, 溶剂极性的提高,利于碳正离子 及卤负离稳定 使反应速率加快。 稳定, 及卤负离稳定,使反应速率加快。
溶剂极性 的影响
的极性对反应不利。 的极性对反应不利。
小结:影响亲核取代机理的因素 小结:
R X C H 3X , 1o 强亲核性, 高浓度 非质子性, 小极性
:
对SN2有利 的因素
Nu 溶剂
: :
有机化学基础知识点亲核取代反应的机理和规律

有机化学基础知识点亲核取代反应的机理和规律有机化学是一门研究碳元素的化合物及其反应的学科。
其中,亲核取代反应是有机化学中一类重要的反应类型,它在有机合成、药物开发以及材料科学等领域起着关键性作用。
本文将重点介绍亲核取代反应的机理和规律,帮助读者更好地理解和应用这一有机化学基础知识点。
一、亲核取代反应的基本概念和机理亲核取代反应是一种典型的酸碱反应,即亲核试剂(通常是含有亲核试剂的阴离子)攻击了一个电子亏损的反应物,将其取代出来,形成新的化学键。
这种反应过程中,亲核试剂的亲电性中心与电子亏损的反应物的亲电性中心发生作用,从而实现取代反应。
亲核取代反应的机理可归纳为以下几个步骤:1. 亲核试剂的进攻:亲核试剂中具有亲电性的部分与电子亏损的反应物发生反应,亲核试剂的亲电性中心接近反应物的亲电性中心。
2. 形成临时五元环中间体:亲核试剂与反应物亲电性中心的结合形成一个临时的五元环中间体。
具体形成过程中,亲核试剂中的亲电性碳离子(通常是负离子)与反应物中的亲电性碳离子形成新的化学键。
3. 断裂反应物化学键:在形成临时的五元环中间体过程中,反应物中的一个化学键断裂,释放出一个亲核试剂与离去基团。
4. 形成新的化学键:离去基团离开后,亲核试剂中的亲电性碳离子与反应物中的亲电性碳离子形成新的化学键,得到产物。
二、亲核取代反应的规律和影响因素亲核取代反应的速率和产物选择性受到多种因素的影响。
下面介绍一些常见的规律和影响因素:1. 亲核试剂的选择:不同的亲核试剂具有不同的亲电性中心和亲核性,因此在不同的反应中选择适合的亲核试剂是十分重要的。
2. 电子密度和空间位阻效应:反应物中存在不同的亲电性中心时,选择攻击电子密度较高的中心更有利于反应进行。
此外,反应物或产物中的取代基团的位阻效应也会影响反应速率和选择性。
3. 溶剂选择:不同的溶剂对反应速率和产物选择性有一定影响。
一些溶剂可以稳定或降低亲核试剂的亲电性,从而影响反应速率和选择性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亲核取代反应及其影响因素航03班 林三春 2010011556摘要:本文分为四部分。
第一部分论述了亲核取代反应的组成部分:亲核试剂、离去基团、反应底物,特地列出了常见的亲核试剂、常见的离去基团。
第二部分论述了亲核取代反应机理,主要论述了四种:SN1、SN2、离子对机理和邻近基团参与机理,其中还包括各种机理的实验现象验证,以及对反应产物的影响,如对构型的影响。
第三部分论述了亲核反应的影响因素,主要有烃基、离去基团、溶剂和亲核试剂四种,详细地说明了这四种因素如何影响反应。
给出了判断离去基团的好坏,以及比较亲核试剂的亲核性的方法。
最后一部分论述了亲和取代反应与消除反应的竞争关系,其中包括SN1与E1竞争,SN2与E2竞争。
主要以卤代烃为例阐述的。
在论述的同时,还附有适当的图示,以及实验数据,通过比较等手段,使得论述更加有说服力。
全文通过这四个部分,详细、全面地介绍了亲核取代反应。
正文:亲核取代反应,简称SN 亲核取代反应,通常发生在带有正电或部分正电荷的碳上,碳原子被带有负电或部分负电的亲核试剂(Nu:-)进攻而取代。
一、亲核取代反应的重要组成成分:亲核取代反应中涉及到的三个重要组成成分为:亲核试剂、离去基团、反应底物。
称为反应底物。
进攻反应底物的试剂CH30Na (或CH3O —)是带着电子对与碳原子结合成键的,它本身具有亲核性,称为亲核试剂,一般用Nu 表示。
这类反应之所以称为亲核取代也正是因为它是由亲核试剂进攻反应底物而引起的取代反应。
反应底物上的溴原子带着电子对从碳原子上离去,所以Br-;称为离去基团,一般用L 表示。
该取代反应是在与溴相连的那个碳原子上进行的,常称该碳原子为中心原子,或反应中心。
.一般的亲核取代反应可以用如下的通式表示: 。
其中R —L 为反应底物,L —为离去基团,Nu —为亲核试剂,弯箭头表示电子转移的方向。
1、亲核试剂:亲核性是指:带负电荷或孤对电子的试剂即亲核试剂对亲电子原子的进攻的能力。
具有亲核性的物质叫做亲核试剂。
凡是带有未共享电子对的物质(如Lewis 碱)都具有一定的亲核性,它们都可能作为亲核试剂。
亲核试剂可以是中性分子,也可以是带负电的阴离子。
下表列出的是亲核取代反应中常见的一些亲核试剂:2、离去基团在进行亲核取代反应的中心碳原子上,必然连有一个能够带着电子离开的基团,即离去基团。
离去基团可以是负离子,也可以是中性分子。
常见的离去基团有等。
3、反应底物一般来说,在脂肪碳原子上连有某种离去基团的化合物都有可能作为亲核取代的反应底物。
二、亲核取代反应的反应机理:对于脂肪亲核取代反应,由于反应物结构和反应条件的差异,SN有两种机理,即单分子亲核取代反应SN1和双分子亲核取代反应SN2。
(一)SN1机理:SN1反应分两步进行:第一步是反应底物发生离解,即离去基团带着电子离开中心原子,形成正碳离子中间体;第二步是正碳离子和亲核试剂结合成键,得到取代产物:依据:1、动力学研究:(1)一级动力学反应在SN1的两步反应中,第二步是活性很高的正碳离子与亲核试剂结合,这是易于进行的快步骤;而第一步要由中性反应底物解离成有高度活性的正碳离子,是控制反应的慢步骤。
反应过程中能量变化曲线如图所示,由于控制反应速度的步骤中只涉及到一种反应物,其反应速度也仅决定这一种反应物的浓度,所以在动力学上应表现为一级反应。
(2)同离子效应。
在SN1反应中,反应底物的解离是一个平衡过程,如果外加一些与解离的离子相同的离子,则会抑制解离,减慢反应速度。
这种作用叫做同离子效应。
同离子效应是SN1反应的一个特征。
(3)盐效应。
在SN1反应中,往往是由中性物质生成带电荷的物种,外加其它离子,增大溶液的离子强度,可提高反应速度,这种作用叫做盐效应。
由于盐效应的存在常常使动力学图象变得复杂,在研究SN1反应动力学时也要考虑这种因素。
(4)桥头碳上的SN1反应。
对桥头碳上带有潜离去基团的化合物进行动力学研究,也能为支持aNl机理提供证据(中间体碳正离子为平面型,所以桥头碳原子很难发生SN1反应)。
2、立体化学如果具有旋光活性的反应底物(中心原子为手性原子)进行SN1反应,由于生成的碳正离子具有平面构型,亲核试剂可以从平面两侧与其结合,取代产物应为几乎等量的一对对映体,消失了光学活性,即反应是外消旋的。
3、重排由于在SN1反应中有正碳离子中间体生成,可以预料,它将显示正碳离子的特征:重排。
碳正离子的稳定性:3°> 2°> 1°> CH3+。
例如:新戊基溴和C2H5OH反应,几乎完全得到重排产物:(二)SN2机理:SN2代表双分子亲核取代,其反应过程可用下式表示:由上式可见,在SN2反应中,首先是亲核试剂从离去基团背面进攻中心原子,与此同时,离去基团携带电子逐渐离开中心原子,中心原子上的三个氢原子由于受Nu进攻的影响而往L一边偏转,当它们同处于一个平面,且Nu,L和中心原子成为垂直该平面的一条直线时,即达到所谓的过渡状态。
接着亲核试剂与中心原子的结合逐渐加强,而离去基团继续远离中心原子,三个氢原子偏转到离去基团所处的一边,最后得到取代产物,在该过程中,旧键的断裂和新键的生成是协同进行的。
新键的逐渐形成可为旧仪断裂提供部分能量。
在过渡态时,其势能达到最高点,反应过程中的能量变化如图所示:依据:1,动力学研究:(1)二级反应。
SN2是一步反应,显然它的反应速度与反应底物及亲核试剂浓度都有关系,在动力学上应为二级。
以溴甲烷和氢氧化钠反应为例,其动力学研究结果丧明,该反应的速度与[CH3Br]以及[—OH]都成正比关系:。
SN2反应一般都遵循二级动力学。
(2)假一级。
在SN2反应中,当亲核试剂为溶剂时,动力学测定结果不是二级,而是一级的。
这是因为溶剂亲核试剂是大量的,其浓度为一常数,所以反应速度只与反应底物有关:。
这种反应动力学叫做假一级,反应仍然是双分子的。
(3)桥碳上的SN2。
化合物在SN2条件下进行反应。
例如化合物3用乙氧离子处理,化合物4用碘化钠加丙酮处理。
实验结果表明,在两种条件下都未得到相应的取代产物。
在化合物3,4中,由于桥坏的屏蔽,亲核试剂很难从离去基团背面进攻中心桥碳原子,所以不发生SN2反应。
而在这些条件下,开链类似物则可以发生SN2反应。
2.立体化学(瓦尔登构型转换):构型转换是由于SN2反应中的背面进攻。
以(一)—2—溴辛烷和氢氧化钠反应为例,亲核试剂—OH按前面进攻的方式反应时,则必然受到携带电子离开的离去基团Br—的排斥,而背面进攻则可避免这种排斥。
进一步分析我们还可以更清楚地看到,背面进攻能形成较稳定的过渡态,从而降低反应的活化能。
因此在SN2反应中,通过亲核试制的背面进攻而形成线型过渡态是必要的。
而这种背面进攻在立体化学上必然导致瓦尔登构型转化。
如图:(三)离子对机理:离子对机理最早是在解释SN1的部分外消旋化现象时被人们注意的,现在不仅可用它来解释SN1反应的部分外消旋化,而且用这种机理可以把SN1和SN2两种机理统一起来,说明很多有关亲核取代反应机理的现象,因此它越来越受到重视。
亲核取代的反应底物在溶剂的作用下可按如下的方式形成离子对:形成离子对的各步反应都是可逆的,各步的速度常数大小取决于溶剂的性质和反应底物的结构。
实际的反应体系是这些不同离子对及其游离的离子的平衡混合物。
如果亲核试剂与分子或紧密离子对作用,则必然是从背面进攻中心碳原子,发生构型转化,外到瓦尔登转化产物。
如果亲核试剂与溶剂分割离子对作用,那么亲核试剂既可从背面进攻得到构型转化产物,也可代替溶剂的位置得到构型保持产物。
—般来说,前者多于后者,在这一阶段的取代结果是部分消旋化。
当亲核试剂和正碳离子作用时,则它们以相等的几率从正碳离子平面的两侧进攻,在这里发生的取代应该是完全消旋化的:取代反应的宏观结果是各个不同阶段受亲核试剂与各种离子对(包括分子和离子)反应的总和,上述过程可用下列图式表达:(四)邻近基团参与从许多实验中发现,当能提供电子的基团处于中心碳原子的邻近位置时,通过某种环状中间体参与亲核取代反应,共结果不仅加快了亲核取代反应的速度,而且往往使产物具有一定的立体化学特征。
这种反应过程叫做邻基参与。
可用下图表示:邻基参与反应的特点是:构型保持、有时得到一定构型的重排产物、反应速度较快。
反应类型有:(1)含杂原子邻近基团参与的反应.(2)邻近双键参与。
(3)邻近芳基参与。
例如:环氧化合物的合成属于第一种。
三、影响因素可分为四种:烃基和离去基团、溶剂、亲核试剂。
1、烃基的影响:对于SN1反应,决定反应速度的步骤是碳正离子的形成,也就是主要决定于碳正离子的稳定性。
其稳定性主要受电子效应和空间效应影响:电子效应主要是σ—P超共轭作用,分散正电荷,使碳正离子更加稳定。
从空间效应分析,四面体构型的sp3碳变为平面三角构型的sp2碳,可以松弛分子内的张力,一般称这种张力为B张力(B代丧背面的意思)。
这种解除B张力的作用叫做空助效应(不是空间障碍,而是空间帮助)。
带正电荷的中心碳原子上的基团越多,共体积越大,所解除的B张力就越大,由此而赋予碳正离子的稳定性就越高。
显然,叔碳正离子的空助作用是最强的。
在不同结构的碳正离子中,电子效应和空间效应对其稳定性的影响是一致的,两种因素都使叔碳正离子稳定性最高,甲基碳正离子的稳定性最低,它们的相对稳定性顺序为:叔碳正离子>仲碳正离子>伯碳正离子>甲基正离子。
对于SN2反应,其速度主要决定于过渡态的稳定性。
从反应物到过渡态,中心碳原子由四价过渡到五价,空间排布变得更加拥挤,所以底物结构的空间因素对反应活性有重要影响:反应物(四价态)过渡态产物(五价态)由上式还可以看到,从反应物到过渡态,中心碳原子的电荷分布并没有明显的变化,所以底物分子中α—或β—位上所连基团的电子效应对共反应速度的影响不大。
因此在SN2反应中,影响反应活性的主要因素是空间因素。
显然,基团的空间障碍会降低SN2反应的活性,不同烷基底物的SN2活性大小顺序为:甲基底物>伯碳底物>仲碳底物>叔碳底物。
2、离去基团的影响:在亲核取代反应中,离去基团L总是带着电子离开中心碳原子,使C—L发生断裂,离去基团的好差无论对SN1,还是SN2都有影响。
有时改变离去基团还可改变亲核取代反应的机理。
在SN1反应中,决定反应速度的关键步骤是离去基团离开中心碳原子,所以离去基团的好差对反应活性有着重要的影响。
在SN2反应中,离去基团离开中心碳原子和亲核试剂进攻中心碳原子是协同进行的,离去基团的好差对反应活性的影响不十分明显。
在反应机理的选择上,离去基团也起一定的作用。
一般来说,好的离去基团倾向于SN1机理;较差的离去基团倾向于SN2机理。
