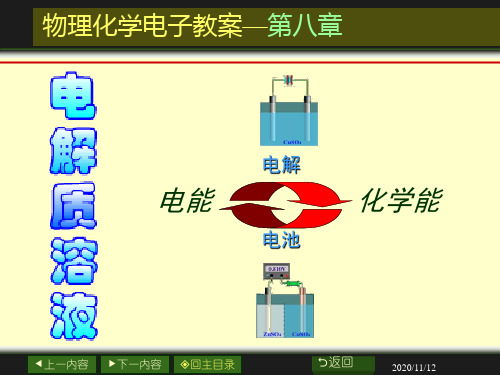
物理化学电子教案第八章(1).ppt
电解质溶液的离子强度-丽水学院

即有2mol的阴离子和2 mol的阳离子互为逆 向通过AA平面和BB平面。 结果 ①中间区,阴、阳离子均是进2mol,出2mol, 所以溶液的浓度不变;
②阴极区, 阳离子进入了 2 mol ,阴离子走 出了2 mol,且反应悼4 mol的阳离子,与原 溶液比,阴、阳离子各少了2 mol;
③阳极区,阳离子走出了2 mol,阴离子走 入了2 mol,并且反应悼4 mol的阴离子,与 原溶液比,阴、阳离子各少了2 mol。
注:阴、阳区物质的量下降;正、负离子所承担的导电 量,正负离子的迁移速率。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
移数(mol)。
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
人们把在数值上等于1 mol元电荷的电量 称为Faraday常数。 因一个元电荷电量为一个电子 e的电量, 为: 1.6022×10-19(C), 则1mol电子(元电荷电量) 电量: 6.022×1023(mol-1)×1.6022×10-19(C)
物 理 化 学 电 子 教 案 丽 水 学 院 化 学 系
结论:当阴、阳离子迁移速率不同时,阴 极区与阳极区离子浓度下降程度不同。 当迁移速率为: r+> r-时, 则C阳↓>C阴↓ 注:↓表示浓度下降程度。 反之,当 r+ < r-时,则C阳↓ < C阴↓ 并且符合如下关系: n阳↓ Q+ r+ ——— = —— = —— n阴↓ Q- r-
4.正、负极与阴、阳极的概念 正极:电势高的极称为正极,电流从正极 流向负极。 负极:电势低的极称为负极,电子从负极 流向正极。 阴极(Cathode): 发生还原作用的极称为阴极。 阳极(Anode) :
发生氧化作用的极称为阳极。
物理化学电子教案第八章

化情况,只提供了一个平
均值,用处不大。
上一内容 下一内容 回主目录
返回
2019/12/4
平均速率
上一内容 下一内容 回主目录
返回
2019/12/4
瞬时速率
R P
rR
d[R] dt
rp
d[P] dt
在浓度随时间变化的图上,在时间t 时,作交点的切线,
就得到 t 时刻的瞬时速率。显然,反应刚开始,速率大,然后 不断减小,体现了反应速率变化的实际情况。
设 Ea为与T无关的常数
•1935年Eyring提出过渡态理论 (从宏观到微观)
•1960年 交叉分子束反应(态—态反应),李 远哲等人1986年获诺贝尔化学奖
上一内容 下一内容 回主目录
返回
2019/12/4
8.2 反应速度和速率
速度 Velocity 是矢量,有方向性。
速率 Rate 是标量 ,无方向性,都是正值。
2019/12/4
8.1 化学动力学的任务和目的
化学热力学的研究对象和局限性
研究化学变化的方向、能达到的最大限度以及外界 条件对平衡的影响。化学热力学只能预测反应的可 能性,但无法回答反应的速率如何及反应的机理如 何等现实性的问题。例如:
1 2
N2
3 2
H2
NH3 (g)
rGm$ / kJ mol1 16.63
ln
a
a
x
k1t
上一内容 下一内容 回主目录
返回
2019/12/4
基元反应(elementary reaction)
基元反应简称元反应,如果一个化学反应,反 应物分子在碰撞中相互作用直接转化为生成物分子, 这种反应称为元反应。
物理化学第八章-PPT课件

Arrhenius方程式:
d lnk E 2 dT RT
K
r Hm 0 从热力学、动力学角度,
温度增加对吸热反应有利
r Hm 0
T↑ ,K T ↑ ,k↑
k正 k逆
3)E的影响: E , k
r r反应 多相反应为化学反应控制
r由r扩散和r反应共同控制,称混合控制
E E 扩散 反应
条件改变,控制步骤改变
T , r r 增 加 得 多 。 增 加 得 少 反应 扩散
2.特点
1)多相反应大多发生在相界面,反应物必须向
相界面扩散,产物必须向相界面外扩散。 2)扩散和反应是多相反应互相串联的两步骤,
2)数值计算
RT T k2 1 2 E ln T k 2 -T 1 1
2.303RT T k 1 2 E lg 2 T k 2 -T 1 1
2. 表观活化能(经验活化能,实验活化能)
§7-7反应速率理论的简介(微观反应动力学) 碰撞理论 过渡状态理论 一、碰撞理论 1.要点 1)碰撞是分子间发生反应的必要条件。 分子运动论 统计力学、量子力学
§7-6 温度对反应速率的影响 一、温度对反应速率影响的类型 r / kn
A
B
C
T
D
E
二、Van’t Holf经验规则 近似规则:反应温度每升高10K反应速率大约
增加24倍。
k T 10 r kT
kT n10 n r kT
(若r看成常数)
r:反应速率的温度系数
r 2 4
三、Arrhenius公式
1)低温范围内,反应速率随温度的变化更敏感。
物理化学:第08章_电解质溶液
anion anode
返回
2020/11/12
1.电解质溶液的导电机理
在电解池中
阳极上发生氧化作用
-
- 电源 +
e-
+
e-
2Cl aq Cl2(g) 2e
阴
阳
阴极上发生还原作用
极
极
CuCl2
Cu2 aq 2e Cu(s)
电解池
上一内容 下一内容
回主目录
例题
解: 1 Au3+ e = 1 Au
3
3
OH
1 4
O2
1 2
H2O e
(1) Q zF 196500197.01.g20mgol-1 /3 Cmol1
= 1763 C
(2)
t
Q I
1763 C 0.025 A
7.05104
s
(3)
m(O2)
1 4
M
(O2)
=197.01g.20mgol1
返回
2020/11/12
1.电解质溶液的导电机理
在原电池中
阳离子移向阴极
负
负载电阻
正
极
e-
Zn
极
Cu e-
e-
阳 Zn2+ Cu2+ 阴
极 SO24-
SO24- 极
ZnSO4溶液 CuSO4溶液
在阴极上发生还原的是
Cu2 aq 2e Cu(s)
阴离子迁向阳极 在阳极上发生氧化的是
Danill电池
上一内容 下一内容 回主目录
返回
2020/11/12
2. 法拉第定律
人们把在数值上等于1 mol元电荷的电荷量称 为Faraday常数,用F表示。
《物理化学》教学大纲电子教案

《物理化学》教学大纲《物理化学》教学大纲开课单位:化学与生物工程学院化学教研室学分:3 总学时:48H(理论教学48学时)课程类别:必修考核方式:考试基本面向:生物工程专业一、本课程的性质、目的和任务物理化学是从物质的物理现象和化学现象的联系人手,来探求化学变化的基本规律的一门科学。
物理化学研究化学变化、相变化及其它有关的物理变化的基本原理,是材料学院和生物工程学院一门必修的基础课。
通过本课程的学习,学生应比较牢固地掌握物理化学基础知识和计算方法,同时还应得到一般科学方法的进一步训练,增长提出问题、分析问题和解决问题的能力。
科学方法的训练应贯彻在课程教学的整个过程中,特别是要通过热力学和动力学的学习,使学生能学会结合具体条件应用理论解决实际问题的一般科学方法。
二、本课程的基本要求1、启发学生对本课程的认识和学习热情,介绍本课程的主要内容和学习方法。
2、理解热力学状态函数的性质和应用,理解热力学三大定律的叙述及数学表达式。
3、理解溶液和相平衡原理及应用。
4、应用热力学定律,理解化学平衡的原理及应用。
5、理解电化学的基本原理及应用。
6、理解表面现象的性质及特点。
三、本课程与其它课程的关系本课程属理论课、基础课性质,它的目的是为后继课程打好基础,化工原理》、《现代分析检测技术》、《生物化学》、《生化工程》、《生化分离工程》等将应用本课程的基础理论及知识。
四、本课程的理论教学内容绪论介绍物理化学的研究对象及主要内容,研究方法。
结合实例说明物理化学理论学习的重要性,并激发学生学习物理化学的积极性。
第一章气体熟练掌握理想气体的状态方程,了解理想气体的微观模型。
掌握道尔顿分压定律和阿马格分体积定律条件及其应用。
了解真实气体pVT行为对理想气体行为的偏差。
第二章热力学第一定律理解下列热力学基本概念:环境和系统,状态函数,途径和过程,热和功,平衡状态。
理解并掌握热力学第一的叙述及数学表达式。
明确热力学能、焓、标准生成焓、标准燃烧焓、标准反应焓、热容的定义并会应用。
物理化学电子教案第一章(1).ppt

上一内容 下一内容 回主目录
返回
2020/11/23
(1) 混合物的组成
a 摩尔分数x或y:
xB 或yB
nB nA
显然 xB 1 或 yB 1
A
B
B
b 质量分数
wB
mB mA
A
wB 1
B
c 体积分数
B
xB Vm,B xA Vm, A
A
B 1
B
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
2020/11/23
§1.1 气体分子动理论
一 气体分子动理论的基本公式 二 理想气体状态方程 三 理想气体模型 四 理想气体混合物 五 分子平均平动能与温度的关系
上一内容 下一内容 回主目录
返回
2020/11/23
1 气体分子动理论的基本公式
气体分子运动的微观模型
返回
2020/11/23
(2) 理想气体混合物状态方程
• 理想气体混合物状态方程为:
pV n总RT nB RT B
pV m RT M mix
上一内容 下一内容 回主目录
返回
2020/11/23
(3) 道尔顿定律与分压力
⑴ 道尔顿定律:
混合气体的总压力等于各组分单独存在于混 合气体的温度、体积条件下所产生压力的总和。
u ( niui2 ) / n
i
n为单位体积内的分子数。
上一内容 下一内容 回主目录
返回
2020/11/23
2 理想气体状态方程
• 17~19世纪三个著名的低压气体经验定律:
• 波义尔定律(R.Boyle,1662):
pV = 常数
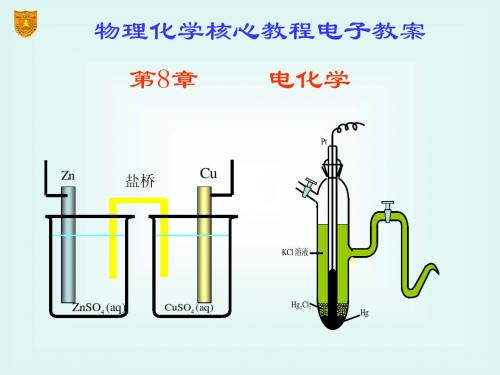
第八章 电化学
⒈ 在电极界面上发生化学变化物质的质量 与通入的电荷量成正比。
⒉ 通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析 出物质的质量与其摩尔质量成正比。
人们把在数值上等于1 mol元电荷的电量称为 Faraday常数。
已知元电荷电量 e 为 1.6022 1019 C
四、电化学的发展史
1600 1791 1799 1800 1807 1833 1839 1900 1884 Gilbert(英) Galvani (意大利) Volta (意大利) Davy(英) Faraday(英) Grove Nernst(德) Arrhenius(瑞典) 发现摩擦生电 发现生物电现象 发明电池 电解制碱金属 电解定律 氢氧燃料电池 Nernst方程 电离学说
在电解池中
阳离子迁向阴极,在
阴极上发生还原作用
阴 极
e-
-
电源 +
+
阳 极
e
-
Cation Cathode
阴离子迁向阳极,在 阳极上发生氧化作用
电解质溶液
Anion Anode
电解池
在电解池中 阳极上发生氧化作用
阴 极
e-
-
电源 +
+
阳 极
e
-
2Cl aq Cl2 (g) 2e
⒈ 是电化学上最早的定量的基本定律,揭示了
通入的电量与析出物质之间的定量关系。
⒉ 该定律在任何温度、任何压力下均可以使用。
⒊ 该定律的使用没有什么限制条件。 4. 适用于多个电化学装置的多个反应(串联)
电流效率
按Faraday定律计算所需理论电荷量 电流效率 100% 实际所消耗的电荷量
2020-2021高中化学竞赛第6章电解与极化作用课件

E(不 可 逆 )(阳 )(阴 )
显然分解电压的数值会随着通入电流强度的 增加而增加。
8.2 极化作用
极化(polarization)
人卒惟子患 过无河志,,意有在志吃无帅有。当不成电者。极上无电流通过时,电极处于平衡状态,
不让怕自路 己远的,内就心怕藏ቤተ መጻሕፍቲ ባይዱ着短一。条巨龙,既是一种苦刑,也是一种乐趣。
影响超电势的因素很多,如电极材料、电极表面 状态、电流密度、温度、电解质的性质、浓度及溶液 中的杂质等。
氢气在几种电极上的超电势
Tafel 公式(Tafel’s equation)
早在1905年,Tafel 发现,对于一些常见的电极反 应,超电势与电流密度之间在一定范围内存在如下的 定量关系:
ablnj
用搅拌和升温的方法可以减少浓差极化,但也可 以利用滴汞电极上的浓差极化进行极谱分析。
极化的类型
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。
(2)电化学极化 电极反应总是分若干步进行,若其中一步反应
速率较慢,需要较高的活化能,为了使电极反应顺 利进行所额外施加的电压称为电化学超电势(亦称 为活化超电势),这种极化现象称为电化学极化。
种对平衡电势的偏离称为电极的极化。
极化的类型
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。
(1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。
金属腐蚀分两类:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
nEF
zEF
上一内容 下一内容 回主目录
返回
2020/11/23
组成可逆电池的必要条件
原电池 电解池
化学反应可逆
上一内容 下一内容 回主目录
能量变化可逆
返回
2020/11/23
组成可逆电池的必要条件
原电池 ()Zn(s) Zn2 2e-
()2AgCl(s) 2e- 2Ag(s) 2Cl-
物理化学电子教案—第八章
上一内容 下一内容 回主目录
返回
2020/11/23
第八章 可逆电池的电动势及其应用
主要内容
可逆电池和可逆电极 电动势的测定 可逆电池的书写方法及电动势的取 号可逆电池的热力学 电动势产生的机理 电极电势和电池的电动势 浓差电池和液体接界电势的计算公 式电动势测定的应用 生物电化学
上一内容 下一内容 回主目录
返回
2020/11/23
问题
上一内容 下一内容 回主目录
返回
2020/11/23
标准电池电动势与温度的关系
ET/V=1.01845-4.05×10-5(T/K-293.15) - 9.5×10-7(T/K-293.15)2 +1×10-8(T/K-293.15)3
我国在1975年提出的公式为:
上一内容 下一内容 回主目录
返回
2020/11/23
8.1 可逆电池和可逆电极
电化学与热力学的联系 组成可逆电池的必要条件 可逆电极的类型
上一内容 下一内容 回主目录
返回
2020/11/23
电化学与热力学的联系
桥梁公式:
( r G)T ,P,R Wf,max nEF
( r Gm )T ,P,R
ET/V=E(293.15K)/V-{39.94(T/K-293.15) +0.929(T/K-293.15)2 - 0.009(T/K-293.15)3 +0.00006(T/K-293.15)4}×10-6
通常要把标准电池恒温、恒湿存放,使电动势稳定。
上一内容 下一内容 回主目录
返回
2020/11/23
→CdSO4·8/3H2O(s)+Hg(l)
上一内容 下一内容 回主目录
返回
2020/11/23
标准电池结构图
上一内容 下一内容 回主目录
返回
2020/11/23
问题
为什么在一定温度下,含Cd的质量百分数在5~14% 之间,标准电池的电动势有定值?
答:从Hg-Cd的相图可知,在室 温下,镉汞齐中镉含量在5~14% 之间时,体系处于熔化物和固溶 体两相平衡区,镉汞齐活度有定 值。而标准电池电动势只与镉汞 齐的活度有关,所以也有定值。
Na+(a+)|Na(Hg)(a)
Mz+(a+)+ze- →M(s) 2H+(a+)+2e- →H2(p) 2H2O+2e- →H2(p)+2OH-(a-) O2(p)+4H+(a+)+4e- →2H2O O2(p)+2H2O+4e- →4OH-(a-) Cl2(p)+2e- →2Cl-(a-)
Na+(a+)+nHg+e- →Na(Hg)n(a)
上一内容 下一内容 回主目录
返回
2020/11/23
对消法测电动势的实验装置
标准电池 待测电池
工作电源
检流计
上一内容 下一内容 回主目录
电位计
返回
2020/11/23
标准电池结构图
电池反应: (-) Cd(Hg)→Cd2++Hg(l)+2e(+)Hg2SO4(s)+2e-→2Hg(l)+SO42净反应: Hg2SO4(s)+Cd(Hg)(a)+8/3H2O
净反应: Zn(s) 2AgCl(s) 2Ag(s) ZnCl 2
电解池 阴极: Zn2 2e- Zn(s)
阳极: 2Ag(s) 2Cl- 2AgCl(s) 2e-
总反应:2Ag(s) ZnCl 2 Zn(s) 2AgCl(s)
上一内容 下一内容 回主目录
返回
2020/11/23
上一内容 下一内容 回主目录
返回
2020/11/23
第二类电极及其反应
电极
电极反应
Cl-(a-)|AgCl(s)|Ag(s) OH-(a-)|Ag2O|Ag(s)
H+(a+)|Ag2O(s)|Ag(s)
AgCl(s)+e- →Ag(s)+Cl-(a-)
Ag2O(s)+H2O+2 e→2Ag(s)+2OH-(a-)
可逆电极的类型
⑴第一类电极
金属与其阳离子组成的电极 氢电极 氧电极 卤素电极 汞齐电极
⑵第二类电极
金属-难溶盐及其阴离子组成的电极 金属-氧化物电极
⑶第三类电极
氧化-还原电极
上一内容 下一内容 回主目录
返回
2020/11/23
第一类电极及其反应
电极
电极反应
Mz+(a+)|M(s) H+ (a+)|H2(p),Pt OH-(a-)|H2(p),Pt H+(a+)|O2(p),Pt OH-(a-)|O2(p),Pt Cl- (a-)|Cl2(p),Pt
上一内容 下一内容 回主目录
返回
2020/11/23
8.2 电动势的测定
对消法测电动势的原理 对消法测电动势的实验装置 标准电池 为什么标准电池有稳定的电势值 电动势与温度的关系
上一内容 下一内容 回主目录
返回
2020/11/23
对消法测定电动势的原理图
E=(R0+Ri)I U=R0I 当R0→∞时,有: R0+Ri→R0 E≈U
Ag2O+2H+(a+)+2e→2Ag(s)+H2O
上一内容 下一内容 回主目录
返回
2020/11/23
第三类(a1), Fe2+(a2)|Pt Cu2+(a1), Cu+(a2)|Pt Sn4+(a1), Sn2+(a2)|Pt
Fe3+(a1)+e- →Fe2+(a2) Cu2+(a1)+e- →Cu+(a2) Sn4+(a1)+2e- →Sn2+(a2)
8.3 可逆电池的书写方法及电动势的取号
可逆电池的书面表示法 可逆电池电动势的取号 从化学反应式设计电池
上一内容 下一内容 回主目录
返回
2020/11/23
可逆电池的书面表示法
1. 左边为负极,起氧化作用; 右边为正极,起还原作用。
2.“|”表示相界面,有电势差存在。
3.“||”表示盐桥,使液接电势降到可以忽略不计。
4.“┆”表示半透膜。
5. 要注明温度,不注明就是298.15 K;要注明物态, 气体要注明压力;溶液要注明浓度。
6. 气体电极和氧化还原电极要写出导电的惰性电极, 通常是铂电极。
