化学反应中活化能PPT
合集下载
《活化能》人教版高中化学优秀-PPT

❖
5.通过学习并理解盖斯定律的内容,能 用盖斯 定律进 行有关 反应热 的简单 计算,培 养宏观 辨识与 微观探 析的核 心素养 。
❖
6.通过学会有关反应热计算的方法技 巧,进一 步提高 化学计 算的能 力。
❖
7.人生的苦难和挫折,实在是对人生的 一种造 就,战胜 挫折和 苦难就 会赢得 财富。
❖
8.今天我们领悟了昌耀的人生体验,明 天我们 也要像 他那样 用自己 的顽强 意志去 直面挫 折,即使 身处孤 绝之境 ,也要 笑对人 生,走 向成功 的彼岸 !
探究淀粉酶对淀粉和蔗糖的水解作用
淀粉溶液
蔗糖溶液
一 1号试管中加入2mL 2号试管中加入2mLBiblioteka 实 淀粉溶液蔗糖溶液
验 二 加入淀粉酶2滴,振荡,试管下半部浸入60℃ 步 左右的热水中,反应5min
骤 三 加入斐林试剂 振荡 约60℃水浴2min
实验 现象
砖红色沉淀
无变化
结论 淀粉酶只能催化淀粉水解,不能催化蔗糖水解。
过程: 酵母细胞研磨 加水搅拌 加压过滤
含酵母细胞的提取液 加入葡萄糖
现象:冒出气泡
毕希纳的实验说明,酵母细胞中的某些物质能够 在酵母细胞破碎后继续起催化作用,就像在活酵 母细胞中一样。
1773年意大利科学家斯
巴兰札尼喂食鹰的实验
关
于 酶
1836年法国科学家施旺提取胃液实验
本 质 的
1926年美国科学家萨姆纳 从刀豆中提取脲酶实验
常态:常叫基态,微观粒子处于能量最低的状态。 当原子处于基态时,电子处于离核最近的轨道上, 此时原子处于稳定状态。
活跃状态就是激发态。 激发态:微观粒子其内部能量高于基态能量时所处 的能量状态。当原子获得能量的时候,便由基态跃 迁到激发态。
2.1.2活化能课件高二上学期化学人教版选择性必修1

活化分子
其它条件不变时 升高温度
其它条件不变时,升高温度,单位体积内活化分子的数目增大,单位体积内活化分子 百分数增多,单位时间内有效碰撞次数增多,化学反应速率加快;反之则慢
简单碰撞理论
解释浓度对化学反应速率的影响
活化分子
其它条件不变时 增大反应物浓度
在其它条件不变时,增大反应物浓度,单位体积内活化分子的数目增大,单位时间 内有效碰撞次数增多,化学反应速率加快;反之则慢
H202+2HI===2H20+I2 定量探究浓度、温度对反应速率的影响:
(1)为了有更明显的现象,还需要加入什么试剂? 淀粉,用于显色
(2)对比实验的数据是? 溶液由无色变为蓝色的时间
在298K时,实验测得溶液中的反应H202+2HI===2H20+I2在不同浓度时 的化学反应速率见表。
实验编号
(3)保持容器内压强不变,充入一定量的氩气_____,理由________________ _____________________________________________________________。 (4)保持容器的容积不变,充入一定量的氩气_____,理由________________ _____________________________________________________________。
简单碰撞理论
解释压强对化学反应速率的影响
活化分子
容器内压强不变 充入非反应气体
在其它条件不变时,充入非反应气体,压强不变,体积增大,各物质浓度减小,反 应速率减慢
【例1】在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g) 高温 Fe3O4(s)+ 4H2(g),分析改变下列条件化学反应速率如何改变(填“变大”“变小”或“不 变”),阐述理由。 (1)增加铁片的质量(不考虑表面积的变化)_不__变__,理由_纯__固__体__的_浓__度__视__为__常____ _数__,_改__变__用__量__不_影__响__化__学__反_应__速__率_____。 (2)保持容器的容积不变,增加水蒸气的通入量_变__大__,理由增__大__反__应_物__浓__度____ _加__快__化_学__反__应__速__率___。
其它条件不变时 升高温度
其它条件不变时,升高温度,单位体积内活化分子的数目增大,单位体积内活化分子 百分数增多,单位时间内有效碰撞次数增多,化学反应速率加快;反之则慢
简单碰撞理论
解释浓度对化学反应速率的影响
活化分子
其它条件不变时 增大反应物浓度
在其它条件不变时,增大反应物浓度,单位体积内活化分子的数目增大,单位时间 内有效碰撞次数增多,化学反应速率加快;反之则慢
H202+2HI===2H20+I2 定量探究浓度、温度对反应速率的影响:
(1)为了有更明显的现象,还需要加入什么试剂? 淀粉,用于显色
(2)对比实验的数据是? 溶液由无色变为蓝色的时间
在298K时,实验测得溶液中的反应H202+2HI===2H20+I2在不同浓度时 的化学反应速率见表。
实验编号
(3)保持容器内压强不变,充入一定量的氩气_____,理由________________ _____________________________________________________________。 (4)保持容器的容积不变,充入一定量的氩气_____,理由________________ _____________________________________________________________。
简单碰撞理论
解释压强对化学反应速率的影响
活化分子
容器内压强不变 充入非反应气体
在其它条件不变时,充入非反应气体,压强不变,体积增大,各物质浓度减小,反 应速率减慢
【例1】在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g) 高温 Fe3O4(s)+ 4H2(g),分析改变下列条件化学反应速率如何改变(填“变大”“变小”或“不 变”),阐述理由。 (1)增加铁片的质量(不考虑表面积的变化)_不__变__,理由_纯__固__体__的_浓__度__视__为__常____ _数__,_改__变__用__量__不_影__响__化__学__反_应__速__率_____。 (2)保持容器的容积不变,增加水蒸气的通入量_变__大__,理由增__大__反__应_物__浓__度____ _加__快__化_学__反__应__速__率___。
活化能课件(共22张PPT)高中化学人教版(2019)选择性必修1

ν↑ ν↑
压强的影响呢?
p↑, ν ↑
催化剂
加入催化剂,ν↑
接触面积
接触面积↑,ν ↑
碰撞理论 有效碰撞理论解释化学反应发生的条件:
单位体积内活化分子数增大,活化分子百分数增大
活化分子百分数
=
活化分子数 反应物分子总数
×100%
单位时间内有效碰撞次数越多,反应速率越快
碰撞理论
碰撞理论 解释浓度对化学反应速率的影响 活化分子
其中的每一步反应称为基元反应
基元反应与反应历程
1. 基元反应 :从微观上看,反应物分子一般总是经过若干个 简单的反应步骤才最终转化为产物分子的。 能够一步完成的反应都称为一个基元反应。
例:反应 2HI = H2 + I2
第一步:2HI 第二步:2I·
H2 + 2I· I2
自由基: 带有单电子的原子或原子团。
大多数化学反应并不是经过简单碰撞就能完成的,而往往 经过多个反应步骤才能实现。要发生反应,对于碰撞也是 有要求的。
碰撞理论与活化能
力量不够
方向不对
好球!
碰撞理论与活化能 例:反应 2HI = H2 + I2
能量不足
取向不合适
足够的能量 取向合适
碰撞理论与活化能 1. 基元反应发生的先决条件:反应物的分子必须发生碰撞 注:并不是每一次碰撞都能发生化学反应。
电弧
强磁场
高速研磨
小结:用简单碰撞理论解释影响化学反应速率的因素
增大反应物浓度
升高温度
单位体积内 活化分子数增大
单位体积内有效碰 撞次数增多
单位体积内活化 分子百分数增大
增大气体压强
增大化学反应速率
化学反应中活化能PPT
2
碘化氢的分解反应 2HI(g) H2 (g)+ I2(g)(△H>0), 在503K,无催化剂时,活化能是184KJ/mol。 请画出反应过程中的能量变化图。
在503K,有催化剂时,反应活化能是104.6KJ· mol-1. 在原图上画出有催化剂时反应过程中能量变化图。 查得碘化氢的键能为298KJ· mol-1请根据键能在 原图上画出HI分解反应的能量变化图。
活化能与反应速率
若Ea<40 kJ· mol-1时,反应速率很快; 若Ea>400 kJ· mol-1时,反应速率很慢, 一般化学反应, 250 kJ· mol-1 <Ea<60 kJ· mol1
3
2HI(g) I2(g)+ H2(g) △H= +9.48 kJ· mol-1
(2) 根据图象下列有关叙述正确的是( )D (1) 下列有关该反应的叙述正确的是 A. 该反应为放热反应 A. 正反应活化能小于9.48 kJ·mol-1 B. 逆反应活化能一定小于9.48 kJ·mol-1 B. 催化剂能改变反应的焓变 -1 C. 正反应反应的活化能 D.正反应活化能比逆反应活化能大9.48 kJ·mol-1 D.逆反应的活化能大于正反 应的活化能
(3)(改编)合成氨工业中的氢气通过题(1)反应: 回答下列问题: CO(g)+H O(g) CO2(g)+H2(g) 制得 , 请问改 小于 (1)在初始阶段 ,2 甲烷蒸汽重整的反应速率 甲烷氧化的 变哪些外界条件既可提高反应速率又可提高原料转 反应速率(填大于、小于或等于)。 -41.2 kJ/mol。 化率 ?分析原因? (2)反应 CO(g)+H2O(g)=CO2(g)+H2(g)的△H=
2
碘化氢的分解反应 2HI(g) H2 (g)+ I2(g)(△H>0), 在503K,无催化剂时,活化能是184KJ/mol。 碘化氢的分解反应中以Au为催化剂时,活化能 降低可使反应速率增加约1千万倍,这给我们什 么启示? 请从活化能、活化分子、有效碰撞的角度分析 外界条件对碘化氢分解速率的影响。
高中化学《活化能》PPT 新人教版1

•
5.宇宙的其他地方对于地球上发生的 任何事 物根本 不在乎 。绕着 太阳公 转的行 星的运 动似乎 最终会 变成混 沌,尽 管其时 间尺度 很长。 这表明 随着时 间流逝 ,任何 预言的 误差将 越来越 大。在 一段时 间之后 ,就不 可能预 言运动 的细节 。
•
6.太阳和其他恒星绕着银河系的运动 ,以及 银河系 绕着其 局部星 系团的 运动也 是混沌 的。我 们观测 到,其 他星系 正离开 我们运 动而去 ,而且 它们离 开我们 越远, 就离开 得越快 。这意 味着我 们周围 的宇宙 正在膨 胀:不 同星系 间的距 离随时 间而增 加。
材料:淀粉酶溶液、蔗糖酶溶液、淀粉 和蔗糖溶液
思考:应该如何设计这个实验?你又怎 么知道淀粉酶催化了糖的水解呢?
非 淀粉
麦芽糖
还
原
酶
性
葡萄糖
糖 蔗糖
果糖
葡萄糖 还 原 性 糖
序号 1 2 3 4 5
6 结论
项目
注入可溶性淀粉溶液 注入蔗糖溶液
注入新鲜淀粉酶溶液
试管
A
B
2mL
/
/
2mL
2mL
2mL
★影响酶促反应速率的因素:
酶
1、温度
促
反
2、pH
应 速
率
3、酶的浓度:反应速率
随酶浓度的升高而加快。
4、底物浓度:在一定浓度
酶 促
范围内,反应速率随浓度的
反 应
速
升高而加快,但达到一定浓 率
度,反应速率不再变化
酶的浓度 酶量一定
底物浓度
(1)酶具有高效性 1、酶的特性 (2)酶具有专一性
(3)酶的作用条件较温和
活化能教学课件2023-2024学年上学期高二化学人教版(2019)选择性必修1

第3页
2.评价目标 (1)通过回顾旧键断裂、新键生成等的能量变化,诊断并发展学生对建立反 应历程、基元反应、活化能等模型的认识进阶(模型认知)。 (2)通过从能量变化的角度分析解释活化能对化学速率的影响,诊断并发展 学生微观认知的水平(微观认知)。 (3)通过碰撞理论,发展学生初步了解催化剂能通过改变反应历程,改变反 应活化能,改变反应速率的本质。
C.2HI===H2+I2
D.2O3===3O2
解析 大多数化学反应往往经过多个反应步骤才能实现,其中的每一步反
应称为基元反应。
第36页
2.下列关于有效碰撞理论与影响速率因素之间关系不正确的是( D ) A.活化分子间所发生的部分碰撞为有效碰撞 B.增大反应物浓度能够增大活化分子数,化学反应速率增大 C.升高温度,活化分子百分数增大,化学反应速率增大 D.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增 大
第42页
谢
谢
观
看
20 23
第43页
第14页
判断正误(对的在括号内打“√”,错的在括号内打“×”。) (1)基元反应发生的先决条件是反应物分子必须发生碰撞。( √ ) (2)活化分子具有的平均能量叫做反应物的活化能。( × ) (3)活化分子之间的碰撞一定是有效碰撞。( × ) (4)发生有效碰撞的分子一定是活化分子。( √ ) (5)对于某具体的化学反应,体系温度升高,单位体积的活化分子数增加, 活化分子百分数不变,化学反应速率加快。( × )
第27页
2.多步反应的活化能及与速率的关系
(1)多步反应的活化能:一个化学反应由几个基元反应完成,每一个基元反 应都经历一个过渡态,及达到该过渡态所需要的活化能(如图E1、E2),而该复合 反应的活化能只是由实验测算的表观值,没有实际物理意义。到达过渡态就越 不容易,该基元反应的速率就越慢。一个化学反应的速率就取决于速率最慢的 基元反应。
2.评价目标 (1)通过回顾旧键断裂、新键生成等的能量变化,诊断并发展学生对建立反 应历程、基元反应、活化能等模型的认识进阶(模型认知)。 (2)通过从能量变化的角度分析解释活化能对化学速率的影响,诊断并发展 学生微观认知的水平(微观认知)。 (3)通过碰撞理论,发展学生初步了解催化剂能通过改变反应历程,改变反 应活化能,改变反应速率的本质。
C.2HI===H2+I2
D.2O3===3O2
解析 大多数化学反应往往经过多个反应步骤才能实现,其中的每一步反
应称为基元反应。
第36页
2.下列关于有效碰撞理论与影响速率因素之间关系不正确的是( D ) A.活化分子间所发生的部分碰撞为有效碰撞 B.增大反应物浓度能够增大活化分子数,化学反应速率增大 C.升高温度,活化分子百分数增大,化学反应速率增大 D.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增 大
第42页
谢
谢
观
看
20 23
第43页
第14页
判断正误(对的在括号内打“√”,错的在括号内打“×”。) (1)基元反应发生的先决条件是反应物分子必须发生碰撞。( √ ) (2)活化分子具有的平均能量叫做反应物的活化能。( × ) (3)活化分子之间的碰撞一定是有效碰撞。( × ) (4)发生有效碰撞的分子一定是活化分子。( √ ) (5)对于某具体的化学反应,体系温度升高,单位体积的活化分子数增加, 活化分子百分数不变,化学反应速率加快。( × )
第27页
2.多步反应的活化能及与速率的关系
(1)多步反应的活化能:一个化学反应由几个基元反应完成,每一个基元反 应都经历一个过渡态,及达到该过渡态所需要的活化能(如图E1、E2),而该复合 反应的活化能只是由实验测算的表观值,没有实际物理意义。到达过渡态就越 不容易,该基元反应的速率就越慢。一个化学反应的速率就取决于速率最慢的 基元反应。
【课件】活化能课件高二化学人教版(2019)选择性必修1

“环式”反应历程图象分析
对于”环式”反应历程图象,位于“环上”的物质 一般是催化剂或中间体,如⑤、⑥、⑦和⑧.“入环” 的物质为反应物,如①和④,“出环”的物质为生成 物、如②和③,由反应物和生成物可写出总反应化学 方程式。
书写基元反应及总反应 图示历程包含__个基元反应,其中速率最慢的是第___个
速率减小
自我测试
3. 平流层中氟氯烃对臭氧层的破坏是由于含氯化合物 的催化作用改变了臭氧分解反应的历程,其反应过程 的能量变化如图。总反应:O3+O―→2O2。 催化反应:①O3+Cl―→O2+ClO; ②ClO+O―→Cl+O2。 下列说法正确的是
A.Ea=Ea1+Ea2 催化效率越强,活化能降低越多,Ea与(Ea1+Ea2)之间没有等 B.反应①为吸热量反关应系,反应②为放热反应,因此反应速率:反应①<反应②
4.自由基:带有单电子的原子或原子团
一、基元反应与反应历程
CH₄与Cl₂的取代反应是自由基反应历程,经历反应的链引发、链传递、链终止: Cl₂→2Cl·,Cl·+CH₄→HCl+·CH₃、 ·CH₃+Cl₂→CH3Cl +Cl·、 CH3Cl+Cl·→·CH2Cl+HCl、 ·CH2Cl+Cl2→CH Cl₂+Cl·
问题思考: 化学反应速率与活化分子有什么关系?根据有效碰撞理论,联系化学 反应速率的影响因素,讨论各因素是如何影响化学反应速率的。
二、碰撞理论与活化能
3.用有效碰撞理论解释影响化学反应速率的因素
(1)浓度、压强对化学反应速率的影响
增大反应物 浓度
增大压强
(相当于增大 浓度)
单位体积内分 子总数增多, 活化分子百分 数不变,单位 体积内活化分
对于”环式”反应历程图象,位于“环上”的物质 一般是催化剂或中间体,如⑤、⑥、⑦和⑧.“入环” 的物质为反应物,如①和④,“出环”的物质为生成 物、如②和③,由反应物和生成物可写出总反应化学 方程式。
书写基元反应及总反应 图示历程包含__个基元反应,其中速率最慢的是第___个
速率减小
自我测试
3. 平流层中氟氯烃对臭氧层的破坏是由于含氯化合物 的催化作用改变了臭氧分解反应的历程,其反应过程 的能量变化如图。总反应:O3+O―→2O2。 催化反应:①O3+Cl―→O2+ClO; ②ClO+O―→Cl+O2。 下列说法正确的是
A.Ea=Ea1+Ea2 催化效率越强,活化能降低越多,Ea与(Ea1+Ea2)之间没有等 B.反应①为吸热量反关应系,反应②为放热反应,因此反应速率:反应①<反应②
4.自由基:带有单电子的原子或原子团
一、基元反应与反应历程
CH₄与Cl₂的取代反应是自由基反应历程,经历反应的链引发、链传递、链终止: Cl₂→2Cl·,Cl·+CH₄→HCl+·CH₃、 ·CH₃+Cl₂→CH3Cl +Cl·、 CH3Cl+Cl·→·CH2Cl+HCl、 ·CH2Cl+Cl2→CH Cl₂+Cl·
问题思考: 化学反应速率与活化分子有什么关系?根据有效碰撞理论,联系化学 反应速率的影响因素,讨论各因素是如何影响化学反应速率的。
二、碰撞理论与活化能
3.用有效碰撞理论解释影响化学反应速率的因素
(1)浓度、压强对化学反应速率的影响
增大反应物 浓度
增大压强
(相当于增大 浓度)
单位体积内分 子总数增多, 活化分子百分 数不变,单位 体积内活化分
活化能PPT教学课件

当ΔH为“+”或ΔH>0 时,为吸热反应。
注:放热反应还是吸热反应主要由反应物、生成物所 具有的总能量的相对大小决定,与反应条件无关。
课堂练习:
1. 反应C(石墨) C(金刚石)是吸热反应,由此可知
A. 石墨比金刚石更稳定
B. 金刚石和石墨可以相互转化
C. 金刚石比石墨稳定
D. 金刚石和石墨不能相互转化
能 活化能 量
E1
活化分子
活化分子变成 生成物分子放 出的能量
E2
反应物
反应热
生成物
ΔH=生成物总能量-反应物总能量 反应过程 ∴ΔH=E1-E2
设问:活化能的大小虽然意味着一般分子成为活化分 子的难易,但对化学反应的反应热是否产生影响?
能 活化能 量
E1
活化分子
活化分子变成 生成物分子放 出的能量
➢食用的面粉中如何长出 “肉虫子”?“肉虫子” 又如何变成蛾的?
生命世界真奇妙﹗
“毛毛虫”是从哪来的?它怎么会 变成美丽的蝴蝶?
想一想有哪些昆虫的发肓过程 与蝴蝶相似呢?
家蚕
蝇
蚊
蜜蜂
悠悠文明史,漫漫丝绸路。
养 蚕
悠悠文明史,漫漫丝绸路。
缫 丝
悠悠文明史,漫漫丝绸路。
丝 绸 之 路 上 的 驼 队
亡雌蛾产卵后也死亡。
体表光滑体型呈 蛹 椭圆柱状
不食不动,羽化成蛾, 破茧而出。
家蚕通过 有性生殖 方式 繁殖后代。
在由受精卵发育成新个体的过程 中,家蚕的幼虫与成体的形态 结构和生活习性差异很大,这
种发育过程称为变态发育。
讨论
1、家蚕是通过哪种方式繁殖后代的?
这种生殖方式的特点是什么?
2、根据日常的观察,说说还有哪些动 物与家蚕的生殖和发育方式相似?
注:放热反应还是吸热反应主要由反应物、生成物所 具有的总能量的相对大小决定,与反应条件无关。
课堂练习:
1. 反应C(石墨) C(金刚石)是吸热反应,由此可知
A. 石墨比金刚石更稳定
B. 金刚石和石墨可以相互转化
C. 金刚石比石墨稳定
D. 金刚石和石墨不能相互转化
能 活化能 量
E1
活化分子
活化分子变成 生成物分子放 出的能量
E2
反应物
反应热
生成物
ΔH=生成物总能量-反应物总能量 反应过程 ∴ΔH=E1-E2
设问:活化能的大小虽然意味着一般分子成为活化分 子的难易,但对化学反应的反应热是否产生影响?
能 活化能 量
E1
活化分子
活化分子变成 生成物分子放 出的能量
➢食用的面粉中如何长出 “肉虫子”?“肉虫子” 又如何变成蛾的?
生命世界真奇妙﹗
“毛毛虫”是从哪来的?它怎么会 变成美丽的蝴蝶?
想一想有哪些昆虫的发肓过程 与蝴蝶相似呢?
家蚕
蝇
蚊
蜜蜂
悠悠文明史,漫漫丝绸路。
养 蚕
悠悠文明史,漫漫丝绸路。
缫 丝
悠悠文明史,漫漫丝绸路。
丝 绸 之 路 上 的 驼 队
亡雌蛾产卵后也死亡。
体表光滑体型呈 蛹 椭圆柱状
不食不动,羽化成蛾, 破茧而出。
家蚕通过 有性生殖 方式 繁殖后代。
在由受精卵发育成新个体的过程 中,家蚕的幼虫与成体的形态 结构和生活习性差异很大,这
种发育过程称为变态发育。
讨论
1、家蚕是通过哪种方式繁殖后代的?
这种生殖方式的特点是什么?
2、根据日常的观察,说说还有哪些动 物与家蚕的生殖和发育方式相似?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)(改编)合成氨工业中的氢气通过题(1)反应: 回答下列问题: CO(g)+H O(g) CO2(g)+H2(g) 制得 , 请问改 小于 (1)在初始阶段 ,2 甲烷蒸汽重整的反应速率 甲烷氧化的 变哪些外界条件既可提高反应速率又可提高原料转 反应速率(填大于、小于或等于)。 -41.2 kJ/mol。 化率 ?分析原因? (2)反应 CO(g)+H2O(g)=CO2(g)+H2(g)的△H=
4
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变 化如图所示,已知断裂1mol化学键所需的能量(kJ): 请画出该反应随反应过程的能量变化曲线图 N≡N为 942、O=O为500、N-N为154,则断裂 1molN-H键所需的能量(KJ)是———。
Ea
1
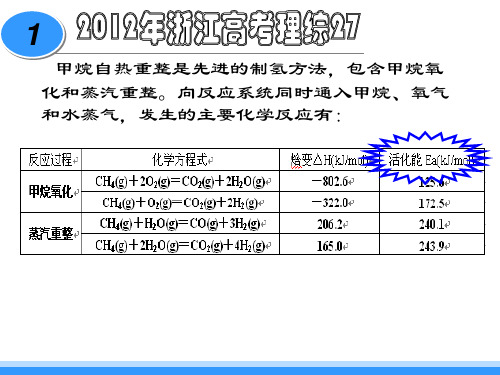
甲烷自热重整是先进的制氢方法,包含甲烷氧 化和蒸汽重整。向反应系统同时通入甲烷、氧气 和水蒸气,发生的主要化学反应有:
祝同学们健康快乐!
活化能与反应速率
若Ea<40 kJ· mol-1时,反应速率很快; 若Ea>400 kJ· mol-1时,反应速率很慢, 一般化学反应, 250 kJ· mol-1 <Ea<60 kJ· mol1
3
2HI(g) I2(g)+ H2(g) △H= +9.48 kJ· mol-1
(2) 根据图象下列有关叙述正确的是( )D (1) 下列有关该反应的叙述正确的是 A. 该反应为放热反应 A. 正反应活化能小于9.48 kJ·mol-1 B. 逆反应活化能一定小于9.48 kJ·mol-1 B. 催化剂能改变反应的焓变 -1 C. 正反应活化能不小于 9.48 kJ · mol C.催化剂能降低反应的活化能 D.正反应活化能比逆反应活化能大9.48 kJ·mol-1 D.逆反应的活化能大于正反 应的活化能
1
甲烷自热重整是先进的制氢方法,包含甲烷氧 化和蒸汽重整。向反应系统同时通入甲烷、氧气 和水蒸气,发生的主要化学反应有:
他是1903年诺贝尔 化学奖获得者。他是电 离理论的创立者,同时 提出了活化能和活化分 子的概念以及根据实验 提出阿累尼乌斯公式,说 明了反应速率与温度的 关系。
斯万特· 奥古斯特· 阿累尼乌 斯 瑞典物理化学家
2
碘化氢的分解反应 2HI(g) H2 (g)+ I2(g)(△H>0), 在503K,无催化剂时,活化能是184KJ/mol。 碘化氢的分解反应中以Au为催化剂时,活化能 降低可使反应速率增加约1千万倍,这给我们什 么启示? 请从活化能、活化分子、有效碰撞的角度分析 外界条件对碘化氢分解速率的影响。 Nhomakorabea2
碘化氢的分解反应 2HI(g) H2 (g)+ I2(g)(△H>0), 在503K,无催化剂时,活化能是184KJ/mol。 请画出反应过程中的能量变化图。
在503K,有催化剂时,反应活化能是104.6KJ· mol-1. 在原图上画出有催化剂时反应过程中能量变化图。 查得碘化氢的键能为298KJ· mol-1请根据键能在 原图上画出HI分解反应的能量变化图。
