有机化学18第十八章周环反应
合集下载
周环反应
例如下列二烯烃都不能进行Diels-Alder反应:
对双烯体系,S-顺式构象是Diels-Alder反应先决条件
(d)Diels-Alder反应的活性
一般情况下,双烯体含有供电基团,亲双烯体含有吸电基团, 反应活性高。 但是,当双烯体含有吸电基团,亲双烯体含有供电基团, 反应活性高。(甲)[1,n]移位反应
3 4
CH2 [1,5]氢移位 H △ CD2
5
2 1
CD2H
CH3 C9H17
CH3 C9H17 7 H2CH HO 6 5 4 1 2 3
[1,7] 氢移位 HO
H2CH
热 2. ( )
氢的[1,7]迁移
14
1
3 2 OAc H
1,3碳移位
D
CH2 *
OH H3C CH3
CH2CH=CH2 *
Claisen重排在有机合成上具有较大价值:
* OCH2CH=CH2 H3CO
△
OH H3CO CH2CH=CH2 *
邻丁子香酚
(b)Cope重排反应[1,3]碳迁移
H3C
1'
1
2 3
3'
300℃
H3C
2'
H3C ROOC
150℃
2 3 3'
H3C ROOC
苯醌>顺酐>硝基烯 > α,β-不饱和酯(酮、腈)
(e) Diels-Alder反应的立体化学
顺式加成规则(实质是同面--同面加成)
COOR
顺丁烯二酸酯 COOR COOR 反丁烯二酸酯
COOR ROOC
COOR
COOR COOR
内向加成规则:
H C CH2
周环反应

-
-
-
-
+
-
顺旋
+ +
+
-
结论:加热下,顺旋成键。 结论:加热下,顺旋成键。 成键
光照下
分子处于激发态, 分子处于激发态,其HOMO为ψ3 为
hν 对旋
+ +
hν
+
顺旋
-
-
-
-
+
-
hν 对旋
+ +
不成键
结论:光照下,对旋成键 结论:光照下,对旋成键
CH3 H H CH3
(E,E)-2,4-hexadiene
加热条件
+ ll
165℃ 90MPa
HOMO
LUMO
LUMO [ 4+2 ] 环加成反应(热 应) 热反
HOMO
HOMO*
LUMO
LUMO [ 4+2 ] 环加成光反应禁阻
HOMO*
• 参与加成的是一个分子的 参与加成的是一个分子的HOMO和另一个分子的 和另一个分子的LUMO, 电子 和另一个分子的 由一个分子的HOMO流向另一个分子的 流向另一个分子的LUMO; 由一个分子的 流向另一个分子的 ; 正常的D 反应由双烯体提供HOMO, LUMO。 正常的D-A反应由双烯体提供HOMO, 亲双烯体提供 LUMO。 吸电子基可降低亲双烯体LUMO能量 给电子基可升高双烯体 能量; 吸电子基可降低亲双烯体 能量 HOMO能量 两者均使反应容易进行。 能量, 两者均使反应容易进行。 能量
第十七章
周 环 反 应
Pericyclic reaction
自由基反应:反应中间体为自由基( 1、自由基反应:反应中间体为自由基(R· ) 离子型反应: 2、离子型反应:反应中间体为离子 周环反应:反应过程中,无中间体生成, 3、周环反应:反应过程中,无中间体生成,反应中 化学键的断裂和生成同步进行。过渡态是环状的协 化学键的断裂和生成同步进行。 同反应。 同反应。
周环反应的理论解释PPT课件

上个世纪60年代以后,有机化学反应的类型扩充为三大类: 自由基型反应
有机反应的类型 离子型反应
分子型反应(周环反应、协同反应)
分子型反应的基本特征: 1. 反应过程中不产生离子或自由基等活性中间体. 2. 反应不受溶剂极性的影响,一般也不被酸或碱所催化。 3. 反应为一步到位过程且只经过一个多中心环状过渡态。 4. 旧键的断裂和新键的形成是同步发生的。
(3) 反应有显著的立体选择性,生成空间定向产物。
R hv
R
R
R
R
R = - COOCH3
R
(一) 分子轨道对称性守恒原理(Conservation of orbital symmetry)
1. 原理的提出:
1965年伍德沃德和霍夫曼(R . B . Woodward , R . Hoffmann)在 系统研究大量协同反应的试验事实的基础上从 量 子 化 学 的 分 子 轨 道 理 论 出 发提出了分子轨道对称性守恒原理。 1971年福井谦一 提出了完整的前线轨道(ontier orbital)理论。
SO2
1,3-偶极加成: CH2 N N
CHCO2Me CHCO2Me
N N
CO2Me CO2Me
[4+2]环加成: CH2 CH CH CH2 CH2 CH2
对称允许的[4π+2π]热环化加成反应
Ψ2(A) Ψ2(A)
Ψ3(S) Ψ1(S)
对称禁阻的[2 π +2 π]热环化加成反应
前线轨道 (FMO)理论认为,在双分子光反应中,两 组分均为具有两个成单电子的激发态分子,单电子占据 的MO又称为SOMO,。故光照下的环加成方式为: 两组分能量较高的两个SOMO组合形成一个σ单键; 两组分能量较低的两个SOMO组合形成另一个σ单键。 两组分相互组合的SOMO必须具有相同的对称性且能量相 近才能重叠。若对称性不同则不能发生环加成反应
有机反应的类型 离子型反应
分子型反应(周环反应、协同反应)
分子型反应的基本特征: 1. 反应过程中不产生离子或自由基等活性中间体. 2. 反应不受溶剂极性的影响,一般也不被酸或碱所催化。 3. 反应为一步到位过程且只经过一个多中心环状过渡态。 4. 旧键的断裂和新键的形成是同步发生的。
(3) 反应有显著的立体选择性,生成空间定向产物。
R hv
R
R
R
R
R = - COOCH3
R
(一) 分子轨道对称性守恒原理(Conservation of orbital symmetry)
1. 原理的提出:
1965年伍德沃德和霍夫曼(R . B . Woodward , R . Hoffmann)在 系统研究大量协同反应的试验事实的基础上从 量 子 化 学 的 分 子 轨 道 理 论 出 发提出了分子轨道对称性守恒原理。 1971年福井谦一 提出了完整的前线轨道(ontier orbital)理论。
SO2
1,3-偶极加成: CH2 N N
CHCO2Me CHCO2Me
N N
CO2Me CO2Me
[4+2]环加成: CH2 CH CH CH2 CH2 CH2
对称允许的[4π+2π]热环化加成反应
Ψ2(A) Ψ2(A)
Ψ3(S) Ψ1(S)
对称禁阻的[2 π +2 π]热环化加成反应
前线轨道 (FMO)理论认为,在双分子光反应中,两 组分均为具有两个成单电子的激发态分子,单电子占据 的MO又称为SOMO,。故光照下的环加成方式为: 两组分能量较高的两个SOMO组合形成一个σ单键; 两组分能量较低的两个SOMO组合形成另一个σ单键。 两组分相互组合的SOMO必须具有相同的对称性且能量相 近才能重叠。若对称性不同则不能发生环加成反应
有机化学Chap18~21-周环杂环糖脂类氨基酸复习重点资料

D. 油脂易酸败
7. 维生素 A 为动物生长发育所必须,人体缺乏它,会导致夜盲症。它属于( )
A. 单萜
B. 倍半萜
C. 双萜
D. 三萜
8. 下列属于甾族化合物的是( )
有机化学
第4页
有机化学习题集
Chap20、21-杂环、脂类、氨基酸
Chap18-杂环化合物 参考答案
Chap19-杂环化合物 参考答案
A. 葡萄糖
B. 蔗糖
5. α-D-吡喃葡萄糖的 Haworth 式为()
C. 糖原
D. 麦芽糖
6. 下列糖与 HNO3 反应后,产生内消旋体的是()
7. D-吡喃葡萄糖与 1mol 无水乙醇和干燥 HCl 反应得到的产物属于()
A. 醚
B. 酯
C. 缩醛
D. 半缩醛
8. 下列叙述正确的是()
A. 糖类又称为碳水化合物,都符合 Cm(H2O)n 通式
一、选择题 1. D 2. A
二、是非题 1. × 2. √
3. C 4. C 5. A 6. A 3. √ 4. × 5. √
参考答案
7. C 8. B
Chap21 脂类、氨基酸 参考答案
一、选择题 1. C 2. C 3. A 4. B 5. B 6. C 7. C 8. A
有机化学
第5页
3. 由于β-D-葡萄糖的构象为优势构象,所以在葡萄糖水溶液中,其含量大于α-D-
葡萄糖。( )
有机化学
第3页
有机化学习题集
Chap20、21-杂环、脂类、氨基酸
4. 葡萄糖、果糖、甘露糖三者既为同分异构体,又互为差向异构体。( ) 5. β-D-甲基吡喃葡萄糖苷在酸性水溶液中会产生变旋光现象。( )
第十八章 周环反应

在化学反应中,凡是通过环状过渡状态进 行的协同反应称为周环反应。
周环反应主要包括:电环化反应,环加成反应, σ键迁移反应。
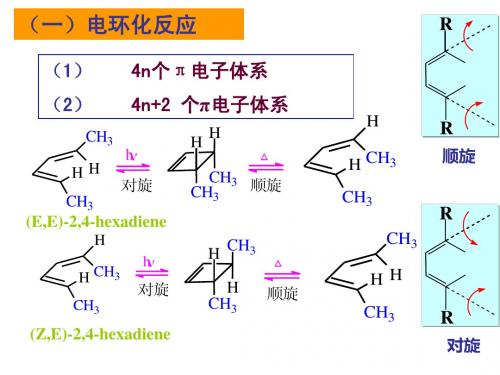
一、电环化反应
在光和热的作用下,链状的共轭烯烃两端形成σ 键并环合转变为环状烯烃,以及它的逆反应—环状 烯烃开环变成共轭烯烃的反应,称为电环化反应。
热(或光)
电环化反应最显著的特点是具有高度的立 体专一性。
分子轨道分析
Ψ4 Ψ3 Ψ2 Ψ1
电环化反应实例分析
CH3 H CH3 H
CH3 H H CH3 175 oC
顺旋
CH3 175 oC
顺旋
CH3
CH3
CH3
CH3 H H CH3
130 o
对旋
C
CH3 CH3
CH3 H H CH3
CH3
光 顺旋
CH3
H hv
对旋
H
H
H
顺旋
H H
对旋
H
H
二、环加成反应
* π B
LUNO HOMO (原 LUNO ) 光反应(对称性允许)
Aπ
*
[ 2+2 ]环加成是光作用下允许的反应。
与乙烯结构相似的化合物的环加成方式与乙稀的相同。
Me
Me
+ Me
hυ Me
Me Me Me
Me
二、[ 4+2 ]环加成
以乙烯与丁二烯为例讨论 从前线轨道(FMO)来看,乙烯与丁二烯 HOMO和LUMO如下图:
CH3 H H CH3 CH3 H CH3 H
对旋
CH3 H H CH3
顺旋
CH3 H H CH3
电环化反应的选择规则
热反应
Π电子数 顺旋 对旋
周环反应主要包括:电环化反应,环加成反应, σ键迁移反应。
一、电环化反应
在光和热的作用下,链状的共轭烯烃两端形成σ 键并环合转变为环状烯烃,以及它的逆反应—环状 烯烃开环变成共轭烯烃的反应,称为电环化反应。
热(或光)
电环化反应最显著的特点是具有高度的立 体专一性。
分子轨道分析
Ψ4 Ψ3 Ψ2 Ψ1
电环化反应实例分析
CH3 H CH3 H
CH3 H H CH3 175 oC
顺旋
CH3 175 oC
顺旋
CH3
CH3
CH3
CH3 H H CH3
130 o
对旋
C
CH3 CH3
CH3 H H CH3
CH3
光 顺旋
CH3
H hv
对旋
H
H
H
顺旋
H H
对旋
H
H
二、环加成反应
* π B
LUNO HOMO (原 LUNO ) 光反应(对称性允许)
Aπ
*
[ 2+2 ]环加成是光作用下允许的反应。
与乙烯结构相似的化合物的环加成方式与乙稀的相同。
Me
Me
+ Me
hυ Me
Me Me Me
Me
二、[ 4+2 ]环加成
以乙烯与丁二烯为例讨论 从前线轨道(FMO)来看,乙烯与丁二烯 HOMO和LUMO如下图:
CH3 H H CH3 CH3 H CH3 H
对旋
CH3 H H CH3
顺旋
CH3 H H CH3
电环化反应的选择规则
热反应
Π电子数 顺旋 对旋
周环化反应
第二节 周环反应(pericyclic reactions)
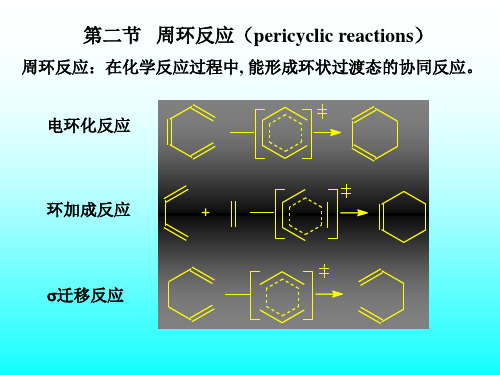
周环反应:在化学反应过程中, 能形成环状过渡态的协同反应。
电环化反应
环加成反应
+
迁移反应
1-1周环反应
1.定义: 在最近的五十年里,有机化学家研究有机化学机理,
主要有两种。一种是游离基型反应,一种是离子型反应,它们都生 成稳定或不稳定的中间体。 离子型或游离基型反应: 反应物→中间体→产物 另一种机理是,在反应中不形成离子或游离基的中间体,而认为 是有电子重新组织经过四或六中心环的过渡态而进行的。这类反应 不受溶剂极性的影响,不被碱或酸所催化,没有发现任何引发剂对 反应有什么关系。这类反应似乎表明化学键的断裂和生成是同时发 生的。这种一步完成的多中心反应叫周环反应。
• 三.前线轨道. • 福井认为最高的已占分子轨道(HOMO)上的 电子被束缚得最松弛,最容易激发到能量最低 的空轨道(LUMO)中去。这些轨道是处于前 线轨道(FMO),前线轨道理论认为:化学 键的形成主要是由FMO的相互作用决定的。 分子的HOMO与LUMO能量接近,容易组成 新轨道。
• 2-3 电环化反应
周环反应:反应物→产物
2.周环反应的特征: ①反应进行的动力,是加热或光照。 ②反应进行时,有两个以上的键同时断 裂或形成,是多中心一步反应。 ③反应时作用物的变化有突出的立体选 择性。 ④在反应过渡态中原子排列是高度有序 的。
1-2 分子轨道理论
• 几个原子轨道线性组合,形成几个分子轨道, 比原子轨道能量低的为成键轨道,比原子轨 道能量高的为反键轨道。其电子填充符合 Pauli原理和Hund规则。
其它烯烃的轨道对称性与乙烯相同,因此,[2+2]环化 加成在面对面的情况下,热反应是禁阻的,光反应是
周环反应:在化学反应过程中, 能形成环状过渡态的协同反应。
电环化反应
环加成反应
+
迁移反应
1-1周环反应
1.定义: 在最近的五十年里,有机化学家研究有机化学机理,
主要有两种。一种是游离基型反应,一种是离子型反应,它们都生 成稳定或不稳定的中间体。 离子型或游离基型反应: 反应物→中间体→产物 另一种机理是,在反应中不形成离子或游离基的中间体,而认为 是有电子重新组织经过四或六中心环的过渡态而进行的。这类反应 不受溶剂极性的影响,不被碱或酸所催化,没有发现任何引发剂对 反应有什么关系。这类反应似乎表明化学键的断裂和生成是同时发 生的。这种一步完成的多中心反应叫周环反应。
• 三.前线轨道. • 福井认为最高的已占分子轨道(HOMO)上的 电子被束缚得最松弛,最容易激发到能量最低 的空轨道(LUMO)中去。这些轨道是处于前 线轨道(FMO),前线轨道理论认为:化学 键的形成主要是由FMO的相互作用决定的。 分子的HOMO与LUMO能量接近,容易组成 新轨道。
• 2-3 电环化反应
周环反应:反应物→产物
2.周环反应的特征: ①反应进行的动力,是加热或光照。 ②反应进行时,有两个以上的键同时断 裂或形成,是多中心一步反应。 ③反应时作用物的变化有突出的立体选 择性。 ④在反应过渡态中原子排列是高度有序 的。
1-2 分子轨道理论
• 几个原子轨道线性组合,形成几个分子轨道, 比原子轨道能量低的为成键轨道,比原子轨 道能量高的为反键轨道。其电子填充符合 Pauli原理和Hund规则。
其它烯烃的轨道对称性与乙烯相同,因此,[2+2]环化 加成在面对面的情况下,热反应是禁阻的,光反应是
周环反应

立体化学选择规律: 含4n+2个电子的共轭体系的电环化反应,热反应按对旋 方式进行,光反应按顺旋方式进行 (即热对旋,光顺旋)。
8
H
H
× △
H
H
4n体系 对旋禁阻
△
4n+2体系 对旋允许
H
△
H H
△
H H
H
4n体系 顺旋允许
4n+2体系 对旋允许
9
[小结]
电环化反应立体选择性规律:
电子数
4n 4n+2
△
OH H3CO CH2CH=CH2 *
邻丁子香酚
28
(b)Cope重排反应
H3C
300℃
H3C
H3C ROOC
150℃
H3C ROOC
29
Cope重排通常认为经过椅式过渡态
H3C
H
H3C H3C
H3C H3C
H3C H3C
CH3
H3C
H
Cope重排在合成上具有重要价值:
CH3 CH3 O O
CH3 H
H
H CH3
顺旋
H
CH3 H
顺旋1
顺旋2
电环化反应的立体选择性,取决于HOMO轨道的对称性。
加热条件下, 顺旋对称允许, 对旋对称禁阻。(4n体系)
34
2)、光照(激发态)
2 3 4
hv 对旋
1
2
3
3 (HOMO)
1
4
hv
H3C H H CH3
H3C H H CH3
对旋
对旋1
对旋2
•
光照条件下, 对旋对称允许, 顺旋对称禁阻。(4n体系)
第十八章 协同反应

O
H
O O O
H
H
H H H
Na2CO3 水溶液
Pb(OAc)4
篮烯basketene)
标出下列反应的条件
Me Me +
hv
O
O
+
H2C CH3
CH2 CH3
Me Et
hv
Me
Et
H
hv
加热
H H H
顺旋
对旋
完成下列反应
hv
+
O
O O
+
hv O
O O
O
O
CH3 H H
O
H
H
CH3 CH3
CH3
4、理论解释电环化的高度立体选择性
(1)4n体系 4
CH3 H H CH3
3
2 1
(LUMO)
(HOMO)
(HOMO)
Ground state
Excited state
反应时,前线轨道理论认为是分子的最高占据轨道转化为 一个新的键。同时只有位相相同的一端接近时才能成键。 (a)加热条件,前线分子轨道为ψ2
4 3 2 1
基态 激发态
1,3-丁二烯的分子轨道
(2)轨道对称性 分子轨道可用几何图形表示,不仅有形状的不同,而 且有位相的差别。分子轨道的对称元素主要有对称轴 (C)和对称面(m)
m m
H H
H H
C2
(3)轨道对称性守恒原则
1965年Woodward和Horfmann提出的,内容:对于一个基元 反应,在整个反应过程中,反应物分子轨道、过渡态分子轨道 以及产物分子轨道的对称性,对于所选定的对称元素而言,其 对称性始终保持不变。此时的反应是对称性允许的反应,反应 所需的活化能较低,反应可以顺利进行。反之,对称性禁阻, 不容易发生反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A BA B
顺旋
AA BB
BB AA
AA BB
A BA B
AA BB
对旋
BB AA
对称性不匹配,不能成键。
链状和环状共轭烯烃的判断
一个环状的共轭多烯是由三个单键连接两端的 双键的,应将其恢复为链状共轭多烯,再判断 它是4n或是4n+2电子体系。
由双键转化而来的单键
电环化反应形成的单键
由双键转化而来的单键
B
A
B AA B
A
B
A
B
以键轴为轴向同一方向(均为顺
时针,或均为逆时针)称为顺旋。 B
A
B
A
A
B
(dl)
以键轴为轴向不同方向(一为顺 时针,另一为逆时针)称为对旋。
B
B
B AA B
A
A
A
A
B
B
对称性不匹配,不能成键。
C. 4n电子体系在光照条件下的电环化反应
在光照条件下,4n电子体系参与电环化反应的 最高占有轨道(HOMO)是3,3在顺旋和对旋 时的成键状态如下:
18.3 -迁移反应
-迁移反应:一个以键与共轭多烯相连 的原子或基团,在加热条件下从共轭体 系的一端到另一端的迁移反应,同时伴 随单双键的互变。
分类:-迁移反应分为原子或基团从共 轭体系的一端到另一端的迁移称为[1,j]迁 移,又可进一步分为氢原子迁移和烷基 迁移;联结两段共轭体系的键在共轭体 系上的位移,称为[i,j]迁移,主要是 [3,3’]--迁移。
1.4n电子体系的电环化反应
A. 4n电子体系的分子轨道
反键轨道
HOMO
成键轨道
加热条件下电子填充
反键轨道
HOMO
成键轨道
光照条件下电子填充
B. 4n电子体系在加热条件下的电环化反应
在加热条件下,4n电子体系参与电环化反应的 最高占有轨道(HOMO)是2,2在顺旋和对旋 时的成键状态如下:
A和B分别为取代基, 在分子的水平面上。
R1
R2 R3
1 23
R1 R3 R2
R2
R3
R1
1 23
类推烷基的[1,j]迁移规律
1,3迁移,构型翻转
R1
R2 R3
1,7迁移,构型翻转
1 23 4 5 6 7 8 9
1,5迁移,平移即可 1,9迁移,平移即可
构型保持
hv
O
O
结论:
氢迁移 烷基迁移 1,3-迁移 禁阻 构型翻转 1,5-迁移 同面迁移 构型保 持 1,7-迁移 异面迁移 构型翻转
最典型的[4+2]环加成反应就是Diels-Alder反应, 其中利用了乙烯分子的HOMO,及1,3-丁二烯 分子的LUMO;或者相反。
基态1,3-丁二烯的HOMO
基态乙烯的LUMO
基态1,3-丁二烯的LUMO
基态乙烯的HOMO
hv
2
+
2
hv
+
2
+
内式为主产物 外式为次产物
结论: [2+2],光照;[4+2],加热。
转化为链状共轭多烯
再判断属于哪种电子体系
结论:
电环化反应条件为光照和加热,成键方 式为顺旋和对旋,电子体系分为4n和 4n+2,它们之间的关系可以表示如下:
4n 4n+2
加热 顺
对
光照 对
顺
加热条件下为顺旋成键
CH3
CH3
CH3
H
H
hv
H
H
H (dl)
CH3
CH3
CH3
H
光照条件下为对旋成键
H
电环化反应:共轭多烯与共轭环烯在加
热或光照条件下的相互转化,同时单双
键互变。根据链状共轭多烯的电子数 可以将共轭多烯分为4n和4n+2两类:
R1-CH=CH-CH=CH-R2 含有4个电子,符合4n(n=1)
R1-CH=CH-CH=CH-CH=CH-R2
含有6个电子,符合4n+2(n=1)
最高占有轨道(high occupied molecular orbital, HOMO),和最低空轨道(low unoccupied molecular orbital, LUMO) 称为前线轨道。
1 23 4 5 6 7 8 9
氢原子的[1,5]迁移——同面迁移
H
氢原子在分子的同面
H
迁移,对称性就是匹
配的,称为同面迁移。
H
氢原子的[1,7]迁移——异面迁移
氢原子在分子的
H
异面迁移,对称
性才是匹配的,
称为异面迁移。
H
H
B. [1,j]烷基迁移
烷基碳原子的杂化状态为sp3,可通过sp2进行 翻转:
才能保证对称性匹配,称为
异面迁移。
H
这样就要求这个键角足够小, 才能将氢原子异面迁移,这 在空间上是不允许的,称为 几何不允许。
共轭多烯的自由基的 HOMO中偶数位置没有
原子轨道,而是由一个节点代替
类似 CH2=CH-CH=CH-CH=CH-CH=CH-CH2 的HOMO:
1
23 4 5 67 89
在加热条件 下,[2+2]环 加成是不能 反应的。
如果在激发态下,即在光照条件下将一个 乙烯分子激发为激发态,利用它的HOMO 与另一处于基态的的乙烯分子的LUMO对 称性匹配就可以成键:
激发态分子的HOMO
基态分子的LUMO
激发态的乙烯分子
[2+2]环加成是在光照条件下进行的。
2.[4+2]环加成反应
分类:双键与双键之间的成环称为[2+2] 环加成;双键与共轭双烯的成环(如: Diels-Aldor反应)称为[4+2]环加成。
1.[2+2]环加成反应
最典型的[2+2]环加成反应就是乙烯分子 间的反应,其中利用了一个乙烯分子 HOMO,另一个乙烯分子的LUMO:
LUMO HOMO
一个分子的HOMO 另一个分子的LUMO
1.[1,j]迁移反应
A. [1,j]氢迁移
氢原子的[1,3]迁移
H
3 12
氢原子的[1,3]迁移实质上就相当于 氢原子在烯丙基自由基上的迁移, 它对引应的轨道就是烯丙基自由基 的最高占有轨道(HOMO):
CH2=CH-CH2
非键轨道
反键轨道
LUMO
HOMO
成键轨道
氢原子要穿过分子平面迁移,
H
LUMO HOMO
3 3'
2'
2
1 1'
CH3 CH3
CH3
E
O
O
E
O
S
R
1'
1O
2'
3' 23
hv
O
O
O
OH
CH3
1' 2' 3'
1 O-CH2-CH=CH-CH3
2 3 CH3
CH3
3,3'迁移
O
CH3
1 32
1' 2' 3'
CH-CH=CH2
CH3
3,3'迁移
CH3
O5
4
3 CH3
12
H CH2-CH=CH2CH315氢迁移OHCH3
CH3
CH2-CH=CH2CH3
相当于烯丙基直接 联到了羟基对位。
基础有机化学的内容到这里就结 束了,它就像这把钥匙,虽然古 旧,却为我们打开了一扇新知识 的大门,相信学习有机化学所带 来的不仅仅是增长知识的快乐!
2.[i,j]迁移反应——[3,3’]--迁 移
联结两个烯丙基的键在加热条件下迁移至烯丙 基的另一端,同时单双键互换,称为Cope重排;
一个烯丙基中含有氧原子,也称为Claisen重排, 以上均为典型的[3,3’]--迁移反应。
两个烯丙基形成了椅式构像式的六元环过渡态:
CH2=CH-CH2
CH3
在加热条件下,4n+2电子体系参与电环化反应 的最高占有轨道(HOMO)是3,3在顺旋和对 旋时的成键状态如下:
A BA B
对旋
AB BA
BA AB
AB
BA
(dl)
AA
A BA B
BB
BB
顺旋
AA
对称性不匹配,不能成键。
C. 4n+2电子体系在光照条件下的电环化反应
在光照条件下,4n+2电子体系参与电环化反应 的最高占有轨道(HOMO)是4,4在顺旋和对 旋时的成键状态如下:
B
AA
B
以对旋方式
B
A
A
B
A
A
B
B
B
B
AA
以顺旋方式
B AA
B
B
A
A
B
A
A
B
B
对称性不匹配,不能成键。
2.4n+2电子体系的电环化反应
A. 4n+2电子体系的分子轨道
反键轨道
HOMO
成键轨道
加热条件下电子填充
反键轨道
HOMO
成键轨道
光照条件下电子填充
B. 4n+2电子体系在加热条件下的电环化反应
第十八章 周环反应
电环化反应 环加成反应 -迁移反应
周环反应是经历环状过渡态的协同反应; 协同反应是指旧化学键断裂和新化学键 的生成在同一过渡态内完成,反应没有 产生活性中间体,
周环反应的特点: 1.协同过程,无活性中间体生成; 2.立体专一反应 ; 3.反应条件只需光照(h)或加热()。
