北师大《无机化学》第四版习题答案5
无机化学第四版思考题答案

无机化学第四版思考题答案【篇一:北师大《无机化学》第四版习题答案5】>5-1 从手册中查出常用试剂浓硫酸、浓盐酸、浓硝酸、浓氨水的密度和质量分数计算它们的(体积)物质的量浓度和质量摩尔浓度。
解:经查阅:p(hcl)=1.19g/ml w(hcl)=37.23%p(h2so4)=1.83g/mlw(h2so4)=98%p(hno3)=1.42g/mlw(hno3)=69.80%p(nh3.h2o)=0.9g/ml w(nh3.h2o)=26%设1㎏水中含溶质n mol,则由w=m/(m+1000)(m为溶质质量)可得: m (hcl)=16.2 mol/㎏m(h2so4)=500 mol/㎏m (nh3.h2o)= 20.67 mol/㎏5-3化学实验中经常用蒸馏水冲洗已用自来水洗净的烧杯。
设洗净烧杯内残留“水”为1ml,试计算,用30ml蒸馏水洗1次和2次,烧杯中残留的“自来水的浓度”分别多大?解:再用自来水洗之后,烧杯中自来水为1ml之后,加入30ml蒸馏水,一共为31ml水,自来水占1/31,倒掉后又倒1ml,故自来水浓度为1/31。
若第一次加入的蒸馏水倒掉之后,1ml中含1/31ml的自来水;再加入30ml蒸馏水,一共为31ml水,自来水占1/312=1/963所以倒掉后自来水占1/312=1/9635-4 计算15℃,97kpa下15g氯气的体积。
该气体的摩尔质量为:52.8 g/mol。
5-6测得2.96g氯化在407℃的1l容积的真空系统里完全蒸发到的压力为60kpa,求氯化汞蒸气的摩尔质量和化学式。
(2)设氯化汞的化学式为hgcln ,则200.6+35.5n=278.9解得 n=2答:氯化汞的摩尔质量是278.9g/mol,化学式是hgcl2(2)设硫蒸气的化学式为sn,则32n=65 解得n=2所以硫蒸气的摩尔质量是 65g/mol化学式是s2.5-8 在25℃时将相同压力的5.0l氮气和15l氧气压缩到一个10.0l 的真空容器中,测得混合气体的总压为150kpa,(1)求两种气体的初始压力;(2)求混合气体中氮和氧的分压;(3)将温度上升到210℃,容器的总压。
北师大《无机化学》第四版习题参考答案

精心整理第十一章电化学基础11-1用氧化数法配平下列方程式(1)KClO 3→KClO 4+KCl(2)Ca 5(PO 4)3F+C+SiO 2→CaSiO3+CaF 2+P 4+CO(3)NaNO 2+NH 4Cl →N 2+NaCl+H 2O(4)K 2Cr 2O 7+FeSO 4+H 2SO 4→Cr 2(SO 4)3+Fe 2(SO 4)3+K 2SO 4+H 2O(5)CsCl+Ca →CaCl 2+Cs解:(((((11-2(1(2(3(4(5解:(2(3(4(511-3.用半反应法(离子-电子法)配平下列方程式(1)K 2Cr 2O 7+H 2S+H 2SO 4——K 2SO 4+Cr 2(SO 4)3+H 2O(2)MnO 42-+H 2O 2———O 2+Mn 2+(酸性溶液)(3)Zn+NO 3-+OH -——NH 3+Zn (OH )42-(4)Cr (OH )4-+H 2O 2——CrO 42-(5)Hg+NO 3-+H +——Hg 22++NO解:(1)K 2Cr 2O 7+3H 2S+4H 2SO 4==K 2SO 4+Cr 2(SO 4)3+7H 2O+3S(2)MnO 42-+2H 2O 2+4H +==2O 2+Mn 2++4H 2O(3)Zn+NO 3-+3H 2O+OH -==NH 3+Zn (OH )42-(4)2Cr(OH)4-+3H2O2+2OH==-2CrO42-+8H2O(5)6Hg+2NO3-+8H+==3Hg22++2NO+4H2O11-4将下列反应设计成原电池,用标准电极电势判断标准态下电池的正极和负极,电子传递的方向,正极和负极的电极反应,电池的电动势,写出电池符号.(1)Zn+2Ag+=Zn2++2Ag(2)2Fe3++Fe=3Fe2+(3)Zn+2H+=Zn2++H2(4)H2+Cl2=2HCl(5)3I2+6KOH=KIO3+5KI+3H2O11-5写出下列各对半反应组成的原电池的电池反应、电池符号,并计算标准电动势。
北师大《无机化学》第四版习题答案5

北师大《无机化学》第四版习题答案5第五章化学热力学基础5-1 从手册中查出常用试剂浓硫酸、浓盐酸、浓硝酸、浓氨水的密度和质量分数计算它们的(体积)物质的量浓度和质量摩尔浓度。
解:经查阅: p(HCl)=1.19g/ml w(HCl)=37.23%p(H2SO4)=1.83g/ml w(H2SO4)=98%p(HNO3)=1.42g/ml w(HNO3)=69.80%p(NH3.H2O)=0.9g/ml w(NH3.H2O)=26%由公式c=pw/M可得:c(HCl)=12 mol·L–1c(H2SO4)=18.3mol·L–1c(HNO3)=15.7 mol·L–1 c (NH3.H2O)=13.8 mol·L–1设1㎏水中含溶质n mol,则由w=m/(m+1000)(m为溶质质量)可得:m (HCl)=16.2 mol/㎏m(H2SO4)=500 mol/㎏m(HNO3)=36.69 mol/㎏m (NH3.H2O)= 20.67 mol/㎏5-2 从手册查出常温下的饱和水蒸气压,计算当时相对湿度为40%时,水蒸气压多大。
解:在298K下,P(饱和水蒸气压)=3.167Kpa,P(不饱和)/P(饱和)=40%,则P(不饱和)/P(饱和)=40%×P(饱和)=0.4×3.167=1.2668 Kpa答:水蒸气压为1.2668 Kpa.5-3化学实验中经常用蒸馏水冲洗已用自来水洗净的烧杯。
设洗净烧杯残留“水”为1mL,试计算,用30mL蒸馏水洗1次和2次,烧杯中残留的“自来水的浓度”分别多大?解:再用自来水洗之后,烧杯中自来水为1ml之后,加入30ml 蒸馏水,一共为31ml 水,自来水占1/31,倒掉后又倒1ml,故自来水浓度为1/31。
若第一次加入的蒸馏水倒掉之后,1ml中含1/31ml的自来水;再加入30ml蒸馏水,一共为31ml水,自来水占1/312=1/963 所以倒掉后自来水占1/312=1/9635-4 计算15℃,97kPa下15g氯气的体积。
大学《无机化学》第四版_习题答案

无机化学(第四版)答案第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
北师大无机化学四版习题答案5章化学动力学基础
解:(1) HBr + O2→HOOBr
HOOBr+HBr→2HOBr
+ 2HOBr+2HBr→2H2O+2Br2
4HBr+O2→H2O+Br2
(2)
(3)中间体是HOOBr和HBr
(4)a、若第一步是速控步,则
b、若第二步是速控步,则 ………①
根据稳态近似假设则
即 - .
代入①,得 。
根据 由上图可解出斜率 ,所以 =232.71kJ∙mol-1:
截距 ,所以
5.9测得某反应在273K和313K下的速率常数分别为1.06×10-5s-1和2.93×10-3s-1.求该反应在298K下的速率常数。
解:
故
解得,k3=4.25×10-4s-1
答:该反应在298K下的速率常数为4.25×10-4s-1
I 30 55
II 70 20
III 16 35
(1)哪个反应的正反应速率最大?
(2)反应I的反应焓多大?
(3)哪个反应的正反应是吸热反应?
解:( 1 )反应III的正反应速率最大·因为 ,Ea越小,k越大:
( 2 )ΔrHm= Ea-Ea’= (30-50) kJ∙mol-1=-25 kJ∙mol-1,
第5章化学动力学基础
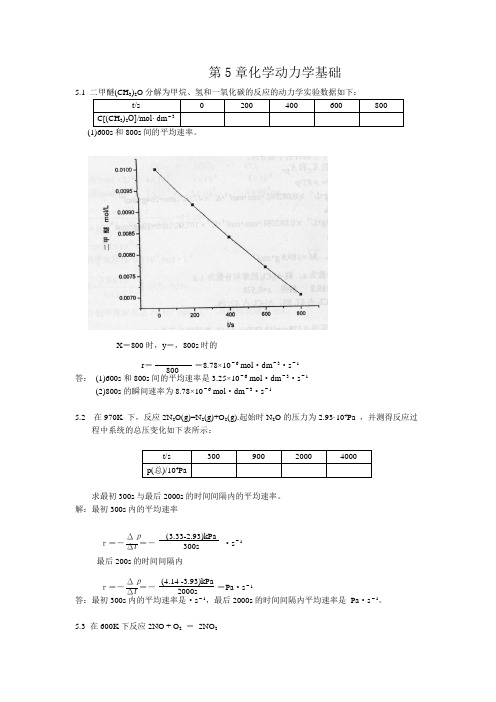
5.1二甲醚(CH3)2O分解为甲烷、氢和一氧化碳的反应的动力学实验数据如下:
t/s
0
200
400
600
800
C[(CH3)2O]/mol∙dm-3
(1)600s和800s间的平均速率。
X=800时,y=,800s时的
r= =8.78×10-6mol·dm-3·s-1
北师大《无机化学》第四版习题答案

第九章 酸碱平衡9-1 以下哪些物种是酸碱质子理论的酸,哪些是碱,哪些具有酸碱两性?请分别写出它们的共轭碱或酸。
SO -24, S-2, H 2PO -4, NH 3, HSO -4, [Al(H 2O)5OH]+2, CO -23, NH +4, H 2S, H 2O,OH -,H 3O +, HS -, HPO -24。
解: 质子酸 — 共轭碱H 2PO -4 — HPO -24 HSO -4 — SO -24 [Al(H 2O)5OH]+2—[Al(H 2O)4(OH)2]+NH +4 —NH 3 H 2S — HS -H 2O — OH -H 3O +— H 2O HS -— S-2 HPO -24 — PO -34质子碱 — 共轭酸SO -24 — HSO -4 S-2 — HS -NH 3 — NH +4 HSO -4— H 2SO 4[Al(H 2O)5OH]+2—[Al(H 2O)6]+3 CO -23 — HCO -3 H 2O — H 3O +OH -— H 2O HS -— H 2S HPO -24 — H 2PO -4酸碱两性:H 2PO -4, HSO -4, [Al(H 2O)5OH]+2, H 2O , HS -, HPO -24。
9-2 为什么pH=7并不总表明水溶液是中性的。
解: 因为水的解离是一个明显的吸热过程,因此水的离子积是温度的函数,只有在常温下K w =1.0×1014-,即[H +]=[OH -]=1.0×107-,所以pH =7,其他温度下则不然。
9-3 本章表示电解质及其电离产物的浓度有两种,一种如c(HAc)、c(NH +4),另一种如[HAc],[NH +4]等,它们的意义有何不同?什么情况下电离平衡常数的表达式中可以用诸如c(HAc)、c(NH +4)等代替诸如[HAc],[NH +4]等?有的书上没有诸如c(HAc)、c(NH +4)这样的浓度符号,遇到浓度时一律用诸如[HAc],[ NH +4]等来表示,这样做有可能出现什么混乱?解:c(HAc)、c(NH +4)用来表示初始状态的浓度,而[HAc],[ NH +4]用来表示平衡状态下的浓度。
大学《无机化学》第四版_习题答案

无机化学(第四版)答案第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
无机化学第四版(北京师范大学大学等)答案下册

无机化学第四版(北京师范大学大学等)答案下册碳的还原性1.与氧气反应(燃烧)2.与石英砂高温反应(工业应用:制硅单质)3.与金属氧化物反应如氧化铜、氧化铁(冶炼铁用焦炭,实际的还原剂主要是什么?)4.被热的浓硫酸氧化5.被热的浓硝酸氧化6.高温下被二氧化碳氧化。
*高温下被水氧化生成水煤气。
碳酸盐小结1.一些碳酸盐的存在、俗称或用途。
大理石、石灰石、白垩、方解石、蛋壳、贝壳、钟乳石—CaCO3;纯碱、苏打—Na2CO3;小苏打—NaHCO3 (可用于食品发泡,治疗胃酸过多症)菱镁矿—MgCO3(制MgO);菱铁矿—FeCO3 ;碳铵—NH4HCO3;(氮肥)草木灰的主要成分—K2CO3;(钾肥)暂时硬水的成分—Ca(HCO3)2和Mg(HCO3)2 ;锅垢的主要成分—CaCO3和Mg(OH)2;炼铁的“熔剂”—CaCO3 (炼钢的造渣剂是生石灰)制普通玻璃原料—石灰石、纯碱、石英;制水泥的原料—石灰石、粘土2.碳酸的正盐和酸式盐(1)相互转化: 碳酸钙和碳酸氢钙的转化(实验现象; 石灰岩洞和钟乳石形成)碳酸钠和碳酸氢钠的转化(碳酸钠溶液跟盐酸反应不如碳酸氢钠剧烈; 除去碳酸氢钠溶液中的碳酸钠杂质; 除去碳酸钠中碳酸氢钠杂质; 除去二氧化碳中的氯化氢杂质为什么不用碳酸钠溶液而用碳酸氢钠溶液等问题)(2)共同性质: 都能跟酸(比碳酸强的酸)反应生成二氧化碳气体. (碳酸盐的检验)(3)稳定性比较: 正盐比酸式盐稳定[稳定性: 酸<酸式盐<正盐,是一个比较普遍的现象如HClO<Ca(ClO)2; H2SO3<Na2SO3等](碳酸氢钠受热的实验现象; 碳酸氢钙溶液受热的实验现象)(4)溶解性比较碱金属碳酸盐: 酸式盐的溶解性弱于正盐. 如NaHCO3<Na2CO3碱土金属碳酸盐: 酸式盐的溶解性强于正盐如Ca(HCO3)2>CaCO3(5)碳酸氢钠与碳酸钠某些反应的异同? 都有碳酸盐的通性—-与盐酸反应生成二氧化碳(要注意熟悉反应时耗酸量及生成气体量的各种情况下的比较.)? 跟石灰水或氢氧化钡溶液都生成白色沉淀? 碳酸氢钠能跟氢氧化钠等碱反应而碳酸钠不反应;? 碳酸钠跟氯化钙或氯化钡溶液易生成碳酸盐沉淀,而碳酸氢钠跟盐类稀溶液不易生成沉淀.钠及其化合物的重要性质(一)钠的反应1. 钠跟氧气常温下一般认为生成氧化钠,加热(燃烧)生成过氧化钠. (钠的保存)2. 钠跟硫能剧烈反应,甚至爆炸3. 钠跟水反应(现象?)4.*钠跟硫酸铜溶液反应(现象?)5. 钠跟乙醇反应(与跟水的反应比较;)(有机物中的醇羟基、酚羟基、羧基都跟钠反应生成氢气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章化学热力学基础5-1 从手册中查出常用试剂浓硫酸、浓盐酸、浓硝酸、浓氨水的密度和质量分数计算它们的(体积)物质的量浓度和质量摩尔浓度。
解:经查阅: p(HCl)=1.19g/ml w(HCl)=37.23%p(H2SO4)=1.83g/ml w(H2SO4)=98%p(HNO3)=1.42g/ml w(HNO3)=69.80%p(NH3.H2O)=0.9g/ml w(NH3.H2O)=26%由公式c=pw/M可得:c(HCl)=12 mol·L–1c(H2SO4)=18.3mol·L–1c(HNO3)=15.7 mol·L–1 c (NH3.H2O)=13.8 mol·L–1设1㎏水中含溶质n mol,则由w=m/(m+1000)(m为溶质质量)可得:m (HCl)=16.2 mol/㎏m(H2SO4)=500 mol/㎏m(HNO3)=36.69 mol/㎏m (NH3.H2O)= 20.67 mol/㎏5-2 从手册查出常温下的饱和水蒸气压,计算当时相对湿度为40%时,水蒸气压多大。
解:在298K下,P(饱和水蒸气压)=3.167Kpa,P(不饱和)/P(饱和)=40%,则P(不饱和)/P(饱和)=40%×P(饱和)=0.4×3.167=1.2668 Kpa答:水蒸气压为1.2668 Kpa.5-3化学实验中经常用蒸馏水冲洗已用自来水洗净的烧杯。
设洗净烧杯内残留“水”为1mL,试计算,用30mL蒸馏水洗1次和2次,烧杯中残留的“自来水的浓度”分别多大?解:再用自来水洗之后,烧杯中自来水为1ml之后,加入30ml蒸馏水,一共为31ml 水,自来水占1/31,倒掉后又倒1ml,故自来水浓度为1/31。
若第一次加入的蒸馏水倒掉之后,1ml中含1/31ml的自来水;再加入30ml蒸馏水,一共为31ml水,自来水占1/312=1/963所以倒掉后自来水占1/312=1/9635-4 计算15℃,97kPa下15g氯气的体积。
5-5 20℃,97kPa下0.842g某气体的体积为0.400L,求气体的摩尔质量。
解:由理想气体状态方程:p×v=n×R×T,n=m /M,得p×v=m/M×R×TM=mpT/pv=0.842×8.314×293/97×103×0.4=52.8 g/mol该气体的摩尔质量为:52.8 g/mol。
5-6 测得2.96g氯化在407℃的1L容积的真空系统里完全蒸发到的压力为60kPa,求氯化汞蒸气的摩尔质量和化学式。
解:(1)设氯化汞蒸汽的摩尔质量为M,则由n=m /M ,p×v=n×R×T得M=m×R×T/p×v =2.96×8.314×680/60=278.9 g/mol(2)设氯化汞的化学式为HgCl n ,则200.6+35.5n=278.9解得n=2答:氯化汞的摩尔质量是278.9g/mol,化学式是HgCl25-7 在1000℃和97kPa下测得硫蒸气的密度为0.5977gL-1,求蒸气的摩尔质量和化学式。
解:(1)设硫蒸气的体积为1L,则由p×v=n×R×T得M=m×R×T/p×v =0.5977×8.314×1273/97×1 = 65g/mol(2)设硫蒸气的化学式为S n,则32n=65 解得n=2所以硫蒸气的摩尔质量是65g/mol化学式是S2.5-8 在25℃时将相同压力的5.0L氮气和15L氧气压缩到一个10.0L的真空容器中,测得混合气体的总压为150kPa,(1)求两种气体的初始压力;(2)求混合气体中氮和氧的分压;(3)将温度上升到210℃,容器的总压。
解:方法1:1)假设压缩两种气体的总压力为P, 分压为P1、P2,则由玻意耳定律得:P1V1=P2V2P= P2V2/ V1=75 kPaP1=75×5/(5+15)=18.75kPaP2=75× 15(5+15)=56025kPa( 2)假设混合气体的分压分别为P3、P4,则有:P3=150×5/(5+15)=18.75 kPaP4=150×15(5+15)=112.5 kPa(3)假设210℃时,容器的总压为P5,则由盖吕莎克定律得:P/T=P5/T5P5=P× T5/T=243kPa方法2:(1)两种气体的初始压力为p ,则由p1v1=p1v1得p(V N2+V O2)=p混V混则p=p混×v混/(v N2+v O2)=150×10/(5+15)=75 Kp(2)同温同压下,n(N2):n(O2)=V(N2):V(O2)=1:3P(O2)=P×X(O2)=1/4×150kPa=37.5kPaP(N2)=P×X(N2)=3/4×150kPa=122.5kPa(3) P2V2=nRT2①PV=nRT ②两式相比,得P2/P=T2/T150kPa/P=298K/483K P=243kPa5-9 在25℃,1.47MPa下把氨气通入容积为1.00刚性壁密闭容器中,在350℃下用催化剂使部分氨分解为氮气和氢气,测得总压为5MPa,求氨的解离度和各组分的摩尔分数和分压。
解:P1V1=n(NH3)RT1→n(NH3)=0.5933molP2V2=n(混)RT →n(混)=0.9653mol设有2x mol的NH3在1123K下分解,则有x molN2和3x molH2生成,则n NH3-2x+x+3x=n 总x=0.186molX(NH3)=(n NH3-2x)/n总=0.229molX(N2)=X/n总=0.193molX(H2)=3x/n总=0.578molP(NH3)=P×X(NH3)=1.146MPaP(N2)=P×X(N2)=1.965MPaP(H2)=P×X(H2)=2.89MPaNH3的解离度=(n(NH3)-2x)/n(NH3)=0.627%。
5-10 某乙烯和足量的氢气的混合气体的总压为6930Pa,在铂催化剂催化下发生如下反应:C2H4(g)+H2(g)=C2H6(g) 反应结束时温度降至原温度后测得总压为4530 Pa。
求原混合气体中乙烯的摩尔分数。
解:由等温变化得:P1V1/n1=P2V2/n2原混合气体中乙烯的摩尔分数为Ni;设气体总体积为16930*1/n=4530*1/(1-Ni)n得=0.346答:原混合气体中乙烯的摩尔分数为0.345—11以下哪些关系式是正确的(p、V、n表示混合气体的总压、总体积和总物质的量)? 说明理由。
pV B=n B RT p B V=n B RT p B V B=nRT pV=nRT答: PV B=n B RT 错误P B V=n B RT正确,它表示B物质的分压力P B V B=nRT 错误PV=nRT 正确,它就是气体的状态方程.5-12 以下系统内各有几个相?(1)水溶性蛋白质的水溶液;(2)氢氧混合气体;(3)盐酸与铁块发生反应的系统;(4)超临界状态的水。
解(1)一个相,因为溶液均匀分布的;(2)一个相,因为混合气体均匀分布的;(3)三个相,因为反映系统中有未反映的铁固体,生成H2气体以及溶液液体。
(4)一个相,因为超临界状态的水,既有水固体,又有水液体和水蒸汽。
5-1310 g水在373k和100kPa下气化,所做的功多大?解: 系统接受环境所给的功:W=P×△V=RT△n=0.008314×373×10/18=1.723kJ5—14 反应CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g)在298K下的标准摩尔热力学能变化量为-128.0Kjmol–1,求该反应的标准摩尔焓变。
解:该反应是在恒温恒压条件下进行,反应的标准摩尔生成焓:△rHm=U+P△V =-128.0+0.008314×298×(1-0)= -125.5kJ•mol–15-15 人类登月使用的阿波罗的第一级火箭使用了550吨煤油在2.5min内与氧发生燃烧反应产生巨大推力。
以C12H26(l)为煤油的平均分子式的燃烧热为-7513KJmol-1,试计算这个燃烧反应的功率。
解:设这个燃烧反应的功率为P,在2.5min内产生的热量为WkJ;则由:C6H12O6+18.5O2=12CO2+13H2O;H= –7513kJ/moL170g 7513kJ550 1000 1000g WkJW=2.43 10 10kJP=W/t=1.62 10 8kW5—16 已知Al2O3(s)和MnO2(s)的标准摩尔生成焓为-1676 KJmol-1和-521 KJmol-1,计算1g铝与MnO2(s)足量反应(铝热法)产生的热量。
解: n(Al)=1/27mol4Al+3MnO2 = 2Al2O3+3MnQp=△H=(-1676+521)×1/27=16.6kJ mol–15-17 已知Cl-1(aq)的标准摩尔生成焓为–167.5 kJ mol–1,计算1molHCl(g)溶于足量的水释放多少热?[注]计算得到的值为氯化氢的溶解热;HCl(g)的标准摩尔生成焓可从本书附表中查获。
假设水量的多少与程度无关(事实上是有关的,因此溶解热的数值通常设定为无限稀释。
)解: 假设溶于定量的水释放的热量为△H,则有: HCl(g)=H(∞aq)++Cl aq–因规定△f Hm O(H(∞aq))=0 △H(Cl–)= –167.5kJ/mol又可查表得:H(HCl) = –92.307kJ/mol△r Hm O=△f Hm O(H(∞aq))+ △f Hm O(Cl aq–)–△f Hm O(HCl(g))=0+(–167.5)–(–92.307)= 75.2 kJ•mol–1所以1 mol HCl(g)溶于足量水的释放热为75.2 kJ•mol–15-18:用标准摩尔生成焓的数据计算SiF4(g)与足量H2O(l)的反应生成SiO2(s)和HF(g)的摩尔反应焓。
解 :反应方程式为:SiF4(g)+ 2H2O(l) =SiO2(s)+4HF(g)△r Hm O=△r Hm O (SiO2)+4△r Hm O (HF) –△r Hm O (SiF4) –2△r Hm O (H2O)=(–910.94 kJ•mol-1)+4*(–271.1 kJ•mol–1) –2*(285.830 kJ•mol-1) –(–1416.98 kJ•mol–1)=191.3( kJ•mol–1)所以为:SiF4(g)+ 2H2O(l) =SiO2(s)+4HF(g) △r Hm O =191.3( kJ•mol-1)5-19 利用本书附表与下列数据计算石灰岩[以CaCO3(方解石)计]被CO2 (g)溶解发育成喀斯特地形的如下反应的标准摩尔反应焓:CaCO3 (s) + CO2 (g) + H2O(l)=Ca2+ (aq)+2HCO–-3(aq)△r Hmθ /kJ•mol-1: Ca2+ (aq) –543.0 HCO-3(aq) –691.1解:CaCO3 (s) + CO2 (g) + H2O(l)=Ca2+ (aq)+2HCO-3(aq)△r Hmθ =△r Hmθ (Ca2+(aq))+2△r Hmθ (HCO-3(aq)) –△r Hmθ(CaCO3 (s))–△r Hmθ (CO2 (g)) –△r Hmθ (H2O(l) )=(–543.0 kJ•mol–1)+2×(–691.1 kJ•mol–1) –2×(–1260.92 kJ•mol–1) –( –393.509 kJ•mol–1)–(–285.830 kJ•mol–1) = –38.941( kJ·mol–1)5-20 火柴头中的P4S3(s)标准摩尔燃烧热为-3677 kJ•mol-1 [注:燃烧产物为P4O10 (s)和SO2],利用本书附表的数据计算P4S3(s)的标准摩尔生成焓。
