青岛大学《620分析化学(含仪器分析)》历年考研真题专业课考试试题
青岛科技大学化学院《620分析化学》历年考研真题专业课考试试题

A.NaOH B.氨水 C.乙二胺
D.无水Na2CO3
8.以佛尔哈德法作沉淀滴定时,应在什麽溶液中进行? ( )。
A.中性溶液 B.碱性溶液 C.微酸性溶液 D.酸度大于0.3 mol/L
9.Zn2+, Pb2+, Al3+和Mg2+与EDTA络合物的稳定常数lgKMY分别为 16.50, 18.04, 16.3和8.7,在pH 5.0时不能滴定的是哪种物质? ( )。
A.Zn2+ B.Pb2+ C.Al3+ D.Mg2+
10.下面是四种常用氧化剂。哪种氧化性最弱?( )。 A.KMnO4 B.K2Cr2O7 C.I2 D.Br2
11.pH玻璃电极测定溶液pH, 以饱和甘汞电极作参比电极,其电 池表示正确的是:( )。
A. H2∣H+ǁHg,Hg2Cl2∣KCl(饱和) B. Ag, AgCl∣HCl∣玻璃∣试液ǁKCl(饱和)∣Hg2Cl2 ,Hg C. Ag, AgCl∣HCl∣玻璃∣试液ǁHg22+,Hg∣KCl(饱和)
6.用0.1000 mol/L HCl滴定20.00 mL 0.1000 mol/L NH3溶液。已 知NH3的Kb=1.8×10-5,下面哪种指示剂可以指示滴定终点( )。 各指示剂的变色范围pH为:甲基黄2.0–4.0,甲基红4.4-6.2,中性红 6.8-8.0,酚酞8.0-10.0.
A.甲基黄 B.甲基红 C.中性红 D.酚酞
2012年青岛科技大学620分析化学考研真题
2011年青岛科技大学620分析化学考研真题
2010年青岛科技大学620分析化学考研真题
青岛大学仪器分析考试重点讲解
H2C CH2
OH
CH3
H2C C
CH
H2C
CH2 CH2
m/z=86
C H2
H
H
H2C
O
H
CH3
CH
H2C
C
CH2
CH2 CH2
H3C
OH m/z=58
C CH2
CH2 CH
CH3
OH
C H2C CH2 H2C
H CHCH2 CH3 m/z=100
CH2
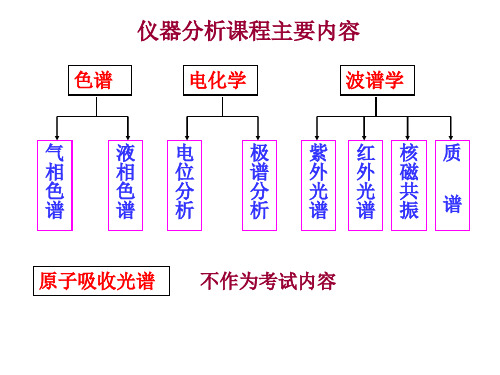
仪器分析课程主要内容
色谱
电化学
波谱学
气
液电
极 紫 红核质
相
相位
谱 外 外磁
色 谱
色分 谱析
分 析
光 谱
光 谱
共 振
谱
原子吸收光谱 不作为考试内容
试题类型与分值分布
一、选择题(30分,共15题) 色谱、电化学、四大波谱
二、填空题(30分,共10题) 电化学、四大波谱
三、计算题(20分,共3题)(公式、步骤、结果要清楚) 色谱、电化学
4. 化学位移:由于屏蔽作用所引起的共振时磁场强度的移动现象
称为化学位移。
H=3.2~4.0ppm O CH3
5. 各类有机化合物中基团的化学位移:H=2.2~3.2ppm N CH3
P370 表13-3。
H=1.8ppm
C C CH3 O
H=2.1ppm H=2~3ppm
C CH3 CH3
5. 干扰电流及其消除方法: 残余电流:切线作图法 迁移电流:加入支持电解质 极谱极大:加入表面活性剂 氧波:通入惰性气体 H2、N2 或CO2;Na2SO3 (碱性或中性溶 液 )、抗坏血酸 (弱酸性溶液)、Na2CO3或Fe粉 (强酸性溶液) 氢波:控制pH值在中性或碱性。
620分析化学(含仪器分析)

青岛大学2009年硕士研究生入学考试试题 科目代码:620 科目名称:分析化学(含仪器分析)(共5页) 请考生写明题号,将答案全部答在答题纸上,答在试卷上无效一、选择题( 共10题20分)1. 2 分某金属离子M与试剂R形成一有色络合物MR,若溶液中M的浓度为1.0×10-4 mol/L,用1cm比色皿于波长525nm处测得吸光度A为0.400, 此络合物在525nm 处的摩尔吸光系数为----------------------------------( )(A) 4.0×10-3(B) 4.0×103(C) 4.0×10-4(D) 4.0×1052. 2 分微溶化合物A2B3在溶液中的解离平衡是: A2B3==2A + 3B。
今已测得B的浓度为3.0×10-3mol/L,则该微溶化合物的溶度积K sp是------------( )(A) 1.1×10-13(B) 2.4×10-13(C) 1.0×10-14(C) 2.6×10-113. 2 分某溶液含Ca2+、Mg2+及少量Al3+、Fe3+,今加入三乙醇胺, 调至pH=10, 以铬黑T为指示剂, 用EDTA滴定, 此时测定的是----------------( )(A) Mg2+量(B) Ca2+量(C) Ca2+, Mg2+总量(D) Ca2+,Mg2+,Al3+,Fe3+总量4. 2 分考虑 -呋喃甲酸甲酯(糠醛甲酯)的核磁共振谱, 若仪器的分辨率足够, 下列预言中正确的是( )C3O(1) 4个单峰, 峰面积比是1:1:1:3(2) 4组峰, 其中一个是单峰, 另外3组峰均是二重峰(3) 4组峰, 其中一个是单峰, 另外3组峰均是四重峰, 多重峰的面积比是1:1:1:1(4) 4重峰, 同(3), 但多重峰面积比是1:3:3:15. 2 分AgNO3滴定NaCl时,若浓度均增加10倍,则突跃pAg增加--------( )(A)1个单位(B)2个单位(C)10个单位(D)不变化6. 2 分下列色散元件中, 色散均匀, 波长范围广且色散率大的是( )(1)滤光片(2)玻璃棱镜(3)光栅(4)石英棱镜7. 2 分电解分析的理论基础是()(1)电解方程式(2)法拉第电解定律(3)Fick扩散定律(4)(1)、(2)、(3)都是其基础8. 2 分以下产生误差的四种表述中,属于系统误差的是-----------()(1)指示剂变色点与化学计量点不一致(2)滴定管读数最后一位估计不准(3)称量过程中天平零点稍有变动(4)天平的砝码未经校准(A)1,2 (B) 3,4 (C) 2,3 (D) 1,49. 2 分在重量分析中对无定形沉淀洗涤时,洗涤液应选择-------------( )(A) 冷水(B) 热的电解质稀溶液(C) 沉淀剂稀溶液(D) 有机溶剂10. 2 分当质子共振所需的外磁场B0增加时, 值将( )(1) 增加(2) 减小(3) 不变(4) 先增加后减小二、填空题( 共10题20分)11. 2 分一符合比尔定律的有色溶液,当浓度为c时,透射比为T,若其它条件不变,浓度为c/3时,T为_________,浓度为2c时,T为_____________。
青岛科技大学-620分析化学考试大纲

620分析化学考试大纲青岛科技大学硕士研究生入学考试《分析化学》考试大纲(包括“化学分析”和“仪器分析”两部分)该考试大纲适用于青岛科技大学分析化学及其相关专业的硕士研究生入学考试。
“化学分析”部分分析化学可分为化学分析和仪器分析两部分,化学分析主要的内容为:数据处理与误差分析、四大滴定分析法、重量分析法。
要求考生牢固掌握其基本的原理和测定方法,建立起严格的“量”的概念。
能够运用化学平衡的理论和知识,处理和解决各种滴定分析法的基本问题,包括滴定曲线、滴定误差、滴定突跃和滴定终点的判断,掌握重量分析法分析化学中的数据处理与误差处理。
正确掌握有关的科学实验技能,具备必要的分析问题和解决问题的能力。
考试内容1、绪论:分析化学的任务和作用;分析方法的分类。
2、定量分析化学概论分析化学中的误差;有效数字及其运算规则;滴定分析概述。
3、酸碱平衡和酸碱滴定法分布分数δ的计算;质子条件式与pH计算最简式;酸碱缓冲溶液;酸碱指示剂;酸碱滴定基本原理;终点误差;酸碱滴定法的应用及相关计算。
4、络合滴定法分析化学中常用的络合物;络合物的平衡常数;副反应常数和条件稳定常数;金属指示剂;络合滴定法的基本原理;滴定误差及相关计算;络合滴定中酸度的控制;提高络合滴定选择性的途径;络合滴定方式及其应用。
5、氧化还原滴定法氧化还原平衡;氧化还原滴定原理;氧化还原滴定指示剂;氧化还原滴定法的应用及相关计算。
6、重量分析法和沉淀滴定法重量分析概述;沉淀的溶解度及其影响因素;沉淀的类型和沉淀的形成过程;影响沉淀纯度的主要影响因素;沉淀条件的选择;重量分析中的换算因素;沉淀滴定法。
7、分析化学中的数据处理标准偏差;随即误差的正态分布;少量数据的统计处理;回归分析;提高分析结果准确度的方法。
考试要求:1、绪论:了解分析化学的任务和作用,分析方法的分类。
2、定量分析化学概论了解误差的种类、来源及减小方法。
掌握准确度及精密度的基本概念、关系及各种误差及偏差的计算,掌握有效数字的概念,规则,修约及计算。
【青岛大学2012年考研专业课真题】分析化学2012

(B)1,2,4 (C)1,3,4
1-4. 以下离子交换树脂属阳离子交换树脂的是------------------( (B) RNH2CH3OH (D) R—N(CH3)3OH
1-5.下面有关随机误差的表述中正确的是----------------------------------(
)
1-6. 含有 0.1250 g I2 的 KI 溶液 25mL, 每次用 25mL CCl4 与之一起振荡。 设 I2 在 CCl4 和 KI 溶液之间的分配达到平衡后, 在水相中测得 0.0050 g I2,
3
Mr(MgSO4)=120.4,
Mr(H2O)=18.02,
Mr(Mg2P2O7)=222.6, Mr(BaSO4)=233.4]
(2) 反 Stokes 线的波长(nm)。
峰与 TMS 吸收峰相隔 240Hz。试计算这两种质子的化学位移值,若改 用 100MHz 仪器测试,这两个峰与 TMS 分别相隔多少? 四、问答题 ( 共 4 题,共 45 分 ) 4-1. (10 分) 应用库仑分析法进行定量分析的关键问题是什么? 4-2. (12 分) 化合物 C7H8O 1H-NMR 谱图如下: (1) 有三组峰 (2) a. =3.8, 单峰, 1 个质子 b. =4.6, 单峰, 2 个质子 c. =7.2 单峰 5 个质子 4-3. (13 分)下表表示离子交换法制备纯水的原理。试指出各种试验的 现象和结论。 原水 EBT 试验 (pH=10) AgNO3 试验 pH 试验 结论 (EBT 试验和 AgNO3 试验若呈阳性,以“+”表示,呈阴性以“”表示) 4-4 (10 分) 何谓梯度洗提?它与气相色谱中的程序升温有何异同之处? 原水通过阳 原水通过阴 原水依次通过阳、 阴离子交换树脂 离子交换树脂 离子交换树脂 请写出结构式, 并解释其理由.
《分析化学》试题及答案解析

一、选择题(20分。
1.用法扬司法测Cl 时,常加入糊精,其作用是--------------------------(B )A. 掩蔽干扰离子;B. 防止AgCl凝聚;C. 防止AgCl沉淀转化D. 防止AgCl感光2.间接碘量法中正确使用淀粉指示剂的做法是----------------------------(D )A. 滴定开始时加入指示剂;B. 为使指示剂变色灵敏,应适当加热;C. 指示剂须终点时加入;D. 指示剂必须在接近终点时加入。
3.螯合剂二乙三氨五乙酸(EDPA,用H5L表示)的五个p K a值分别为1.94,2.87,4.37,8.69和10.56,溶液中组分HL4-的浓度最大时,溶液的pH值为------(D )A. 1.94;B. 2.87;C. 5.00;D. 9.62。
4. K2Cr2O7法测定铁时,哪一项与加入H2SO4-H3PO4的作用无关----------(C )A.提供必要的酸度;B.掩蔽Fe3+;C.提高E(Fe3+/Fe2+);D.降低E(Fe3+/Fe2+)。
5.用BaSO4重量分析法测定Ba2+时,若溶液中还存在少量Ca2+、Na+、CO32-、Cl-、H+和OH-等离子,则沉淀BaSO4表面吸附杂质为------------------------------( A )A. SO42-和Ca2+;B. Ba2+和CO32-;C. CO32-和Ca2+;D. H+和OH-。
6.下列各条件中何者不是晶形沉淀所要求的沉淀条件---------------------(A )A.沉淀作用宜在较浓溶液中进行;B.应在不断的搅拌下加入沉淀剂;C.沉淀作用宜在热溶液中进行;D.应进行沉淀的陈化。
7.为了获得纯净而易过滤、洗涤的晶形沉淀,要求----------------------(A )A.沉淀时的聚集速度小而定向速度大;B.沉淀时的聚集速度大而定向速度小;C.溶液的过饱和程度要大;D.沉淀的溶解度要小。
精编版-2010年山东青岛大学分析化学(含仪器分析)考研真题
2010年山东青岛大学分析化学(含仪器分析)考研真题一、选择题 ( 共 10 题,每题各 2 分, 共 20 分) 1-1.当气相色谱中下列参数改变时,会引起分配系数改变的是----- ( )(1)柱长缩短(2)固定相改变(3)流动相流速增加(4)相比减少1-2.在恒电流库仑滴定中采用大于 45V 的高压直流电源是为了-- ( )(1) 克服过电位(2) 保证 100% 的电流效率(3) 保持电流恒定(4) 保持工作电极电位恒定1-3.下列关于提高分析结果准确度的表述中正确的是-------------------()(1) 选择灵敏度高的仪器分析方法(2) 增加平行测定次数减小随机误差(3) 称样量越大越好(4) 做对照试验消除系统误差(A) 1,2 (B) 1,3 (C) 2,3 (D) 2,41-4.用挥发法测定某试样的吸湿水时,结果偏高,可能是由于--------( )(A) 加热的温度过低(B) 加热时间不足(C) 试样加热后没有冷到室温就称量(D) 加热后的称量时间过长1-5.用 NH4Cl-NH3 沉淀 Fe3+,使它与 Cu2+分离,为分离完全,应使----( )(A) NH4Cl 浓度大一些,NH3 浓度小一些(B) NH4Cl 浓度小一些,NH3 浓度大一些(C) NH4Cl、NH3 浓度均大一些(D) NH4Cl、NH3 浓度均小一些1-6.下列表述中错误的是-----------------------------( )(A) 由于无定形沉淀颗粒小,为防止沉淀穿滤,应选用致密滤纸(慢速)(B) 微溶化合物的临界值(Q/S)愈大,则愈不容易均相成核(C) 相对过饱和度愈大,分散度愈高(D) 均相成核作用是指构晶离子自发形成晶核1-7.用 RCOOH 型离子交换树脂交换 Na+,对溶液酸度要求是 --- --( )(A)碱性(B)中性 (C)中性或碱性(D)强酸性用沉淀滴定法测定银,下列方式中适宜的是---------------------( )(A) 莫尔法直接滴定 (B) 莫尔法间接滴定(C) 佛尔哈德法直接滴定 (D) 佛尔哈德法间接滴定1-9.移取饱和 Ca(OH)2 溶液 50.00mL,用 0.05000mol/L HCl 标准溶液滴定,终点时耗去 20.00 mL,由此得 Ca(OH)2 沉淀的K sp为------------( )(A) 1.6×10-5 (B) 8.0×10-6(C) 2.0×10-6 (D) 4.0×10-61-10.在含有 Fe3+和 Fe2+的溶液中,加入下述何种溶液,Fe3+/Fe2+电对的电位将升高(不考虑离子强度的影响)------------ -------------------------( ) (A) 稀 H2SO4 (B) HCl(C) NH4F (D) 邻二氮菲二、填空题 ( 13 题, 每题各 2 分, 共 26 分 )2-1.吸光光度法中,实际测定时,只有使吸光度 A 在________范围之间,才能保证测量的相对误差较小,当吸光度 A=____时测量的相对误差最小。
青岛科技大学考研历年真题之考研历年真题之分析化学2005--2007,2009--2012年考研真题
青岛科技大学2005年研究生入学考试(B)试卷考试科目:分析化学(答案全部写在答题纸上)一、填空题(共38分,每空1分)1.在分析化学中,有时用和表示不同情况下分析结果的精密度,精密度高准确度高。
2.已知NH4+是NH3的共轭酸,K bNH3 =1.80⨯10-5, 则反应NH4+ + OH-= NH3 + H2O 的平衡常数为。
3.酸碱指示剂的实际变色范围一般与理论变色范围不一致,其原因是1),2) 。
4.在配合滴定中,越低,滴定曲线的起点,滴定突跃就,而配合物的越大,滴定突跃就。
5.用0.200 mol/L 的氢氧化钡溶液滴定0.100 mol/L 的醋酸溶液至化学计量点时,溶液的pH值为。
(已知醋酸的pka = 4.74)6.莫尔法测定氯离子时,以为滴定剂,以为指示剂,控制指示剂的浓度为。
7.氧化还原滴定突跃大小,与其它滴定法不同,它只是与,有关,而与无关。
8.单色酸碱指示剂,当指示剂用量增加时,在较高的下变色,而增加离子强度时,指示剂的变小。
9. 毛细管色谱柱由于高,因此k很小,一般需采用进样法,这对痕量分析来说极为不利。
10. 在气相色谱法中,选哪种检测器最适宜?(1)农作物中含氯农药残留;(2)酒中水含量;(3)啤酒中微量硫化物;(4)分离苯和甲苯异构体。
11. 用氟离子选择性电极测定水样中F-时,加入“总离子强度调节缓冲溶液”,其中NaCl 和HAc-NaAc的作用分别是和。
12. 在加入支持电解质、极大抑制剂和除氧剂后,极谱分析中的极限电流是指。
13. 极谱定量分析的基础是,定量的方法主要有和。
对于不可逆过程,由于的影响,氧化波的半波电位比还原波的半波电位。
14. 气体库仑计阳极反应为,阴极反应为,生成气体总体积16800 mL,则通过的总电量为库仑。
15. 极谱分析中,还原波方程式是,氧化波方程式是。
16. 原子发射线的自吸现象是由于。
二、选择题(共36分,每题1.5分)1.下列有关准确度、精确度、系统误差、偶然误差之间关系的说法中不正确的是()。
2017年青岛科技大学硕士研究生入学考研真题分析化学
11.某碱样为NaOH和Na2CO3的混合液,用HCl标准溶液滴定。先以酚酞为指示剂,耗去HCl溶液体积为V1;继以甲基橙为指示剂,又耗去HCl溶液体积为V2。V1与V2的关系是-------()。
A、V1=V2;B、V1=2V2;C、2V1=V2;D、V1V2
16.在法扬斯法测Cl,常加入糊精,其作用是------------------------()。
A、掩蔽干扰离子;B、防止AgCl凝聚;
C、防止AgCl沉淀转化;D、防止AgCl感光
17.在1molL1HCl溶液中,已知 =1.28V,当0.1000molL1Ce4有99.9%被还原成Ce3时,该电对的电极电位为-------------Байду номын сангаас-----------------------------------()。
34.25C时将pH=1.00和pH=3.00溶液等体积混合,该强电解质溶液的pH=____________。
35.用0.1molL1NaOH标准溶液滴定0.1molL1邻苯二甲酸(Ka1=6.1105,Ka2=2.3106),应有_______个pH突跃,宜选用______________作指示剂。
A、分子的振动跃迁;B、分子的转动跃迁;
C、原子核内层电子的跃迁;D、原子核外层电子的跃迁
23.在分光光度法中,为了把吸光度读数控制在适当范围,下列方法中不可取的是----------()。
A、控制试样的称取量;B、改变比色皿的厚度;
C、改变入射光的波长;D、选择适当的参比溶液
24.某化合物,其红外光谱在3000~2800cm1,1460cm1,1375cm1,和725cm1等处有主要吸收带,该化合物可能是------------------------()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2015年青岛大学620分析化学(含仪器分析)考研真题(部分) 2012年青岛大学620分析化学(含仪器分析)考研真题 2011年青岛大学620分析化学(含仪器分析)考研真题 2010年青岛大学620分析化学(含仪器分析)考研真题 2009年青岛大学620分析化学(含仪器分析)考研真题
2015年青岛大学620分析化学(含仪器分 析)考研真题(部分)
2012年青岛大学620分析化学(含仪器分 析)考研真题
2011年青岛大学620分析化学(含仪器分 析)考研真题
2010年青岛大学620分析化学(含仪器分 析)考研真题
2009年青岛大学620分析化学(含仪器分 析)考研真题
