2019年新版人教版高中化学必修一:第一章 第一节 第一课时 物质的分类 胶体 讲义
物质的分类课件-高一化学人教版(2019)必修第一册

盐+水 盐+水
CaO、Na2O
酸性氧化物: 能跟碱起反应生成一种相应价态的盐和水
碱性氧化物: 能跟酸起反应生成一种相应价态的盐和水
氧化物的分类
从组成 元素分
金属氧化物
(如:Na2O、CaO、MgO、ZnO、 MnO2、CuO、Fe2O3、Al2O3)
非金属氧化物 (如:CO2、SO2、CO、SO3、P2O5)
CO2+2NaOH=Na2CO3+H2O SiO2+2NaOH=Na2SiO3+H2O
学 习 评 价 1 概念辨析-判断对错
× 1. 所有的酸性氧化物都是非金属氧化物
Mn2O7
× 2. 所有的非金属氧化物都是酸性氧化物
NO、CO
3. 所有的碱性氧化物都是金属氧化物
× 4. 所有的金属氧化物都是碱性氧化物
2、交叉分类法 同一种事物可以按不同标准(角度)进行分类。标准不同进行分 类产生的分类结果就不同。
特点: 物质类别间有交叉的部分
知识精讲 3、具体分类
(1)单质
想一想:碳元素是不是只能形成一种单质?
结构不同,物质不同
金刚石、石墨、C60是什么关系?
同素异形体:由同一种元素形成的几种性质 不同的单质叫做这种元素的同素异形体
②⑧ ①④ ⑥ ⑤ ⑦⑩
学习总结 物质的分类
1. 分类是一种科学的学习方法,科学分类的前提是有准确的分类标准 2. 用树状分类法,按物质组成、物质性质对氧化物进行分类 3. 酸性氧化物、碱性氧化物的概念区分
纯净物: 纯净物是由一种成分(分子)组成的物质,有单个化学式,有固定熔、沸点
混合物: 混合物是由多种成分(分子)组成的物质,无单个化学式,无固定熔、沸点 单质: 由同一种元素组成的纯净物 化合物: 由两种或两种以上元素组成的纯净物 氧化物: 两种元素组成,其中一种为氧元素的化合物 酸: 电离出的阳离子只有氢离子的化合物 碱: 电离出的阴离子只有氢氧根离子的化合物 盐:电离时生成的阳离子是金属离子或(NH4+),阴离子是酸根离子的化合物
人教版2019新教材高中化学必修一第一章第一节物质的分类及转化知识点梳理
第一章物质及其变化一、物质的分类及转化1.同素异形体:由同一种元素形成的几种性质不同(物理性质不同,化学性质相似)的单质。
常见的实例:金刚石、石墨和C60;氧气和臭氧;红磷和白磷。
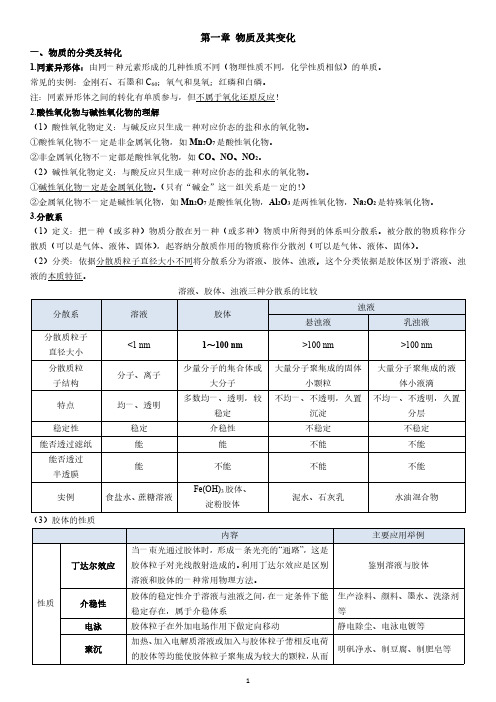
注:同素异形体之间的转化有单质参与,但不属于氧化还原反应!2.酸性氧化物与碱性氧化物的理解(1)酸性氧化物定义:与碱反应只生成一种对应价态的盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。
②非金属氧化物不一定都是酸性氧化物,如CO、NO、NO2。
(2)碱性氧化物定义:与酸反应只生成一种对应价态的盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
(只有“碱金”这一组关系是一定的!)②金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,Na2O2是特殊氧化物。
3.分散系(1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
(2)分类:依据分散质粒子直径大小不同将分散系分为溶液、胶体、浊液,这个分类依据是胶体区别于溶液、浊液的本质特征。
溶液、胶体、浊液三种分散系的比较(3)胶体的性质形成沉淀从分散剂中析出提纯渗析由于胶体粒子较大不能通过半透膜,而离子、小分子较小可通过半透膜,用此法将胶体提纯用于分离溶液和胶体(4)胶体部分易错归纳①胶体的本质是胶体粒子的直径介于1~100nm之间,而不是丁达尔效应。
②胶体本身并不带电,而是由于胶体粒子吸附溶液中的离子而带电。
④电泳现象是由于胶体粒子吸附溶液中的离子而带电,通电后胶体粒子定向移动,所以并非所有胶体都有电泳现象(如淀粉胶体)。
(5)Fe(OH)3胶体的制备在小烧杯中,加入40mL蒸馏水,加热至沸腾,向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,立即停止加热,即可得到Fe(OH)3胶体,整个过程不能搅拌。
人教版(2019)高一化学必修第一册第一章 第一节 第二课时:物质的分类及转化(33张PPT)

2021/1/11
1.【提示】 分散系的树状分类图 分散系
溶液
胶体
浊液
2021/1/11
悬浊液
乳浊液
2.【提示】泥浆水和Ca(OH)2悬浊液属于浊液。 澄清石灰水和海水属于溶液,牛奶和豆浆属于胶体。
【想一想】
三种分散系的分散质粒子大小不相同,物理性质上 有哪些不同?
2021/1/11
分散系
溶液
胶体
浊液
外观
均一、稳 均一、稳定、 不均一、不稳
定、透明 透明
定、不透明
分散质微粒组 成
分子、离子
大分子、离 子的集合体
固体颗粒、 液体小液滴
微粒直径
<1nm
1~100nm
>100nm
能否透过滤纸
能
能
不能
能否透过半透
反应类型
与金属反应
Fe +CuSO4 =Cu+FeSO4
与酸反应 CaCO3+2HCl=CaCl2+H2O+CO2↑ 与碱反应 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 与盐反应 NaCl+AgNO3=AgCl↓+NaNO3
小结: 酸、碱、盐相互反应
复分解反应
为什么不同的酸 (或碱 )具有相似的化学性质?
溶液 >1nm
能 无 食盐水
胶体
浊液
1nm~100nm <100nm
能
不能
有 Fe(OH)3胶体
无 泥水
【学习任务】酸、碱、盐的化学性质
链接初中:同类物质往往具有相似的性质,请同学们完成P10思考与讨论。
1.1.1物质的分类 课件-高一上学期化学人教版(2019)必修第一册

课堂总结
1、分类是一种科学的学习方法 2、用交叉分类法、树状分类法,按物质组成对物质进行分类。
3、分散系的概念与分类
跟踪训练
1、某气体经过检验只含有一种元素,则该气体( D )
A.是一种单质 B.是一种化合物 C.是单质与化合物的混合物 D.可能是一种单质,也可能是几种单质的混合物
2、根据某种共性,可将CO2、SO2归为一类氧化物,下列物
质中与它们属于同一类的是( B )
A.CaCO3 C.CuO
B.P2O5 D.KMnO4
3.用特殊方法把固体物质加工到纳米级(1nm—100nm)的超细粉 末粒子,然后制得纳米材料。下列分散质粒子直径具有与此相同
氧化 物 酸
碱
A H2O H2CO3 Mg(OH)Cl
B H2O2 CH3COOH Na2CO3
C CuO NaHCO3 Fe(OH)3
盐
BaSO4 CuSO4·5H2O NaH2PO4
D K2O HCl NaOH Na2S
2.下列物质的分类正确的是( D )
选项 A B C D
碱 NaOH 纯碱 NaOH KOH
解析 碘酸钾属于钾盐,能溶于水,根据“加碘盐”的食用方法“待食品 熟后加入碘盐”可知碘酸钾受热易分解。
感谢您的聆听
B.可能有多种分类标准 C.能用交叉分类法进行分类的物质就不能用树状 分类法进行分类 D.能用交叉分类法进行分类的物质也可以用树状 分类法进行分类
02
分散系及其分类
思考:初中所学混合物中“溶液”的概念?还有哪些属 于混合物?
2019-2020学年新教材人教版化学必修1第1章第1节第1课时 物质的分类 课件

课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
变式训练2关于胶体和溶液的区别,下列叙述正确的是( ) A.溶液呈电中性,胶体带有电荷 B.溶液中溶质不能通过半透膜,胶体中分散质能通过半透膜 C.溶液中通过一束光线没有特殊现象,胶体中通过一束光线会出 现光亮的“通路” D.溶液稳定,放置后不会生成沉淀,胶体不稳定,放置后会生成沉 淀 答案C 解析溶液和胶体都呈电中性,胶体中胶体粒子可能带有电荷;溶 液中溶质能通过半透膜,胶体中分散质不能通过半透膜;胶体有介 稳性,一定时间内放置不产生沉淀。
课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
常见分散系的比较
问题探究 1.试分别比较溶液、胶体、悬浊液三种分散系中的分散质粒子 能否透过滤纸和半透膜。 提示溶液中分散质粒子可以透过滤纸和半透膜;胶体中分散质粒 子可以透过滤纸但不能透过半透膜;浊液中分散质粒子既不能透过 滤纸,也不能透过半透膜。 2.清晨去公园或树林锻炼身体,可以看到有一束束光柱透过树叶 的缝隙射入林间,在电影院也可以看到放映室射到银幕上的光柱, 试解释产生此现象的原因。 提示这是因为空气中的悬浮颗粒扩散到空气中形成了气溶胶,当 有光线通过时,就会产生丁达尔效应。
探究二
素养脉络
随堂检测
课堂篇探究学习
3.已知下列物质:铁、烧碱、铜、乙醇、碳酸钠、硫酸、甲烷。 请用两种树状分类法将它们进行分类。
提示(1)
探究一
(2)
ቤተ መጻሕፍቲ ባይዱ
探究二
素养脉络
随堂检测
课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
深化拓展 1.根据物质的组成和性质对物质进行分类
课堂篇探究学习
1.1 物质的分类及转化 讲义【新教材】人教版(2019)高中化学必修一

第一章物质及其变化第一节物质的分类及转化一、物质分类1、根据物质的组成和性质分类任何物质都是有元素组成的,根据元素组成对物质进行分类是常用的方法。
(1)同素异形体:由一种元素形成的几种性质不同的单质。
如:金刚石和石墨、白磷(P4)和红磷、氧气和臭氧【注】①同素异形体之间的转换是化学变化。
②同素异形体之间由于结构不同,物理性质有差异,但由于同种元素组成,化学性质相似或略有差异。
③由一种元素组成的物质不一定是纯净物。
如氧气和臭氧。
2、分类方法(1)树状分类:对同类事物进行再分类的方法。
单质:O2、Fe、He等纯净物有机化合物:CH4、葡萄糖、酒精(乙醇)等酸:电离出的阳离子全部是氢离子化合物碱:电离出的阴离子全部是氢氧根无机化合物物质盐:由金属阳离子或NH4+与酸根离子结合氧化物:只含两种元素,其中一种是氧元素溶液:NaCl溶液、稀硫酸等混合物胶体:Fe(OH)3胶体、淀粉胶体等浊液:泥水【注】冰水混合物、胆矾、明矾、水银等并非混合物,均为纯净物。
①酸的分类:酸可依据电离出氢离子的个数,将酸分为一元酸、二元酸、多元酸。
也可按照酸分子中是否含氧元素,将酸分为含氧酸和无氧酸。
一元酸:HCl、HNO3、CH3COOH等含氧酸:HNO3、、H2SO4等酸二元酸:H2CO3、H2SO4等酸多元酸:H3PO4无氧酸:HCl、H2S等②碱的分类:可依据电离出OH-的个数,将酸分为一元碱、二元碱、多元碱。
也可按照溶解性,将碱分为可溶性碱、难溶性碱。
一元碱:NaOH、NH3·H2O 可溶性碱:NaOH、Ba(OH)2等碱二元碱:Mg(OH)2、Cu(OH)2 碱多元碱:Fe(OH)3、Al(OH)3 难溶性碱:Mg(OH)2、Cu(OH)2 等③盐的分类正盐:既不能电离出H+,也不能电离出OH-的盐,如Na2CO3、CuSO4盐酸式盐:酸根能电离出H+的盐,如NaHCO3、NaHSO4碱式盐:能电离出OH-的盐,如Cu2(OH)2CO3④氧化物的分类:依据氧化物的性质,可将氧化物分为酸性氧化物、碱性氧化物、两性氧化物及不成盐氧化物。
人教版化学必修第一册第一章第一节第一课时物质的分类(共40张PPT)

人教版(2019)化学必修第一册第一 章第一 节第一 课时物 质的分 类(共40 张PPT)
物质类别
— — — CH4 氢__化__物__
— — C60 — _单__质__
CO2 H2CO3 Na2CO3 NaHCO3
CO —
—
—
—
—
—
—
—
—
—
—
_氧__化__物_ _酸___ _碳__酸__盐__ _碳__酸__盐__
人教版(2019)化学必修第一册第一 章第一 节第一 课时物 质的分 类(共40 张PPT)
人教版(2019)化学必修第一册第一 章第一 节第一 课时物 质的分 类(共40 张PPT)
归纳总结
(1)分类是根据研究对象的共同点和差异点,将它们区分为不同种类和层次的 科学方法。 (2)物质的分类标准不同,其分类方式不同。对物质及其变化既可以从物质的 组成和性质等宏观的角度进行分类,也可从物质的构成和参加化学反应的粒 子等微观的角度分类。
梳理基础 突破重点
SHU LI JI CHU TU PO ZHONG DIAN
01Leabharlann 一、根据物质的组成和性质分类
1.物质的元素组成 (1)物质都是由_元__素__组成,单质都是由同一__种_____元素组成,化合物是由_不__同__种__ 元素组成。 (2)金刚石、石墨和C60都是由碳____元素组成的单质,它们的性不质同______。 (3)同素异形体是由_同__一__种___元素形成的几性种质_____不同的单质。 (4)CO和CO2是由_碳___元素和氧____元素以不同的方式组成的化合物,它们都属
4.氧化物的分类 (1)氧化物的分类方法
人教版(2019)化学必修第一册第一 章第一 节第一 课时物 质的分 类(共40 张PPT)
1.1.1物质的分类(教案)-高中化学人教版(2019)必修第一册

课时1 物质的分类课标解读内容要求学业要求1.认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类。
2.同类物质具有相似的性质。
3.认识胶体是一种常见的分散系。
1.能依据物质类别列举某种元素的典型代表物。
2.能从物质的类别预测物质的性质和变化。
3.能举例说明胶体的重要特征。
学习任务一根据物质的组成和性质分类1.在初中我们就接触过金刚石、石墨和C60,它们都是由碳元素组成的。
它们是同种物质吗?它们属于单质还是化合物?答案不是同一种物质,它们属于单质。
2.在日常生活和学习实践中,我们已接触过许多物质,如:①空气、②二氧化碳、③铁、④食盐水、⑤臭氧(O3)、⑥石灰水、⑦纯碱、⑧硫酸、⑨氧化铁、⑩苛性钠等。
按照这些物质的类别用序号填表:混合物单质氧化物酸碱盐①④⑥③⑤②⑨⑧⑩⑦1.根据物质的组成分类(1)根据元素组成对物质进行分类——单质与化合物单质化合物含义由同种元素组成的纯净物由两种或两种以上元素组成的纯净物形成方式由①同一种元素形成的几种性质不同的②单质,叫做这种元素的同素异形体不同的元素可以按照一定的规律,以不同的方式进行组合,形成化合物实例金刚石、③石墨和④C60;O2和⑤O3等H2O、HCl、NaCl、CaCl2等(2)根据物质的组成对物质进行分类——树状分类法(3)从不同的角度对物质进行分类——交叉分类法Ⅰ.碳酸钠的交叉分类分类标准所属类别组成的阳离子⑥钠盐组成的阴离子⑦碳酸盐溶解性⑧可溶性盐Ⅱ.在不同的物质和其所属的类别之间进行连线。
2.根据物质的性质对物质进行分类酸性氧化物碱性氧化物定义能与碱反应生成盐和水的氧化物能与酸反应生成盐和水的氧化物实例CO2、SO3等CaO、Fe2O3等大多数非金属氧化物(某些金属氧化物,属类大多数金属氧化物(Al2O3、Na2O2例外) 如Mn2O7)判断下列说法的正误(正确的画“√”,错误的画“✕”)。
1.氧气和臭氧的混合气体属于纯净物( ✕)2.Ca(OH)2既属于碱又属于化合物、纯净物( √)3.胆矾(CuSO4·5H2O)是混合物( ✕)4.硝酸钾既属于钾盐,又属于硝酸盐( √)5.所有非金属氧化物都是酸性氧化物( ✕)在某食品的包装盒内,小高同学发现有一个装有白色颗粒状固体A的小包装袋,上面写着“石灰干燥剂”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的分类胶体
[明确学习目标] 1.学会物质分类方法,会从不同角度对物质进行分类。
2.了解同素异形体。
3.能够根据分散质粒子的大小对分散系分类。
4.会制备Fe(OH)3胶体,会鉴别胶体与溶液。
学生自主学习
根据物质的组成和性质分类
1.同素异形体
(1)由□01同一种元素形成的几种性质不同的单质叫做该元素的同素异形体。
(2)同素异形体的物理性质不同,化学性质不同。
(3)举例:O2与□02O3;红磷与白磷;金刚石、□03石墨与C60互为同素异形体。
2.根据物质的组成分类
(1)交叉分类法
①含义:根据不同的分类标准,对同一事物进行多种分类的一种分类方法。
②举例:
Ⅱ.某些盐的交叉分类
(2)树状分类法
①含义:对同类事物按照某些属性进行再分类的分类法。
②举例:
3.根据物质的性质分类
(1)根据物质的性质对物质进行分类是化学上常用的分类方法。
(2)举例:根据性质对氧化物进行分类
分散系及其分类
1.分散系
(1)概念:□01把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
(2)组成
(3)分类
①分散质和分散剂各有固、液、气三种状态,以其状态为分类标准共分为□049种分散系。
②分散系按照分散质粒子直径大小分类
2.胶体的制备和特征
(1)Fe(OH)3胶体的制备
制备原理:FeCl 3+3H 2O=====△
Fe(OH)3(胶体)+3HCl
具体操作:往烧杯中注入40 mL 蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴□08FeCl 3饱和溶液,继续煮沸至溶液呈□09红褐色,停止加热。
(2)胶体的特性——丁达尔效应
当平行光束通过胶体时,可以看到□10一条光亮的“通路”,这是由于胶体粒子对光线□11散射形成的,叫做丁达尔效应,可用来区分胶体和□
12溶液。
1.在科学研究中分类法的意义何在?
提示:运用分类法对物质进行科学的分类,然后分门别类地研究它们的组成、结构、性质和用途,就能够发现物质及其变化的规律,把握物质的本质属性和内在联系。
2.金属氧化物一定是碱性氧化物吗?酸性氧化物一定是非金属氧化物吗?
提示:不一定,Mn2O7是金属氧化物,但属于酸性氧化物。
3.悬浊液中的微粒直径均大于10-7 m吗?
提示:否,悬浊液中含水分子,其直径小于10-9 m。
4.向FeCl3溶液中滴加NaOH溶液得到Fe(OH)3胶体吗?
提示:否,得到Fe(OH)3悬浊液。
课堂互动探究
知识点一正确理解同素异形体这一概念
同素异形体是指由同种元素组成的性质不同的单质,不是化合物,同素异形体间在一定条件下可以相互转化,同素异形体与某一物质发生化合反应时可得同一化合物。
1某气体经过检验只含有一种元素,则该气体是()
A.一种单质
B.一种化合物
C.单质与化合物的混合物
D.可能是一种单质,也可能是几种单质的混合物
[批注点拨]
[答案] D
[练1](双选)下列叙述中正确的是()
A.由碳元素单质组成的物质一定是纯净物
B.金刚石和石墨具有相同的化学组成
C.石墨转化为金刚石不属于化学变化
D.C60是一种碳的单质
答案BD
解析由碳元素组成的单质有石墨、金刚石和C60等,若将它们混合在一起,则该物质只含碳元素,但属于混合物。
石墨和金刚石是不同的单质,所以石墨转
化为金刚石是化学变化。
[练2]下列说法中正确的是()
A.金刚石、石墨和C60性质不同的根本原因是所含碳原子的数目不同
B.金刚石、石墨和C60在氧气中完全燃烧都生成二氧化碳
C.C60和P4互为同素异形体
D.H2O和H2O2互为同素异形体
答案 B
解析金刚石、石墨和C60性质不同的根本原因是碳原子的连接方式不同,A 错误;金刚石、石墨和C60互为同素异形体,所以在氧气中完全燃烧都生成二氧化碳,B正确;C60和P4不是由同种元素组成的,不是同素异形体,C错误;H2O 和H2O2不是单质,不是同素异形体,D错误。
知识点二单质、化合物、混合物、纯净物、酸性氧化物、
碱性氧化物等概念及概念间的关系
1.基本概念
(1)单质:由同一种元素组成的纯净物。
(2)化合物:由不同种元素组成的纯净物。
几种元素组成化合物时,有的只能组成一种化合物,有的可以组成不同的化合物。
(3)纯净物:只由一种成分组成的物质。
有化学式,有固定熔、沸点。
(4)混合物:由多种成分组成的物质。
无化学式,无固定熔、沸点。
2.概念间的关系——“并列”与“包含”
(1)并列关系:纯净物与混合物,单质与化合物,酸与碱、盐。
(2)包含关系:纯净物包含化合物和单质,化合物包含氧化物和酸、碱、盐。
3.酸性氧化物和碱性氧化物的概念和理解
(1)酸性氧化物是与碱反应生成盐和水的氧化物,如CO2。
①酸性氧化物不一定是非金属氧化物,如Mn2O7。
②非金属氧化物不一定都是酸性氧化物,如CO、NO。
(2)碱性氧化物是与酸反应生成盐和水的氧化物,如Na2O。
①碱性氧化物一定是金属氧化物。
②金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物。
2下列关于氧化物的叙述正确的是()
A.酸性氧化物均可以和碱发生反应
B.酸性氧化物在常温下均为气态
C.金属氧化物都是碱性氧化物。
