实验室药品的取用和溶液的配制
药品取用规则

药品取用规则1 取用药品的规则三不:1.不能用手接触药品。
2.不要把鼻孔凑到容器口去闻气体气味(原因:可能有毒、有腐蚀性;正确操作为:把集气瓶放在鼻孔下方约20cm处,用手轻轻在集气瓶口扇动,使少量气体飘入鼻孔闻气体气味)。
3.不能品尝药品的味道二量:1.有说明的按照规定用量。
2.无说明的取最少用量(固体:只需盖满试管底部;液体:1~2mL)。
2 取用药品的方法取用粉末状固体药品横:先倾斜试管;送:再将盛药品的药匙(或纸槽)送入试管底部;竖:然后使试管直立起来,让药品全部落到底部。
取用块状固体药品横:先将容器横放,用镊子将块状固体放在容器口;竖:再把容器慢慢竖起来;滑:使块状固体缓缓地滑向容器底部,以免打破容器。
取用液体药品用少量时用胶头滴管;用量较多时用倾倒法。
倾倒法:塞倒放→标签向手心→互倾斜→口对口→缓慢倒→刮一下。
3 取用药品的仪器托盘天平:取用一定质量的固体药品。
量筒:取用一定体积的液体药品。
胶头滴管:取用少量液体药品。
药匙或纸槽:取用粉末状药品。
镊子:取用块状固体药品。
物质加热规则1 酒精灯的使用酒精灯是广泛应用的加热器具,加热温度为500℃左右。
注意事项:1.使用前先要检查灯芯棉线的长度,若长度不够,应当更换;要检查灯芯顶端是否已经烧焦或变黑,应适当剪去烧焦部分,还要用镊子调整灯芯的高度;要检查酒精的量是否合适,不能少于酒精灯容积的1/4,也不能超过2/3(因为超过2/3时,容易因酒精蒸发而在灯颈处起火;少于1/4时,因酒精少,既容易烧焦灯芯,又容易在灯内形成酒精与空气的易爆炸混合物)。
2.点燃时要用火柴,绝对不能以燃着的酒精灯去点燃另一只酒精灯,否则会因酒精外溢而引起失火。
3.绝对禁止向燃着的酒精灯内添加酒精。
4.实验结束熄灭酒精灯时,应用灯帽盖灭,不可用嘴吹,以免引起灯内酒精燃烧。
5.如果碰倒燃着的酒精灯,洒出的酒精在桌上燃烧起来,应立即用湿抹布扑盖。
2 给试管里的物质加热1.加热试管时应用试管夹或将其固定在铁架台上。
化验室试剂的配制

试剂的配制方法:TN :过硫酸钾氧化紫外分光光度法1、碱性过硫酸钾溶液:称取 4g 过硫酸钾(K2S2O8)(经过提纯的),1.5g 氢氧化钠(NaOH),溶于无氨水中,稀释至100mL。
溶液存放在聚乙烯瓶中,一般用四、五天。
3、过硫酸钾提纯:在 1 升广口瓶中加入约800mL 水, 50 摄氏度水浴锅加热,然后逐渐加入过硫酸钾,直至不能溶解为止,然后把完全溶解的饱和溶液放在室温中自然冷却,再放进四度冰箱重结晶,同时冰一瓶去离子水,重结晶一夜后,倒掉上清液然后用冰冻好的去离子水清洗几遍,洗净后倒掉上清液,倒入烧杯中,然后放入50 摄氏度烘箱烘干即可。
2、(1+9)盐酸: 10mL 盐酸加到 90mL 的水中。
TP:钼锑抗分光光度法1、5%过硫酸钾溶液:称取5g 过硫酸钾(上海国药的)溶于水中,稀释至100mL。
保质期为一个星期。
2、10%抗坏血酸溶液:溶解10g 抗坏血酸于水中,稀释至100mL。
3、钼酸盐溶液:溶解 13g 钼酸铵于 100mL 水中;溶解 0.35g 酒石酸锑钾于 100mL 水中,并在不断搅拌下,将钼酸盐溶液徐徐加到300mL(1+1)硫酸中,加酒石酸锑钾溶液并混合均匀。
此溶液贮存于棕色瓶中,在冷处可保存两个月。
NH 3-N:纳氏试剂光度法1、10%硫酸锌溶液:取10g 硫酸锌溶于水中,稀释至100mL。
2、25%NaOH 溶液:称取 25g 氢氧化钠(片状)溶于水中,稀释至100mL。
3、纳氏试剂:①称取10g 碘化钾溶于约50mL 水中,边搅拌边分少量加入二氯化汞(Hgcl2)结晶粉末( 4.5g),至出现朱红色沉淀不易溶解时,改为滴加饱和二氯化汞溶液,并充分搅拌,当出现微量朱红色沉淀不易溶解时,停止滴加氯化汞溶液。
另称取 60g 氢氧化钾溶于水,并稀释至 125mL,充分冷却至室温后,将上述溶液在搅拌下,徐徐注入氢氧化钾溶液中,用水稀释至 200mL,混匀。
静置过夜,装到聚乙烯瓶中,密塞保存。
溶液的配制一、实验目的1、练习固体、液体试剂的取用;2、掌握几种...

溶液的配制一、实验目的1、练习固体、液体试剂的取用;2、掌握几种常用浓度溶液的配制的方法;3、熟悉有关浓度的计算;4、练习量筒、移液管、容量瓶及比重计的正确使用。
二、实验提要1、仪器的使用度量仪器的分类:量入仪器:容量瓶。
量出仪器:移液管、量筒。
⑴、容量瓶的使用,见课本P55-56;容量瓶的使用方法:先检查,其次洗涤(洗涤剂、自来水、蒸量水),溶液转移方法,定容。
提问:①蒸馏水洗完后是否还需要用溶液润洗2—3遍?② 转移溶液时直接靠着倾到,还是用玻棒引流?为什么定容前不能盖好塞上下摇荡?⑵、吸管和移液管的使用,见课本P56;先检查尖嘴是否损坏,其次洗涤(洗涤剂、自来水、蒸馏水、待移液)。
移取时“一靠二直再三靠”。
⑶、相对密度计(比重计)的使用;2、化学试剂的取用⑴、固体试剂的取用(纸槽、药匙)⑵、液体试剂的取用①、倾注法;②、滴瓶盛取;③、估计取用;④、定量取用。
3、溶液的配制 计算→选择称量工具→称量→溶解→转移→贴标签称量工具 溶解 分析天平(固体) 准确浓度移液管(溶液) 烧杯(洗瓶、玻璃棒)容量瓶 台秤(固体) 量筒(溶液)一般浓度 烧杯(刻度) 烧杯(洗瓶、玻璃棒)烧杯 试剂瓶陇南师专生化系·无机化学实验⑴、一般溶液的配制配制一般溶液常用以下三种方法:①直接水溶法对易溶于水而不发生水解的固体试剂,如NaOH、H2C2 O4、KNO3、NaCl等,配制其溶液时可用托盘天平直接称取一定量的固体于烧杯中,加入少量蒸馏水,搅拌溶解后稀释至所需体积,再转入试剂瓶中。
②介质水溶法对易水解的固体如FeCl3,AlCl3,BiCl3等,配制其溶液时,称取一定量的固体,加入适量一定浓度的酸或碱使之溶解,再以蒸馏水稀释,摇匀后转入试剂瓶。
在水中溶解度较小的固体试剂,在选用合适的溶剂溶解后,稀释,摇匀转入试剂瓶。
例如固体I2,可先用KI水溶液溶解。
③稀释法对于液态试剂,如盐酸、H2SO4、HNO3、HAc等,配制其稀溶液时,先用量筒量取所需量的浓溶液,然后用适量蒸馏水稀释。
试剂的配制和取用
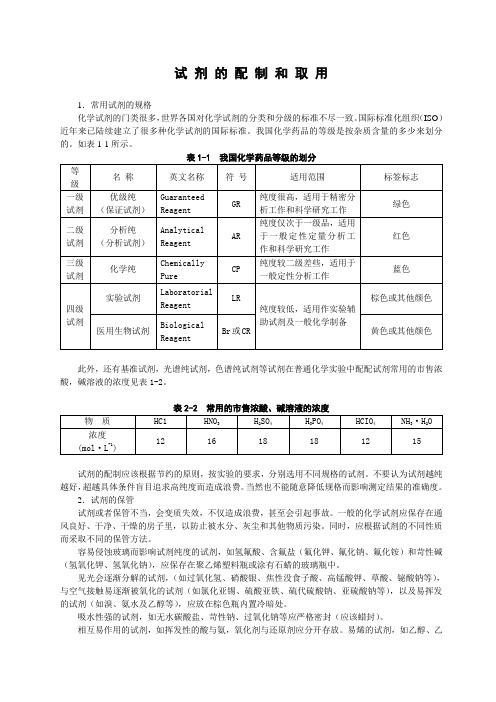
试剂的配制和取用1.常用试剂的规格化学试剂的门类很多,世界各国对化学试剂的分类和分级的标准不尽一致。
国际标准化组织(ISO)近年来已陆续建立了很多种化学试剂的国际标准。
我国化学药品的等级是按杂质含量的多少来划分的。
如表1-1所示。
此外,还有基准试剂,光谱纯试剂,色谱纯试剂等试剂在普通化学实验中配配试剂常用的市售浓酸,碱溶液的浓度见表1-2。
试剂的配制应该根据节约的原则,按实验的要求,分别选用不同规格的试剂。
不要认为试剂越纯越好,超越具体条件盲目追求高纯度而造成浪费。
当然也不能随意降低规格而影响测定结果的准确度。
2.试剂的保管试剂或者保管不当,会变质失效,不仅造成浪费,甚至会引起事故。
一般的化学试剂应保存在通风良好、干净、干燥的房子里,以防止被水分、灰尘和其他物质污染。
同时,应根据试剂的不同性质而采取不同的保管方法。
容易侵蚀玻璃而影响试剂纯度的试剂,如氢氟酸、含氟盐(氟化钾、氟化钠、氟化铵)和苛性碱(氢氧化钾、氢氧化钠),应保存在聚乙烯塑料瓶或涂有石蜡的玻璃瓶中。
见光会逐渐分解的试剂,(如过氧化氢、硝酸银、焦性没食子酸、高锰酸钾、草酸、铋酸钠等),与空气接触易逐渐被氧化的试剂(如氯化亚锡、硫酸亚铁、硫代硫酸钠、亚硫酸钠等),以及易挥发的试剂(如溴、氨水及乙醇等),应放在棕色瓶内置冷暗处。
吸水性强的试剂,如无水碳酸盐、苛性钠、过氧化钠等应严格密封(应该蜡封)。
相互易作用的试剂,如挥发性的酸与氨,氧化剂与还原剂应分开存放。
易烯的试剂,如乙醇、乙醚、苯、丙酮与易爆炸的试剂,如高氯酸、过氧化氢、硝基化合物,应分开贮存在阴凉通风、不受阳光直射的地方。
剧毒试剂,如氰化钾、氰化钠、氢氟酸、二氯化汞、三氧化二砷(砒霜)等,应特别注意由专人妥善保管,严格做好记录,经一定手续取用,以免发生事故。
极易挥发并有毒的试剂可放在通风橱内,当室内温度较高时,可放在冷藏室内保存。
3.试剂滴液的配制配制试剂溶液时,首先根据所配制试剂纯度的要求,选用不同等级试剂,再根据配制溶液的浓度和数量,计算出试剂的用量。
化学实验室的注意事项

化学实验室的注意事项一、药品的取用1.实验室药品取用规则(1) “三不”原则:不摸——不能用手接触药品。
不闻——不要把鼻孔凑到容器口直接闻药品气味。
不尝——不得尝任何药品的味道。
(2)最少量原则:应严格按规定的用量取药品;若无说明用量,一般应按最少量取用:液体为1~2 ml,固体只需盖满试管底部即可。
(3)环保原则:用剩的药品不能放回原瓶,不要随意丢弃,不能拿出实验室,要放入指定容器内。
2、固体药品的取用:固体药品通常保存在广口瓶里,取用固体药品一般用药匙,有些块状的药品可以用镊子夹取。
用过的药匙或镊子要立即用干净的纸擦拭干净,以备下次使用。
往试管中加入粉末状固体时,试管倾斜,把盛有药品的药匙(或纸槽)送至试管底部,然后使试管直立。
往试管中加入块状固体时,试管横放,用镊子把药品放入试管口,慢慢使试管竖立,药品缓缓滑入试管底部。
3、液体药品的取用:(直接倾倒)4、试剂保存(1)固态试剂要盛放在广口瓶中,液态试剂一般要盛放在细口瓶中。
(2)易潮解、易挥发、易与空气中的氧气、水蒸气、二氧化碳起反应的药品应密封保存。
如固体NaOH、浓盐酸、浓硫酸等。
特殊的如K、Na要放在煤油中,白磷放于水中。
(3)见光或受热易分解的物质应盛放在棕色瓶中,放置阴凉处。
如AgNO3、浓HNO3等。
(4)液态溴有毒且易挥发,应贮于磨口的细口瓶中,加盖玻璃塞(不能用胶塞),液面上加些水起水封作用,以减少溴的挥发并放阴凉处。
(5)易挥发、着火的药品应密封保存在阴凉处,远离火源。
如乙醇、乙醚、苯等。
(6)盛放药品的器皿应不能跟所盛药品反应。
如盛NaOH的试剂瓶不能用玻璃塞而应用橡胶塞。
二、仪器洗涤:(1)基本方法:先注入少量水,振荡倒掉,冲洗外壁,若仍有污迹,刷洗或用洗涤液处理。
最后用蒸馏水冲洗。
(2)洗净的标准:内壁均匀附着一层水膜,不聚成水滴,也不成股流下。
(3)仪器洗涤的方法:根据仪器沾有污痕的性质,选择适当的试剂溶解而除去。
初中化学实验基本操作知识点

初中化学实验基本操作知识点初中化学实验是必考内容,初中化学实验的各类知识点也是非常的多,下面给大家带来一些关于初中化学实验基本操作知识点,希望对大家有所帮助。
1、实验中取用药品时,如果要求取定量,必须严格要求取用,如果没有说明用量,应取最少量,一般按固体盖满试管底部,液体1~2毫升。
2、固体药品的取用取用粉末、颗粒状固体药品应用药匙或纸槽,其操作要点是:一斜二送三直立,斜:将试管倾斜;送:用药匙或纸槽将药品送入试管底部;直立:把试管直立起来,让药品均匀落到试管底部。
目的:避免药品沾在管口和管壁上。
取用块状固体药品应用镊子夹取,操作要领:一横二放三慢立,横:将试管横放;放:把药品放在试管口;慢立:把试管慢慢竖立起来。
目的:以免打破容器。
液体药品的取用可用移液管、胶头滴管等取用,也可用倾注法,使用倾注法取试剂加入试管时,打开瓶塞倒放在桌上试剂瓶标签应朝上对着手心,把试剂瓶口紧挨在另一手所持的略倾斜的试管口,让药品缓缓地注入试管内,注意防止残留在瓶口的药液流下来腐蚀标签,如果向烧杯内倾入液体时,应用玻璃棒引流,以防液体溅出,倾倒完液体后,试剂瓶立即盖好原瓶塞。
使用滴管取液体时,用手指捏紧橡胶胶头,赶出滴管中的空气,再将滴管伸入试剂瓶中,放开手指,试剂即被吸入,取出滴管,注意不能倒置,把它悬空放在容器口上方(不可触容器内壁,以免沾污滴管,造成试剂污染),然后用拇指和食指轻轻捏挤胶头,使试剂滴下。
3、某些药品的特殊保存方法(1)白磷在空气中易与氧气反应而自燃,必须保存在盛有冷水并密封的广口瓶中,切割时只能在水下进行,用镊子取用。
(2)易挥发物质的存放,要密封且存放于低温处,如浓盐酸、硝酸、氨水等(3)见光易分解的试剂要保存在棕色试剂瓶内,并置于阴凉处,如浓硝酸、硝酸银等(4)有强腐蚀性的物质,如氢氧化钠、氢氧化钾及各种碱溶液,要密封于橡胶塞的玻璃瓶中,不用磨口玻璃塞4、过滤时A、防止倾倒液体击穿滤纸,在倾倒液体时要用玻璃棒引流,使液体沿玻璃棒流进过滤器;B、防止液体未经过滤从滤纸和漏斗壁的缝隙间流下,漏斗中的液体的液面要低于滤纸边缘;C、防止滤液溅出,漏斗颈下端管口处要紧靠在烧杯内壁D、过滤时,绝对禁止用玻璃棒在漏斗中搅拌,这样易划破滤纸,造成实验失败。
溶液的配制步骤及其配置过程中的注意事项

溶液的配制步骤及其配置过程中的注意事项我们在学习初中化学时,有时候会碰到需要配制一定重量、一定质量分数的溶液。
例如:配制100克质量分数为10%的氯化钠溶液。
面对着这种物质,我们应该做呢?本文我们就来学习如何配置溶液?配置溶液的步骤是什么?配置溶液需要注意什么事项?【配制溶液的分类】1.用气体配制溶液2. 用固体配制溶液3.用液体配制溶液注:初中只需掌握固体液体两类溶液的配制就可以。
【配制溶液的步骤】①实验用品:托盘天平、量筒、胶头滴管、烧杯、玻璃棒、药匙等。
②实验步骤:计算→称量药品→量取溶剂水→搅拌溶解具体步骤为:1.利用公式计算所需溶质和水的质量。
其中:溶质的质量=溶液质量×溶质的质量分数,溶液质量=溶液体积×溶液密度,溶剂的质量=溶液质量-溶质的质量;由于溶剂一般是水,且密度为1g/cm3,所以溶剂的体积和质量在数值是相等的。
2.用托盘天平称量所需溶质,包含称取溶质的质量和量取溶剂的体积;首先用托盘天平(配用药匙)称量所需的溶质,倒入烧杯中;然后用量筒(配用胶头滴管)量取所需的水,倒入盛有溶质的烧杯中。
3.把水的密度近似看作1g/cm3,用量筒量取一定体积的水,倒入盛有溶质的烧杯里,用玻璃棒搅拌,使溶质溶解。
4.把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品的名称和溶液中溶质的质量分数),放到试剂柜中(注意标签向外)。
【溶液配制过程中的注意事项】1.容量瓶是刻度精密的玻璃仪器,不能用来溶解2.溶解完溶质后的溶液需要冷却到常温再转移3.溶解过程中的烧杯以及搅拌、引流用的玻璃棒都需要在转移后洗涤两三次。
4.把小烧杯中的溶液往容量瓶中转移时,需要借助玻璃棒引流,因容量瓶瓶口较细,目的是避免溶液洒出。
5.定容时要注意溶液凹液面的最低处和刻度线相切,眼睛需与凹液面底部持平,否则就会导致读数偏大或者偏小。
6.如发现定容时溶剂水的体积过大,则实验失败。
切勿使用胶头滴管洗去多余水量。
化学试剂的取用

化学试剂的取用和溶液的配制一、化学试剂的取用规则1. 固体试剂的取用规则(1)要用干净的药勺取用。
用过的药勺必须洗净和擦干后才能使用,以免沾污试剂。
(2)取用试剂后立即盖紧瓶盖,防止药剂与空气中的氧气等起反应。
(3)称量固体试剂时,必须注意不要取多,取多的药品,不能倒回原瓶。
因为取出已经接触空气,有可能已经受到污染,再倒回去容易污染瓶里的其它药剂。
(4)一般的固体试剂可以放在干净的纸或表面皿上称量。
具有腐蚀性、强氧化性或易潮解的固体试剂不能在纸上称量,应放在玻璃容器内称量。
如氢氧化钠有腐蚀性,又易潮解,最好放在烧杯中称取,否则容易腐蚀天平。
(5)有毒的药品称取时要做好防护措施。
如戴好口罩、手套等。
2. 液体试剂的取用规则(1)从滴瓶中取液体试剂时,要用滴瓶中的滴管,滴管绝不能伸入所用的容器中,以免接触器壁而玷污药品。
从试剂瓶中取少量液体试剂时,则需使要专用滴管。
装有药品的滴管不得横置或滴管口向上斜放,以免液体滴入滴管的胶皮帽中,腐蚀胶皮帽,再取试剂时受到污染。
(2)从细口瓶中取出液体试剂时,用倾注法。
先将瓶塞取下,反放在桌面上,手握住试剂瓶上贴标签的一面,逐渐倾斜瓶子,让试剂沿着洁净的管壁流入试管或沿着洁净的玻璃棒注入烧杯中。
取出所需量后,将试剂瓶扣在容器上靠一下,再逐渐竖起瓶子,以免遗留在瓶口的液体滴流到瓶的外壁。
(3)在某些不需要准确体积的实验时,可以估计取出液体的量。
例如用滴管取用液体时,1ml相当于多少滴,5ml液体占容器的几分之几等。
倒入的溶液的量,一般不超过其容积的1/3。
(4)定量取用液体时,用量筒或移液管取。
量筒用于量度一定体积的液体,可根据需要选用不同量度的量筒,而取用准确的量时就必须使用移液管。
(5)取用挥发性强的试剂时要在通风橱中进行,做好安全防护措施。
二、溶液的配制(1)配制溶质质量分数一定的溶液计算:算出所需溶质的质量。
如溶质是液体时,要算出液体和溶剂的体积。
称量:用天平称取固体溶质的质量;用量筒量取或吸管吸取所需溶质的体积。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验室药品的取用和溶液的配制
1 固体试剂的取用规则
(1)要用干净的药勺取用。
用过的药勺必须洗净和擦干后才能再使用,以免沾污试剂。
(2)取用试剂后立即盖紧瓶盖。
(3)称量固体试剂时,必须注意不要取多,取多的药品,不能倒回原瓶。
2 液体试剂的取用规则
(1)从滴瓶中取液体试剂时,要用滴瓶中的滴管,滴管绝不能伸入所用的容器中,以免接触器壁而沾污药品。
从试剂瓶中取少量液体试剂时,则需要专用滴管。
装有药品的滴管不得横置或滴管口向上斜放,以免液体滴入滴管的胶皮帽中。
(2)使用胶头滴管“四不能”:不能伸入和接触容器内壁,不能平放和倒拿,不能随意放置,未清洗的滴管不能吸取别的试剂。
(3)配制一定物质的量溶液时,溶解或稀释后溶液应冷却再移入容量瓶。
(4)配制一定物质的量浓度溶液,要引流时,玻璃棒的上面不能靠在容量瓶口,而下端则应靠在容量瓶刻度线下的内壁上(即下靠上不靠,下端靠线下)。
(5)容量瓶不能长期存放溶液,更不能作为反应容器,也不能互用。
(一般用于配制标准溶液的容量瓶最好专用)
3 溶液的配制
(1)配制溶质质量分数一定的溶液
计算:算出所需溶质和水的质量。
把水的质量换算成体积。
如溶质是液体时,要算出液体的体积。
称量:用天平称取固体溶质的质量;用量筒量取所需液体、水的体积。
溶解:将固体或液体溶质倒入烧杯里,加入所需的水,用玻璃棒搅拌使溶质完全溶解。
(2)配制一定物质的量浓度的溶液
计算:算出固体溶质的质量或液体溶质的体积。
称量:用托盘天平称取固体溶质质量,用量筒量取所需液体溶质的体积。
溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里。
转移:用适量蒸馏水将烧杯及玻璃棒洗涤2-3 次,将洗涤液注入容量瓶,振荡,使溶液混合均匀。
定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3cm处,改用胶头滴管加水,使溶液凹面最低处恰好与刻度相切。
把容量瓶盖紧,再振荡摇匀。
4 溶液配制的注意事项
(1)分析实验所用的溶液应用GB6682中规定的三级水配制,容器应用纯化水洗涤三次。
特殊要求的溶液应事先作空白值检验。
(2)溶液要用带塞的试剂瓶盛装,见光易分解的溶液要装于棕色瓶中,挥发性试剂瓶塞要严密,见空气易变质及放出腐蚀性气体的溶液也要盖紧,必要时用蜡封住。
浓碱液应用塑料瓶盛装。
(3)每瓶试剂必须有标明名称、规格、浓度和配制日期的标签。
(4)配制硫酸、磷酸、硝酸、盐酸等溶液,都必须将酸倒入水中。
配制时不可在试剂瓶中进行配制。
(5)用有机溶剂配制溶液时,有时有机物溶解较慢,应不时搅拌,可以在热水浴中温热搅拌,不可直接加热,必须避免火源。
(6)不可用手接触带腐蚀性或剧毒的溶液。
剧毒废液必须经解毒处理,不可直接倒入下水道
(7)一般溶液保存时间不可超过6个月,如果试剂发生浑浊变质,就必须废弃不得使用。
5 溶液储存时可能的变质原因
(1)玻璃与水和试剂作用后多少会被侵蚀(特别是碱性溶液),使溶液中含有钠、钙、硅酸盐等杂质。
某些离子容易被吸附于玻璃表面,这对于低浓度的离子标准液更不可忽视。
故低1mg/ml的离子溶液不适合长期保存。
(2)由于试剂瓶密封不好,空气中的二氧化碳、氧气、氨或酸雾侵入使溶液发生变质。
(3)某些溶液见光分解(硝酸银、汞盐),有些溶液放置时间长了会水解(铋盐、锑盐),有些溶液会受微生物的分解。
(4)含有易挥发的组分,使其浓度降低。
