第九章化学键与分子结构
化学键与分子结构

化学键与分子结构化学键是原子间的一种相互作用力,它使原子形成化学结合并形成分子。
分子结构是描述分子中原子之间连接关系的方式。
化学键和分子结构是化学研究中非常重要的概念,对于理解物质的性质和化学反应具有重要意义。
本文将介绍不同类型的化学键和分子结构的基本原理。
一、共价键共价键是最常见的化学键类型之一。
在共价键中,原子通过共享电子来实现化学结合。
共价键的形成源于原子的电子云之间的相互作用。
1. 单共价键单共价键是最简单的共价键形式。
它是一个电子对在两个原子之间的共享。
例如,氢气(H2)中的两个氢原子通过共享一个电子对形成单共价键。
在化学方程式中,这种键可以用一个连线“-”来表示。
2. 双共价键和三共价键双共价键和三共价键是由于电子双共享和三共享而形成的。
以氧气(O2)为例,两个氧原子彼此共享两对电子形成双共价键。
类似地,氮气(N2)中两个氮原子通过共享三对电子形成三共价键。
二、离子键离子键是由正负电荷之间的相互吸引力形成的化学键。
在离子键中,电子从一个原子转移到另一个原子,形成带电离子。
1. 阳离子和阴离子在离子键中,其中一个原子失去电子变成带正电的阳离子,另一个原子获得电子变成带负电的阴离子。
这种电子转移使两个原子之间形成强烈的吸引力,形成离子键。
2. 离子晶体离子键的典型例子是盐(NaCl)晶体。
在盐晶体中,钠离子和氯离子通过离子键紧密地结合在一起。
由于离子键的强力,盐晶体具有高熔点和良好的导电性。
三、金属键金属键是金属元素中特有的一种化学键。
金属键是由金属中自由移动的电子形成的。
1. 电子海模型金属键的一个重要概念是“电子海模型”。
在这个模型中,金属中的原子释放出部分外层电子形成电子海,而原子核则形成离子核。
这些自由移动的电子使金属中的原子之间形成强大的连接。
2. 金属的特性金属键的存在赋予金属独特的性质。
金属具有良好的导电性和热导性,以及可塑性和延展性。
这些性质是由金属键中的自由电子能够自由移动而产生的。
化学键与分子结构

化学键与分子结构在我们的日常生活中,从我们呼吸的空气到我们所吃的食物,从我们所穿的衣物到我们使用的各种材料,无一不与化学相关。
而在化学的世界中,化学键与分子结构则是理解物质性质和化学反应的关键所在。
让我们先来聊聊什么是化学键。
简单来说,化学键就是将原子结合在一起形成分子的“强力胶水”。
想象一下,原子就像是一个个独立的小珠子,而化学键就是把这些小珠子串起来的线。
不同类型的化学键有着不同的强度和性质,从而决定了所形成分子的特性。
最常见的化学键类型有离子键、共价键和金属键。
离子键通常在金属元素和非金属元素之间形成。
比如说,氯化钠(NaCl)就是一个典型的例子。
钠原子失去一个电子变成带正电的钠离子,氯原子得到一个电子变成带负电的氯离子,这两种带相反电荷的离子通过静电引力相互吸引,从而形成了离子键。
这种键的强度较大,使得离子化合物在常温下通常是固体,具有较高的熔点和沸点。
共价键则是原子之间通过共用电子对形成的化学键。
例如氢气(H₂),两个氢原子各自拿出一个电子形成共用电子对,从而把两个氢原子紧紧地“绑”在一起。
共价键又可以分为极性共价键和非极性共价键。
如果两个原子对共用电子对的吸引能力相同,比如氢气中的氢原子,那么形成的就是非极性共价键;而如果两个原子对共用电子对的吸引能力不同,就像氯化氢(HCl)中氢原子和氯原子,形成的就是极性共价键。
金属键则存在于金属单质中。
金属原子失去部分或全部外层电子,形成“电子气”,这些自由电子在整个金属晶体中自由移动,将金属原子或离子“胶合”在一起。
这也解释了为什么金属具有良好的导电性和导热性。
了解了化学键的类型,接下来我们看看分子结构。
分子结构指的是分子中原子的排列方式和空间构型。
分子的结构对于其物理和化学性质有着至关重要的影响。
比如甲烷(CH₄),它的分子结构是正四面体。
碳原子位于正四面体的中心,四个氢原子分别位于正四面体的四个顶点。
这种结构使得甲烷分子具有相对稳定的性质。
第九章 双原子分子结构与化学键理论(中)

σ
AO以“头顶头”方式形成成键轨道 σg 和反键轨道 σu , 它们都绕键轴呈圆柱形对称,区分在于有无垂直于键轴 的节面:
20
14
/7
/2
3
南
京
大
学
化 学 原 理 课 件
πu 和反键轨道 πg ,它们都有一个包含 键轴的节面,区分在于有无垂直于键 轴的节面:
大
学 南 京
乙烯的LUMO: πg
_
20
dxz , s
dxz-px 异号重叠 对称匹配 组成反键轨道
dxz , pz 同、异号重叠完全抵消 对称不匹配 不能组成任何分子轨道
组成成键轨道
20
对称匹配
14
分子轨道的类型
σ
AO以“头顶头”方式形成成键轨道 σg 和反键轨道 σu , 它们都绕键轴呈圆柱形对称,区分在于有无垂直于键轴 的节面:
京
学
2
20
p NO 等含奇数电子的分子结构 p 预言“He2”、“Be2”、“Ne2”等的不存在
14
/7
/2
物种 H2+ He2+
键长/pm 106 108
3
南
化 学 原 理 课 件
3、分子轨道理论
键能/kJ·mol−1 268 299
p 描述分子中电子运动的波函数,指具有特定能量的某
电子在相互键合的两个或多个原子核附近空间出现概 率最大的区域;
ü 能级相近,能级差通常小于15 eV; ü 轨道最大重叠。
对称性匹配是形成分子轨道的前提,其余两条
13
20
14
/7
/2
则是组合效率的问题。
3
南
京
大
化学键与分子结构

化学键与分子结构化学键是指由原子之间的电子相互作用形成的强力,用于连接原子并形成分子的结构。
它决定了分子的性质、稳定性和反应性。
本文将介绍不同类型的化学键以及它们对分子结构的影响。
一、离子键离子键是指由正负电荷之间的电吸引力形成的,常见于金属和非金属之间的化合物。
金属原子会失去电子形成阳离子,而非金属原子会接受这些电子形成阴离子。
两种离子之间的电吸引力就形成了离子键。
离子键通常是非常强大的,使得离子化合物具有高熔点和高溶解度。
二、共价键共价键是由原子共享一个或多个电子而形成的。
它是分子中最常见的键。
共价键可以分为极性共价键和非极性共价键。
1. 极性共价键极性共价键是指电子不均匀地被共享,导致形成不均匀的电荷分布。
极性共价键通常由非金属原子之间形成,其中一个原子的电负性较高,吸引了共享电子对。
由于电荷分布的不均匀,极性共价键会导致分子局部带电。
2. 非极性共价键在非极性共价键中,共享电子对是均匀分布的,没有电荷分离。
这种键形成于相同或相似电负性的原子之间,如氢气分子(H2)或氧气分子(O2)。
非极性共价键通常较弱。
三、金属键金属键是金属原子之间形成的。
在金属晶体中,金属原子通过共享它们的外层电子来形成金属键。
这些电子在整个晶体中自由移动,形成所谓的电子海。
金属键是金属具有高导电性和高热传导性的关键原因。
四、氢键氢键是指由部分带正电的氢原子与带有负电荷的氮、氧或氟原子之间的作用力。
氢键在生物分子如DNA、蛋白质和多肽中起着重要作用。
氢键虽然较弱,但对分子的稳定性和特性产生显著影响。
总结起来,化学键的类型和分子结构密切相关。
离子键在金属和非金属之间形成,共价键有极性和非极性两种形式,金属键形成于金属晶体中,而氢键具有特殊的电荷吸引力。
通过理解不同类型的化学键,我们可以更好地理解分子的性质和行为,促进对化学和生物学等领域的深入研究。
阅读本文,希望读者对化学键与分子结构有更清晰的认识,进一步了解分子间的相互作用和性质变化机制,为科学研究提供更为坚实的基础。
无机化学(上册):第9章 化学键与分子结构 习题答案
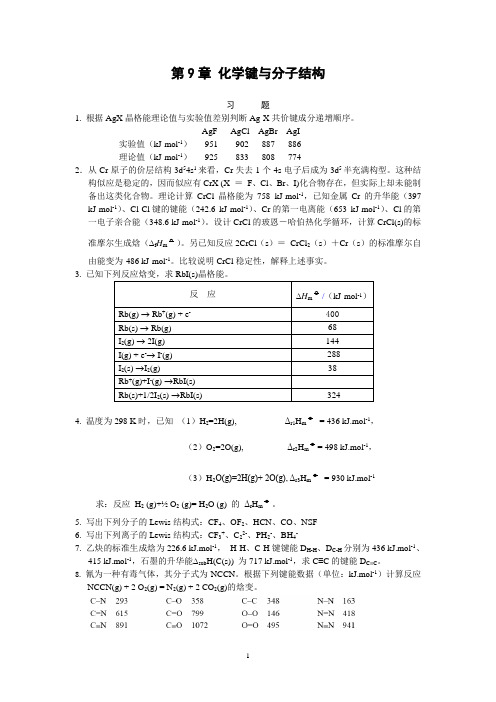
第9章化学键与分子结构习题1. 根据AgX晶格能理论值与实验值差别判断Ag-X共价键成分递增顺序。
AgF AgCl AgBr AgI实验值(kJ·mol-1)951 902 887 886理论值(kJ·mol-1)925 833 808 7742.从Cr原子的价层结构3d54s1来看,Cr失去1个4s电子后成为3d5半充满构型。
这种结构似应是稳定的,因而似应有CrX (X =F、Cl、Br、I)化合物存在,但实际上却未能制备出这类化合物。
理论计算CrCl晶格能为758 kJ·mol-1,已知金属Cr的升华能(397 kJ·mol-1)、Cl-Cl键的键能(242.6 kJ·mol-1)、Cr的第一电离能(653 kJ·mol-1)、Cl的第一电子亲合能(348.6 kJ·mol-1)。
设计CrCl的玻恩-哈伯热化学循环,计算CrCl(s)的标准摩尔生成焓(∆f H m o)。
另已知反应2CrCl(s)=CrCl2(s)+Cr(s)的标准摩尔自由能变为-486 kJ·mol-1。
比较说明CrCl稳定性,解释上述事实。
3.4. 温度为298 K时,已知(1)H2=2H(g), Δr1H m o= 436 kJ.mol-1,(2)O2=2O(g), Δr2H m o= 498 kJ.mol-1,(3)H2O(g)=2H(g)+ 2O(g), Δr3H m o= 930 kJ.mol-1 求:反应H2 (g)+½ O2 (g)= H2O (g) 的Δr H m o。
5. 写出下列分子的Lewis结构式:CF4、OF2、HCN、CO、NSF6. 写出下列离子的Lewis结构式:CF3+、C22-、PH2-、BH4-7. 乙炔的标准生成焓为226.6 kJ.mol-1,H-H、C-H键键能D H-H、D C-H分别为436 kJ.mol-1、415 kJ.mol-1,石墨的升华能∆sub H(C(s)) 为717 kJ.mol-1,求C≡C的键能D C≡C。
第九章双原子分子结构与化学键理论

第九章双原子分子结构与化学键理论第九章双原子分子结构与化学键理论(下)主要讲述了双原子分子的能量和电子结构,包括分子轨道理论和离化能。
在双原子分子中,原子间的相互作用将导致分子的结合和分裂,这种作用被称为化学键。
分子轨道理论被用来描述能量和电子结构,而离化能则是用来度量化学键的强度。
分子轨道理论是基于量子力学的。
在这个理论中,分子中的原子轨道将组合成分子轨道,这些分子轨道可以是成键轨道或反键轨道。
成键轨道具有较低的能量,而反键轨道具有较高的能量。
当原子轨道重叠时,将形成成键电子密度,从而使分子稳定。
分子轨道的数量与原子轨道的数量相等,分子轨道可以用波函数来描述,这些波函数可以用来计算分子的性质。
离化能是指将一个电子从一个原子中移动到另一个原子中所需的能量。
离化能越大,说明化学键越强。
离化能的大小取决于分子的电子结构和分子大小。
较小的分子通常具有较大的离化能,因为它们的电子云更接近核心,更难离开。
在分子轨道理论中,键的强度可以通过排斥能来衡量。
排斥能是指电子间的相互斥力,它越大,表示键越强。
排斥能的大小取决于成键和反键电子的数量和能量。
本章还介绍了氢分子离子(H2+)和氢分子(H2)的结构和能量。
在氢分子离子中,一个原子损失了一个电子,形成一个正离子和一个负离子。
在氢分子中,两个氢原子共用一个电子,形成化学键。
此外,本章还包括分子的振动和旋转以及分子光谱学。
分子的振动是指分子中原子之间相对于它们的平衡位置的周期性运动。
分子的旋转是指分子以其轴心为中心的旋转运动。
分子光谱学是研究分子吸收和发射光的过程。
总的来说,本章通过双原子分子的能量和电子结构、分子轨道理论和离化能的介绍,深入讲述了双原子分子的结构和化学键的理论基础。
并且讨论了分子的振动、旋转和分子光谱学,为后续的分子结构和化学键理论的学习打下了基础。
基础化学第九章分子结构

H
109.5
C H
H H H
N H H NH3 H H H2O O
CH4
孤电子对数: 0 键 角:109.5º
1 107.3º 三角锥
2 104.5º V形
空间结构: 正四面体
结论:在CH4、NH3和H2O分子中,中心原子都采 用sp3杂化,其键角随孤电子对数的增加而减小。 27
空间构型
sp sp2 sp3
如:CO分子:
2s C O 2p
价键结构式:
C O
C
O
14
一个 键,一个 键 ,一个配位 键
4、价键理论的局限性
2s C
2p
• 价键理论可以较好地解释许多分子价键的形成, 但也存在局限。 根据VB 法,C:1s22s22p2,有两个未成对电子,如 与H 成键,只可能生成CH2——与事实不符:CH2 不稳定,而CH4却十分稳定。 解释:c 的2s、2p 轨道能量相近,成键前,2s电 子发生激发: 这样,有四个未成对电子,可以形成四个共价键。 但这四个共价键应该不同, 事实:四个键无差别(正 四面体)为了解释上述事实,鲍林提出了“杂化轨道 15 理论”
第九章 分子的结构与性质
分子的空间构型 分子结构 离子键
化学键
共价键
金属键
1
§9.1 化学键参数和分子性质
一、键参数:用来表征化学键性质的物理量 1、键能:
(1)定义:通常指在标准状态下,将1mol理想气体 分子AB解离为理想气态下A、B原子时的焓变,称为 AB的键能。用EA-B表示。 AB(g) A(g) +B(g) E (A-B)
q d
q
极性分子的偶极矩称为永久偶极
7
2、分子的磁性: (1)顺磁性物质:分子中有未成对电子,在 磁场中能顺磁场方向产生磁矩。 (2)抗(反)磁性物质:分子中所有电子均 成对,无未成对电子。
基础化学第九章分子结构

(一) σ 键
四、共价键的类型
四、共价键的类型
(一) σ 键
以“头碰头”方式沿键轴(两原子核间联线) 方向重叠,重叠部分对于键轴呈圆柱形对称。沿键 轴方向旋转任意角度,轨道的形状和符号均不改变。
σ 键沿键轴方向形成,重叠程度大,所以其
键能大、稳定性高。
σ 键是化学结构的保持者。
第九章 分子结构
第一节 第二节 第三节 第四节 第五节 第六节 第七节
离子键 共价键的价键理论 价层电子对互斥理论 轨道杂化理论 分子轨道理论简介 离域π键 分子作用力和氢键
第九章 分子结构
第二节 第四节 第七节
共价键的价键理论 轨道杂化理论 分子作用力和氢键
于是, CO 可表示成
CO
六、共价键参数
共价键参数是表征共价键性质的物理量, 常见的参数有:键能、键长、键角和键的极性。
键能Ed:使气态 A—B分子解离成气态原子 A 和
原子 B 所需要的能量。一般在102 kJ·mol-1数 量级。
键长l:分子中两个成键原子核间的平衡距离。
一般在102 pm 数量级。
一、共价键的本质
而电子自旋方式相同的两个氢原子相互接近时,两 核间电子出现的概率密度降低,从而增大了两个原 子核的排斥力,使系统能量升高,所以无法形成化 学键。
由此可见,电子自旋相反的两个氢原子以核间距R0
相结合,比两个远离的氢原子能量低,可以形成稳 定的分子。而电子自旋相同的两个氢原子接近时, 系统能量比两个远离的氢原子能量还高,不能形成 稳定的分子。
成的化学键的键能大; (4) 杂化轨道不能以空轨道形式存在; (5) 杂化轨道的构型决定了分子的空间构型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子型化合物形成的结晶状固体叫离子晶体。
7
9.1.2 离子键的特点
● 本质是静电引力(库仑引力) ● 没有方向性和饱和性(库仑引力的性质所决定) ● 键的极性与元素的电负性有关
NaCl
CsCl
这个例子能够说明一个离子周围的异电荷离子数与各自所带 电荷的多少(或者说由引而产生的作用力的强弱)无关.
8
离子键的本质是静电引力(库仑引力)
f
=
q+ R
q-
2
离子型化合物的性质决定于: 组成化合物的离子的电荷 离子的半径
离子的电子构型
离子所带的电荷越高、离子核间的距离越小,则正负
离子之间的吸引力越强,离子键强度越大,形成的化合
物越稳定。
9
离子键没有方向性和饱和性 离子是带电球体,其电荷分布是球形对称 的,它可以在空间任何方向上吸引带有相反 电荷的离子。
(1)2电子构型:最外层是2个电子的离子。
Li 1s2 2s1
Li+
1s2
Be B e 2+
1s2 2s2 1s2
(2)8电子构型:最外层是8个电子的离子。
Na 2s2 2p63s1 N Ca+ 3s2 3p6
15
(3)18电子构型:最外层是18个电子的离子。
核间距 R0为74 pm。 共价键的本质——原子轨道重叠,核间 电子概率密度大吸引原子核而成健。
22
++
+
+
+ 不成键
p轨道共价键形成示意图
成键
共价键:原子间通过共用电子对而形成的化 学键。
23
㈡ 价键理论要点 电子配对法(VB法) (1)电子配对原理 (2)能量最低原理 (3)原子轨道最大重叠原理
2.0
63
0.6
9
2.2
70
0.8
15
2.4
76
1.0
22
2.6
82
1.2
30
2.8
86
1.4
39
3.0
89
1.6
47
3.2
92
若两个原子电负性差值大于1.7时,可以判定二者之间形
成离子键,若小于1.7则可以判定二者之间形成共价键12。
9.1.3 离子的特征
一般离子具有三个重要的特征:离子的电荷、 离子的半径和离子的电子构型。
Zn [Ar]3s23p63d104s2 Cu [Ar]3s23p63d104s1
Zn2 [Ar]3s23p63d10
Cu [Ar]3s23p63d10
(4)18+2电子构型:此外层是18个电子,最外 层是2个电子的离子。
Pb [Xe]5d106s26p2 Pb2 [Xe]5d106s2
Sn [Kr]4d105s25p2 Sn2 [Kr]4d105s2
Na+
10
离子键的极性与元素的电负性有关 离子键形成的重要条件是相互作用的原
子的电负性差值越大,元素原子间的电负 性相差越大,二者之间键的离子性越大。
11
单键的离子性百分数与电负性之间的关系
电负性差值 XA-XB 0.2
离子性百 分比%
1
电负性差值 XA-XB 1.8
离子性百 分比%
55
0.4
4
共价键理论
价键理论 分子轨道理(不 论介绍)
金属键理论
3
离子键
双原子
化
共价键
学 共价键
键
多原子
共价键
金属键
极性共价键 非极性键
4
9.1.1 离子键理论的内容
最外层 电子结构 原子之间发生电子的转移而生成正负离子。 正负离子一般达到稀有气体的稳定结构。
5
所谓稳定结构,对于主族元素索生成的 离子,多数都具有稀有气体结构,即p轨道 为全充满状态。
离子半径的大小对离子型化合物的性质有 显著的影响,离子半径越小,离子间引力越 大,离子型化合物的熔、沸点也越高。
20
§9.2 价键理论
9.2.1 共价键的本质与特点 9.2.2 共价键的键型 9.2.3 杂化轨道
量子力学处理H2分子的结果 两个氢原子电
子自旋方式相反, 靠近、重叠,核间 形成一个电子概率 密度较大的区域。 系统能量降低,形 成氢分子。
离子的电荷
离子的电荷对离子的性质和所组成的离子 型化合物的性质都有很大的影响。
如
Fe3+
Fe2+
氧化性
还原性
13
Fe3+
无水FeCl3棕黄色
含水FeCl3棕黄色
与SCN反应
血红色化合物
Fe2+ 无水FeCl2白色 含水FeCl2浅蓝色
不反应
离子电荷上的差异是离子性质差异的最直 接因素。
14
离子的电子构型
16
(3)8~18电子构型:最外层是8~18个电子之间 的不饱和结构的离子。
Fe [Ne]3s23p63d64s2 Fe2+ [Ne]3s23p63d6 最外层14个电子
Cr [Ne]3s23p63d54s1 Cr3+ [Ne]3s23p63d3 最外层11个电子
Mn [Ne]3s23p63d64s2 Mn2+ [Ne]3s23p63d5 最外层13个电子 17
离子的半径 当正负离子间的吸引力和核外电子与电 子之间以及原子核之间的排斥力达到平衡 时,正负离子之间保持着一定的平衡距离, 这个距离叫核间距,常用符号d表示。
正负离子半径与 核间距的关系
18
离子半径大致有如下变化规律:
(1)周期表中个主族元素中,自上而下电 子层数依次增多,具有相同电荷数的同族离 子半径依次增大;
(1)电子配对原理
自旋相反的成单电子相互接近时,可以形成稳定的 化学键,若原子A和B各有一个未成对的电子且自旋方 向相反,则可以互相配对形成共价单键。
Li+<Na+<K+<Rb+<Cs+ F-<Cl-<Br-<I-
(2)同一周期中自左而右,主族元素正离 子的电荷数依次增大,离子半径依次减小;
Na+>Mg2+>Al3+
19
(3)同一元素形成不同电荷的正离子时,高 价离子的电荷高,离子半径小于低价离子 的半径。
Fe原子半径116.5pm,Fe2+ 76pm,Fe3+ 67pm
如 N a + 2 s2 2 p 6 C l- 3 s2 3 p 6
对于副族元素所生成的离子,d轨道一般 为半充满状态,
如
F e 3+ 3 d5 M n2 + 3 d5
但过渡元素的s轨道和d轨道能量相近,所
以常出现例外情况。
6
正、负离子之间通过静电作用而形成的化学 键叫离子键。
离子键的本质:库仑力。 离子所带电荷越大、离子之间的距离越小, 则离子键越强。
第九章 化学键与分子结构
§9.1 离子键理论 §9.2 价键理论 §9.3 杂化轨道理论 §9.4 分子间力和氢键
§9.1 离子键理论
9.1.1 离子键理论的内容 9.1.2 离子键的特点 9.1.3 离子的特征
2
化学键:
分子或晶体中相邻原子(或离子)之间 强烈的吸引作用。
化学键理论:
离子键理论:
