2018版高考化学二轮复习第八章水溶液中的离子平衡8.3盐类的水解课件
合集下载
优质课课件-盐类的水解

Na2CO3溶液
NaHCO3溶液
醋酸钠的水解:
CH3COONa = CH3COO + Na+ + _ + H2O H + OH
CH3COOH _ CH3COO +H2O CH3COOH+OH
_
CH3COONa + H2O
CH3COOH+NaOH
氯化铵的水解
NH4Cl = NH4+ + Cl+
H2O
相遇相
相遇相互促进使水解趋于完全,不能大量共存。
4.盐溶液蒸干产物的判断
如AlCl3的制备,不能通过加热溶液、浓缩结晶的方法,因为温度升高,
水解程度增大,同时由于HCl挥发,生成Al(OH)3,若对沉淀继续加热灼 烧,Al(OH)3将分解生成Al2O3。
5.盐类水解在日常生活中的应用
(1)去污:如常把某些盐当作碱使用,如纯碱、肥皂具有去污作用,且热溶液的去 污能力比冷溶液的去污能力强。这是由于纯碱、肥皂都属于强碱弱酸盐,其水解后 溶液均显碱性,升高温度水解的程度增大,溶液的碱性增强。 (2)灭火:泡沫灭火器内所盛装的药品分别是 NaHCO3溶液和Al2(SO4)3溶液,在使用 时将二者混合,能够水解彻底: Al3 + + 3HCO===Al(OH)3↓ + 3CO2↑ 。在炸油条过 程中加入纯碱、明矾,利用水解产生的CO2气体,使油条变得松脆可口。 (3)净水:明矾用于净水,这是由于铝盐水解产生的氢氧化铝具有吸附性的缘故。 其水解的离子方程式为Al3++3H2O 质,可用于净水。 Al(OH)3+3H+。铁盐也具有相类似的性
OH- + H+
NH3.H2O
NH4+ +H2O NH4Cl +H2O NH3.H2O + H+ NH3.H2O + HCl
NaHCO3溶液
醋酸钠的水解:
CH3COONa = CH3COO + Na+ + _ + H2O H + OH
CH3COOH _ CH3COO +H2O CH3COOH+OH
_
CH3COONa + H2O
CH3COOH+NaOH
氯化铵的水解
NH4Cl = NH4+ + Cl+
H2O
相遇相
相遇相互促进使水解趋于完全,不能大量共存。
4.盐溶液蒸干产物的判断
如AlCl3的制备,不能通过加热溶液、浓缩结晶的方法,因为温度升高,
水解程度增大,同时由于HCl挥发,生成Al(OH)3,若对沉淀继续加热灼 烧,Al(OH)3将分解生成Al2O3。
5.盐类水解在日常生活中的应用
(1)去污:如常把某些盐当作碱使用,如纯碱、肥皂具有去污作用,且热溶液的去 污能力比冷溶液的去污能力强。这是由于纯碱、肥皂都属于强碱弱酸盐,其水解后 溶液均显碱性,升高温度水解的程度增大,溶液的碱性增强。 (2)灭火:泡沫灭火器内所盛装的药品分别是 NaHCO3溶液和Al2(SO4)3溶液,在使用 时将二者混合,能够水解彻底: Al3 + + 3HCO===Al(OH)3↓ + 3CO2↑ 。在炸油条过 程中加入纯碱、明矾,利用水解产生的CO2气体,使油条变得松脆可口。 (3)净水:明矾用于净水,这是由于铝盐水解产生的氢氧化铝具有吸附性的缘故。 其水解的离子方程式为Al3++3H2O 质,可用于净水。 Al(OH)3+3H+。铁盐也具有相类似的性
OH- + H+
NH3.H2O
NH4+ +H2O NH4Cl +H2O NH3.H2O + H+ NH3.H2O + HCl
2018年高考化学大一轮复习第8章水溶液中的离子平衡第3讲盐类水解课件

实例
NaCl、 KNO3
否
中性
pH=7
强酸弱 碱盐
NH4Cl、 Cu(NO3)2
是
NH、Cu2+
CH3COO-、 - CO2 3
酸性
pH<7
弱酸强 CH3COONa 碱盐 、Na2CO3
是
碱性
pH>7
[思维深化] 1.(1)酸式盐溶液一定呈酸性吗? (2)离子能够发生水解的盐溶液一定呈酸性或碱性吗?试分别 举例说明。 提示:(1)不一定,如 NaHSO4、NaHSO3、NaH2PO4 溶液均呈 酸性,但 NaHCO3、NaHS 溶液均呈碱性。 (2)不一定, 如 NH4Cl、 AlCl3 溶液呈酸性, Na2CO3、 CH3COONa 溶液呈碱性,CH3COONH4 溶液呈中性。
H2CO3+OH-(主
H2SO3+OH-(次
4 . 相同条件下的水解程度:正盐 > 相应酸式盐 , 如 CO 2 3 >HCO- 3。
-
5.相互促进水解的盐>单独水解的盐>水解相互抑制的盐。如 NH+ 4 的水解:(NH4)2CO3>(NH4)2SO4>(NH4)2Fe(SO4)2。
考点二 1.内因
+
⑤NH4Cl 溶于 D2O 中: NH 4 +
-
+
NH3· D2O+H
⑥HS 的水解:HS +H2O
-
S2 +H3O
-
+
⑦将饱和 FeCl3 溶液滴入沸腾的水中: FeCl3+3H2O 体)+3HCl
Fe(OH)3(胶
⑧将 NaHCO3 溶液与 AlCl3 溶液混合 Al3++3HCO- 3
Al(OH)3↓+3CO2↑
较大,产生的 c(OH-)较大,pH 较大。由于盐的一级水解大于二级 水解,故 Na2CO3 溶液的 pH 比 NaHCO3 大。
高考化学总复习(苏教版)专题8第三单元 盐类的水解 课件(共71张PPT)

有 c(Na+)+c(H+)=c(A-)+c(OH-) D.无论该溶液呈酸性还是碱性,都有 c(Na+)=c(A-)+c(HA)
解析:选C。依题意知,混合溶液中 c(HA)=0.1 mol· L-1,c(NaA)=0.1
mol· L-1。A项,若HA的电离程度大于
混合溶液。下列有关推断正确的是(
) A .若该溶液中 HA 的电离能力大于 A - 的 水 解 能 力 , 则 有 c(Na + ) > c(A - ) > c(HA)>c(H+)>c(OH-)
B.若该溶液中A-的水解能力大于HA 的电离能力,则有c(A-)>c(HA)>c(Na
+)>c(OH-)>c(H+)
条件
升温
通HCl气 体 加 H2O
移动 方向 右 ____ 左 右 ____
n(H+)
pH
现象
增多 增多 ______
增多
减小
减小 增大
产生红褐色沉淀
溶液棕黄色加深 溶液棕黄色变浅
条件 加Fe粉 加 NaHCO3
移动 方向 左 右 ____
n(H+) 减少 减少
pH 增大 增大 _____
现象 溶液由棕黄色 变为浅绿色 及无色无味气 体
用“+”连接;
③各离子浓度前的化学计量数就是各离
子所带的电荷数。 如小苏打溶液中:
- c(Na + ) + c(H + ) = c(HCO - ) + c (OH )+ 3
2- 2c(CO3 )
(2)物料守恒式 在电解质溶液中, 由于某些离子能够水解, 粒子种类增多,但中心原子总是守恒的。 如小苏打溶液中,虽然 HCO3 既水解又电
吸热 (填“吸热”或“放热”)反 (2)是______
应,是____________ 酸碱中和 反应的逆反应;
解析:选C。依题意知,混合溶液中 c(HA)=0.1 mol· L-1,c(NaA)=0.1
mol· L-1。A项,若HA的电离程度大于
混合溶液。下列有关推断正确的是(
) A .若该溶液中 HA 的电离能力大于 A - 的 水 解 能 力 , 则 有 c(Na + ) > c(A - ) > c(HA)>c(H+)>c(OH-)
B.若该溶液中A-的水解能力大于HA 的电离能力,则有c(A-)>c(HA)>c(Na
+)>c(OH-)>c(H+)
条件
升温
通HCl气 体 加 H2O
移动 方向 右 ____ 左 右 ____
n(H+)
pH
现象
增多 增多 ______
增多
减小
减小 增大
产生红褐色沉淀
溶液棕黄色加深 溶液棕黄色变浅
条件 加Fe粉 加 NaHCO3
移动 方向 左 右 ____
n(H+) 减少 减少
pH 增大 增大 _____
现象 溶液由棕黄色 变为浅绿色 及无色无味气 体
用“+”连接;
③各离子浓度前的化学计量数就是各离
子所带的电荷数。 如小苏打溶液中:
- c(Na + ) + c(H + ) = c(HCO - ) + c (OH )+ 3
2- 2c(CO3 )
(2)物料守恒式 在电解质溶液中, 由于某些离子能够水解, 粒子种类增多,但中心原子总是守恒的。 如小苏打溶液中,虽然 HCO3 既水解又电
吸热 (填“吸热”或“放热”)反 (2)是______
应,是____________ 酸碱中和 反应的逆反应;
《高二化学盐的水解》PPT课件

反思总结
(1)盐类水解是可逆反应,水解方程式中用可 逆符号连接,而不使用等号。 (2)一般水解程度小,水解产物少,通常不生 成沉淀和气体,不标“↓” “↑”符号,生成 物如(H2CO3、 NH3.H2O )也不写成分解产物。
练习:
1、写出 NH4Cl、Al2(SO4)3、NaF、 Na2CO3 的水解方程式。
盐的溶液
CH3COONa溶液 K2CO3溶液 NH4Cl溶液 Al2(SO4)3溶液 NaCl溶液 KNO3溶液
溶液的酸 碱性
碱性
酸性
中性
盐的组成 强碱弱酸 强酸弱碱 强酸强碱
理论探究
为什么盐的组成不同,溶液的酸碱性 就不同呢?请以NaCl CH3COONa、 NH4Cl、为例展开分析讨论。
强酸强碱盐 NaCl
4、多元弱酸根离子多步水解,以第一步为主 ③条件
1、盐中必须有弱离子:①弱碱阳离子_NH_4+、_Fe3_+、_Cu2_+、_Al3+等。 ②弱酸根离子_HC_O3-_C_O32_- C_H3C_OO_- _Cl_O-等。
2、盐必须易溶于水
3. 盐类水解的规律
类型
实例 是否 水` 解的
水解 离子
强酸弱 碱盐
NH4Cl
水解
强酸碱盐弱弱弱酸N碱a 碱盐 NaNO3 不水解 无
生成的弱 电解质 弱碱
弱酸
无
溶液的酸 碱性
酸性
碱性
中性
有弱才水解,无弱不水解。越弱越水解, 都弱双水解。谁强显谁性,同强显中性。
二、水解方程式的书写
1、一般模式:
(1)用化学方程式表示:盐+水 酸+碱
原因: (用离子方程式和简要文字说明表示) 。
化学专题复习课件水溶液中的离子平衡
x=y,且 a+b=14,则 n(NaOH)=n(HCl)二者恰好完全反应,pH =7;若 10x=y 且 a+b=13,则碱不足,pH<7;若 ax=by 且 a +b=13 则 n(NaOH)∶n(HCl)=ba·110<1,故 pH<7;若 x=10y 且 a+b=14,则 n(NaOH)∶n(HCl)=10>1,NaOH 过量,pH>7。
H3O++OH—
H20
H++OH—
•
(正反应为吸热反应)
⑵水的离子积常数:Kw=[H+][OH-]
• 250C 时Kw =1.0×10-14 mol2·L-2
• 1000C 时Kw =1.0×10-12 mol2·L-2 .
• ⑶无论是纯水还是酸、碱、盐等电解质的 稀溶液,水的离子积为该温度下的Kw。
离子浓度大小比较: 三个守恒关系
(1)微粒数守恒关系(即物料守恒)。
(2) 电荷守恒。
(3)水电离的离子数平衡关系(即质子守恒)。
3.质子守恒: 电解质溶液中分子或离子得到或失去质子(H+)的 物质的量应相等。
如:在Na2CO3溶液中 H+、HCO3-、H2CO3 为得 到质子后的产物; OH- 为失去质子后的产物 c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
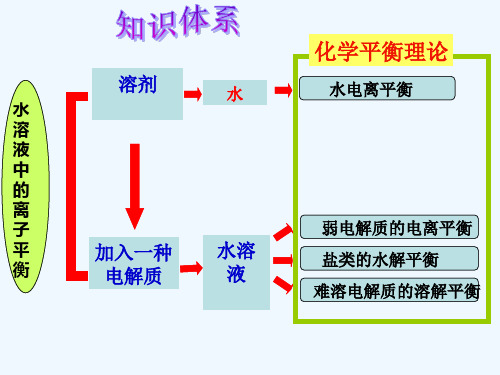
化学平衡理论
溶剂
水
水电离平衡
水
溶
液
中
的
离
子
弱电解质的电离平衡
平 衡
加入一种 电解质
水溶 液
盐类的水解平衡
难溶电解质的溶解平衡
水溶液中的离子平衡
• 一、强、弱电解质的判断方法 • 1.电离方面:能否完全电离,如: • (1)0.1 mol·L-1CH3COOH溶液pH约为3; • (2)0.1 mol CH3COOH溶液的导电能力比
H3O++OH—
H20
H++OH—
•
(正反应为吸热反应)
⑵水的离子积常数:Kw=[H+][OH-]
• 250C 时Kw =1.0×10-14 mol2·L-2
• 1000C 时Kw =1.0×10-12 mol2·L-2 .
• ⑶无论是纯水还是酸、碱、盐等电解质的 稀溶液,水的离子积为该温度下的Kw。
离子浓度大小比较: 三个守恒关系
(1)微粒数守恒关系(即物料守恒)。
(2) 电荷守恒。
(3)水电离的离子数平衡关系(即质子守恒)。
3.质子守恒: 电解质溶液中分子或离子得到或失去质子(H+)的 物质的量应相等。
如:在Na2CO3溶液中 H+、HCO3-、H2CO3 为得 到质子后的产物; OH- 为失去质子后的产物 c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
化学平衡理论
溶剂
水
水电离平衡
水
溶
液
中
的
离
子
弱电解质的电离平衡
平 衡
加入一种 电解质
水溶 液
盐类的水解平衡
难溶电解质的溶解平衡
水溶液中的离子平衡
• 一、强、弱电解质的判断方法 • 1.电离方面:能否完全电离,如: • (1)0.1 mol·L-1CH3COOH溶液pH约为3; • (2)0.1 mol CH3COOH溶液的导电能力比
高考化学总复习 08 水溶液中的离子平衡(28)盐类的水解(1)课件

【答案】 D
第十六页,共三十一页。
好题冲关 1.下列电离或水解方程式正确的是( ) A.亚硫酸钠溶液呈碱性: SO23-+H2O HSO-3 +OH- B.氯化铝溶液显酸性: Al3++3H2O===Al(OH)3+3H+ C.氨水呈碱性:NH3·H2O===NH+4 +OH- D.硫化氢溶液呈酸性:H2S S2-+2H+
第六页,共三十一页。
4.规律 有弱才水解,越弱越水解;谁强显谁性,同强显中性。
第七页,共三十一页。
5.水解方程式的书写 (1)一般简单离子水解程度很小,最终建立水解平衡,水解产物不产生沉淀或气体, 不标注“↑”或“↓”。 如 NH4Cl 的水解离子方程式为___________________________。 (2)多元弱酸根水解:分步进行,以第一步为主,一般只写第一步水解方程式。 如 Na2CO3 的水解离子方程式为_________________________。 (3)多元弱碱盐水解:方程式一步写完。 如 FeCl3 的水解离子方程式为:_________________________。
(7)对于易溶于水的正盐 MnRm 溶液,若 pH>7,其原因是_____________________; 若 pH<7,其原因是____________________________________。 (用离子方程式说明)
第二十页,共三十一页。
解析:(7)pH 大于 7 是由于酸根离子水解呈碱性,pH 小于 7 是由于弱碱阳离子水解 呈酸性。
08 水溶液中的离子(lízǐ)平衡
第28讲 盐类的水解(shuǐjiě)
第一页,共三十一页。
李仕才
1.了解盐类水解的原理。 2.了解影响盐类水解程度的主要因素。 3.了解盐类水解的应用。
第十六页,共三十一页。
好题冲关 1.下列电离或水解方程式正确的是( ) A.亚硫酸钠溶液呈碱性: SO23-+H2O HSO-3 +OH- B.氯化铝溶液显酸性: Al3++3H2O===Al(OH)3+3H+ C.氨水呈碱性:NH3·H2O===NH+4 +OH- D.硫化氢溶液呈酸性:H2S S2-+2H+
第六页,共三十一页。
4.规律 有弱才水解,越弱越水解;谁强显谁性,同强显中性。
第七页,共三十一页。
5.水解方程式的书写 (1)一般简单离子水解程度很小,最终建立水解平衡,水解产物不产生沉淀或气体, 不标注“↑”或“↓”。 如 NH4Cl 的水解离子方程式为___________________________。 (2)多元弱酸根水解:分步进行,以第一步为主,一般只写第一步水解方程式。 如 Na2CO3 的水解离子方程式为_________________________。 (3)多元弱碱盐水解:方程式一步写完。 如 FeCl3 的水解离子方程式为:_________________________。
(7)对于易溶于水的正盐 MnRm 溶液,若 pH>7,其原因是_____________________; 若 pH<7,其原因是____________________________________。 (用离子方程式说明)
第二十页,共三十一页。
解析:(7)pH 大于 7 是由于酸根离子水解呈碱性,pH 小于 7 是由于弱碱阳离子水解 呈酸性。
08 水溶液中的离子(lízǐ)平衡
第28讲 盐类的水解(shuǐjiě)
第一页,共三十一页。
李仕才
1.了解盐类水解的原理。 2.了解影响盐类水解程度的主要因素。 3.了解盐类水解的应用。
高考化学一轮复习 第8单元 水溶液中的离子平衡 8.3 盐类的水解课件

2-
2-
-
-
mol·L-1 的 Na2SO3 和 Na2CO3 的混合溶液中,SO3 、
CO3 、
HSO3 、
HCO3
浓度从大到小的顺序为
。
已知:H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
)=10-6 mol·
L-1,所以 pH=6 的溶液
W
-1 的说明在水溶液中只存在电离平
B.25 ℃时
,0.1 mol·L-1的
NaHSO3mol·
溶液LpH=4,
显中性,A
项错误;25
℃时,0.1
NaHSO3 溶液 pH=4,不能说
衡
-
明在水溶液中只存在电离,亚硫酸是弱酸,HSO3 既电离又水解,溶液
-
Al(OH)3↓+3CO2↑
为 Al3++3HCO3
明矾可作净水剂,
Al(OH)3(胶体)+3H+
原理为 Al3++3H2O
铵态氮肥与草木灰不得混合使用
NH4Cl 与 ZnCl2 溶液可作焊接时的除锈剂
第十八页,共五十四页。
-19-
核心考点
考点(kǎo
diǎn)一
如 NH4Cl 的水解离子方程式为
NH4++H2O
NH3·H2O+H+。
第五页,共五十四页。
-6-
核心考点
考点(kǎo
diǎn)一
考点(kǎo
diǎn)二
考点三
基础(jīchǔ)考点突破
2-
-
-
mol·L-1 的 Na2SO3 和 Na2CO3 的混合溶液中,SO3 、
CO3 、
HSO3 、
HCO3
浓度从大到小的顺序为
。
已知:H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
)=10-6 mol·
L-1,所以 pH=6 的溶液
W
-1 的说明在水溶液中只存在电离平
B.25 ℃时
,0.1 mol·L-1的
NaHSO3mol·
溶液LpH=4,
显中性,A
项错误;25
℃时,0.1
NaHSO3 溶液 pH=4,不能说
衡
-
明在水溶液中只存在电离,亚硫酸是弱酸,HSO3 既电离又水解,溶液
-
Al(OH)3↓+3CO2↑
为 Al3++3HCO3
明矾可作净水剂,
Al(OH)3(胶体)+3H+
原理为 Al3++3H2O
铵态氮肥与草木灰不得混合使用
NH4Cl 与 ZnCl2 溶液可作焊接时的除锈剂
第十八页,共五十四页。
-19-
核心考点
考点(kǎo
diǎn)一
如 NH4Cl 的水解离子方程式为
NH4++H2O
NH3·H2O+H+。
第五页,共五十四页。
-6-
核心考点
考点(kǎo
diǎn)一
考点(kǎo
diǎn)二
考点三
基础(jīchǔ)考点突破
人教版化学《盐类的水解》优秀课件

Page 4
NaHCO3:碳酸氢钠是强碱与弱酸中和后生成的 酸式盐,溶于水时呈现弱碱性。常利用此特性作为 食品制作过程中的膨松剂。
Page 5
NaCl和C5H8O4NNa主要用于食品调味,而Na2CO3和 NaHCO3被视作“碱”用于油污清洗和面食制作。
明明是盐为什么叫“碱”呢?
Page 6
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
盐类的水解 (第一课时)
新课导入
NaCl:在食品工业和渔业用于盐腌,还可用作调 味料的原料和精制食盐。
Page 2
C5H8O4NNa:味精是调味料的一种,主要 成分为谷氨酸钠。
Page 3
Na2CO3:块碱、纯碱、苏打(Soda) 、口碱(历 史上,一般经张家口和古北口转运全国,因此又有 “口碱”之说。)、碱面(食用碱)。
溶液显碱性。 离子方程式:
CH3COOH
CH3COO-+H2O 化学方程式:
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
归纳 总结
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
(3)结果:破坏了H+和OH-浓度的等量
关系使溶液呈酸性或碱性。 (4)盐类水解的条件:
a.必须溶于水; b.必须含弱酸阴离子或弱碱阳离子
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
交流 讨论 盐的水解有什么规律吗?
NaHCO3:碳酸氢钠是强碱与弱酸中和后生成的 酸式盐,溶于水时呈现弱碱性。常利用此特性作为 食品制作过程中的膨松剂。
Page 5
NaCl和C5H8O4NNa主要用于食品调味,而Na2CO3和 NaHCO3被视作“碱”用于油污清洗和面食制作。
明明是盐为什么叫“碱”呢?
Page 6
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
盐类的水解 (第一课时)
新课导入
NaCl:在食品工业和渔业用于盐腌,还可用作调 味料的原料和精制食盐。
Page 2
C5H8O4NNa:味精是调味料的一种,主要 成分为谷氨酸钠。
Page 3
Na2CO3:块碱、纯碱、苏打(Soda) 、口碱(历 史上,一般经张家口和古北口转运全国,因此又有 “口碱”之说。)、碱面(食用碱)。
溶液显碱性。 离子方程式:
CH3COOH
CH3COO-+H2O 化学方程式:
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
归纳 总结
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
(3)结果:破坏了H+和OH-浓度的等量
关系使溶液呈酸性或碱性。 (4)盐类水解的条件:
a.必须溶于水; b.必须含弱酸阴离子或弱碱阳离子
人教版化学选修四3.3盐类的水解(第 一课时) 课件 (共24张PPT)
交流 讨论 盐的水解有什么规律吗?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基点小练
3.按要求书写离子方程式 (1)AlCl3 溶液呈酸性:_A__l3_+_+__3_H_2_O_____A_l_(O__H__)3_+__3_H__+__。 (2)Na2CO3 溶液呈碱性:C__O_23_-_+__H__2O_____H_C__O_- 3_+__O__H__-__ __H_C__O_- 3_+__H__2_O____H__2C__O_3_+__O__H_-_____。 (3)NH4Cl 溶于 D2O 中:_N_H__+ 4_+__D__2O_____N_H__3_·H__D_O__+__D_+。
_是__
水解的 离子
溶液的 酸碱性
- _N_H__+4 _、_C__u_2+_
_中__性 _酸__性
_C_H__3C__O_O_ห้องสมุดไป่ตู้-_、C_O_23_- _碱___性
溶液 的 pH __=_7
_<__7
_>__7
基点小练
1.判断正误(正确的打“√”,错误的打“×”)。
(1)酸式盐溶液一定呈酸性
( ×)
第三节 盐类的水解
考纲要求:
1.了解盐类水解的原理。 2.了解影响盐类水解程度的主要因素。 3.了解盐类水解的应用。
考点一
盐类的水解及其规律
? 学什么
双基为本,基稳才能楼高
一
理清盐类水解 的概念及实质
1.概念:在溶液中盐电离出来的离子与 水电离 产生 的 H+或 OH-结合生成 弱电解质 的反应。
的溶液,若它们的 pH 依次为 8、9、10,则 HX、HY、HZ 的
酸性由强到弱的排列顺序是
()
A.HX、HZ、HY B.HZ、HY、HX
C.HX、HY、HZ D.HY、HZ、HX 解析:组成盐的酸根对应的酸越弱,该酸根的水解程度越大,
(4)将 NaHCO3 溶液与 AlCl3 溶液混合: _A__l3_+_+__3_H__C_O__- 3 _=_=_=_A_l_(_O_H__)3_↓__+__3_C__O_2_↑_____________。 解析:pH 大于 7 是由于酸根离子水解呈碱性,pH
小于 7 是由于弱碱阳离子水解呈酸性。
3.多元弱碱阳离子的水解简化成一步完成,如 FeCl3 溶液中:_F_e_3+_+__3_H__2O_____F_e_(_O_H__)_3+__3_H__+__。
4.水解分别是酸性和碱性的离子组由于水解相互促 进的程度较大,书写时要用“===”、“↑”、“↓”等, 如 NaAlO2 与 AlCl3 混合溶液反应的离子方程式:Al3++ 3AlO- 2 +6H2O===4Al(OH)3↓。
NaHCO3、Na2CO3 均是强碱弱酸盐,CO23-水解程度大于
HCO
-
3
水
解
程
度
而
导
致
溶
液
碱
性
NaHCO3 < Na2CO3 ;
Na2SO4 不水解,常温下 pH=7。四种溶液中 pH 最大的是
Na2CO3。
答案:C
2.(2017·银川模拟)物质的量浓度相同的三种盐 NaX、NaY 和 NaZ
如 NH4Cl 水解的离子方程式: NH+ 4 +H2O NH3·H2O+H+。
1.一般来说,盐类水解的程度不大,用可逆号“ ” 表示。盐类水解一般不会产生沉淀和气体,所以不用符号
“↓”和“↑”表示水解产物。如 CuCl2、NH4Cl 水解的离 子方程式:
__C_u_2_+_+__2_H__2O_____C_u_(_O__H_)_2_+__2_H_+___; __N__H_+ 4_+__H__2O_____N__H_3_·H__2_O_+__H__+___。 2.多元弱酸盐的水解是分步进行的,水解离子方程式 要分步表示。如 Na2S 水解反应的离子方程式:_S_2_-_+__H_2_O_ _____H__S_-_+__O__H_-_、__H__S_-_+__H__2O_____H__2S__+__O_H__-__。
(5)实验室制备 Fe(OH)3 胶体: _F__e3_+_+__3_H__2O__=_=_△=_=_=_F__e(_O__H_)_3_(胶__体__)_+__3_H_+____________。 (6)NaHS 溶液呈碱性的原因:_H__S_-_+__H_2_O_____H_2_S_+__O_H__-。 (7)对于易溶于水的正盐 MnRm 溶液,若 pH>7,其原因 是:__R_n_-_+__H_2_O_____H_R__(n_-_1)_-_+__O__H_-_______;若 pH<7, 其原因是___M__m_+_+__m__H_2_O____M__(_O__H_)_m_+__m_H__+________。
解析:pH 大于 7 是由于酸根离子水解呈碱性,pH 小于 7 是由于弱碱阳离子水解呈酸性。
? 考什么
高考为标,全练题点无盲区备考
1.(2017·赣州模拟)室温下,0.1 mol·L-1 下列溶液的 pH 最大的是
()
A.NH4Cl
B.NaHCO3
C.Na2CO3
D.Na2SO4
解析: NH4Cl 为强酸弱碱盐,溶液呈酸性,常温下 pH<7;
CH3COOH 溶液,水的电离程度相同
( ×)
2.怎样用最简单的方法区别 NaCl 溶液、NH4Cl 溶液 和 Na2CO3 溶液? 提示:将三种溶液各取少许装入试管中,分别滴入紫色 石蕊溶液,溶液不变色的为 NaCl 溶液,变红色的为 NH4Cl 溶液,变蓝色的为 Na2CO3 溶液。
三 掌握盐类水解离 子方程式的书写
(2)能水解的盐溶液一定呈酸性或碱性,不可能呈中性 (×)
(3)Na2CO3
溶
液
显
碱
性
的
原
因
:
CO
2- 3
+
2H2O
2OH-
H2CO3 + ( ×)
(4)向 Na2CO3 溶液中加入少量 Ca(OH)2 固体,CO23-水解程度
减小,pH 减小
(× )
(5) 常 温 下 , pH = 11 的 CH3COONa 溶 液 和 pH = 3 的
2.实质
二 明晰盐类水解 的特点及规律
1.水解的特点
2.盐类水解的规律及类型 有弱才水解,越弱越水解;谁强显谁性,同强显中性。
盐的 类型
强酸强 碱盐 强酸弱 碱盐
弱酸强 碱盐
实例
NaCl、 KNO3 NH4Cl、 Cu(NO3)2 CHN3aC、OO Na2CO3
是否 水解 _否___ _是___
