2.3 离子键、配位键与金属键(解析版)-2020-2021学年高二化学课时同步练
高中化学 2.3离子键、配位键与金属键课件 鲁科版选修3(共41张PPT)

(4)离子键的特征 特征:离子键没有方向性和饱和性。 (5)离子键的影响因素: 离子键强弱的影响因素有离子半径的大小和离子所带电荷 的多少,即离子半径越小,所带电荷越多,离子键就越强。 特别提醒:含离子键的化合物都是离子化合物。 离子化合物中一定含有离子键,可能含有共价键。如: MgO、NaF只含离子键;NaOH、NH4Cl既含有离子键, 又含有共价键。共价化合物中只有共价键。
【慎思2】形成配位键的几个实验现象的分析? 提示 实验1: (1)操作:向试管中加入2 mL 5%的硫酸铜溶液,或CuCl2 溶液或Cu(NO3)2溶液,再逐渐滴加入浓氨水,振荡,观察 实验现象。 (2)现象:先有蓝色絮状沉淀,然后沉淀逐渐溶解生成深 蓝色溶液。 (3)原理:Cu2++2NH3·H2O===Cu(OH)2↓+2NH4+; Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O。
• You have to believe in yourself. That's the secret of success. 人必须相信自己,这是成功的秘诀。
•
(1)金属键:金属阳离子与_自__由__电子之间的强烈的相互作 用。 (2)成键微粒:金属阳离子和_自__由__电子(存在只含阳离子不 含阴离子的晶体) (3)成键条件:金属单质或合金。 (4)实质:电性作用。 (5)金属键的特征:无方向性和饱和性。
实验3: (1)操作:向FeCl3溶液中加入1滴KSCN溶液。 (2)现象:溶液呈血红色。 (3)原理:Fe3++SCN-===Fe(SCN)2+或Fe3++3SCN- ===Fe(SCN)3。(实际上,Fe3+与SCN-形成一系列配合物: [Fe(SCN)n]3-n,n=1~6,它们都呈血红色。)
2021学年新教材化学鲁科版选择性必修第二册课件:第2章+第3节+离子键、配位键与金属键(课件)

金属、合金
2.化学键类型与物质类别的关系 (1)离子化合物中一定含有离子键,可能含有共价键。简单离子组成的离子化 合物中只有离子键。如MgO、NaF等,复杂离子组成的化合物中既有离子键、又 有共价键。如NH4NO3、NaOH、Na2O2、NH4Cl等。 (2)共价化合物中只有共价键,一定没有离子键。 (3)中学常见物质中的化学键 ①只有非极性键的物质:H2、O2、N2、P4、S2、S8、金刚石、晶体硅等。 ②只有极性键的物质:HX、CO、SO2等。
第3节 离子键、配位键与金属 键
课前自主学习
学习任务一 离子键 任务驱动: 离子键是必修2学习的化学键中重要的一类,离子键是通过阴、阳离子间的静 电吸引形成的吗?离子键跟共价键有什么不同? 1.概念 阴、阳离子之间通过_静__电__作__用__形成的化学键。 2.形成条件 一般认为,当成键原子所属元素的电负性差值大于_1_._7_时,原子间才有可能形 成离子键。
③既有极性键、又有非极性键的物质:H2O2、C2H2、C2H4、C6H6、C2H5OH等。 ④只有离子键的物质:如CaCl2、K2O、KH等(固体)。 ⑤既有离子键、又有非极性键的物质:Na2O2、Na2S2、CaC2等。 ⑥稀有气体中不存在化学键。
⑦金属或合金中存在金属键。
【典例】下列关于化学键的认识错误的是( ) A.离子化合物中肯定有金属元素,离子键没有方向性和饱和性;而共价化合物 中肯定没有金属元素,共价键有方向性和饱和性 B.金属键的实质是在整块固态金属中不停运动的“自由电子”与金属阳离子 相互作用,使得体系的能量大大降低 C.一般来说,共价键在形成时,由成键双方各提供一个电子形成共用电子对 D.根据元素电负性的差值可以判断化学键类型
2.配合物 (1)概念:组成中含有_配__位__键__的物质。 (2)组成:过渡金属的原子或离子(含有空轨道)与含有_孤__电__子__对__的原子或离子
高中化学第2章第3节离子键配位键与金属键课件鲁科选修3鲁科高二选修3化学课件

栏目导航
A [离子键的特征是无方向性和饱和性。因为离子键无方向性,故带
异性电荷的离子间的相互作用与其所处的方向无关,但为了使物质的能量
最低,体系最稳定,阴、阳离子的排列是有规律的,而不是随意的;离子
键无饱和性,体现在每个离子周围可以尽可能多地吸引带异性电荷的离
子,但也不是任意的,每个离子周围吸引带异性电荷的离子的多少主要取
12/7/2021
第二十二页,共五十页。
栏目导航
配位键和配合物 1.配合物的组成 配合物由中心原子(提供空轨道)和配位体(提供孤对电子)组成,分为 内界和外界,以[Cu(NH3)4]SO4 为例表示为
12/7/2021
第二十三页,共五十页。
栏目导航
(1)配位体
配位体可以是阴离子,如 X-(卤素离子)、OH-、SCN-、CN-、RCOO-
12/7/2021
第二页,共五十页。
栏目导航
自主预习 探新知
12/7/2021
第三页,共五十页。
栏目导航
一、离Байду номын сангаас键
1.概念 阴、阳离子通过静电作用形成的化学键。
2.形成条件
成键原子所属元素的电负性差值越大,原子间越容易发生电子得失,
形成离子键。一般认为,当成键原子所属元素的电负性差值大于 1.7 时,
第十一页,共五十页。
栏目导航
2.下列有关金属键的叙述错误的是( )
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和“自由电子”之间存在的强烈的静电吸引
作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关 B [金属键是金属阳离子和“自由电子”之间存在的强烈的静电作
高中化学第2章微粒间相互作用与物质性质3离子键配位键与金属键课时练习含解析2
离子键、配位键与金属键(40分钟70分)一、选择题(本题包括7小题,每小题5分,共35分)1.(2020·衡水高二检测)氯化钠是日常生活中人们常用的调味品。
下列性质可以证明氯化钠中一定存在离子键的是()A。
具有较高的熔点 B.熔融状态能导电C。
水溶液能导电 D.常温下能溶于水【解析】选B。
NaCl在熔融状态能导电,说明NaCl Na++Cl-,即说明NaCl中存在离子键。
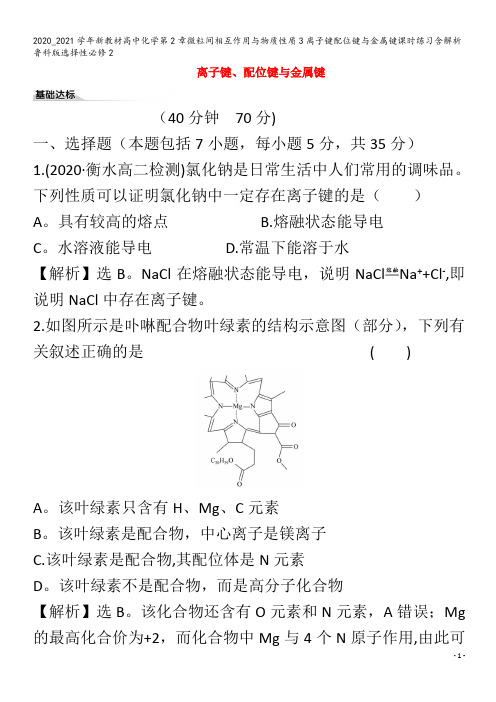
2.如图所示是卟啉配合物叶绿素的结构示意图(部分),下列有关叙述正确的是()A。
该叶绿素只含有H、Mg、C元素B。
该叶绿素是配合物,中心离子是镁离子C.该叶绿素是配合物,其配位体是N元素D。
该叶绿素不是配合物,而是高分子化合物【解析】选B。
该化合物还含有O元素和N元素,A错误;Mg 的最高化合价为+2,而化合物中Mg与4个N原子作用,由此可以判断该化合物中Mg与N原子间形成配位键,该物质为配合物,B正确,D错误;该化合物中配位原子为N原子,不能称N原子为配位体,同样也不能称N元素为配位体,因为配位体一般为离子或分子,C错误.3。
(2020·湖州高二检测)下列说法中,正确的是()A。
含有金属元素的化合物一定是离子化合物B。
ⅠA族和ⅦA族元素的原子化合时,一定形成离子键C。
活泼金属元素与活泼非金属元素化合时,能形成离子键D。
完全由非金属元素形成的化合物,一定是共价化合物【解析】选C。
含有金属元素的化合物也可能是共价化合物,如AlCl3等,A不正确;H与ⅦA族元素的原子化合时形成共价键,B 不正确;NH4Cl为离子化合物,D项错误。
【补偿训练】(2020·咸阳高二检测)下列关于金属的叙述中,不正确的是()A。
金属键是金属阳离子和自由电子间的强烈相互作用,其实质与离子键类似,也是一种电性作用B。
金属键可以看作是许多原子共用许多电子所形成的强烈相互作用,所以与共价键类似,也有方向性和饱和性C.金属键是金属阳离子和自由电子间的相互作用,故金属键无饱和性和方向性D.构成金属的自由电子在整个金属内部的三维空间中做自由运动【解析】选B。
2020-2021鲁科化学性2教师用书:第2章 第3节离子键、配位键与金属键含解析

2020-2021学年新教材鲁科化学选修性必修2教师用书:第2章第3节离子键、配位键与金属键含解析第3节离子键、配位键与金属键发展目标体系构建1.结合常见的离子化合物的实例,认识离子键的本质。
2.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用.3。
知道金属键的特点与金属某些性质的关系。
一、离子键1.离子键的形成(1)形成过程(2)实质:离子键的实质是静电作用,它包括阴、阳离子之间的静电引力和两原子核及它们的电子之间的斥力两个方面。
微点拨:并不是只有金属阳离子和阴离子才能形成离子化合物,NH+4与阴离子也可形成离子化合物。
2.离子键的特征(1)离子键没有方向性阴离子或阳离子可以对不同方向的带异性电荷的离子产生吸引作用,因此离子键没有方向性.(2)离子键没有饱和性在离子化合物中,每个离子周围最邻近的带异性电荷的离子数目的多少,取决于阴阳离子的相对大小。
只要空间条件允许,阳离子将吸引尽可能多的阴离子排列在其周围,阴离子也将吸引尽可能多的阳离子排列在其周围。
(3)离子极化在电场的作用下产生的离子中电子分布发生偏移的现象称为离子极化。
离子极化可能导致阴、阳离子的外层轨道发生重叠,使得许多离子键不同程度的显示共价性,甚至出现键型变异。
如AgF→AgCl→AgBr→AgI共价性依次增强,且AgI以共价键为主。
二、配位键1.配位键的形成(1)配位键(2)配位化合物(配合物)①概念:组成中含有配位键的物质.②组成2.配合物的制备与应用(1)制备[Cu(NH3)4](OH)2Cu2++2NH3·H2O===Cu(OH)2↓+2NH错误!Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-(2)制备银氨溶液Ag++NH3·H2O===AgOH+NH+,4AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O(3)有些配合物显现出特征颜色,从而可用于物质的检验。
高二化学离子键、配位键与金属键

硬度最小的金属是-------- 铯
硬度最大的金属是-------- 铬
延性最好的金属是-------- 铂
展性最好的金属是-------- 金
最活泼的金属是---------- 铯 最稳定的金属是---------- 金
试一试
1、金属晶体的形成是因为晶体中存在
( C)
A.金属离子间的相互作用 B.金属原子间的相互作用 C.金属离子与自由电子间的相互作用 D.金属原子与自由电子间的相互作用
2-3 离子键、配位键与金属键
(第3课时)
金属样品 Ti
一、金属共同的物理性质
容易导电、导热、有延展性、有金属光泽等。
金属为什么具有这些共同性质呢?
二、金属的结构
金属单质中金属原子之间怎样结合的?
组成粒子: 金属阳离子和自由电子
金属原子脱落来的价 电子形成遍布整个晶体 的“自由流动的电子”, 被所有原子所共用,从 而把所有的原子维系在 一起。
【讨论2】金属为什么易导热?
金属容易导热,是由于自由电子 运动时与金属离子碰撞把能量从温 度高的部分传到温度低的部分,从 而使整块金属达到相同的温度。
【讨论3】金属为什么具有较好的延展性?
金属晶体中由于金属离子与自由电子间 的相互作用没有方向性,各原子层之间发生 相对滑动以后,仍可保持这种相互作用,因 而即使在外力作用下,发生形变也不易断裂。
2.金属能导电的原因( C )
A.金属晶体中金属阳离子与自由电子间的 相互作用较弱 B.金属晶体中的自由电子在外加电场作用下 可发生定向移动 C.金属晶体中的金属阳离子在外加电场作用 下可发生定向移动 D.金属晶体在外加电场作用下可失去电子
3、下列叙述正确的是( B )
A.任何晶体中,若含有阳离子也一定含有 阴离子 B.原子晶体中只含有共价键 C.离子晶体中只含有离子键,不含有共价 键 D.分子晶体中只存在分子间作用力,不 含有其他化学键
第三节 离子键、配位健与金属键

第三节离子键、配位健与金属键银光闪闪的精美银器会令居室内熠熤生辉,玲珑晶莹的银制饰物也会让你变的光彩照人。
你当然应清楚:之所以有这么多不同的银制品来装点人类的生活,原因是金属银是可以被改变形状的,可以被压成薄片,也可以被拉成细丝。
构成金属银的微粒能发生相对滑动但又不容易被分开而断使银断裂。
说明微粒之间存在着较强的相互作用力,这就是金属键。
金属键是化学键的一种。
这一节我们主要来学习几种重要的化学键。
一、离子键:1、定义:阴、阳离子间通过静电作用而形成的化学键2、离子键的形成条件:成键原子所属元素的电负性差值越大,原子间越容易发生电子得失。
一般认为,当成键原子所属元素的电负性差值大于1.7时,原子间才有可能形成离子键。
如:电负性较小的金属元素的原子容易失去价电子形成阳离子,电负性较大的非金属元素的原子容易得电子形成阴离子。
当这两种原子相互接近到一定程度时,容易发生电子得失而形成阴、阳离子。
镁与氧气在通电情况下生成氧化镁,同时发出强光。
在这一反应过程中,镁原子失去两个电子成为Mg2+,氧分子中的每个原子得到两个电子成为O2-,带正电的Mg2+和带负电的O2-通过静电作用形成稳定的离子化合物——氧化镁。
以NaCl为例说明离子键的形成过程:例1、现有七种元素的原子,其结构特点见下表:元素的原子可以形成离子键的是( )A.a和bB.a和fC.d和gD.b和g解析:较活泼的金属因素的原子与较活泼的非金属因素的原子可以形成离子键。
答案:BD3、离子键的实质(1)实质:离子键的实质阴阳离子之间的静电作用。
(2)静电引力:根据库仑定律,阴、阳离子间的静电引力(F)与阳离子所带电荷(q +)和阴 离子所 带电 荷(q -)的 乘 积 成 正 比,与阴、阳离子的核间距离(r )的平方成反比。
F= (k 为比例系数)(3)静电斥力:阴、阳离子中都有带负电荷的电子和带正电荷的原子核,除了异性电荷间的吸引力外,还存在电子与电子、原子核与原子核之间同性电荷所产生的排斥力。
2.3离子键、配位键与金属键

6、金属键及金属性质
【讨论1】金属为什么易导电?
在金属晶体中,存在着许多自由电子, 这些自由电子的运动是没有一定方向的, 但在外加电场的条件下自由电子就会发 生定向运动,因而形成电流,所以金属 容易导电。
6、金属键及金属性质
【讨论2】金属为什么易导热?
金属容易导热,是由于自由电 子运动时与金属离子碰撞把能量从 温度高的部分传到温度低的部分, 从而使整块金属达到相同的温度。
位错
+
金属离子
金属原子
提供1molCl-,[Co(NH3)6]Cl3需89.2g, [Co(NH3)5Cl]Cl2需125.3g
【探究实验】
①向盛有AgNO3溶液的试管里逐滴的加入氨水 ②向盛有CuSO4溶液的试管里逐滴的加入氨水
根据实验分析出现现象的原因
实验:向硫酸铜溶液中加入过量氨水,观察现象
实验已知氢氧化铜与足量氨水反应后溶解是因为 生成了[Cu(NH3)4]2+ ,其结构简式为: NH3 H3N Cu NH3 NH3
二、配位键
1、配位键的形成 2、配位键的形成条件: 成键的微粒一方有空轨道,另一方有孤对电子。 3、配合物:由提供孤电子对的配体与接受孤电子对 的中心原子以配位键结合形成的化合物称为配合物。
组成:价电子层的部分d轨道和s、d轨道是空轨道 的过渡金属的原子或离子和含有孤对电子的分子(例 如CO,NH3,H2O)或离子(如Cl-,NO2-,CN-)。
6、金属键及金属性质
【讨论3】金属为什么具有较好的延展性? 金属晶体中由于金属离子与自由电子间 的相互作用没有方向性,各原子层之间发生 相对滑动以后,仍可保持这种相互作用,因 而即使在外力作用下,发生形变也不易断裂。
金属的延展性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2章微粒间相互作用与物质性质2.3 离子键、配位键与金属键一、选择题(共12小题,每小题只有一个正确答案)1.下列叙述错误的是()A.带相反电荷离子之间的相互吸引称为离子键B.金属元素与非金属元素化合时,不一定形成离子键C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键D.非金属元素形成的化合物中也可能含有离子键【答案】A【解析】离子键是阴、阳离子间强烈的相互作用,不只是吸引;成键原子所属元素的电负性差值大于1.7时才能形成离子键。
2.下列叙述不正确的是()A.活泼金属与活泼非金属化合时,能形成离子键B.离子化合物中只含离子键C.离子所带电荷的符号和数目与原子成键时得失电子有关D.阳离子半径比相应的原子半径小,而阴离子半径比相应的原子半径大【答案】 B【解析】离子化合物中一定含离子键,可能含共价键,如NaOH,B错误。
3.下列关于化学键的各种叙述正确的是()A.含有金属元素的化合物一定是离子化合物B.共价化合物中一定不存在离子键C.由多种非金属元素组成的化合物一定是共价化合物D.由不同种元素组成的多原子分子中,一定只存在极性键【答案】B【解析】含有金属元素的化合物,可能为共价化合物,如氯化铝,A项错误;含离子键的化合物一定为离子化合物,则共价化合物中一定不存在离子键,B项正确;由多种非金属元素组成的化合物,可能为离子化合物,如铵盐,C项错误;由不同种元素组成的多原子分子中可存在极性键和非极性键,如H2O2中存在极性键和非极性键,D项错误。
4.下列物质中离子键最强的是()A.KCl B.CaCl2C.MgO D.Na2O【答案】C【解析】离子键的强弱与离子本身所带电荷数的多少和离子半径的大小有关,离子半径越小,离子所带电荷数越多,离子键越强。
根据题给物质分析可知,Mg2+带两个单位正电荷,且半径最小,在阴离子中,O2-带两个单位负电荷,且半径比Cl-的小,故MgO中离子键最强。
5.下列有关叙述正确的是()A.任何固体中,若含有阳离子也一定含有阴离子B.金属键越强,则该金属的熔点越低C.将铁制品做成炊具,金属键没有被破坏D.常温下,金属单质都以固体金属形式存在【答案】C【解析】固体金属中有金属阳离子、自由电子,但无阴离子;金属键越强,金属的熔点越高;常温下,金属汞是液体。
6.金属能导电的原因是()A.金属晶体中金属阳离子与自由电子间的相互作用较弱B.金属晶体中的自由电子在外加电场作用下发生定向移动C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动D.金属晶体在外加电场作用下可失去电子【答案】B【解析】金属晶体中的自由电子,在外加电场作用下,沿导线定向移动而形成电流。
7.配位化合物Pt(NH3)2Cl2有顺铂和反铂两种同分异构体。
顺铂在水中的溶解度较大,具有抗癌作用;反铂在水中的溶解度小,无抗癌作用。
下列说法正确的是()A.顺铂在苯等有机溶剂中溶解度小于反铂B.已知Pt位于周期表第十纵行,则Pt是d区的ⅧB族元素C.分子中Pt和N之间为离子键D.N原子杂化方式为sp2杂化【答案】A【解析】根据“相似相溶原理”,顺铂的极性大于反铂,因而顺铂在苯等有机溶剂中溶解度小,A对;第十纵行属于Ⅷ族,不存在ⅧB族,B错;Pt和N之间为配位键,C错;NH3分子中N原子为sp3杂化,D错。
8.金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。
据此判断下列金属熔点逐渐升高的是() A.Li Na K B.Na Mg AlC.Li Be Mg D.Li Na Mg【答案】 B【解析】同周期从左到右金属元素的价电子数越多、离子半径减小,则金属键越强;同主族从上到下金属元素的离子半径增大,则金属键越弱。
9.下列关于配位化合物的叙述中,不正确的是()A.配位化合物中必定存在配位键B.配位化合物中只有配位键C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用【答案】B【解析】配位化合物中一定含有配位键,但也可能含有其他化学键;Cu2+有空轨道,H2O中氧原子有孤对电子,可以形成配位键;配位化合物应用领域特别广泛,D选项中提到的几个领域都在其中。
10.某化合物的分子结构如图所示,其分子内不含有()A.离子键B.共价键C.极性键D.配位键【答案】A【解析】由题图可知,N原子与Ni原子之间为配位键;共价键中C—C键为非极性键,C—H键、N—O 键、C===N键、O—H键为极性键,故选A。
11.2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子的化学式为N-5。
下列关于全氮阴离子盐的说法正确的是()A.每个N-5含有26个电子B.N-5的摩尔质量为71 g·mol-1C.全氮阴离子盐既含离子键又含共价键D.全氮阴离子盐可能属于电解质,也可能属于非电解质【答案】C【解析】每个N-5含有36个电子,故A错误;N-5的摩尔质量为70 g·mol-1,故B错误;N-5含有共价键,全氮阴离子与阳离子之间存在离子键,故C正确;盐都是电解质,所以全氮阴离子盐属于电解质,故D错误。
12.20世纪60年代初,化学家巴特列特用PtF6(六氟化铂)与等物质的量的氧气在室温下制得了一种深红色的固体,经实验确认,该化合物的化学式为O2PtF6。
这是人类第一次制得O+2的盐。
巴特列特经过类比和推理,考虑到稀有气体Xe(氙)和O2的第一电离能几乎相等,断定XePtF6也应存在。
巴特列特立即动手实验,结果在室温下轻而易举地制得了XePtF6黄色固体。
根据以上叙述判断下列说法不正确的是() A.O2PtF6可能是离子化合物B .XePtF 6可能存在离子键C .PtF 6具有强氧化性D .Xe 元素的化合价一定为零【答案】D【解析】A 项,抓住“这是人类第一次制得O +2的盐”故O 2PtF 6为离子化合物,A 正确。
XePtF 6是巴特列特类推后制得的,可以推断它的结构类似于O 2PtF 6,也应是一种离子化合物,离子化合物中存在离子键,B 正确。
得电子的是PtF 6,说明PtF 6具有氧化性,C 正确。
稀有气体原子的最外层有2个或8个电子,属于稳定结构,但稀有气体也可以参与反应,形成具有共价键或离子键的化合物,单质Xe 的化合价为零,在其形成的化合物XePtF 6中,它的化合价不为零,D 错误。
二、非选择题(共4小题)13.Cu 2+能与NH 3、H 2O 、Cl -等形成配位数为4的配合物。
(1)[Cu(NH 3)4]2+中存在的化学键类型有________(填序号)。
A .配位键B .极性共价键C .非极性共价键D .离子键 (2)[Cu(NH 3)4]2+具有对称的空间构型,[Cu(NH 3)4]2+中的两个NH 3被两个Cl -取代,能得到两种不同结构的产物,则[Cu(NH 3)4]2+的空间构型为________。
(3)某种含Cu 2+的化合物可催化丙烯醇制备丙醛的反应:HOCH 2CH===CH 2―→CH 3CH 2CHO 。
在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为________。
【答案】(1)AB (2)平面正方形 (3)sp 2【解析】[Cu(NH 3)4]2+中铜离子与氨分子之间的化学键是配位键,氨分子内部的化学键是极性键。
[Cu(NH 3)4]2+是平面正方形。
HOCH 2CH===CH 2中的C 原子,有一个采取sp 3杂化,两个采取sp 2杂化。
CH 3CH 2CHO 中的C 原子有两个采取sp 3杂化,一个采取sp 2杂化。
14.A 、B 、C 三种均是中心原子配位数为6的不同配合物,它们的化学式都是CrCl 3·6H 2O ,但结构不同,颜色不同:A 呈亮绿色;B 呈暗绿色,当B 与硝酸银溶液反应时,能沉淀出13的氯元素,而C 呈紫色。
(1)试写出B 的结构简式__________________________。
(2)B 配合物配离子的空间形状如何?画出其两种几何异构体的空间结构。
【答案】 (1)[Cr(H 2O)4Cl 2]Cl·2H 2O(2)八面体,B 的配离子[Cr(H 2O)4Cl 2]+的几何异构体:【解析】分子式为CrCl 3·6H 2O ,中心原子配位数为6的配合物,与硝酸银溶液反应,能沉淀出13的氯元素,所以只有一个Cl -在配合物的外界。
15.已知氯化铝的熔点为190 ℃(2.02×105 Pa)但它在180 ℃即开始升华。
(1)氯化铝是________(填“离子化合物”或“共价化合物”)。
(2)在500 K和1.01×105 Pa时,它的蒸气密度(换算成标准状况时)为11.92 g·L-1,且已知它的结构中还含有配位键,氯化铝的化学式为________,结构式为________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是________。
(4)如何通过实验来判别氯化铝是离子化合物还是共价化合物?__________________________________________________________________________________________________________________。
【答案】(1)共价化合物(2)Al2Cl6(3)AlCl3遇空气中的水蒸气发生水解,生成的HCl与空气中的水蒸气形成酸雾(4)将AlCl3加热至熔融状态,测试其导电性【解析】(1)由氯化铝的熔点较低,且又易升华,说明氯化铝是共价化合物。
(2)M=V mρ0=22.4 L·mol-1×11.92 g·L-1≈267 g·mol-1,AlCl3的相对分子质量为133.5,267/133.5=2由此可知氯化铝的蒸气是二聚体。
结构式:化学式:Al2Cl6。
(3)AlCl3遇到空气中的H2O发生水解,生成的HCl与空气中水蒸气形成酸雾,反应式:AlCl3+3H2O =Al(OH)3+3HCl。
16.在分子结构式中,由一个原子提供成键电子对而形成的共价键用“―→”表示,例如:硫酸,硝基甲烷,写出三硝酸甘油酯的结构式:______________________________________。
【答案】【解析】对于三硝酸甘油酯的结构式可借助硝基甲烷中硝基结构写出。
